Familiárna karcinóm žalúdka: detekcia dedičné príčiny pomáha pochopiť jeho etiológiu
abstraktné
Worldwide, rakovina žalúdka je jedným z najčastejších foriem rakoviny, s vysokou chorobnosťou a mortalitou. Niekoľko faktorov životného prostredia predispozíciu k vývoju rakoviny žalúdka, ako je infekcia Helicobacter pylori
, diéty a fajčenie. Familiárna výskyt rakoviny žalúdka je vidieť v 10% prípadov, a vznikajú pri stanovení dedičné difúzneho karcinómu žalúdka (HDGC) približne 3% prípadov rakoviny žalúdka. V rodinách s HDGC, rakovina žalúdka prezentuje v relatívne mladom veku. Zárodočnej mutácie v géne CDH1
sú hlavnou príčinou HDGC a sú identifikované v približne 25 až 50% rodín, ktoré spĺňajú prísne kritériá. Profylaktická gastrektómia je jedinou možnosťou, ako zabrániť rakovine žalúdka u jedincov s CDH1
mutácie. Avšak vo väčšine rodín s viac prípadov rakoviny žalúdka nie je zárodočnej línie genetické abnormality môžu byť identifikované, a preto preventívne opatrenia nie sú k dispozícii, s výnimkou všeobecného životného štýlu radu. Budúci výskum by sa mal zamerať na identifikáciu nových genetickou predispozíciou pre všetky typy familiárna rakoviny žalúdka.
Kľúčové
Karcinóm žalúdka Genetika Dedičné difúzny rakovina žalúdka CDH1
E-cadherin Všeobecný úvod
S približne 900.000 nových prípadov za rok (8,6% všetkých nových prípadov rakoviny, okrem rakoviny kože), rakovina žalúdka (GC) je štvrtou najčastejšou formou rakoviny na celom svete. Aj keď je výskyt prudko klesá v západnom svete, je stále druhou najčastejšou príčinou úmrtí na rakovinu, s 740.000 úmrtí ročne a 5-ročné prežitie 20% a [1]. Vysoko rizikové oblasti patrí východnej Ázii (Japonsko, Čína a Kórea), východnej Európe a časti Strednej a Južnej Ameriky. Incidencia sú nízke v severnej Európe, Severnej Amerike a Austrálii [1]. S priemerným vekom v čase diagnózy nad 60 rokov, rakovina žalúdka je prevažne o ochorenie starších ľudí [2]. Iba 6-7% pacientov s rakovinou žalúdka prejednávanej pred dosiahnutím veku 50 a menej ako 2% pred dosiahnutím veku 40 [2, 3].
Karcinómu žalúdka je heterogénne ochorenie, ktoré sa odráža v rozmanitosti rôznych histopatologické klasifikačné schémy [4]. Najčastejšie používané sú tie Svetovou zdravotníckou organizáciou [4] a Lauren [5]. Praktická schéma Lauren rozdeľuje GC zhruba do troch hlavných typov; difúzny typ, črevné typ a zvyšok skupina zložená zo zmiešaného a neurčitého typu [5]. Črevné GC ukazuje žliaz alebo rúrkovité komponenty s rôznym stupňom diferenciácie. Difúznu GC sa skladá zo zle súdržných jednotlivých buniek bez tvorby žľazy. Často pečatný prsteň bunky sú prítomné; Preto je tiež označovaná ako karcinóm pečatný prsteň buniek [4]. V Severnej Amerike distribúciu rôznych podtypov je približne 50% čistý črevnej, 35% čistý difúzna a 15% zmiešané difúzna črevnej [6]
Etiológia rakoviny žalúdka :. Faktory životného prostredia
karcinómu žalúdka je multifaktoriálne ochorenie, vyplývajúce z kombinácie niekoľkých faktorov životného prostredia a genetickými zmenami. faktory prostredia sa podieľajú najmä v etiológii črevnej typu GC. Hlavným činiteľom zapojení je Helicobacter pylori
(H. pylori
) infekcia, ktorá sa bežne získal počas detstva a pretrváva, ak vykoreniť [7]. H. pylori
môže vyvolať sekvenciu gastritídy, črevné metaplázia, dysplázia a rakovina žalúdka nakoniec [8]. Meta-analýza 12 štúdií ukázala, že infekcia H. pylori
zvyšuje riziko vzniku GC asi šesťnásobne [9] a WHO klasifikovala H. pylori
ako trieda Aj karcinogén v roku 1994 [10, 11 ].
fajčenie cigariet je dôležitým správanie rizikovým faktorom pre vývoj GC. Veľký systematický prehľad 42 štúdií ukázala, že riziko GC sa zvýšil o 60% u mužov a 20% u žien fajčiarov v porovnaní so nikdy fajčiari [12]. Fajčenie tiež zvyšuje karcinogénne účinky infekcie H. pylori
[13]. Ďalším dôležitým rizikovým faktorom pre vývoj GC je diéta. Dostatočný príjem ovocia a zeleniny pravdepodobne znižuje riziko vzniku GC [4]. Soli príjem, na druhej strane, je pevne spojený so zvýšeným rizikom k rozvoju karcinómu žalúdka. Z tohto dôvodu, diétne úpravy, ktoré znižujú príjem soli, napríklad po výmene zachovanie soli potravín u chladničiek, sú dôležitými faktormi pri znížení výskytu GC, [4]. Údené mäso a ryby, nakladaná zelenina a chilli papričky sú tiež spojené s GC v niektorých populáciách [4]. konzumácia alkoholu bola skúmaná v niekoľkých populáciách, ale výsledky boli nepresvedčivé [4].
Výskyt GC klesá po celom svete, čo je spôsobené predovšetkým poklesom výskytu distálnej, črevné typu GC. Výskyt difúzne GC, pre ktorý sú známe žiadne jasné rizikové faktory životného prostredia, nedošlo k poklesu [4]. U mladých ľudí, u ktorých karcinómy sú s väčšou pravdepodobnosťou byť kvôli genetickou predispozíciou, väčšia časť ukazuje difúzny typ, čo naznačuje, že najmä v tomto podtypu zárodočnej genetika hrá úlohu [4]
Príčiny rakoviny žalúdka :. Genetické faktory
familiárna agregácie rakoviny žalúdka je známe, že sa vyskytujú v približne 10% pacientov [14]. Epidemiologické štúdie ukázali, že vo všeobecnej populácii riziko vzniku rakoviny žalúdka v príbuzným s akýmkoľvek typom rakoviny žalúdka sa zvyšuje 2-3 krát [15]. Až doteraz sa však v prevažnej väčšine týchto pacientov základnej genetická príčina nie je známa. Najdôležitejšie GC citlivosť gén je CDH1
, čo predstavuje 1-3% karcinómov žalúdka [16]. Predisponujúcim CDH1
mutácie vznikli v asi 30% prísne vybrané dedičnou difúznou rakoviny žalúdka (HDGC) rodinní príslušníci [17, 18]. Okrem toho môže tiež dôjsť CDH1
zárodočnej mutácie v približne 7% pacientov diagnostikovaných ako 50 rokov s nádormi s buď rozptýlené alebo zmiešaná histológia [19]. Uznanie, dohľad a liečbu CDH1
mutácie nosičov sú rozsiahlo popísané nižšie.
Rakovinou žalúdka v familiárna črevnej žalúdočnej rakoviny a iných dedičných rakovinových syndrómov
Mnoho rodín s črevnou typu GC vykazujúce autozomálne dominantné dedičnosť vzor boli zdokumentované. Avšak v takýchto rodinách, ochorenie spôsobujúce zárodočnej mutácie pre črevnú GC neboli nájdené doteraz.
Zvýšené riziko vzniku oboch difúzna a črevné typu GC bolo preukázané v niekoľkých dobre známych dedičných rakovinových syndrómov, okrem HDGC. Tieto syndrómy zahŕňajú Lynch syndróm [20-22], Peutz-Jeghersův syndróm [23] Syndróm Li-Fraumeni [24-26], dedičné rakoviny prsníka a vaječníkov [27, 28], familiárnej adenomatóznej polypózy (FAP) [29-31 ], MUTYH asociované adenomatóznej polypózy (MAP) [32], juvenilná polypóza syndróm [33], a Cowden syndrómu [34]. Celoživotné riziko GC v týchto syndrómov medzi populáciami študovaných podstatne líšia, ale je všeobecne nízka. Napríklad, aj keď benígne žalúdočné abnormality, ako je fundusu žľazy polypy vyvíjať približne 12.5-84% pacientov s FAP, iba 40% týchto polypov vykazujú adenomatóznych vlastnosti a ešte menší podiel (asi 0,5%), sa vyvinie do adenokarcinóme žalúdka [35]. V Lynch syndróm, je celoživotné riziko GC sa pohybuje medzi 2,1% v Holandsku po 30% v Kórei [36]. Je zrejmé, že riziko vzniku GC v týchto syndrómov je vyššia v oblastiach s vysokým výskytom GC vo všeobecnej populácii, ako je východnej Ázie, čo naznačuje, že v týchto typoch dedičných foriem GC faktorov životného prostredia môže hrať podstatnú rolu. Takto, vo všetkých týchto rodín životný štýl poradenstva je dôležité, aj keď jeho vplyv na riziko GC nie je presne známa. Vo väčšine uvedených syndrómov neexistuje konsenzus o odporúčaniach dohľade žalúdka.
Identifikácia nových génov základné dedičné rakoviny žalúdka
v približne dve tretiny rodín, ktoré spĺňajú prísne kritériá HDGC, žiadne CDH1
mutácie nájdených a zostávajú geneticky nevysvetliteľné. Väčšina z týchto rodín môže niesť mutácie v iných, je ešte potrebné identifikovať, GC citlivosti gény. Ako väzbového partnera pre E-cadherinu, mutované p- a y-kateninu boli považované za kandidátov pre difúzne GC predispozície [37]. Β-katenin gén (CTNNB1
) bol nedávno hodnotená v sérii 40 rodín s pozitívnou históriou GC z Holandska bez nájdenie akejkoľvek mutácie [Vogelaar et al., Nepublikované dáta, 2012].
Aj v rodinách s črevnej typ GC vykazovať autozomálne dominantné dedičnosť vzor, genetické gény citlivosti môže hrať úlohu. Žiadny gén bol spájaný s ešte tohto typu GC. V starostlivo vybraných pacientov sekvencovania budúcej generácie založené na techniky, ktoré umožňujú exome alebo dokonca genóm širokú detekciu genetických chýb, by mohla byť zneužitá, aby odhalili genetické predispozície nezaujatým spôsobom.
Dedičná šíriť rakovinu žalúdka spôsobený zárodočnými CDH1
mutácií
V roku 1998, Guilford et al
. identifikovať zárodočnej mutácie v géne CDH1
ako príčina dedičného difúzneho rakoviny žalúdka (HDGC) [38]. CDH1
kóduje proteín E-cadherin, ktorý hrá dôležitú úlohu v adhéziu bunka-bunka a udržiavanie integrity epitelové [39]. Miera detekcie mutácie je v rodinách s dvoma karcinómov žalúdka vo príbuzným s aspoň jednou difúznou rakovinou žalúdka (DGC) diagnostikovaná pred dosiahnutím veku 50, alebo tri alebo viac DGC v blízkych príbuzných diagnostikovaných v každom veku [18] približne 50%. Percento klesá, ak aj ojedinelé prípady GŘC mladší 35 sú zahrnuté [17]. Zárodočnej CDH1
mutácie sa nachádzajú vo všetkých etnických skupín [40]. Medzi najčastejšie typy mutácií sú malé inzercie alebo delécie (35%) mutácií. Missense mutácie sa vyskytujú u 28% rodín, nezmyselných mutácií a ich mieste zostrihu sú obaja pozorované u 16% rodín. Veľké exonic delécie sú relatívne vzácne, s frekvenciou asi 5% [41].
Pre mužov i ženy, CDH1
mutácie dopravcovia majú kumulatívne riziko vzniku karcinómu žalúdka o 80 rokov 80%, pričom priemerný vek v čase stanovenia diagnózy 40 rokov. Navyše, ženy nesúce mutáciu CDH1
mať 60% celoživotné riziko vzniku rakoviny prsníka lobulárna [40] a.
Genetického poradenstvo a kritériá pre CDH1
testovanie mutácie
genetického poradenstva je nevyhnutnou zložkou vedenie HDGC. To zahŕňa analýzu rodinnej anamnéze najmenej tri generácie a histopatologického potvrdenie žalúdočných (pred) malignít. Revidované medzinárodné kritériá, ako stanovuje Medzinárodná rakovina žalúdka Prepojenie Consortium (IGCLC) pre výber pacientov so zvýšeným rizikom rakoviny žalúdka familiárna pre CDH1
testovanie mutácií sú uvedené v tabuľke 1. [40]. Genetické testovanie je s výhodou začal v postihnutého príbuzného. Vo väčšine krajín je najmladší vek, v ktorom príbuzní s rizikom by mala byť ponúknutá testovanie nastaviť vo veku 18. zriedkavé prípady rakoviny žalúdka pred veku 18 rokov boli hlásené, ale celkové riziko GŘC pred dosiahnutím veku 20 je veľmi nízka [42, 43] .Table 1 Klinické kritériá pre testovanie na zárodočnej mutácie CDH1 [40]
•
1 difúzny žalúdočné prípad rakoviny nižší ako 40 rokov, alebo
•
2 žalúdočné prípadov rakoviny v rodine, jeden potvrdený difúzny rakovinu žalúdka nižší ako 50 rokov, alebo
• Sims 3 potvrdené difúzna prípadov karcinómu žalúdka v 1. alebo 2. stupňa príbuznými sú nezávislé na veku, alebo
•
osobná alebo rodinná anamnéza difúzne rakovinou žalúdka a lobulárna prsníka rakoviny, s jednou diagnózou mladších 50
navrhovanej mechanizmus HDGC iniciačného
V roku 2009 Humar a Guilford navrhla mechanizmus HDGC začatia [44]. E-cadherin je známe, že hrajú dôležitú úlohu v bunkovej polarity a epitelové tkanivá architektúry [45, 46]. Navrhuje sa, že mutácie v CDH1
narušujú adhéziu bunka-bunka sprostredkovanej E-cadherinu, čo spôsobuje narušenie správnej priestorové usporiadanie buniek. To môže interferovať s procesmi, ktoré regulujú bunkové delenie, ako je orientácia mitotického vretienka. Zrušená buniek polarita môže tiež viesť k narušeniu stanovenie buniek osudu [44, 47, 48]. Tieto narušené procesy môžu v konečnom dôsledku viesť k presunu buniek s samoobnovy kapacít do lamina propria a vedú k vzniku karcinómov pečatný prsteň buniek s dostatočnou kapacitou pre trvalé delenie buniek a tým k progresii [44].
Profylaktické celkom gastrektómia v CDH1
mutácie dopravcov
profylaktické gastrektómii je v súčasnosti jedinou možnosťou, ako eliminovať riziko vzniku GC v CDH1
mutácie dopravcom [49]. Prognóza pacientov s profylaktickou gastrektómii je veľmi dobrá. Odhadovaná celková úmrtnosť na totálnu gastrektómii je 2-4% s takmer 100% rizikom dlhodobej chorobnosti. Súvisiace problémy po gastrektómii zahŕňajú bolesti brucha po jedle, dumpingové syndróm, intolerancia laktózy, tuku a malabsorpcia steatorey a postprandiálnej plnosť [40, 50-52]. Optimálne načasovanie profylaktické gastrektómii u jedincov s CDH1
mutáciou nie je doposiaľ známy. Preventívne gastrektómia vzorky CDH1
mutácie nosičov odhaliť viac malých pečatný prsteň bunkovej lézie s nízkou mierou zbraní; Niektoré z týchto lézií postúpiť do agresívneho karcinómu za svalovej sliznice [53]. Nie je známe, prečo len niektoré z týchto lézií vyvinúť agresívne karcinómov. Nebola pozorovaná žiadna korelácia medzi vekom pacienta a počtu malých pečatný prsteň buniek ohnísk. Blair et al.
Poradiť CDH1
mutácií nosiče s normálnou žalúdočné biopsia, aby zvážila gastrektómii akonáhle jedinci sú staršie ako 20 rokov [43]. Iní autori odporúčame zvážiť preventívne gastrektómii, kedy CDH1
mutácie nosičom je 5 rokov mladší, než je najmladší člen rodiny s DGC, čo vo všeobecnosti znamená, že preventívne gastrektómia sa odkladá do veku do 18 rokov [54]. V prípade, že
preventívneho gastrektómii, odporúča sa celková gastrektómii s rekonštrukciou Roux-en-Y. Neexistuje žiadna potreba radikálnej lymfadenektómia v profylaktické prostredí, pretože sliznice adenokarcinóm bez submukóznu invázie majú nízke riziko metastáz lymfatických uzlín [55].
Patologická analýza preventívnych vzoriek gastrektómii
Patologické analýza celého gastrektómii vzorka zahŕňa dôkladné posúdenie mikroskopicky s hematoxylínom a eosínu (H &E) a mucínu škvrny, ako je napríklad kyselina periodickej-Schiff (PAS). PAS-farbenie sa ukázalo byť užitočné ako primárny škvrna, zvýšenie miery detekcia malých invazívne pečatný prsteň buniek ložísk a zníženie doby skríning [56]. Ďalej len "Swiss valec" technika môže byť použitá, aby obsahoval úplnú sliznicu [57]. Správa o patológie je potrebné spomenúť všetky žalúdočné abnormality a lokalizácia, as (pre) malígny lézie, črevné metaplázia, dysplázia, zápal a prítomnosť H. pylori
-associated gastritídu. Histologické potvrdenie resekčných okrajov skladajúci sa z proximálneho pažeráka a distálnej dvanástnikové sliznice je dôležité, pretože nový GC môže vyvinúť v zostávajúcich žalúdočnej sliznici.
Patológia HDGC
patologické mapovanie kompletných gastrektómia vzoriek preukázala, že v počiatočnej fáze HDGC je charakterizovaný prítomnosťou niekoľkých do až stovky ohnísk štádium T1a pečatný prsteň karcinómu (SRCC) obmedzená na povrchné lamina propria, bez metastáz do lymfatických uzlín (obrázok 1a a 1b) [43, 54, 58, 59]. Väčšina týchto ložísk javí ako pomerne indolentní s mitoticky neaktívnych nádorových buniek. Tieto bunky sú malé na úrovni krku zóny a zvyčajne rozšíriť smerom k povrchu žalúdočnej sliznice má rozlišovaciu pečatný prsteň bunkovú morfológiu. Navrhovaný histologickým model vývoja HDGC podľa Carneiro et al.
Začína s karcinómom pečatný prsteň buniek in situ (Tis), čo zodpovedá prítomnosti pečatný prsteň buniek v bazálnej membrány, a pagetoid šírenie vzor pečatný prsteň buniek nižšie konzervované epitel žliaz a foveolae v bazálnej membrány [60]. Potom nasleduje zvýšenú pagetoid proliferácie pečatný prsteň buniek a nakoniec k invazívneho karcinómu [60]. Nápadný je rozdiel medzi početnými T1a karcinómov a najčastejšie absencia karcinóm in situ (Tis) lézie, čo naznačuje, že invázia zvyčajne dochádza bez morfologicky detekovateľné karcinóm in situ [60]. zmeny pozadia v žalúdočnej sliznici profylaktické vzoriek gastrektómia sa skladajú z foveolární hyperplázia, strapcov povrchového epitelu, vakuolizácia povrchového epitelu a miernou chronickou lymfatickou gastritídu bez H. pylori
infekcie alebo črevné metaplázia [41, 60, 61]. Advanced HDGC prejavuje ako zle diferencovaný difúzny karcinóm sa niekedy niekoľko pečatný kruhových buniek (linitis plastica), ale aj nediferencovaných alebo zmiešané s podtypy mucinózního a niekedy rúrkové dediferenciace sú vidieť [Van der Post a kol., Nepublikované dáta, 2012]. Tieto pokročilé žalúdočné karcinómy CDH1
mutácie nosičov nevykazujú žiadne vlastnosti, ktoré by ich mohli diskriminujú zo sporadických karcinómov žalúdka. Obrázok 1 Intramucosal pečatný prsteň karcinóm. a. Typické malé intramucosal zameranie karcinómu s pečatný prsteň bunky v preventívnych gastrektómia vzorke z A CDH1 mutácie nosiča (H &E, zväčšenie 100x). b. Detail pečatný prsteň buniek medzi normálnymi foveolární žliaz a normálne pozadí bez známok gastritídy. (H &E, zväčšenie 200x).
Surveillance endoskopia
"protokol Cambridge dozoru" sa odporúča pre CDH1
mutácie dopravcovia, ktorí nie sú (zatiaľ) chcú podstúpiť preventívnu gastrektómii, jednotlivcom vo výške 50% ohrozené tým, že dopravca, ktorí nie sú (zatiaľ) ochotný byť testované na mutáciu, rovnako ako pre členov z HDGC rodín bez známeho CDH1
mutácií [62]. Tento protokol obsahuje H. pylori
-testing, ročné gastroskopia s "vysokým rozlíšením" endoskopu, starostlivé prehliadke sliznice po dobu 30 minút, insuflácie a desufflation žalúdka, biopsia slizníc abnormalít a 30 náhodných biopsiou z rôznych žalúdočných krajov (antra , angulus, korpus, fundus, kardio) [40]. Endoskopickým by malo byť vykonávané pomocou bieleho svetla s vysokým rozlíšením endoskopu na vyhradenom zasadnutí s aspoň 30 minút pridelených počítať so starostlivou prehliadkou sliznice inflácie a deflácie, a dovoliť čas na niekoľko biopsia ktoré majú byť prijaté [40]. Použitie mukolytiká, ako acetylcysteínu môže byť užitočné získať dobrý výhľad. Endoskopia umožňuje priame inšpekcie a biopsia podozrivých oblastí, ale difúzny GC je ťažké odhaliť v ranom štádiu a liečiteľné, pretože lézie majú tendenciu sa šíriť do lamina propria bez viditeľných exophytic masy. Medzi hlavné problémy patrí ťažkosti identifikovať (sub) slizničných lézií a predsudky vo vzorke odobratej v makroskopicky normálne vyzerajúci žalúdočnú sliznicu [63]. Takéto exempláre preto musia byť hodnotené patológov so skúsenosťami s týmto typom lézií. Niekoľko štúdií ukázalo, že aj keď CDH1
mutácie nosiče mala negatívny biopsia otvorení pred profylaktické gastrektómii, ložiská boli zistené v ich gastrektómii vzoriek [49, 53, 58, 59]. Iné techniky, ako je napríklad chromoendoscopic techniky, trimodální imaging, konfokálna endomikroskopie a techniky molekulárnej zobrazovanie sa v súčasnej dobe neodporúča, ale treba ďalej skúmať vo výskumnom prostredí [40].
Záver
Celkový výskyt GC klesá , ktorý je s najväčšou pravdepodobnosťou v dôsledku zníženia rizikových faktorov životného prostredia. Zárodočnej mutácie v géne CDH1
boli identifikované ako dôležitá príčina HDGC, ale stále vo viac ako dvoch tretinách prísne vybraných rodín HDGC genetická príčina zostáva neznáma. Navyše genetický základ familiárna prípadov s karcinómom žalúdka intestinálneho typu je do značnej miery neznámy. Objasnenie nových rakovina citlivosti génov žalúdočných bude dôležitým krokom smerom k ďalšej možnosti pre prevenciu rakoviny žalúdka. Preto identifikácia nových genetických faktorov rakoviny žalúdka predisposing je jedným z dôležitých cieľov v blízkej budúcnosti.
Notes
Ingrid P Vogelaar, Rachel S van der Post prispelo rovnakou mierou k tejto práci.
Vyhlásenia
Autori "pôvodné predložené súbory obrazov
Nižšie sú uvedené odkazy na autorov pôvodných predložených súborov pre obrázky. "Pôvodný súbor pre Obrázok 1 13053_2012_438_MOESM2_ESM.jpeg autorského 13053_2012_438_MOESM1_ESM.tiff autorov pôvodného súboru na obrázku 2 protichodnými záujmami
Autori vyhlasujú, že nemajú žiadne protichodné záujmy
Príspevky autorov
Všetci autori prispeli k literárnej rešerše a rukopis príprava. Všetci autori čítať a schválená konečná rukopis.
 Črevné komplikácie po tehotenstve
Črevné komplikácie po tehotenstve
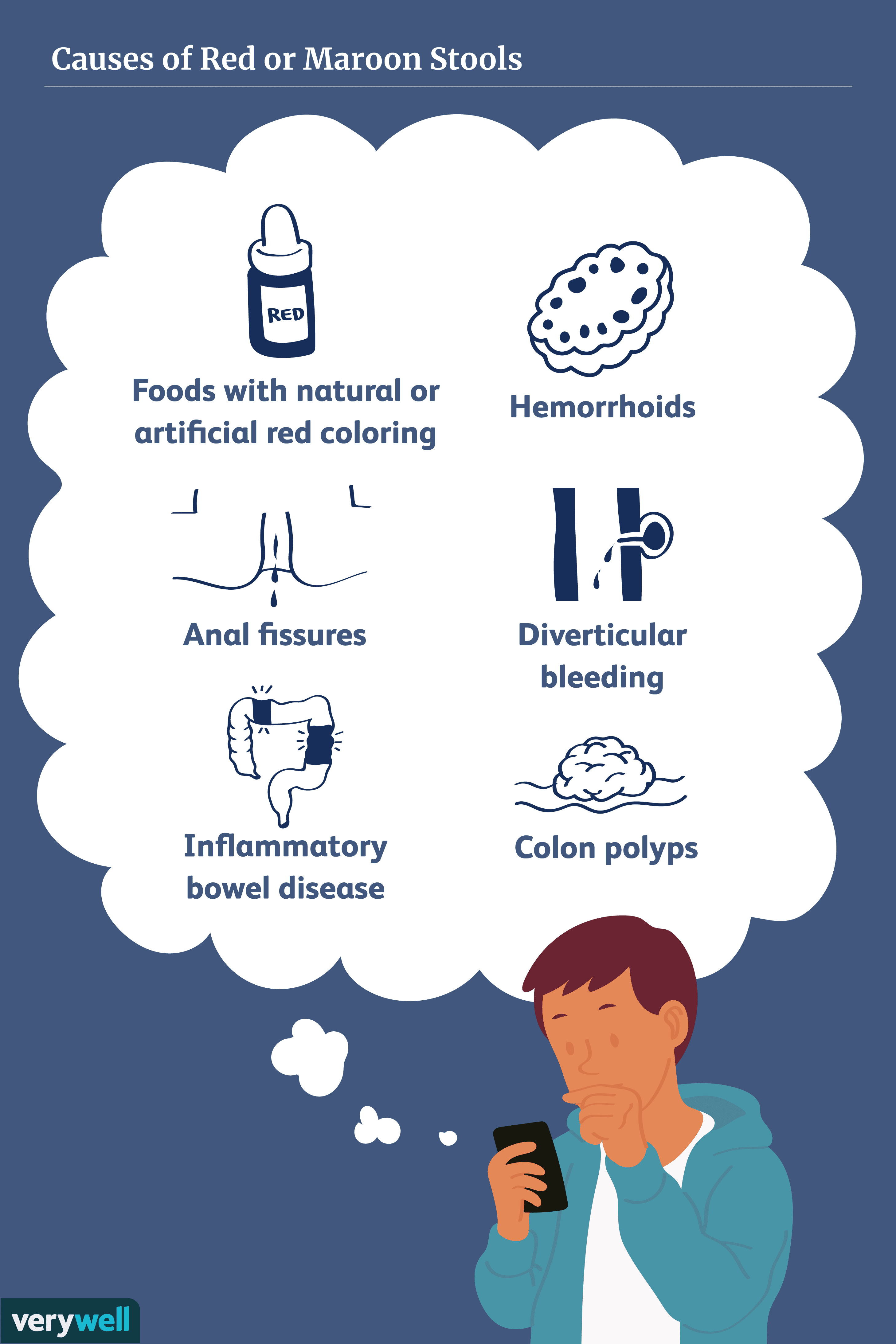 Čo spôsobuje červenú alebo gaštanovú stolicu?
Čo spôsobuje červenú alebo gaštanovú stolicu?
 Diéta pri celiakii:Prečo bezlepková strava nefunguje (a čo robiť namiesto nej)
Diéta pri celiakii:Prečo bezlepková strava nefunguje (a čo robiť namiesto nej)
 Je streptokoka nákazlivá? 12 Symptómy a príznaky
Je streptokoka nákazlivá? 12 Symptómy a príznaky
 10 jednoduchých tipov pre SIBO, ako sa zotaviť z prehnaného vianočného pôžitkárstva
10 jednoduchých tipov pre SIBO, ako sa zotaviť z prehnaného vianočného pôžitkárstva
 Výživa pri hnačke žlčových kyselín:Čo potrebujete vedieť
Výživa pri hnačke žlčových kyselín:Čo potrebujete vedieť
 Skleróza multiplex – netesné črevo
Skleróza multiplex (SM) je najčastejším neurologickým ochorením na svete. Ale či už ste to vy, priateľ alebo člen rodiny, ktorí dostali diagnózu - je to absolútne desivé. Aj keď je to najbežnejšie
Skleróza multiplex – netesné črevo
Skleróza multiplex (SM) je najčastejším neurologickým ochorením na svete. Ale či už ste to vy, priateľ alebo člen rodiny, ktorí dostali diagnózu - je to absolútne desivé. Aj keď je to najbežnejšie
 Krvné testy používané na diagnostiku rakoviny
Zatiaľ čo žiadny krvný test nedokáže diagnostikovať rakovinu, niektoré krvné testy môžu pomôcť pri diagnostike rakoviny. Ak existuje podozrenie na rakovinu, môžu sa objednať krvné testy. Existujú aj k
Krvné testy používané na diagnostiku rakoviny
Zatiaľ čo žiadny krvný test nedokáže diagnostikovať rakovinu, niektoré krvné testy môžu pomôcť pri diagnostike rakoviny. Ak existuje podozrenie na rakovinu, môžu sa objednať krvné testy. Existujú aj k
 Crohnova remisia
Crohnova choroba je ochorenie čriev, ktoré spôsobuje vážne príznaky bolesti, hnačky a únavy. Aj keď neexistuje žiadny liek na Crohnovu chorobu, mnohí ľudia zažívajú obdobia remisie. Tieto časy v život
Crohnova remisia
Crohnova choroba je ochorenie čriev, ktoré spôsobuje vážne príznaky bolesti, hnačky a únavy. Aj keď neexistuje žiadny liek na Crohnovu chorobu, mnohí ľudia zažívajú obdobia remisie. Tieto časy v život