Prítomnosť S100A9 pozitívnych zápalových buniek v nádorových tkanivách koreluje s rakovinou ranej fáze a lepšie prognózou u pacientov s karcinómom žalúdka
abstraktné
pozadia
S100A9 bol pôvodne objavený ako faktor vylučované zápalových buniek. V poslednej dobe bolo zistené, S100A9, ktoré majú byť spojené s niekoľkými ľudských malignít. Účelom tejto štúdie je zistiť, S100A9 expresie v karcinómu žalúdka a preskúmať jeho úlohu v progresii rakoviny.
Metódy
S100A9 expresiu vo vzorkách žalúdočné tkaniva od 177 pacientov s karcinómom žalúdka bola hodnotená pomocou imunohistochémia. Expresia jeho dimerizační partnera S100A8 a S100A8 /A9 heterodiméry bola tiež hodnotená rovnakým spôsobom. Účinok exogénneho S100A9 na motilitu žalúdka rakovinových buniek AGS a BGC-823 bol potom skúmaná.
Výsledky
S100A9 sa špecificky exprimovaný zápalovými bunkami, ako sú makrofágy a neutrofily v rakovina žalúdka a gastritídy tkanív. Štatistická analýza ukázala, že počet vysoko S100A9 buniek (väčšie alebo rovné 200) na 200x zväčšenie mikroskopickom poli v rakovinových tkanivách bola prediktívne skorých štádií rakoviny žalúdka. S100A9-pozitívne Vysoký počet buniek bol v negatívnej korelácii s lymfatických uzlín (P
= 0,009) a invázie nádoru (P
= 0,011). S100A9 bol identifikovaný ako nezávislý prognostický prediktor celkové prežívanie pacientov s rakovinou žalúdka (P
= 0,04). Pacienti s vysokým počtom S100A9 buniek boli s priaznivou prognózou (P
= 0,021). Ďalšie vyšetrovanie zistilo, že S100A8 distribúciu v ľudských nádorových tkanivách žalúdka bola podobná S100A9. Avšak, počet S100A8-pozitívnych buniek nebol pozitívne koreluje s prežitím pacientov. Zápalové bunky infiltrujúcej rakoviny boli S100A8 /A9 negatívne, zatiaľ čo v žalúdku boli pozitívne. Navyše exogénne S100A9 proteín inhibujú migráciu a inváziu buniek karcinómu žalúdka.
Závery
Naše výsledky naznačujú S100A9-pozitívne zápalové bunky v žalúdočnej rakovinové tkanive sú spojené s počiatočnom štádiu rakoviny žalúdka a dobrou prognózou.
Kľúčové slová
karcinóm žalúdka S100A9 zápalové bunky nádoru predstavovať Survival pozadí
rakovina žalúdka je jednou z hlavných príčin úmrtnosti na rakovinu po celom svete. Celkom 989,600 nových prípadov rakoviny žalúdka a 738,000 úmrtia boli odhadnuté že k nim došlo v roku 2008, a viac ako 70% nových prípadov a úmrtí dochádza v rozvojových krajinách, ako je Čína [1]. rakovina žalúdka je obvykle detekovaná u pokročilejších štádiách, kedy prognostické výsledky sú žalostný. Takmer 70 až 80% pacientov má účasť regionálnych lymfatických uzlín, ktoré má silný vplyv na prežitie [2, 3]. Z tohto dôvodu, objavovanie nových biomarkerov pomoc pri skorej detekcii a presnú predpoveď správanie nádoru môže zlepšiť prežitie pacientov [4-6].
Členovia rodiny S100 proteínov sa objavujú ako biomarkerov u viacerých typov nádorov [7]. S100 člen rodiny S100A9 je 13kd proteín, ktorý obsahuje konzervované štruktúrne motívy sa skladá z dvoch EF-hand Ca
2 + viažuci domény. Po nadviazaní vápnika, S100A9 interaguje s inou S100 člena rodiny S100A8 tvoriť funkčné heterodiméry s názvom kalprotektinu [8, 9]. S100A9 bol pôvodne identifikovaný ako faktor secernovaného zápalových buniek, ako sú neutrofily a makrofágy v reumatickej artritídy, zápalového ochorenia čriev, a ďalších zápalových ochorení [10-14]. S100A9, S100A8, rovnako ako heterodiméry kalprotektinu S100A8 /A9, sú nadmerne exprimované v zápalom indukovanej karcinogenézy [15]. S100A9 expresie je up-regulovaná v nádorových bunkách v pľúcach [16], prostaty [17], a rakovina prsníka [18, 19], pričom je down-regulovaná v ľudských bunkách rakoviny pažeráka [20]. Vo vzorkách kolorektálneho karcinómu tkaniva, však, S100A9 proteín nebol detegovaný v rakovinových bunkách, ale v zápalových buniek rozptýlených v celej nádorového stromálnych [21]. Okrem toho, S100A9 bol vo vzorkách stolice pacientov s kolorektálnym karcinómom významne vyššia než u kontrolnej skupiny [22]. V karcinómu žalúdka, génovej expresie a proteomické analýzy preukázali vysokú expresiu S100A9 v tkanive. [23, 24]. Avšak, jeho distribúcie v tkanive a spojenie s klinicko-funkciami neboli plne dokázaná.
V tejto štúdii sme použili analýza génovej expresie pre porovnanie S100A9 expresiu v rakovinové tkanive žalúdku a v priľahlých, zdanlivo normálneho tkaniva. Imunohistochemické farbenie ukázalo, S100A9 v nádorom spojených zápalových buniek. Okrem toho, sme sa obrátili na koreláciu medzi počtom S100A9-pozitívnych buniek v nádorovom tkanive a klinicko-funkcií. Tiež obrátil na spoločnú lokalizáciu S100A9 a S100A8, ako aj lokalizáciu diméru kalprotektinu imonufluoreskujúca. A konečne, získať vhľad do funkcie S100A9 v nádorových bunkách, sme skúmali účinok rekombinantného proteínu S100A9 na migráciu a inváziu buniek karcinómu žalúdka AGS a BGC-823.
Metódy
Pacienti a vzorky tkaniva
Toto vyšetrovanie bolo vykonané po schválení etickou komisiou Peking fakultnej nemocnice rakoviny. Informovaný súhlas bol získaný od každého pacienta. Boli študované sto sedemdesiat šesť pacientov s karcinómom žalúdka. 124 mužov a 53 žien (priemerný vek 57 rokov, rozpätie, 26-80 rokov) bolo diagnostikovaných a operované v Peking University Hospital rakoviny medzi rokmi 1998 a 2004. Hĺbka invázie nádoru, histologického stupňa, lymfatických uzlín, pečeňové metastázy, a vaskulárne invázie boli získané z klinických a histopatologických správ. Štádium rakoviny žalúdka bola klasifikovaná podľa siedmeho vydania nádor uzlín (TNM) klasifikácia odporúčané Spoločným výborom amerického rakoviny. Žiadny z pacientov dostávala chemoterapiu alebo rádioterapiu pred operáciou. Všetci pacienti boli sledovaní až do januára 2010. Po gastrektómii, jedna časť resekcii vzorky bola stanovená v 10% formalínu a spracovaná bežne pre patologické hodnotenie, a ďalší bol snap-zmrazené v tekutom dusíku skladované pri teplote -80 ° C na extrakciu RNA. Okrem toho, 30 uzavreté metastatické lymfatické uzliny boli odobraté z týchto pacientov. Desať prípadov chronickej zápal slepého čreva tkanív sa zhoršením boli poskytnuté odboru všeobecnej chirurgie, sesterská nemocnice Qingdao University Medical College.
Imunohistochémia (IHC)
Štvor-mikrometra dielov z formalínom fixovaných parafínových tkanív boli zahájené poly-L-lyzínom potiahnutá sklíčka a potom zbavené parafínu v xyléne a rehydratované pomocou alkoholu destilovanej vody. Endogénnej peroxidázy aktivita bola blokovaná 3% peroxidu vodíka po dobu 15 minút pri teplote miestnosti. Po tlaku varenie sklíčka do 10 mmol /l EDTA (pH 8,0) po dobu 3 minút, boli rezy inkubované s 5% kozieho séra a potom inkubované cez noc pri 4 ° C s myšou anti-S100A9 protilátkou (1: 200, T1028, BMA Biomedicals, Švajčiarsko), alebo myšou anti-S100A8 protilátkou (1: 200, T1031, BMA Biomedicals), alebo myšou anti-S100A8 /A9 protilátkou (1: 200, T1023, BMA Biomedicals). Primárne protilátky boli detekované pomocou dvojstupňový systém Envision (Dako, Glostrup, Dánsko). Chrenovej peroxidáze a diaminobenzedene hydrochlorid (DAB) bol enzým a chromogén činné. Vyjadrenie S100A9, S100A8 a S100A8 /A9 sa zistili aj v Cybrdi tkanivo microarray sklíčka (IC00-01-001, Cybrdi, Xi'an, Čína), ktorý obsahuje chronickú gastritídu s metaplázia (57 prípadov) a rakovina žalúdka tkanivách (23 prípadov). Desať prípadov chronických vzoriek zápal slepého čreva sa zhoršením boli slúžila ako pozitívna kontrola pre S100A8 /A9.
Posúdenie IHC a cut-off definície
S100A9 a S100A8 boli zafarbené v zápalových buniek, ako sú makrofágy a neutrofily infiltrácie nádorového tkaniva. Pozitívne bunky vykazovali rôzneho stupňa cytoplazmatickej farbenie. Snímky boli získané pomocou Ariola analýza obrazu systému (Applied Imaging, San Jose, CA, USA). Skener je založený na Olympus BX61 mikroskopu s motorizovaným stolíkom a automatickým zaostrovaním schopnosťami vybavených fotoaparátom. Sklíčka bola naskenovaná v 200 × zväčšenie. Stupeň monoklonálnu S100A9 a S100A8 reaktivity protilátky v každej sekcii tkaniva bola stanovená počítaním počtu zafarbených zápalových buniek v troch 200 x zväčšenie odbory. To bolo vykonané dvoma nezávislými patológov za pomoci automatického systému mikroskopu a software pre spracovanie obrazu (pozri doplnkovú súbor 1: Obrázok S1). Cut-off hodnota S100A9 zafarbia zápalové bunky pre predikciu pacienta patologickým štádiom bola stanovená prijímačom prevádzkové charakteristiky (ROC) krivky.
Laserová konfokálna snímanie
vyšetrovať spoločnú lokalizáciu S100A9 a jeho dimerizační partnera S100A8, alebo heterodiméry S100A8 /A9 sa Cybrdi mikroskopické sústavy tkanív sklíčka (IC00-01-001) sa inkubujú 1,5 hodiny pri teplote miestnosti s myšou anti-S100A9 protilátkou (1: 200) vopred označené Zenon Alexa Fluór 647 Mouse IgG Labeling Kit (z-25008, červená fluorescencia), a to buď anti-S100A8 protilátkou (1: 200), alebo anti-S100A8 /A9 protilátkou (1: 200) vopred označené Zenon Alexa Fluór 488 Mouse IgG Labeling Kit (z-25002 , zelená fluorescencia). Konfokálna snímky boli získané pomocou Leica TCS SP5 konfokálního mikroskopu (Leica, Mannheim, Nemecko). , Okrem toho, jadrá kontrastne zafarbený s DAPI (Vector, Burlingame, CA, USA), excitácia pri 358 nm
Vzorky chronických zápal slepého čreva tkanív s exacerbácií boli inkubované s anti-S100A9 protilátky (1: 200, červený fluorescenčné značené), a anti-S100A8 /A9 protilátka. (1: 200, zelená fluorescencia označený) ako pozitívna kontrola pre konkrétny S100A8 /A9 heterodiméry expresie
Bunková kultúra
obe bunkové línie v tejto štúdii boli predtým profilovaný pomocou microarray analýzy a pravidelne boli overené pomocou analýzy STR (short tandem repeat analýzou DNA) [25]. Rakovina žalúdka bunkové línie AGS bola získaná od ATCC (American Type Culture Collection, Manassas, VA) a bunkové línie BGC-823 bola založená v Číne a získal od Cell Research Institute, Shanghai, Čína. Rakovinové bunky boli rutinne pestované ako monovrstvy v médiu RPMI-1640 (GIBCO BRL, Carlsbad, CA), doplnenom 10% (objem /objem) fetálneho teľacieho séra (FCS, Gibco) a antibiotikami pri teplote 37 ° C vo zvlhčenej 5% CO 2 atmosféru.
Cell invázie test
CytoSelect 24-Well Cell Invasion testovacia súprava bola získaná od Cell Biolabs, USA. S100A9 rekombinantný proteín bol zakúpený od BMA Biomedicals, Švajčiarsko. Invázia buniek testy boli vykonané s Transwell vložky, ktorý umožňuje bunkám migrovať cez 8 um veľkosťou pórov polykarbonátovú membránu. Horný povrch vložky membrány bola potiahnutá rovnomernú vrstvou vysuší bazálnej membrány roztoku matrice. Bunky boli resuspendované v médiu bez séra boli umiestnené v hornej komore každého Transwell v hustote 10 6 buniek /ml (200 ul /komora). S100A9 rekombinantný proteín bol pridaný do hornej komory médiu pri 0 ° C, 10, 20, 50, alebo 100 ng /ml. Spodná komora bola naplnená 500 ul média obsahujúceho 10% FCS. Bunky boli ponechané migrovať po dobu 48 hodín pri teplote 37 ° C. Bunky, ktoré zostali v hornej komore boli odstránené bavlneným tampónom, a bunky, ktoré prenikla na spodnú stranu membrány boli zafarbené v Cell Stain roztoku po dobu 15 minút, a počítajú v deviatich náhodne vybraných mikroskopických polí (200 x) na jamku , Každá vložka bola potom prevedená do prázdnej jamky a inkubované v 200 ul extrakčného roztoku. Po 10 minútach sa 100 ul roztoku z každej vzorky boli prenesené do mikrotitračnej doštičky s 96 jamkami a meria v čítačke doštičiek pri OD560nm. Migrácia
bunková skúška
pohybu buniek bola hodnotená s použitím testu hojenie rán. Bunky boli vrúbľovať do šiestich-jamkových tkanivových kultivačných misiek a kultivované do zhlukovania získať bunkovú monovrstvu, ktorá bola potom zranený použitie sterilných 200 ul špičky pipety. Akákoľvek bunková drvina sa odstráni premytím PBS. Ranených monovrstva buniek sa potom inkubuje v médiu so 100 ng /ml S100A9 rekombinantný proteín. Kontrolné bunky boli ošetrené bez séra RPMI-1640. Časozberné snímky boli nadobudnuté invertovaný mikroskop s fázovým kontrastom pri 200 × zväčšenie pre 0, 24 a 48 hodín. Migrácia buniek bola hodnotená schopnosť výpočtom priemernej migráciu buniek vzdialenosť.
Štatistická analýza
patologickým premenné boli získané z klinických a histopatologických správ. ROC krivky boli použité na stanovenie hodnoty cut-off zápalové počtu S100A9-pozitívnych buniek pri posudzovaní patologického TNM štádia. Združenie S100A9-pozitívne zápalové počtu buniek s rôznymi TNM etapách bola vykonaná s rank-sum Wilcoxonova testu. Ak chcete získať spojenie medzi počtom S100A9 alebo S100A8 buniek a patologickým premenných, dáta boli cross-tabuľkovej a χ
2 Skúška bola vykonaná. Kumulatívne prežitie bola odhadnutá pomocou metódy Kaplan-Meierova a porovnanie medzi skupinami bolo uskutočnené pomocou log-rank testu. Celková doba prežitia bola meraná od dátumu prvej operácii k dnešnému dňu úmrtia, počítanie smrť z akejkoľvek príčiny ako koncový bod, alebo k poslednému dňu informácií, ako koncového bodu, ak žiadna udalosť bola dokumentovaná. Viacrozmernom analýza Cox pomerného rizika regresného modelu (dozadu, postupného) bol vytvorený s cieľom posúdiť vplyv každej premennej na prežitie. Významnosť bola stanovená na P Hotel < 0,05.
Výsledky
Expresia S100A9 v infiltrácie zápalových buniek v žalúdku rakoviny a chronické gastritídy tkanív
V predchádzajúcej analýzy génu poľa, sme zistili, že rakovina žalúdka tkanivá boli odlíšené od priľahlej nenádorové sliznice charakteristické rozdiely v ich génovej expresie vzory [26]. Rozmanitosť génovej expresie vzoriek môže odrážať rozdiely v podstatných vlastnostiach nádorových a normálnych buniek, ako aj rozdiely v bunkovej zloženie týchto komplexných tkanív. V rámci týchto génov, expresia S100A9 v žalúdočných rakovinových tkanivách bola vyššia, než je uzavreté priľahlé nenádorové sliznice (P
= 0,00241, obrázok 1A). Obrázok 1 Expresia S100A9 v karcinómu žalúdka a priľahlých non-rakovinové tkanivá. (A) iný výraz hodnota S100A9 v 72 žalúdočných rakovinových tkanív a spárovaný No-rakovinové tkanivá na základe analýzy dát z Illumina Sentrix BeadChip cDNA mikročipu. (B-E) Imunohistochemické farbenie S100A9 v žalúdočných rakovinové tkanive (B) metastatických lymfatických uzlín (C), chronickej gastritídy (D), a priľahlé non-rakovinové žalúdočnej sliznice (E). S100A9 lokalizácia bola odhalená ako hnedé alebo červené granulované lokusov v cytoplazme infiltrujúcich zápalových buniek, a to najmä v mononukleárnych fagocytov a neutrofilných granulocytov. (Zväčšenie 200 x).
Imunohistochémia vzoriek od 177 pacientov s karcinómom žalúdka ukázali, že S100A9 bol pozitívny vo všetkých primárnych rakovinových tkanív imunologické nachádza výlučne v zápalových buniek, ako sú makrofágy a neutrofily infiltrujúcich primárneho nádoru tkaniva (rôzne typy buniek v tkanive vzorky boli identifikované dvoma nezávislými patológov) (obrázok 1B). Všetky skúmané metastatických lymfatických uzlín (n = 30) boli tiež pozitívne pre S100A9 s imunologické nachádza výlučne v zápalových buniek obklopujúcich metastatickou rakovinou tkaniva (obrázok 1C). V priľahlom bez rakoviny sliznice, S100A9 bola vyjadrená v zápalových buniek infiltrujúcich gastritídu. Žalúdočnej sliznice mal negatívny alebo veľmi slabý S100A9 expresie (obrázok 1D, E).
S100A9-pozitívny zápalových počtu buniek v nádorových tkanivách je spojená s štádiu rakoviny a pacienta prežitie
Pre vyhodnotenie rozsahu S100A9 expresie v žalúdočnej karcinóm spojená prostredie, počet S100A9 pozitívnych zápalových buniek v každej nádorovom tkanive bola meraná spriemerovaním počtu krviniek troch polí (pôvodné zväčšenie, 200 ×) v oblasti s najväčším počtom pozitívnych buniek v mieste najhlbšieho invázie tumoru. Korelácia medzi počtom buniek a klinicko parametrov a prežitie pacienta bola analyzovaná za použitia Wilcoxonova rank-sum test a Kaplanove-Meierove metódy. Ako je ukázané na obrázku 2A, postupného znižovania S100A9-pozitívny zápalové počtu buniek v nádorových tkanivách bolo spojené so zvýšením nádorového patologického fázy I až IV (Wilcoxonův test číslo súčet pre 4 fázach, P
= 0.0265). Obrázok 2 High S100A9 počtu buniek v tkanive rakoviny znamená lepšie výsledky u pacientov s karcinómom žalúdka. (A) bodový graf S100A9-pozitívny zápalové počtu buniek v každej patologickým TNM štádiu. Modrá čiara udáva úroveň 200. (B) ROC krivkou počtu S100A9 buniek pre predikciu patologického TNM fázy. Arrow ukázal na limitnej bod o 200. (C) Kaplan-Meierovej analýzy celkového prežitia za každú patologickým TNM štádiu. (D) Kaplan-Meierovej analýzy celkového prežitia pre vysoký počet S100A9 buniek (≥ 200) skupina a počet buniek nízky S100A9 (< 200) skupinu. (Iba 176 pacientov bolo zaradených do analýzy pre jeden pacient stratil nasledovať-up).
Potom sme testovali predikcie silu počtu S100A9 bunkovom štádiu nádoru u rakoviny žalúdka. Na TNM štádiu základe Pacienti boli rozdelení do dvoch skupín, menej vyspelé skupiny (štádium I + II) a pokročilé skupine (štádium III + IV). Plocha pod krivkou (AUC) získané z prijímača prevádzková charakteristika (ROC) krivky pomocou S100A9-pozitívny zápalové bunky počet bol 0,623 pre patologické stupňov TNM. Hodnota cut-off bol 198,5 (sme 200 v nasledujúcej analýzy) na 200 x zväčšenie oblasti s 64,3% a 61,9% citlivosť špecifickosťou pre tumor fázy predikciu (obrázok 2B). Medzná línia 200 môže byť použitá na oddelenie menej rozšírené skupiny z rozšírenej skupiny. Rozdiel bol významný medzi oboma skupinami (Wilcoxonův rank test na súčet dvoch skupín, P = 0,017
, obrázok 2A). Vzhľadom k tomu,
analýzu prežitia ukázali podstatne vyššiu prognózu pre pacientov s rakovinou žalúdka v rôznych fázach s rakovinou (obrázok 2C) sme analyzovali vzťah medzi S100A9-pozitívny zápalových buniek počítať a prežitie pacienta. Pacienti boli rozdelení podľa spodným limitom do vysokého počtu S100A9 buniek (≥ 200) skupina a počet buniek nízky S100A9; skupiny (menej ako 200). 5-ročné prežitie bol 44,6% vo vysoko mobilnom počte skupine v porovnaní s 22,5% v nízkom počte buniek skupine (P = 0,021
, obrázok 2D). Stredná doba prežitia bola 35,1 ± 10,8 mesiacov pre vysoké bunkové počtu skupine a 20,3 ± 3,0 mesiaca na počte buniek skupine s nízkym, resp. Dohromady, S100A9-pozitívny zápalových počtu buniek v žalúdočnej tkanive rakoviny môže byť použitá ako prediktor rozlišovať počiatočnej fáze a karcinóm žalúdka s cut-off 200 pozitívnych buniek /HPF. Prítomnosť S100A9-pozitívnych zápalových buniek v nádorových tkanivách koreluje s lepšou prognózou u pacientov s karcinómom žalúdka.
Nízky počet S100A9-pozitívnych zápalových buniek v nádorových tkanivách pozitívne koreluje s Bolo zistené, chudobných klinicko-funkcie,
Nízky počet buniek S100A9 koreluje s hĺbkou invázie tumoru (T fáza), lymfatických uzlín (N kole) a klinickom štádiu TNM (P
= 0,011, 0,009 a 0,002, v uvedenom poradí). Korelácia medzi počtom S100A9 buniek a iných klinických príznakov, ako je pohlavie, vek, umiestnenie nádoru, pečeňových metastáz (M fáza), vaskulárny invázie a diferenciácie neboli štatisticky významné (P všetky Hotel &0,05) (tabuľka 1). Navyše, viacrozmerné analýza ukázala N fázy (P
= 0,006), pečeňové metastázy (P
= 0,000) a počet S100A9 buniek (P
= 0,046) byť nezávislé faktory v predikciu prežitie (Tabuľka 2 ) .Table 1 Združenie S100A9-pozitívny zápalové počtu buniek v nádorových tkanivách s klinicko-parametrov v onkologickí pacienti žalúdočnej
premenných
Low S100A9 (pozitívnych buniek < 200)
High S100A9 ( pozitívnych buniek > = 200)
P
hodnota
sex
0,125
Male
74
50
Žena
25
28
Vek
0,089 Hotel < 50
32
18
50-59
24
12
60-69
33
33 Hotel > = 70
10
15
umiestnenie nádoru
0,271
Cardia
26
15
Non-kardia
73
63
Hĺbka nádorové invázie **
0,011
T1 Sims 3
2
T2
7
19
T3
69
42
T4
20
15
lymfatických uzlín
0,009
N0
13
23
N1
32
30
N2
32
17
N3
22
8
pečeňových metastáz
0,571
Negatívne
89
68
pozitívny
10
10
TNM štádium
0,002
І Sims 3
12
II
37
35
III
50
21
IV
9
10
vaskulárnej invázie
0,742
Negatívne
38
31
pozitívny
58
43
nezaznamenávajú * Sims 3
4
Diferenciácia **
0,472
No
2
4
Stredne + Zle
82
66
Iné typy
13
6
nie je určené
2
2
* Údaje boli neúplné.
** Fisherov presný test.
Tabuľka 2 Viacrozmerná analýza prognostických faktorov pre celkové prežívanie pacientov s nádorovým ochorením žalúdočných
variáciami
P
RR
CI (95%)
Sex
0,671 1,106
0.694-1.765
Muž proti ženskej
Age
0,179 1,148
0,938-1,405 Hotel < 50
50-59
60-69 Hotel > = 70
lokalizácia nádoru
0,545 0,864
0,538-1,387
Cardia vs.
Non-kardia
diferenciácie
0,301 0,751
0.437- 1,292
No oproti mierne + zle
lymfatických uzlín
0,006 1,841
1,196-2,835
N0 + N1, N2 + N3 oproti
hĺbky invázie tumoru
0.1
1,756
0,897-3,435
T1 + T2 vs. T3 + T4
pečeňových metastáz
0
3,461
2,002-5,983
Negatívny proti Pozitívna
vaskulárnej invázie
0,107 1,452
0,922-2,285
Negatívne proti pozitívnej
S100A9-pozitívny zápalové bunky Počet
0,046
0,643 0,417 - 0,991
Hotel < 200 vs. > = 200
RR: relatívne riziko; CI :. Interval spoľahlivosti
expresiu stav S100A8 a heterodiméry S100A8 /A9 v žalúdočnej rakovina tkaniva a tkaniva gastritída
chronickej gastritídy je chronický žalúdočné lézie, patologicky vyznačuje nešpecifickej chronického zápalu žalúdočnej sliznice. Zápalové bunky v chronickej gastritídy sú morfologicky podobné tým, infiltrovať primárna rakovina žalúdka tkaniva. V niektorých prípadoch, chronická gastritída dokonca môže viesť k rakovine žalúdka. Ďalej sme ďalej skúmali vyjadrenie S100A8, blízkeho rodinného príslušníka S100A9 a heterodimerizaci forme S100A8 /A9 v oboch žalúdočnej rakovinových tkanív a okolitom normálnom chronickej gastritídy tkanív vzoriek s karcinómom žalúdka prevedením imunohistochémia. Podobne ako v prípade vzore S100A9, S100A8 bol exprimovaný výlučne v zápalových buniek infiltrujúcich ako nádorové tkanivá a susediace gastritídy tkaniva. . S100A8 nebola vyjadrená vo všetkých žalúdočných rakovinových buniek a normálne žalúdočnej sliznicou
Ďalej sa kvantifikuje počet S100A8-pozitívnych zápalových buniek v každej nádorovom tkanive, ako bolo popísané vyššie pre S100A9 (ďalší súbor 1: Obrázok S1). Prekvapivo, počet S100A8 bunky v žalúdočnej rakovinové tkanive nekoreluje s väčšinou klinicko-funkcií (ďalšie súbor 2: Tabuľka S1) alebo prežitie pacienta (Ďalší súbor 3: Obrázok S2). Okrem toho, expresia forme heterodimerizaci S100A8 /A9 nebola detekovaná v žiadnom zápalových buniek infiltrujúcich karcinómu žalúdka tkanív, zatiaľ čo niektoré S100A8 /A9 pozitívne bunky boli identifikované v chronickej gastritídy tkanív (dáta nie sú uvedené). Tieto dáta ukazujú, že distribúcia S100A9, S100A8 a S100A8 /A9 sa môže líšiť v ľudskom žalúdku rakoviny a chronické gastritídy tkanív.
Pre potvrdenie tejto hypotézy sme ďalej skúmali subcelulárnu lokalizácia vzor S100A9, S100A8 a S100A8 /A9 heterodiméry expresia prevedením immunofluorecence farbenie na mikroskopické sústavy tkanív, vrátane 23 prípadov karcinómu žalúdka a 57 prípadov chronickej gastritídy. V žalúdočných rakovinové tkanive, a to ako S100A9 a S100A8 proteíny boli detekované v infiltrujúcej nádor zápalových buniek (obrázok 3A, B), zatiaľ čo žiadna S100A8 /A9 heterodiméry bolo zistené vo všetkých prípadoch (obr 3G). Expresie S100A8 a S100A9 čiastočne prekrývali v cytoplazme buniek (obrázok 3D, E). Okrem toho, S100A9 a S100A8 proteíny boli detekované v zápalových buniek v chronickej gastritídy (obrázok 3 K, L). Rozdelenie týchto dvoch proteínov tiež čiastočne prekrývali (obr 3N, O). V súlade s výsledkami imunohistochemického vyšetrenia, S100A8 /A9 nebola vyjadrená v akýchkoľvek bunkách karcinómu žalúdka tkanivách (obr 3G), zatiaľ čo expresia S100A8 /A9 čiastočne prekrýva s S100A9 v zápalových bunkách gastritídy tkanív (obr 3Q, S, T) , Nie je prekvapením, že expresia a distribúcia S100A8 /A9 chronickým zápalom slepého čreva tkanivách s exacerbácií (pozitívna kontrola) boli podobní tie, chronickej gastritídy tkanivách (obr 3U, V, X, Y). Celkovo vzaté, diferenciálnej expresie a subcelulárnu lokalizácia S100A9, S100A8 a S100A8 /A9 v rôznych tkanivách môže znamenať ich rôzne úlohy v žalúdočnej rakovina alebo chronickej gastritídy prostredie. Obrázok 3 imunofluorescencie obrazy S100A9, S100A8 a S100A8 /A9 proteínov v microarray sklíčka tkanivo obsahujúce žalúdočné rakovinové tkanive (A-J) a chronickej gastritídy tkanív (K-T), a chronickej zápal slepého čreva, tkanivá s exacerbácií (U-Y). S100A9 a S100A8 boli detekované monoklonálne protilátky, prelabeled s Zenon Alexa Fluór Mouse IgG Labeling Kit (s zelené a červené fluorescencie v tomto poradí). Jadro bola farbená pomocou DAPI. S100A8 /A9 heterodiméry boli zistiteľné pomocou dimér špecifické protilátky 27E10 z BMA Biomedicals prelabeled so zelenou fluorescenciu. Ko-lokalizácia S100A9 a S100A8 a S100A8 /A9 sa ukázalo v zlúčených snímok (D, I, N, S, X) a väčších obrazov zlúčených (E, J, O, T, Y). Biela šípka v 3 T ukazuje spoločnú lokalizáciu S100A9 a S100A8 /A9 u pacientov s chronickou gastritídu. dĺžka lišty, 50 um.
inhibičný účinok rekombinantného proteínu S100A9 o migrácii a invázii žalúdočných nádorových bunkových línií in vitro
The S100A9 proteín exprimovaný v a secernovaných zápalových buniek, ktoré slúžia ako mediátor a akútne chronický zápal. Vzhľadom k tomu, zápalové počet S100A9-pozitívnych buniek v korelácii s menej agresívnym klinicko vlastnosti, sme ďalej testované priamou inhibičné funkcie rekombinantného S100A9 na migráciu a inváziu buniek karcinómu žalúdka. Na vyhodnotenie invazívne schopnosť buniek karcinómu žalúdka, bol použitý Transwell testy. Dva žalúdočné rakovina bunkové línie, AGS a BGC-823, boli liečené médium alebo médium bez séra, ktoré obsahujú rôzne koncentrácie S100A9 rekombinantného proteínu (10, 20, 50 a 100 ng /ml, v danom poradí). Invazívne bunky boli počítané v deviatich náhodne vybraných mikroskopických polí (200 x). Výsledky ukázali, že rekombinantný proteín S100A9 mierne inhibovaná AGS invázie buniek (obrázok 4A), zatiaľ čo S100A9 významne inhibujú BGC-823 inváziu v závislosti od koncentrácie (P
menšie ako 0,05, obr 4C). Analyzovať schopnosť migrovať buniek karcinómu žalúdka, sme vykonali test hojenie rán. Obe bunkové línie boli liečené médium alebo médium bez séra, obsahujúce 100 ng /ml S100A9 rekombinantný proteín. Výsledky ukázali, že S100A9 mierne inhibovala AGS bunkovej migrácie (Obrázok 4B), zatiaľ čo bunková migrácia odstupy BGC-823 buniek ošetrených S100A9 po 24 hodinách a 48 hodinách inkubácie boli významne nižšie ako u kontroly (P
menšie ako 0,05, obrázok 4D). Obrázok 4 Účinok S100A9 rekombinantného proteínu na inváziu a migráciu žalúdočných nádorových bunkových línií. V transwell teste, AGS (A) a BGC-823 (C) boli bunky ošetrené médium alebo médium bez séra obsahujúce 10, 20, 50 alebo 100 ng /ml S100A9 rekombinantný proteín. Invazívne bunky boli počítané v náhodne vybraných mikroskopických deviatich poliam (200 x). V teste hojenie rán, AGS (B) a BGC-823 (D), bunky boli ošetrené s RPMI-1640 alebo médiu bez séra obsahujúcom 100 ng /ml S100A9 rekombinantný proteín. Fotografie boli zachytené obráteného mikroskopu s fázovým kontrastom pri 0 h, 24 h a 48 h po zranení. Tri nezávislé experimenty boli vykonané. Výsledky boli prezentované ako priemer ± smerodajná odchýlka z týchto nezávislých experimentov. P
hodnotu voči kontrolnej skupine.
Diskusia
ľudskej rakoviny je chronické ochorenie, ktoré pochádza z transformovaných buniek nesúcich genetickú aj epigenetické zmeny. Avšak, rakovina nie je zložený len z nádorových buniek. Rakovinu tkanivo obsahuje iné typy buniek vrátane fibroblastov a epiteliálnych bunkách, bunkách imunitného systému a buniek, ktoré tvoria krvné cievy a lymfatický cievny [27]. V tomto zložitom mikroprostredie nádoru, mediátory zápalu regulujú jednotlivé etapy vývoja nádorov, vrátane začatia, propagáciu, invázie a metastáz [28].
S100A9, člena rodiny S100, je bohatý na granulocyty, monocyty a aktivovaných keratinocytoch počas rôznych zápalové stavy. V tejto štúdii sme zistili, že S100A9 bol špeciálne nachádza v zápalových buniek infiltrujúcich rakovina žalúdka tkaniva a chronickej gastritídy tkaniva, zatiaľ čo všetky žalúdočné rakovinové bunky alebo v priľahlých buniek žalúdočnej sliznice nevyjadril S100A9. Naše výsledky sa zhodujú s predchádzajúce štúdie preukazujú vysokú expresiu S100A9 v infiltrujúcich imunitných buniek v rôznych typov rakoviny, vrátane rakoviny hrubého čreva [21] a rakoviny pankreasu [29]. Všetci autori čítať a schválená konečná rukopis.
 Príbeh pacienta s Crohnovou chorobou a kolitídou:Zoznámte sa s Erin Bush
Príbeh pacienta s Crohnovou chorobou a kolitídou:Zoznámte sa s Erin Bush
 Odhalená nová knižná edícia SCD Lifestyle – plus sladké nové bonusy
Odhalená nová knižná edícia SCD Lifestyle – plus sladké nové bonusy
 Ako zistíte, či má vaše dieťa apendicitídu?
Ako zistíte, či má vaše dieťa apendicitídu?
 Ako dlho zostáva cholecystostomická trubica v nej?
Ako dlho zostáva cholecystostomická trubica v nej?
 Poruchy trávenia:Ako zastaviť bolesť plynov
Poruchy trávenia:Ako zastaviť bolesť plynov
 Imunitné bunky opravujú poškodené črevo u detí s IBD
Imunitné bunky opravujú poškodené črevo u detí s IBD
 Čo je IBS? | Dietológ vysvetľuje
Ahojte všetci. Som nadšený. Mám so sebou dietetickú stážistku – a je taká úžasná. Zoznámte sa s Danielle – má za úlohu vytvoriť skutočne úžasné, praktické zdroje pre mojich klientov IBS. Dnes pre vás
Čo je IBS? | Dietológ vysvetľuje
Ahojte všetci. Som nadšený. Mám so sebou dietetickú stážistku – a je taká úžasná. Zoznámte sa s Danielle – má za úlohu vytvoriť skutočne úžasné, praktické zdroje pre mojich klientov IBS. Dnes pre vás
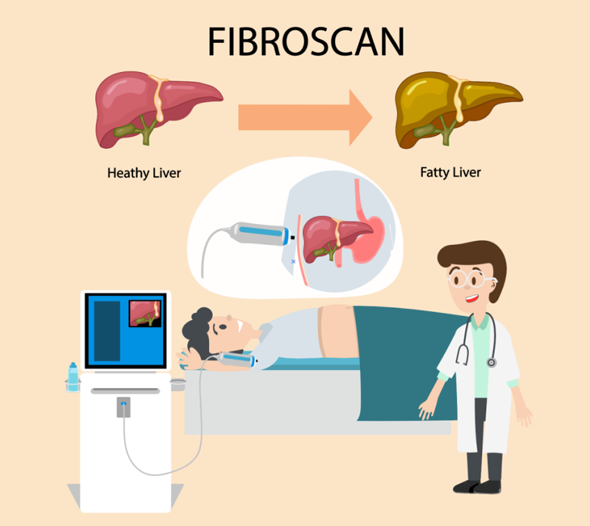 Všetko, čo potrebujete vedieť o testovaní FibroScan®
Zhrnutie:Ak máte príznaky problémov s pečeňou, môže sa odporučiť testovanie FibroScan na posúdenie stupňa fibrózy a tukových zmien v pečeni. FibroScan je neinvazívny test, ktorý vykonávajú lekári n
Všetko, čo potrebujete vedieť o testovaní FibroScan®
Zhrnutie:Ak máte príznaky problémov s pečeňou, môže sa odporučiť testovanie FibroScan na posúdenie stupňa fibrózy a tukových zmien v pečeni. FibroScan je neinvazívny test, ktorý vykonávajú lekári n
 Alergie súvisiace s vyššou spotrebou nezdravého jedla,
navrhuje novú štúdiu Mnoho potravinových alergií v detstve môže byť dôsledkom konzumácie nezdravého jedla, podľa novej štúdie. Deti s potravinovými alergiami, a deti, ktoré jedia veľa nezdravého jedla
Alergie súvisiace s vyššou spotrebou nezdravého jedla,
navrhuje novú štúdiu Mnoho potravinových alergií v detstve môže byť dôsledkom konzumácie nezdravého jedla, podľa novej štúdie. Deti s potravinovými alergiami, a deti, ktoré jedia veľa nezdravého jedla