Caveolin-1 (Cav1) je oder protein in patogen receptor v sluznici prebavil. Kronična infekcija epitelnih celic želodca s Helicobacter pylori Avtor Povzetek Okužba z bakterijo Helicobacter pylori Navedba. Hitkova I Yuan G Anderl F Gerhard M, Kirchner T Reu S, et al. (2013) Caveolin-1 Varuje B6129 miši proti Helicobacter pylori Urednik: Steven R. Blanke, University of Illinois, Združene države Amerike Prejeto: 23. maj 2012; Sprejeto: 4. februar 2013; Objavljeno: 11. april 2013 Copyright: © 2013 Hitkova et al. To je odprtega dostopa članek razširja pod pogoji Creative Commons Attribution License, ki omogoča neomejeno uporabo, distribucijo in razmnoževanje v katerem koli mediju, pod pogojem, da prvotni avtor in vir knjižijo Financiranje:. Ta študija je podprta s sredstvi za EB in MPAE iz Deutsche Krebshilfe (108287) in DFG (BU-2285). MPAE je podprt tudi z donacijami Deutsche Krebshilfe (107885), DFG (SFB poskusno 824, TP B1), Else kron Stiftung (št P14 /07 //A104 /06) in BMBF (Mobimed 01EZ0802;. KMU-innovativ Ne 0315116B The financerji imel nobene vloge pri oblikovanju študije, zbiranje in analizo podatkov, sklep, da se objavi, ali pripravi rokopisa nasprotujočimi si interesi.. avtorji so izjavili, da niso konkurenčni interesi obstajajo Uvod Helicobacter pylori dva glavna H. pylori Caveolin-1 (Cav1) je 21-24 kDa velik in bistveni strukturni beljakovine caveolae, specializirana oblika lipidov splav mikrodomen. Caveolae so 50-100 nm bučko /-cev v obliki črke invaginations v plazemski membrani obilno v makrofagih, endotelijskih in gladkih mišičnih celic, tipa I pneumocytes in adipocitov, kjer sodelujejo v celičnih procesov prometa, vključno z endocitozo, holesterola iztok in membransko prometa [15] [16]. V tem kontekstu lahko Cav1 deluje tudi kot zaviralec clathrin neodvisen endocitozo in blok povzročitelja /toxin absorpcije [17], [18]. Z vezavo na svojo odra domeni, Cav1 neposredno zavira obilice receptorjev in encimov, vključno s tirozin kinaz ZRC in Ras družine, G-proteinov in sintaza dušikovega oksida [15]. Poleg tega, da vlogo v membranski prometa, Cav1 kar predstavlja kontrolno platformo za regulacijo celično proliferacijo in preživetje [19]. Cav1 izvaja tudi pomembno vlogo pri celični gibljivost in migracij ter v epitelnih, stromalnih in endotelijskih tkiv, z izvajanjem celica celice stike, celično matriko oprijem in imunske odzive [20] [21] [22] [23] . Cav1 neposredno veže holesterol in prepis Cav1 negativno ureja prepis faktor sterolov odzivno-element vezavo beljakovin 1 (SREBP1) [24]. SREBP1 je vezan na endoplazemski retikulum (ER), kot neaktivna 125 kDa prekurzor in se aktivira v razmerah pomanjkanja holesterola s proteolitično cepitev v aparatu Golgi. To cepitev sledi prenosom aktivnega 68 kDa SREBP1 v jedro, kjer se veže na sterolov odzivali elementov (SREs) ciljnih genov, vključno Cav1, ki sodelujejo pri sintezi holesterola in maščobnih kislin [25]. H. pylori Zato predpostavili, da holesterola vezavo proteinov SREBP1 in Cav1 so tarče H. pylori etika izjava študij na živalih so bile izvedene v soglasju z etičnimi smernicami Technische Universität München (Zakon o nemški Animal Welfare, Deutsches Tierschutzgesetz) in ga je odobril (7.2-1-54-2531-74-08), ki ga vlada Bavarske Živali Homozigotna Cav1 knockout (Cav1-KO) (sev Cav1tm1Mls /J, število stock 004.585) (Regierung von ÖBB, München, Nemčija.). in ujemanjem nadzor divjega -Type (WT) (sev B6129SF2 /J, število stock 101045) miši (8 tednov) so bili pridobljeni iz Jackson Laboratory (Bar Harbor, Maine) in vzdržuje na mešani podlagi v patogenov brez objekta miške [28], [ ,,,0],29]. Eksperimentalni razjede želodca je bila izvedena z indometacin kot je bila objavljena pred [30]. Infekcija miši z miška prilagojen CagA /Váca-dostavi pomanjkljivo H. pylori Reagenti Kemija od Merck (Darmstadt, Nemčija) ali Sigma (Taufkirchen, Nemčija). Poliklonalna antiserumi so SREBP1 (# PA1-46142, Thermofisher Znanstveni, Waltham, MA), Cav1 (N-20, sc-894), SREBP1 (C-20, sc-366), CagA (b-300, sc-25766) , FAK (a-17, sc-557), fosfo-FAK (Tyr-397, sc-11765), Hsp90 alfa /beta (H-114, sc-7947), Lamin a /C (H-110, sc- 20.681, vsi iz santa Cruz Biotech., CA), splošno in fosfo ERK1 /2 (P44 /P42), p38, JNK (vse iz celična signalizacija, Danvers, MA) in Ki-67 (SP6, DCS GmbH, Hamburg, Nemčija ). Mouse monoklonska protitelesa so Cav1 (ɢ406) in fosfo-Cav1 (pY14,ɣ338) (oba iz BD /transdukcija Lab., San Jose, CA), DLC-1 (C-12, sc-271915) in beta-aktina (AC-15, sc-69879) (oba iz Santa Cruz Biotech.). makrofagni specifična podgana anti-miš F4 /80 protitelo (# MF48000) dobimo iz Invitrogen (Life Technologies, Darmstadt, Nemčija). Piščančje anti H. pylori humanih embrionalnih ledvičnih (HEK293), Madin-Darby pasje ledvice ( MDCK), starševska GC humane celične linije (AGS, MKN45, N87) (vsi iz American Type Culture Collection, Rockville, MD) in stalni transfekciji kloni nastajajo njihovi so se ohranili kot prej [37] opisano. Okužba celic s celicami prilagojeno CagA-dobave obvladajo H. pylori DNA konstrukti Izraz plazmid pEGFP-CagA je navedena drugje [38]. ~800 Bp fragment proksimalnem človeškega promotorja Cav1 The (AF019742, položaj 69 do 859) [24] smo pomnožili s PCR iz genomske DNK humanega normalnega jeter in klonirali v Kpnl /HindIII območij pGL3-luc luciferaza reporterskega plazmida ( Promega GmbH, Mannheim, Nemčija). Izoforma 4 človeškega DLC1 mRNA [39] (DLC1v4, NM_001164271.1) smo pomnožili s človeškimi hepatom HepG2 celic in vstavijo v mestih BamHI /NotI na izražanje vektorja pTarget (PT, Promega GmbH). Prehodni transfekciji in luciferazne teste smo izvedli kot prej [37]. H. pylori Ex vivo Cela želodci so izrezali iz miši in oblikovanje kolonija je bila določena v bistvu, kot je opisano [31] . Antralnih trak želodca smo stehtali, damo v 5 ml Brucella brozge in vrtimo 10 minut. Pripravili smo razredčitve 1:10, 1:100 in 1:1000 in 100 ml vsake razredčitve smo zasadili na H. pylori Preostali želodec izperemo s sterilno vodo. Antralnih trak smo razrezali, zamrznili v tekočem dušiku in shranili pri -80 ° C, dokler ekstrakcijo RNA. Preostali del želodca damo v 3 ml 4% (m /v) paraformaldehida (PFA) v fosfatnim pufrom (PBS) in inkubirali 24 ur pri 4 ° C. Nato je bil želodec reši vzdolž večjega in majhne ukrivljenosti na dve polovici, čemur sledi dehidracija in vgradnjo v parafin za histološko analizo. Celice smo okužili z H. pylori odkrivanje imunoprecipitirali proteinov s SDS-PAGE in WB bila izvedena kot prej [41]. -Matrix pomaga Laser Desorpcijske /ionizacijski masne spektrometrije (MALDI-MS) je podrobneje opisan v [29]. obarvanje je bila izvedena v triple-barvni način vizualizacije 4,6- diamidino-2-phenylindole (DAPI), Alexa-488 in -594 z digitalnim fotoaparatom, povezan (Axiovision, sprostitev 4.4) fluorescentni mikroskop (Axiovert 200m, Carl Zeiss MicroImaging GmbH, Hallbergmoos, Nemčija). Konfokalna mikroskopija (Axiovert 40, Zeiss) in 3D-rekonstrukcija H. pylori Histopatološka vrednotenje in imunohistokemija (IHK) Kronična aktivna gastritis je bila opredeljena s sočasno prisotnostjo nevtrofilnih polymorphnuclear (PMN) in mononuklearnih celic (limfocitov in plazemskih celic) v želodčni sluznici. Active (PMN) in kronične (enojedrni) infiltrat je bila ocenjena na naslednji način: Parafinski-vgrajeni želodca tkivo je znižal na 3 mikrometrov odseke z uporabo polavtomatsko mikrotom (Leica Microsystems GmbH, Wetzlar, Nemčija). Oddelki so se nato obarvajo z uporabo Hematoxylin & Eozin (H & E) rešitve. Histopatološke Analiza je bila izvedena s tremi patologi (CR, SR, TK) slepo za nastavitev študije. Morfološke spremembe v želodčni sluznici so bile razvrščene v skladu z dopolnitvijo Sydney sistema [32], [42]. Razred z gastritisom je dosegel na podlagi gostote intramucosal vnetnih infiltratov iz mononuklearnimi in PMN celic, kot je bila objavljena pred [43]: none (0), blago (1+), zmerna (2+) in hudo (3+). Poleg tega, hiperplastični ali regenerativne epitelijskih sprememb, so bile ugotovljene izgube parietalnih celicah in pogostost limfatičnih foliklov ali limfnih agregatov. Intenzivnost H. pylori čip (Kit iz podeželju, Millipore GmbH, Schwalbach, Nemčija) in vse druge metode so bile izvedene kot prej [45] opisano. Oligonukleotidi so navedeni v tabeli S1. Viabilnost prilepljenih celic smo izmerili z 1- (4,5-dimetiltiazol-2-il) 3,5-difenil-formazana (MTT ) test (Roche Diagnostics GmbH, Mannheim, Nemčija), ki ga priporoča proizvajalec. Ugotoviti adhezijo celic, smo 1 x 10 4 celice zasejemo v 6 cm posode celične kulture za 1 do 6 ur, čemur sledi ponavljajoče spiranjem s PBS. Preostali sprijete celice so bile določene s 4% (m /v) PFA v PBS, obarvali s kristal vijoličnim in nato prešteti uporabo ImageJ (NIH, Bethesda, MD). Celjenju ran teste smo izvedli v bistvu, kot je opisano v [46]. Na kratko smo celice gojijo do konfluentnosti v 6 cm posodo, in 5 mm praske bila uvedena v monosloja z uporabo obrnjeno modro konico čemur sledi inkubacija celične kulture plošč za dodatno 24, 48 in 72 ur. Zapiranje ran smo spremljali na fiksiranje in barvanje celic s kristal vijoličnim uporabljajo svetla polja mikroskopije (Axiovert 200m, Carl Zeiss MicroImaging GmbH). Rezultati so sredstva ± S.E. iz najmanj 5 živali na genotip ali 3 neodvisnih poskusov iz različnih prehodov celic. Programska oprema GraphPad Prism (različica 4.0, La Jolla, CA), je bila uporabljena za analizo podatkov. P-vrednosti (* p < 0,05) smo izračunali z uporabo Studentov t in Fisher točno testi Pristopna številke Human: Cav1. NM_001753.4, Q03135; B2M: NM_004048.2, P61769; IL8: NM_000584.3, P10145; DLC1 v1: NM_182643.2, Q96QB1; DLC1 v4: NM_001164271.1, Q96QB1; ACS: NM_018677.3, Q9NR19; HMGCoAS: NM_001098272.2, Q01581; HMGCoAR: NM_000859.2, P04035; LDLR: NM_000527.4, P01130; beta-Actin: P60709; Lamina A: P02545; Lamina C: P02545; Hsp90 alfa: P07900; Hsp90 beta: P08238; ERK1 (p44): P27361; ERK2 (P42): P28482; FAK: Q05397; JNK1: P45983; JNK2: P45984; p38: Q16539; Src: P12931; SREBP1: P36956; Ki-67: P46013; Mouse: Cav1: NM_007616.4, P49817; B2M: NM_009735.3, Q91XJ8; TNFalfa: NM_013693.2, P06804; IFNgamma: NM_008337.3, P01580; IL1beta: NM_008361.3, P10749; IL6: NM_031168.1, P08505; CD4: NM_013488.2, P06332; CD19: NM_009844.2, P25918; CD25: NM_000417.2, P01589; CD86: NM_019388.3, P42082; CCL5: NM_013653.3, P30882; CXCL1: NM_008176.3, P12850; PPARg2: NM_015869.4, P37231; TFF2: NM_009363.3, Q9QX97; Dog: B2M: NC_006612, XP_850148; H. pylori Rezultati miši Cav1 s pomanjkanjem prikaz okrepljeno gastritis na okužbo z CagA-dobave nesposobni H. pylori Za oceno histološke spremembe, ki jih povzročajo želodčnega tkiva na H. pylori Cav1-pomanjkanje spodbuja zaposlovanje makrofagov v okuženem želodčne sluznice Da bi ocenili identiteto imunskih celic, ki prispevajo k H. pylori Podobni rezultati so bili pridobljeni iz poskusov uvajanja hitro poškodbe želodčne pri miših z injekcijo indometacina [30] (Fig.S1). V skladu z okrepljenim poškodbe tkiva Cav1-KO želodcev (* p = 0,0161, WT v primerjavi Za oceno funkcije Cav1 v H. pylori Cav1 ščiti GC celic človeških proti-CagA povzroča preureditev citoskelet Oblikovanje igličastih projekcije ( "kolibrija") je tipičen morfološka fenotip AGS celice kot odgovor na okužbo z CagA-dostavo obvladajo H. pylori V podporo teh ugotovitev so celične adhezije in rane stopnje zaprtje izrazitejše v AGS /Cav1 primerjavi z AGS /EV celic (Fig.S2). V skladu s svojo funkcijo kot ciljnega proteina CagA in komponente kontaktne zarastline [48], WB analize (sl. 4D), prav tako ugotovljene višje stopnje (0,4 ± 0,1 AGS /EV v primerjavi CagA dostavo pristojni H. pylori Cav1 je bilo dokazano, da se fosforilirajo citosolskih tirozin kinaz (SRC, Abl) na tirozin 14 [49], in fosforilirata Cav1 in src tako aktivirajo majhne GTPases Rho /Rac /CDC42 ki urejajo citoskeletne funkcije [13], [50]. Da bi ugotovili osnovni molekularni mehanizem, kako Cav1 ščiti pred povezane z CagA celični stres, smo ocenili na poti signalne jih CagA-dostavno obvladajo H začel. pylori ni bilo mogoče zaznati neposredno sodelovanje ali kvantitativno colocalization za CagA beljakovine ali H. pylori Za identifikacijo beljakovino kandidatke, ki podeljuje zaščito pred CagA je z Cav1 odvisnega način, smo izvedli interakcij protein zaslon na osnovi MALDI-MS (sl. 7A). AGS /Cav1 celice so bili okuženi 16 ur s H. pylori Ta rezultat nas je spodbudilo, da pomnoževanje cDNA variante 4 človeškega DLC1 [39] iz človeškega hepatoma HepG2 celic (Slika . 7C). CDNA smo vstavili v ekspresijski vektor pTarget (PT-DLC1v4), čemur sledi prehodni transfekciji v starševski AGS ali HEK293 celicah za 24 h. WB analize zazna izražanje ~110 kDa proteina, v skladu s predvideno velikostjo DLC1v4 [39]. Prehodno transficirane AGS celice nato okužen z H. pylori
( H. Pylori
) je pomemben dejavnik tveganja za raka človeške želodčne (GC), kjer je Cav1 pogosto navzdol regulirane. Vendar pa je funkcija Cav1 v H. pylori
okužbo in patogeneza GC ostal neznan. Pokazali smo tukaj, da miši Cav1 s pomanjkanjem, okuženih za 11 mesecev z CagA dobave, pomanjkljiva H. pylori
sev SS1, razvili strožjo gastritis in poškodbe tkiva, vključno z izgubo parietalnih celicah in foveolar hiperplazija, in prikaže nižjo kolonizacijo sluznice želodca od divjega tipa B6129 littermates. Cav1-null miši pokazala izboljšano infiltracija makrofagov in B-celic in izločanje Kemokini (RANTES), vendar se je znižalo ravni od CD25 + regulatornih T-celic. Cav1 s pomanjkanjem GC celice človeka (AGS), okuženi z CagA izročitvi obvladajo H. pylori
sev G27, so bili bolj občutljivi na povezanih s CagA citoskeletnim stresnih morfologijo ( "kolibrija") v primerjavi z AGS celice stabilno transfekciji s Cav1 (AGS /Cav1). Okužba AGS /Cav1 celic sproži zaposlovanje P120 RhoGTPase-aktivacije proteinskih /izbrisanih v jetrih rak-1 (p120RhoGAP /DLC1), da Cav1 in ovirali-CagA povzroča citoskeletnim prerazporeditve. V GC humanih celičnih linijah (MKN45, N87) in miška želodčne tkiva, H. pylori
down-urejeno endogenega izražanje Cav1 neodvisno od CagA. Mehanično, H. pylori PODJETJA
aktivira sterola odzivali na element-vezavni protein-1 (SREBP1) za zatiranje transkripcijo človeškega Cav1 gena iz sterolov odzivna elementov (SREs) v proksimalni promotor Cav1. Ti podatki kažejo zaščitno vlogo Cav1 proti H. pylori
inducirano vnetje in tkiva škodo. Predlagamo, da H. pylori
izkorišča dol ureditev Cav1 omajalo imunski odziv gostitelja in za spodbujanje signalizacijo svojih virulentnih dejavnikov v gostiteljske celice.
( H. pylori
) v glavnem prizadene otroke v državah v razvoju, ki so v nevarnosti za napredovanje raka želodca (GC) kot pri odraslih po več letih vztrajnih okužbe, še posebej s sevi, ki so pozitivni na onkogensko virulence dejavnik CagA. Izkoreninjenje H. pylori
z antibiotiki je zdravljenje izbire, lahko pa tudi spremeni dovzetnost za alergije in drugih vrst tumorjev. Tako, potrebne so nove diagnostične ali prognozi, ki odkrivajo zgodnje molekularne spremembe želodčne sluznice ob prehodu kroničnega vnetja raka. V naši raziskavi smo ugotovili, da je tumor supresorski caveolin-1 (Cav1) zmanjša na okužbo s H. pylori
in CagA bilo dovolj, vendar ni nujno, da to navzdol regulaciji. Izguba Cav1 je povzročil H. pylori
-dependent aktivacija sterolov se odzivajo-element vezavo protein-1 (SREBP1), in ta dogodek odpravila interakcijo Cav1 s P120 RhoGTPase-aktiviranje beljakovin /črta v raka-1 jeter (p120RhoGAP /DLC1), sekundo bona fide
zaviralnih želodčnega tkiva. Prepričljivo, lahko Cav1 in DLC1 predstavlja nove molekulske označevalce v H. pylori
okuženimi želodčne sluznice pred neoplastične transformacije epitela
gastritis. PLoS Pathog 9 (4): e1003251. doi: 10,1371 /journal.ppat.1003251
( H. pylori
) je po Gramu negativna bakterija, ki colonizes želodcev cca. 50% svetovnega prebivalstva in povečuje tveganje za razvoj kroničnih gastritis, peptičnega ulkusa, želodčni sluznici povezan limfoidni tkivni (MALT) limfom, atrofija sluznice in rak želodca (GC) [1], [2]. na podlagi teh etiologijo, H. pylori
je uvrščen kot razred I rakotvorne snovi, ki jih je Svetovna zdravstvena organizacija (WHO) leta 1994 [3].
toksini [4], CagA in Vaca, steka v želodcu epitelijskih celic po injekciji preko bakterij tipa sistem izločanja IV (CagA) [5], ali z neposrednim vstavitvijo v lipidnih splavov (Váca) [6] [7]. Lipidov splavi so holesterol in sfingolipid bogati mikrodomene v plazemski membrani [8], [9], ki jih izkoriščajo veliko povzročiteljev bolezni, vključno z virusi, paraziti in bakterije, za lažje sprejemanje celih organizmov in /ali internalizacije toksinov v celice gostitelja [ ,,,0],10], [11] [12]. Na primer, Neisseria spec
. uporablja lipidov splavov in Rho posredovanega signalizacijo na aktina citoskeleta dostop do citosol [13]. Pseudomonas aeruginosa
izkorišča lipidov epitelnih celic, splav, povezane cestninski kot receptor 2 za okužbe pljuč [14].
Dokazano je, da prebavi holesterola iz gostitelja celične membrane in gostitelj holesterola spreminja onkogenih lastnosti CagA [26], [27].
okužbe in /ali efektorske funkcije. Natančneje, smo vprašali, ali (i) H. pylori
izkorišča Cav1 olajšati injekcijo in navzdol-stream signalizacijo CagA v želodčnih epitelnih celic ali (ii) Cav1 deluje kot zaščitni "neprepustnega uveljavitev" beljakovine, ki preprečuje bolezni, ki jih H izzvan. pylori
. Za to so fenotipi, ki izhajajo iz H preizkusiti. pylori
okužbe so preučevali pri miših Cav1 s pomanjkanjem in GC humanih celičnih linijah. Naši podatki so pokazali, da Cav1 zaščiten B6129 miši proti H. pylori
-povezana gastritis in tkivne poškodbe in vivo
neodvisno CagA. H. pylori PODJETJA
aktiviran tudi SREBP1 in navzdol regulirano ekspresijo mišjim in humanim Cav1 neodvisno od CagA. Poleg tega Cav1 preprečujejo CagA odvisne citoskeletnim preureditve in vitro
jih zaposlovanjem v supresorski tumorja črta v jetrih raka-1 (DLC1).
Materiali in metode
sev SS1 smo izvedli oralno, kot je opisano [31]. Povprečni čas miši iz različnih genetskih okolij (C57BL /6, B6129, BALB /c) da za prehod na kronični gastritis in naprej (želodca atrofija, hiperplazija, displazija) [32] se giblje med 10 in 15 meseci na okužbo s standardizirano referenco sev SS1 [28] [33] [34] [35]. Zato smo se odločili za naše analize v tem časovnem obdobju.
bili
poliklonalni Ab je bila uporabljena kot je opisano v [36]. Serumskih citokinov smo izmerili z ELISA (R &D Systems, Minneapolis, MN) v skladu z navodili proizvajalca. Potegnite navzdol teste za mala GTPases Rho /Rac /CDC42 so bili kupljeni od Biocat (Heidelberg, Nemčija).
celične kulture
sev G27 je bila izvedena kot prej [36].
Bakterijska kultura
SS1 in G27 bakterije so opomogla od -80 ° zalog C glicerola in zrasel na Wilkins-Chalgren (WC) krvni agar plošče pod pogoji microaerobic (10% CO2, 5% O2, 85% N2, 37 ° C) za 2-3 dni. The-miš prilagojeno H. pylori
SS1 je pridelano iz agar plošče za in vivo
okužb, kot je bilo prej [31] objavila. Sev SS1 je PCR pozitiven za cagA
gene in mRNA, vendar ni injicirati funkcionalno CagA protein [40], kot je razvidno z odsotnostjo fenotip "kolibrija" v okuženih AGS celicah (podatki niso prikazani) . The-cell prilagojeno H. pylori
bakterije CagA dostavo obvladajo G27 ut
in CagA-izbris mutant G27 Delta cagA
so bile pridelane iz agar plošče in nato gojijo v stalnem sodelovanju kulture z MDCK celic, kot je opisano [36].
količinsko enot, ki tvorijo kolonije (CFU)
selektiven WC krvni agar plošče. Število bakterijskih kolonij je bila določena po 5 dneh normalizirajo na težo ustreznih kosov želodcu.
Obdelava miške želodčnega tkiva
gentamicina zaščita vsebnosti
G27 seva od 2 h do 24 h na množico okužbe (MNZ) od 500:1. Zatem smo celice izprali trikrat s PBS, da se odstrani bakterije in so bili dodatno inkubirali 2 uri pri 37 ° C v navlaženi atmosferi v DMEM /F12 (10% FCS, 10% Brucelo brozge) z dodatkom gentamicina (200 ug /ml ), penicilin /streptomicina (100 ug /ml) in kloramfenikol (100 mg /ml). Odsotnost zunajceličnih bakterij je bila potrjena pod mikroskopom, in celice so nato lizirali za odkrivanje znotrajcelično CagA ga Western blot (WB).
Coimmunoprecipitation (CoIP) in Western blot (WB)
Imunofluorescenčni
okuženimi celice z LSM510 (Zeiss) in Volocity (Improvision, Tübingen, Nemčija) je bila izvedena kot prej [37].
kolonizacija v želodčni sluznici bila zabeležena kot blage (nekaj in posameznih bakterij v naključne porazdelitve), zmerno (eno- in nakopičenih bakterij v nezvezne porazdelitve) in hudo (gosto bakterijskih skupin, ki pokrivajo želodčne sluznice v zveznih plasti). smo določili več mnogo različnih regijah želodcu. Imunohistokemija (IHK) je bila izvedena na parafinskih odsekih, kot je opisano prej [44].
Elektroforetskimi premik mobilnost test (EMSA), kromatin imunoprecipitacije (čip), obratno prepisovanje PCR (RT-PCR) in kvantitativni PCR (qPCR)
celičnih preskusih
STATISTIKA
: CagA: YP_002266135.1, B5Z6S0; UreB. YP_626814.1, Q1CV82
SS1
okužba, B6129 WT in Cav1-KO miši so bili okuženi z mišjim prilagoditi in CagA-dostave pomanjkljiva H. pylori
sev SS1. Miši žrtvovati 11 mesecev pozneje, in H. pylori
smo izolirali iz resekcija želodca tkiva [31]. Cav1-KO miši so pokazali manj bakterijsko kolonizacijo sluznice želodca kot WT miši (7,3 ± 2,4 WT v primerjavi
1,6 ± 0,5 KO × 10 3 CFU /mg želodčne tkivo; * p = 0,0141; n = 15 na genotip) (sl. 1A). Histopatološke analiza je pokazala, da sta WT in Cav1-KO miši razvila aktivni kronični gastritis z infiltracijo mononuklearnih in polymorphnuclear (PMN) celice skupaj v želodčni sluznici (sl. 1B). V nasprotju s tem je imelo neokuženih WT in Cav1-KO miši ne intramucosal vnetja (podatki niso prikazani). Namesto tega se je gastritis precej razširjen v H. pylori
okuženimi Cav1-KO miši v primerjavi z okuženimi WT miši (sl. 1C). V Cav1-KO miši, povprečna ocena za gastritis (0,7 ± 0,2 WT v primerjavi
1,7 ± 0,1 KO; * p = 0,0002, n = 15 na genotip) je bila hujša (tabela 1), kot v WT miših in želodčne sluznice razstavljena intramucosal B-celic foliklov, foveolar hiperplazijo in izgubo parietalnih celic. Ti podatki kažejo, da se Cav1-pomanjkanje povezana s povečanim vnetni odziv v želodčni sluznici in manj učinkovito naselitev H. pylori
.
-povezana vnetje Cav1-KO miši, analizo RT-qPCR izbranih citokinov, površinskih označevalcev in Kemokini je bila izvedena (sl. 2A). Skladne z obstoječo vnetja, H. pylori
SS1 inducirano ekspresijo TNFalfa in IFNgamma v želodčni sluznici tako WT in KO miši. Poleg tega smo navedli povečano mRNA izraz CD 19 (B-celice) (1,6 ± 0,3 WT v primerjavi
3,3 ± 0,9 KO; p = 0,0512; n = 15 na genotip) in RANTES (CCL5) (1.3 ± 0,2 mas v primerjavi
2,1 ± 0,6 KO; p = 0.0449; n = 15 na genotip) v želodčni tkivu H. pylori
okuženimi Cav1-KO miši v primerjavi z okuženimi WT miši. V nasprotju s tem so nivoji mRNA CD4 (T-pomožne celice), CD25 (T-regulatorne celice) in CD86 (celice antigen predstavljajoče) zatreti z H. pylori
neodvisno od statusa Cav1. Imunohistokemija (IHK) zaznal izrazito povečanje intramucosal F4 /80-pozitivnih makrofagov v želodcu tkivu okuženih miši Cav1-KO v primerjavi z WT littermates (sl. 2B). limfocitov CD3 pozitivni bili nameščeni okrog in znotraj intramucosal foliklov (podatki niso prikazani).
KO, n = 9 na genotip), značilna vnetje, erozije in razjede, miši Cav1 s pomanjkanjem izrazil tudi višje zneske na mRNA, ki kodirajo za celjenje razjed beljakovine triperesne deteljice faktorja 2 (TFF2) (0,8 ± 0,3 WT v primerjavi
2,3 ± 0,4 KO; * p = 0,0048; n = 9 na genotip) in peroksisom proliferator aktiviran receptor gama (PPARg) (0,6 ± 0,2 WT v primerjavi
2,5 ± 0,5 KO; * p = 0,0008; n = 9 na genotip). Skratka, ti podatki kažejo, da izguba Cav1 povečuje dovzetnost miši do želodca vnetja in tkivnih poškodb.
Cav1 niti druge osebe oprijem H. pylori
sevi, da niti preživetje GC celic človeških
okužba in vitro
želodca celično linijo človeških epitelijskih bila uporabljena AGS, ki je bila stabilno transfektirali z Cav1 izražanja plazmida (AGS /Cav1) ali prazna vektorja (AGS /EV) [37]. Najprej smo pregledali, ali Cav1 vpliva na preživetje celic na H. pylori
okužbe (sl. 3A). AGS klonov z in brez Cav1 okužilo 48 ur s celicami prilagojeno CagA-dostavi pristojnemu H. pylori
sev G27 na različnih multiplicitete okužbe (MOI), ki segajo od 1:100 do 1:2000. Kolorimetrične MTT testi so pokazali, da je imel Cav1 ne vpliva na splošno preživetje AGS celic na H. pylori
okužbe. Podobne rezultate smo dobili z CagA-dostavo nesposobni H. pylori
SS1 in z analizo Western blot (WB) detekcijo ekspresije in fosforilacijo kinaz preživetja (AKT /PKB, ERK1 /2, p38MAPK) (podatki niso prikazani). Ker sta H. pylori
in Cav1 interakcijo v lipidne rafte, smo vprašali, ali oprijem bakterij na celice je odvisen od prisotnosti Cav1. AGS /Cav1 in AGS /EV celice inficiramo (MOI = 10), s G27 (sl. 3B, C) ali SS1 (podatki niso prikazani) bakterij za 30 minut, čemur sledi spiranje in poznejšo inkubaciji v svežem mediju za 2 uri. Zatem smo celice obarvamo za imunofluorescenco mikroskopijo in število bakterij, ki prilepljen na Cav1 izražajo ali prazne-vektorskih transficirane celice so bili prešteti (sl. 3B, C). med AGS /Cav1 in AGS /EV celice niso opazili nobenih razlik v oprijema, kar kaže, da Cav1 ne vpliva na adhezijo H. pylori
bakterije gostiteljske celice.
sevi in prenos CagA v citosol [47]. Preučiti vlogo Cav1 v tem, stres povzroča preureditev aktina citoskeleta, so AGS /Cav1 in AGS /EV okuženih 16 ur s H. pylori
G27 ut
ali izogenimi mutant Delta cagA
(MOI = 100). Okužene celice smo obarvali kot je opisano zgoraj, in število podolgovatih AGS celic smo določili (sl. 4A, B). Cav1 s pomanjkanjem AGS celice pokazala precej bolj podolgovate morfologijo kot Cav1-izražajo celic (11 ± 0,8% AGS /EV v primerjavi
4 ± 0,8% AGS /Cav1; * p = 1,1 × 10 -8; n = 3 klonom). Kot je bilo pričakovati, ni bilo "kolibrija" fenotip pridobljeno v celicah, okuženih z CagA dobave, pomanjkljiva SS1 ali CagA-brisanje mutant G27 Delta cagA
sevov, ki so tako ne morejo dati injekcijo funkcionalno CagA proteina v celice gostitelja (podatki niso prikazani). AGS /EV celice proizvajajo tudi več IL8 mRNA na H. pylori
okužba G27 kot AGS /Cav1 celic (64 ± 19 EV v primerjavi
19 ± 6 Cav1; * p = 0,0176; n = 3 klonom) (. slika 4C). Ti podatki kažejo, da Cav1 ščiti pred povezane z CagA celični stres.
1,4 ± 0,1 AGS /Cav1 * p = 0,0012; n = 3 klonom) fosforiliranega osrednja oprijemljivosti kinaze (FAK) v Cav1 izražajo celicah okuženih z H. pylori
G27. Ti podatki potrjujejo, da AGS /Cav1 celice, okužene z CagA-dostavo pristojni H. pylori
ohranila svojo razširjeno-out epitelne obliko v primerjavi s stresom podolgovate fenotip Cav1 /EV celic.
G27 sproži vezava p120RhoGAP /DLC1 da Cav1 v GC celicami
G27. Okužba AGS celic izzvan hitro fosforilacije Cav1 v AGS /Cav1 celic in Src v obeh AGS /Cav1 in AGS /EV celic. Ta rezultat je pokazala, da Cav1 deluje dolvodno od CagA odvisna od aktivacije Src vendar gorvodno od aktivacije majhnih GTPases (sl. 5A, B). V skladu s tem sklepom, raven beljakovin fosforiliranega JNK, ki prebiva v nadaljevanju ZRC, so bile višje v AGS /EV celic v primerjavi z AGS /Cav1 celic.
G27 bakterije z Cav1 v CoIP ali imunofluorescenčnega poskusi (sl. 6A, B). Gentamicina testi za zaščito je pokazala, da je bila celotna količina vbrizganega znotrajcelične CagA tudi neodvisen od Cav1 navzočnosti (sl. 6c). Tako Cav1 niti zaviral oprijem H. pylori
bakterije do niti vbrizgavanjem CagA v celico gostiteljico, ampak zmanjša učinke po toku navzdol od CagA na znotrajcelično signalizacijo.
G27 (MOI = 100), čemur sledi liza celic pri sobni temperaturi v MES-pufru 1% (v /v) Triton-X100. Beljakovinski trakovi, ki jih Cav1 protitelesi Oborjene so vidne tudi barvanje s srebrom, in so bile ugotovljene peptide, ki MALDI-MS, kot je bilo prej [29] objavila. Protein fragment ~95 kDa vsebuje peptide, ki ustreza varianti 4 P120 Rho GTPase-aktiviranje beljakovin /črta v jetrih rak-1 (p120RhoGAP /DLC1) [51], [52] je zaviralnih povezana s kontaktnimi zarastline in caveolae /lipidov splavi [53]. DLC1 varianta 4 (DLC1v4) ima predvideno velikost ~110 kDa ter je obogaten v vzorcih iz celic, ki so bile okužene z H. pylori
G27 v primerjavi z neokuženih celic (tabela S2). Ti rezultati so potrdili CoIP za Cav1 in endogene DLC1 beljakovin v AGS /Cav1 celic (sl. 7B), kar kaže, da je H. pylori
G27 izzvan posebno zaposlovanje DLC1 za Cav1 v okuženih želodčne epitelijskih celic.
G27 (moi = 100) za dodatno 16 ur. Imunofluorescenco je pokazala, da DLC1 per se
ni zaviral nastanek "brenčanje ptičje" fenotip-CagA povzroča (19 ± 2% AGS /DLC1 v primerjavi
19 ± 2% AGS /EV; n = 3 klonom) v primerjavi s praznimi prenašalci transfektiramo celice (sl. 8A, B). Namesto, DLC1 spodbuja celice širi (20 ± 3% AGS /DLC1 v primerjavi
11 ± 2% AGS /EV; * p = 0,0067; n = 3 klonom) skladni z njeno vlogo pri uravnavanju kontaktnih zarastline [ ,,,0], H. H. pylori
okužbe. pylori
.
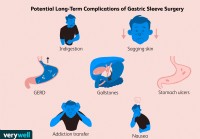 Dolgotrajni zapleti po operaciji želodčnega rokava
Dolgotrajni zapleti po operaciji želodčnega rokava
 Alergikom prijazni priboljški za noč čarovnic
Alergikom prijazni priboljški za noč čarovnic
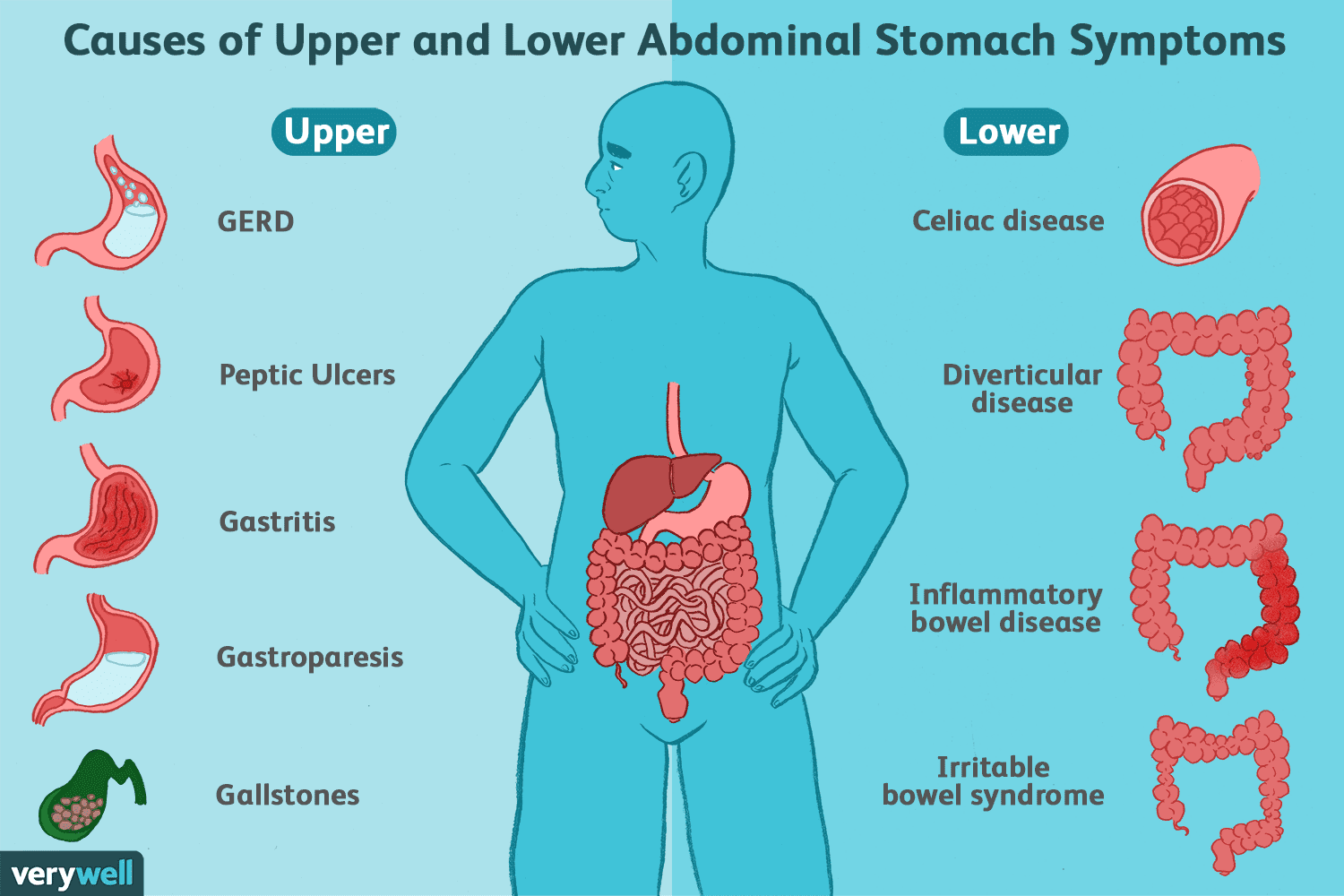 Črevesne bolezni in motnje (ki niso KVČB)
Črevesne bolezni in motnje (ki niso KVČB)
 Prehrana in občutljivost pšenice brez celiakije
Prehrana in občutljivost pšenice brez celiakije
 Psihološke terapije imajo lahko dolgoročne koristi za bolnike z razdražljivim črevesjem
Psihološke terapije imajo lahko dolgoročne koristi za bolnike z razdražljivim črevesjem
 IBS in kontracepcijske tablete
IBS in kontracepcijske tablete
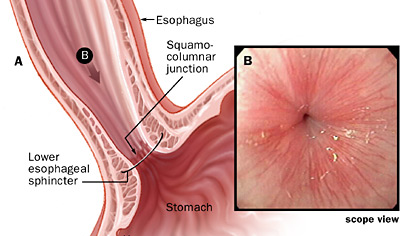 Barrettov požiralnik
Barrettov požiralnik je zaplet GERB. Gre za metaplazijo spodnje sluznice požiralnika od stratificiranega skvamoznega epitelija, ki običajno obdaja distalni požiralnik do neciliranega stebričnega epite
Barrettov požiralnik
Barrettov požiralnik je zaplet GERB. Gre za metaplazijo spodnje sluznice požiralnika od stratificiranega skvamoznega epitelija, ki običajno obdaja distalni požiralnik do neciliranega stebričnega epite
 Vodnik za nivoje fekalnega kalprotektina, teste in vnetne črevesne bolezni
Ugotovite, kako deluje test kalprotektina in kaj visoke ravni fekalnega kalprotektina pomenijo za vaše zdravje v tem članku. Težave s spodnjim prebavnim traktom, kot so driska, zaprtje, napenjanje
Vodnik za nivoje fekalnega kalprotektina, teste in vnetne črevesne bolezni
Ugotovite, kako deluje test kalprotektina in kaj visoke ravni fekalnega kalprotektina pomenijo za vaše zdravje v tem članku. Težave s spodnjim prebavnim traktom, kot so driska, zaprtje, napenjanje
 Kaj morate vedeti o zeliščnih stimulativnih odvajalih
Zelišča, znana po svojih odvajalnih učinkih, lahko najdemo v različnih prehranskih dopolnilih, čajih za hujšanje in pripravkih za čiščenje debelega črevesa. Preden razmišljate o uporabi enega od teh i
Kaj morate vedeti o zeliščnih stimulativnih odvajalih
Zelišča, znana po svojih odvajalnih učinkih, lahko najdemo v različnih prehranskih dopolnilih, čajih za hujšanje in pripravkih za čiščenje debelega črevesa. Preden razmišljate o uporabi enega od teh i