NMDA liksom andra nitrosaminföroreningar har undersökts ett tag nu av FDA, särskilt i blodtrycksmedicin som kallas Angiotensin II Receptor Blockers. Höga halter av nitrosaminer har lett till att flera märken av dessa läkemedel återkallas. För närvarande är halterna av nitrosaminer som upptäcks i märken av ranitidin låga och FDA skulle offentliggöra uttalanden om återkallelse. Detta var en varningsrapport.
Rapporten säger, ”Patienter bör kunna lita på att deras läkemedel är så säkra de kan vara och att fördelarna med att ta dem uppväger alla hälsorisker. Även om NDMA kan orsaka skada i stora mängder, de nivåer FDA hittar i ranitidin från preliminära test överstiger knappt mängder du kan förvänta dig att hitta i vanliga livsmedel. ”
Ranitidine är ett allmänt använt receptfria och receptbelagda läkemedel som tillhör H2 (histamin-2) blockerare av läkemedel och är användbart för att minska syrautsöndringen i magen. Det används för behandling av halsbränna, syraintag etc. Recept ranitidin används för behandling av sura peptiska störningar, förebyggande och behandling och behandling av GERD (gastroesofageal refluxsjukdom).
Från och med nu tittar FDA på källan till NDMA vid ranitidintillverkning och hoppas att om den tas bort, läkemedlet kan förklaras säkert igen. Rapporten säger, ”FDA kommer att vidta lämpliga åtgärder baserat på resultaten av den pågående utredningen. Byrån kommer att ge mer information när den blir tillgänglig. ”
Varningen upprepar att individer inte ska sluta ta ranitidin baserat på denna varning. Personer som vill avbryta sina ranitidinrecept måste prata med sina vårdgivare om alternativa behandlingsalternativ, säger FDA.
FDA tillade i varningen, "Konsumenter och vårdpersonal bör rapportera eventuella biverkningar med ranitidin till FDA:s MedWatch -program för att hjälpa byrån att bättre förstå omfattningen av problemet." De ber konsumenterna att fylla i och skicka in en rapport online på www.fda.gov/medwatch/report.htm och fylla i lämpligt formulär och skicka via fax på 1-800-FDA-0178.
Den 24 september, FDA släppte igen en varning som varnade sjukvårdspersonal och patienter om att de hade återkallat 14 massor av receptbelagda ranitidinkapslar som distribuerades av Sandoz Inc. Denna återkallelse berodde på mängden NDMA som fanns i partierna.
Tillförordnad FDA -kommissionär Ned Sharpless, M.D., i ett uttalande, ”FDA har åtagit sig att se till att medicinerna amerikaner tar är säkra och effektiva. Vi började testa ranitidinprodukter direkt efter att vi fick veta om den potentiella orenheten. När vi identifierar bortfall i kvaliteten på läkemedel som utgör potentiella risker för patienter, FDA gör allt för att förstå frågan och ge vår bästa rekommendation till allmänheten så snabbt och exakt som möjligt. ” ”Vi kommer att fortsätta undersöka och arbeta för att säkerställa att denna typ av föroreningar inte överskrider acceptabla gränser, så att patienterna kan fortsätta att ta de läkemedel de behöver utan oro, " han lade till.
I den andra rapporten gav FDA information till patienter och hälso- och sjukvårdspersonal om ranitidin som producerats av Sandoz och sa att om patienten tog en av de återkallade medicinerna, han eller hon bör följa återkallelsesinstruktionerna på FDA:s webbplats. Rapporten tillade att de patienter som inte är några återkallade märken av ranitidin kan fortsätta att göra det. Rapporten tillade, "Det är viktigt att komma ihåg att inte allt ranitidin som marknadsförs i USA återkallas." Rapporten sa att patienter som tar OTC -ranitidin kan överväga andra alternativ för sina symtom.
Janet Woodcock, M.D., chef för FDA:s Center for Drug Evaluation and Research, i ett uttalande, ”Vi fortsätter vår utredning tillsammans med våra internationella motsvarigheter, och vi kommer att hålla den amerikanska allmänheten informerad om ytterligare återkallelser samt de potentiella riskerna med att ta ranitidinprodukter. ”
För att upptäcka nivåerna av NDMA har FDA lagt ut ett protokoll för tillsynsmyndigheter och tillverkare. Nivåerna av NDMA i ranitidin som tillverkas av dessa tillverkare ska rapporteras av dem med hjälp av dessa tester. Vidare ska de skicka proverna till FDA för testning av forskarna vid byrån.
 De 5 vanligaste matsmältningssjukdomarna och hur de behandlas
De fem främsta matsmältningssjukdomarna är: IBS :IBS, eller Irritable Bowel Syndrome, är en gastrointestinal störning som tekniskt sett är en sammansättning av symtom. Det diagnostiseras när en indi
De 5 vanligaste matsmältningssjukdomarna och hur de behandlas
De fem främsta matsmältningssjukdomarna är: IBS :IBS, eller Irritable Bowel Syndrome, är en gastrointestinal störning som tekniskt sett är en sammansättning av symtom. Det diagnostiseras när en indi
 Icke-farmakologiska strategier för IBS-D-hantering
Tro det eller ej, ungefär 20% av befolkningen har irritabel tarmsyndrom (IBS). Av detta ser vi att ungefär hälften av IBS-patienterna på Ignite Nutrition faller under paraplyet av diarré-predominant c
Icke-farmakologiska strategier för IBS-D-hantering
Tro det eller ej, ungefär 20% av befolkningen har irritabel tarmsyndrom (IBS). Av detta ser vi att ungefär hälften av IBS-patienterna på Ignite Nutrition faller under paraplyet av diarré-predominant c
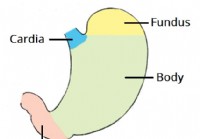 Magen
1 anatomisk position 2 Anatomisk struktur 2.1 Uppdelningar av magen 2.2 Större och mindre krökningar 3 anatomiska relationer 4 sfinktrar i magen 4.1 Inferior Esophageal Sphincter 4.2 Pylorisk sfink
Magen
1 anatomisk position 2 Anatomisk struktur 2.1 Uppdelningar av magen 2.2 Större och mindre krökningar 3 anatomiska relationer 4 sfinktrar i magen 4.1 Inferior Esophageal Sphincter 4.2 Pylorisk sfink