Detta experiment utformades för att fastställa lokaliseringen och neurokemiska fenotypning av sympatiska neuroner som levererar prepyloric område av svin magen i ett fysiologiskt tillstånd och under acetylsalicylsyra (ASA) inducerad gastrit. För att lokalisera det sympatiska perikarya magen på både kontroll och acetylsalicylsyra behandlade (ASA) djur injicerades med neuronal bakåtsträvande spårämne Fast Blue (FB). Sju dagar efter FB injektion, Djuren delades upp i en kontrollgrupp och ASA supplementation grupp. ASA-gruppen fick 100 mg /kg av kroppsvikt ASA oralt i 21 dagar. På 28 e dagen alla grisar avlivades med gradvis överdos av narkosmedel. Sedan fjorton-mikrometer tjocka kryostatsnitt bearbetades för rutinmässig dubbelmärkning immunofluorescens med användning av primär antisera riktade mot tyrosinhydroxylas (TH), dopamin β-hydroxylas (DβH), neuropeptid Y (NPY), galanin (GAL), neuronal kväveoxid syntas (nNOS), leu 5-enkefalin (LENK), kokain och amphetamine- reglerad transkriptet peptid (CART), kalcitoningenrelaterad-relaterad peptid (CGRP), substans P (SP) och vasoaktiv intestinal peptid (VIP). De data som erhållits i denna studie indikerar att postganglionära sympatiska nervfibrerna som levererar prepyloric område av porcin magen kommer från celiac-kraniala mesenteriska ganglion-komplex (CCMG). I kontrolldjur, FB-märkta nervceller uttryckte TH (94,85 ± 1,01%), DβH (97,10 ± 0,97%), NPY (46,88 ± 2,53%) och GAL (8,40 ± 0,53%). I ASA, var TH och DβH- positiva nervceller reduceras (85,78 ± 2,65% och 88,82 ± 1,63% respektive). Dessutom ASA- inducerad gastrit resulterade i ökad expression av NPY (76,59 ± 3,02%) och GAL (26,45 ± 2,75%) liksom den novo-syntesen av nNOS (6,13 ± 1,11%) och LENK (4,77 ± 0,42%) i spåras CCMG neuroner. Dessutom, ett nätverk av kasset-, CGRP-, SP-, VIP-, LENK- var nNOS- immun (IR) nervfibrer som omger FB-positiva perikarya observerats i både intakta och ASA-behandlade djur. Resultaten från denna studie indikerar inblandning av dessa neuropeptider i utvecklingen eller förmodligen motverkan av gastric inflammation Citation. Palus K, Całka J (2015) Inverkan av Långvarig Acetylsalicylsyra Komplettering-inducerad gastrit på neurokemi av det sympatiska nervceller Leveransen Prepyloric Region svin magen. PLoS ONE 10 (11): e0143661. doi: 10.1371 /journal.pone.0143661 Redaktör: Michael Bader, Max-Delbrück Centrum för Molekylär Medicin (MDC), Tyskland Mottagna: 16 augusti, 2015, Accepteras: 6 november 2015, Publicerad: 25 november 2015 Copyright: © 2015 Palus, Całka. Detta är en öppen tillgång artikel distribueras enligt villkoren i Creative Commons Attribution License, som tillåter obegränsad användning, distribution och reproduktion i alla medier, förutsatt den ursprungliga författaren och källan kredit datatillgänglighet: Alla relevanta uppgifter är inom pappers- Finansiering:. Publikation stöd av den polska statliga kommittén för vetenskaplig forskning nummer 1890 /B /P01 /2010/39, University of Warmia och Mazury i Olsztyn (lagstadgad forskning) bevilja nr 15,610. 003-300 och vet (Ledande National Research Centre) Vetenskaplig Consortium "friskt djur - Säker mat", beslut av ministeriet för vetenskap och högre utbildning nr 05-1 /KNOW2 /2015 Konkurrerande intressen: författarna. har förklarat att inga konkurrerande intressen finns. Inledning de senaste trettio åren har visat allt snabbare framsteg i studier av innervation av magtarmkanalen. I allmänhet är magen och tarmen innerverad av både neuroner inom intramural ganglier och därför tillhöra enteriska nervsystemet (ENS) [1, 2], samt av yttre cellkroppar med ursprung i sympatiska, parasympatiska och sensorisk ganglia [3- 5]. Nya undersökningar har visat att sympatiska ganglier är inte bara centrum för nervös integration men också innehav av viktiga egenskaper av sina nervceller. Bland annat de inkluderar konvergens centrala impulser, projektionen av viscerala impulser vid pre- och postsynaptiska nivåer, tillgång /möjliggör centrala fibrer av visceral skydd och pacemaker aktivitet [6, 7]. Dock inte sympatiska postganglionära neuroner som förser mag-tarmkanalen inte direkt påverka på dess funktioner men utövar sina effekter genom ENS [8, 9], eller sammandra artärerna som försörjer matsmältningsorgan [10]. Dessutom är magen funktion medierad och moduleras av massor av neuronala sändare och neuropeptider, som spelar en roll i regleringen av motilitet, syrautsöndring, hormonfrisättning, lokalt blodflöde och mucosal försvarsmekanismer [3]. det finns en stor volym av publicerade studier som beskriver sympatisk innervation av magen, som främst bygger på små laboratoriedjur, såsom råtta [10-12], mus [13, 14], marsvin [15, 16], kanin [17] eller husdjur, såsom hund [7] och katt [18, 19]. Författarna rapporterar att prevertebral ganglierna eg. celiaki ganglion utgör den huvudsakliga källan till postganglionära sympatiska innervationen av buken inälvor. Medan endast enstaka perikarya hittades i paravertebral ganglierna eg. sympatisk kedja ganglier [16, 20]. Hittills relativt lite är känt om innervation av magen i tamsvin, som liknar det i människa med avseende på anatomiska och fysiologiska kännetecken [21, 22]. Tidigare studier på området beskriver endast den extrinsiska innervation av tunntarm och tjocktarm [4, 20] eller fokusera på det enteriska nervsystemet [23, 24]. Det autonoma nervsystemet kännetecknas av hög plasticitet som svar olika patologiska stimuli, och förmågan att anpassa sig till förändrade miljöförhållanden [25, 26]. Anpassningen innebär förändras i kemisk fenotypen av neuroner genom ökat uttryck av vissa signalsubstanser och minskade för andra eller aktivering av uttryck av tidigare inaktiva gener [26, 27]. Under de senaste åren har det skett en ökande mängd litteratur som beskriver byte av kemisk kodning av sympatiska neuroner som förser mag-tarmkanalen under ileit [20], proliferativ enteropati [28], kolit [4] och axotomi [29-31]. Dessutom kan vissa Författarna föreslår att sympatiska neuroner förändra inte bara sin kemiska egenskap, men också uppvisar förmågan att regenerera [32]. Intressant nog vissa Författarna föreslår att sympatiska nervsystemet spelar en roll som en modulator av gastrointestinal inflammation, eftersom sympatiska neuroner leverera lymfoid vävnad. Dessutom har närvaron av receptorerna för sympatiska signalsubstanser i immunceller bekräftats [33]. Acetylsalicylsyra, känd som aspirin (ASA), är ett av de mest använda icke-steroida anti-inflammatoriska läkemedel (NSAID) i hela världen och är särskilt uppskattad för dess terapeutiska egenskaper. Fördelarna med den breda terapeutiska alternativ, såsom förebyggande av hjärt- och kärlsjukdomar, har behandling av symtom på olika inflammatoriska tillstånd, antitumöraktivitet, eller smärtlindring varit kända under många år [34]. Aspirin förhindrar prostaglandinsyntesen genom att hämma enzymet cyklooxygenas (COX) via irreversibel acetylering av hydroxylgruppen av en serinrest [35, 36]. COX kallas också som prostaglandin endoperoxidase syntas är ett membranbundet hemoprotein och glykoprotein enzym som katalyserar omvandlingen av cellmembranfosfolipider, involverade i syntesen av prostanoider som innefattar: prostaglandin (PG), prostacyklin (PGI) och tromboxaner (TXA) och existerar som 3 isoformer (COX-1, -2 och -3) [34, 37]. Eikosanoider, härledda från en reaktion som katalyseras av COX-1, är involverade i trombocytaggregation, skydd av magslemhinnan, och många andra fysiologiska processer, medan de som bildas med deltagande av COX-2 är delaktiga endast i utvecklingen av det inflammatoriska svaret. COX-3 är en post-transkriptionell modifiering av COX-1, som förekommer i det centrala nervsystemet [38]. Aspirin är en icke-selektiv NSAID och hämmar den enzymatiska aktiviteten hos COX-1 flera hundra gånger mer ett effektivt sätt, jämfört med COX-2 [38, 39]. Faktum är att dess verkan resulterar i både positiva (febernedsättande och antiinflammatoriska) och toxiska (gastrointestinal skada) effekter [40]. Även liten dos av acetylsalicylsyra inducerar ytliga skador i magsäcken epitel och leder till onormal jonflöde med ökad H + tillbaka diffusion. Dessutom hämning av COX-1, vilket leder till brist på prostaglandiner (PG) i mag- och tarmslemhinnan, accepteras som den viktigaste mekanismen för mucosal skador som inkluderar blödning, erosioner och sår [41]. Dessa skador uppträder oftast i human antrum och prepyloric området, även om de också kan ses i den proximala delen av tolvfingertarmen [34]. Dessutom minskade nivåer av prostaglandin E2 (PGE2) exponerar slemhinnan skada orsakad av klorvätesyra och galla, och minskar möjligheten för regenerering av slemhinneceller genom att minska frisättningen av slem, en hämning av ytaktiva medel och fosfolipider syntes, minskad sekretion av HCO 3 och störningar av blodflödet i mikrocirkulationen [40, 42]. För närvarande, är ganska fragmentarisk påverkan av aspirin-inducerad gastrit på adaptiva processer och neurokemiska egenskaperna av sympatiska neuroner som levererar magen Därför var detta experiment utformat för att fastställa följande:. 1) lokaliseringen och distributionen av sympatiska neuroner som förser prepyloric området i magen i tamsvin; 2) neurokemiska fenotyp av spåras perykarya i fysiologiska tillstånd; 3) eventuella förändringar i neurokemiska kodning av spåras nervceller under gastrit inducerad av långvarig acetylsalicylsyra tillskott. Etik Statement Det experimentella förfarandet inklusive avlivning godkändes av den lokala etiska kommissionen för experiment på djur vid universitetet i Warmia nad Mazury i Olsztyn (Tillstånds Numbers 05/2010). All kirurgi utfördes under natrium tiopental anestesi, och alla tänkbara ansträngningar gjordes för att minimera djurens lidande. Studien utfördes på tio unga suggor av den stora viten polska ras, cirka 8 veckor gammal och väger ca. 20 kg. Djuren hölls under vanliga ljusförhållanden i en temperaturkontrollerad miljö. De matades med kommersiell spannmålsblandningen och kranvatten efter behag
Material och metoder
Djur och kirurgiska ingrepp
. Alla djuren preanesthetized med azaperon (Stresnil, Jansen Pharmaceutica NV, Belgien, 4 mg /kg kroppsvikt, im) 15 min före tillämpningen av huvud bedövningsmedel, natrium tiopental (tiopental Sandoz, Kundl-Rakúsko, Österrike, 10 mg /kg kroppsvikt, som ges intravenöst). I syfte att lokalisera de sympatiska cellkroppar, var grisarna utsattes för median laparotomi och erhöll injektioner av det fluorescerande retrograd neuronal spårämne Fast Blue (FB, EMS-Chemie, GmbH, Tyskland) in i diamantformade delen (ca 4 cm x 4 cm) av magen anterior prepyloric vägg vid en total volym av 50
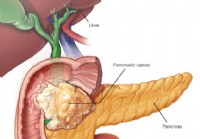 Bukspottkörtelcancer (adenokarcinom)
Bukspottkörteltumörer kan klassificeras i fyra kategorier:Vi kommer att fokusera på adenokarcinom här eftersom det är den typ av cancer som finns i 95 % av diagnostiserad pankreascancer. Epitelial:Du
Bukspottkörtelcancer (adenokarcinom)
Bukspottkörteltumörer kan klassificeras i fyra kategorier:Vi kommer att fokusera på adenokarcinom här eftersom det är den typ av cancer som finns i 95 % av diagnostiserad pankreascancer. Epitelial:Du
 Bajsning 101:4 tecken på att din bajs är frisk
Du skulle inte tro några av de bajsbilder som folk skickar e-post till oss. Jag ska bespara dig detaljerna, men jag har sett fler bajsselfies från människor för att hålla livet ut. Vårt team började
Bajsning 101:4 tecken på att din bajs är frisk
Du skulle inte tro några av de bajsbilder som folk skickar e-post till oss. Jag ska bespara dig detaljerna, men jag har sett fler bajsselfies från människor för att hålla livet ut. Vårt team började
 Vaginala bakterier kopplade till för tidig födsel
En ny studie publicerad i tidskriften Gränser i mikrobiologi i april 2020 rapporterar att kvinnor som levererar tidigt är mer benägna att ha ett större antal bakterier i sina födelsekanaler. Forskni
Vaginala bakterier kopplade till för tidig födsel
En ny studie publicerad i tidskriften Gränser i mikrobiologi i april 2020 rapporterar att kvinnor som levererar tidigt är mer benägna att ha ett större antal bakterier i sina födelsekanaler. Forskni