Baggrund
Infektion med Helicobacter pylori Metodologi /vigtigste resultater Ved hjælp af en musemodel for infektion og gastriske biopsier fra 29 personer, har vi analyseret makrofag rekruttering og polarisering under H. pylori Konklusioner /Betydning Disse resultater viser, at vaccination af mus mod H. pylori Henvisning:. Quiding-Järbrink M, Raghavan S, Sundquist M (2010) Forbedret M1 makrofag polarisering i Human Helicobacter pylori Redaktør: Niyaz Ahmed, University of Hyderabad, Indien Modtaget: 26 august, 2010; Accepteret: 7 oktober 2010; Udgivet: 23 November, 2010 Copyright: © 2010 Quiding-Järbrink et al. Dette er en åben adgang artiklen distribueres under betingelserne i Creative Commons Attribution License, som tillader ubegrænset brug, distribution og reproduktion i ethvert medie, forudsat den oprindelige forfatter og kilde krediteres Finansiering:. Denne undersøgelse blev støttet af videncenter MIVAC, finansieret af det svenske Fonden for Strategisk Forskning, den Adlerbert Research Foundation, Wilhelm & Martina Lundgrens fundament, Inga-Britt & Arne Lundberg fundament, og Sahlgrenska Universitetshospital. De finansieringskilder havde ingen rolle i studie design, indsamling og analyse af data, beslutning om at offentliggøre, eller forberedelse af manuskriptet Konkurrerende interesser:.. Forfatterne har erklæret, at der ikke findes konkurrerende interesser Introduktion Helicobacter pylori En stærk pro-inflammatorisk reaktion er forbundet med øgede niveauer af reaktive ilt og kvælstof arter i maveslimhinden [3], som kan fremme udviklingen af kræft [4]. For eksempel mus inficeret med H. pylori M1 makrofager typisk tage del i den indledende immunreaktion mod invaderende mikroorganismer og fremme T-hjælper (Th) 1 immunitet, hvorimod M2 makrofager induceres under opløsning fase af inflammation og er involveret i vragrester latrintømning, væv remodellering, og fremme af Th2 immunitet [8], [9]. Polarisering af makrofager er instrueret af mikromiljøet. M1 makrofager induceres af interferon-y og mikrobielle produkter, såsom lipopolysaccharid [9]. På den anden side, er M2 makrofager fremkaldt af TH2- eller anti-inflammatoriske cytokiner og vækstfaktorer, herunder IL-4, IL-10 og transformerende vækstfaktor-β [8], [9]. Under H. pylori øget hyppighed af makrofager, eosinofiler og neutrofiler i maveslimhinden efter H. pylori Rekrutteringen af medfødte celler til stedet for infektion er en forudsætning for smitsomme kontrol. Ikke alene kan medfødte celler, såsom makrofager og neutrofiler, deltage i bakteriel drab; de producerer også inflammatoriske mediatorer, der satte scenen for den efterfølgende immunrespons. For at undersøge akkumuleringen af medfødte celler i maveslimhinden under H. pylori Eosinofiler blev defineret som CD11b + Siglec-F + celler (Fig. 1C, [17]). Disse celler udtrykte mellemliggende niveauer af F4 /80 og havde en høj sidespredning profil, når analyseret ved flowcytometri (fig. 1E). Cresylviolet farvning af sorteret CD11b + Siglec-F + -celler bekræftet eosinofil morfologi (fig. 1C). Hyppigheden af eosinofile i maveslimhinden blev fordoblet efter otte uger, og steg yderligere efter 26 ugers infektion (fig. 1 F). Neutrofiler blev defineret som CD11b + Gr1 + celler (Fig . 1D). Da Gr1 antistof genkender både Ly6C og Ly6G epitop vi bekræftede, at alle CD11b + Gr1 + celler udtrykte det specifikke neutrofil markør Ly6G (fig. 1 D og E). Hyppigheden af neutrofiler steg 10 gange otte uger efter infektion og blev yderligere forøget efter 26 uger (fig. 1F). Således under H. pylori Karakterisering af gastrisk DCs For at karakterisere gastriske udviklingslandene, identificerede vi først en befolkning af CD11c + MHC-II + -celler (fig. 2A). Når disse celler blev yderligere analyseret for ekspression af F4 /80 og den αE integrinkæde CD103, halvdelen af CD11c + MHC-II + celler blev identificeret som F4 /80 + makrofager (fig. 2A ). Men blandt de CD11c + MHC-II + celler, som manglede ekspression af F4 /80, to populationer af formodede DC'er med differentiel ekspression af CD103 kunne skelnes (fig. 2A). På grund af de mange fluorochromer krævede vi valgte at kun karakterisere den gastriske CD103 + For at undersøge de mulige virkninger af H. pylori M1 polarisering af gastrisk makrofager under H. pylori Da vores resultater antydede, at mavens makrofager måske ikke fuldt aktiveret under H. pylori for at identificere kilden til iNOS og CXCL11 i maveslimhinden, makrofager (CD11 + Gr1 -Siglec-F -MHC-II +), eosinofiler (CD11 + Gr1 -Siglec-F + MHC-II -), og de resterende celler efter gating ud makrofager og eosinofiler (CD11b - og CD11b + Gr1 +), blev sorteret fra poolet gastriske lamina propria celler fra mus inficeret med H. pylori Vaccination mod H. pylori Beskyttende immunisering mod H. pylori Derudover analyserede vi hyppigheden af makrofager i maveslimhinden af immuniserede og udfordret mus ved flowcytometri. I forhold til inficerede kun for mus, immuniserede mus havde en signifikant øget hyppighed af gastrisk makrofager tre uger efter udfordring (fig. 5C). Men på trods at makrofager blev rekrutteret til maveslimhinden af immuniserede og udfordrede mus, makrofagerne ikke opregulere ekspressionen af CD86 eller MHC-II vedrørende inficeret kun mus (fig. 5D). Disse resultater viser, at efter en vellykket vaccination med H. pylori forstærkning af makrofag M1 polarisering i human atrofisk gastritis Vi næste undersøgt rolle af H. pylori For at undersøge om den forøget mRNA-ekspression af M1 og M2 markører udmønter sig også i forøgede proteinniveauer blev totale proteiner ekstraheret fra antrale biopsiprøver og koncentrationen af iNOS og CCL18 blev bestemt ved ELISA. Gastric biopsier fra personer med atrofisk gastritis var kun tilgængelig for protein udvinding fra en frivillig, som er forskelligt angivet i figur 6B. Halvdelen af H. pylori Tilsammen disse resultater indikerer tilstedeværelse af både M1 og M2 makrofager i maveslimhinden af H. pylori I denne undersøgelse har vi undersøgt polariseringen af gastrisk makrofager under kronisk H. pylori I modsætning til human H . pylori Vi observerede en sekventiel rekruttering af medfødte celler til maveslimhinden af SS1-inficerede mus, med makrofagerne akkumulere temmelig sent under forløbet af infektion (26 uger). I modsætning hertil frekvenserne af gastriske neutrofiler og eosinofiler i maveslimhinden steg otte uger efter infektion og forblev forhøjede efter 26 uger. Ophobningen af makrofager forekom meget hurtigere i vaccinerede mus, i hvilket tilfælde frekvens af gastriske makrofager blev forøget allerede tre uger efter udfordring. Tidligere har vist neutrofiler at blive ansat til maveslimhinden af SS1-inficerede mus i to faser, en tidlige fase topper 1-2 dage efter infektion, og en sen fase, der indledes på 2-3 uger efter infektion [24]. En rekruttering mønster, svarende til den i neutrofiler, blev også beskrevet for gastriske makrofager [24]. Men makrofagerne blev defineret, da CD11 + Gr1 - celler [24], en cellepopulation, som i vore hænder primært består af eosinofiler (se fig 1 og 2.). Asim et al. definerede makrofager som CD11b + F4 /80 + celler, og observerede en tidlig top i makrofag nummer i maveslimhinden 1-2 dage efter infektion med H. pylori Vi var i stand til at identificere to populationer af DC'er i maveslimhinden af mus. Begge delmængder udtrykte høje niveauer af CD11c og MHC-II, manglede ekspression af makrofag markør F4 /80, men adskilte sig med hensyn til ekspression af CD103. Hyppigheden af gastrisk CD103 + udviklingslandene ikke ændrede efter fire, otte eller 26 ugers H. pylori På trods af, at M1 makrofager typisk opregulere MHC-II og co-stimulerende molekyler, vi kunne ikke registrere en øget ekspression af MHC -II eller CD86 på gastrisk makrofager eller CD103 + DC'er fra enten immuniserede eller immuniserede mus efter infektion. I modsætning hertil in vitro inkubation af H. pylori Under akutte inflammatoriske responser, makrofager er typisk polariseret til M1 og udøve potente antimikrobielle virkninger. For eksempel, infektion med Salmonella typhimurium Vil makrofager bidrager til værtsforsvar mod H. pylori Som konklusion, denne undersøgelse viser, at vaccination af mus mod H. pylori Materialer og metoder Etik erklæring Undersøgelsen blev godkendt af regeringen dyreetik komité (Göteborgs djurförsöksetiska nämnd, 328/2008 og 254 /2009). Den regionale menneskelige etiske komité i Västra Götaland County i Sverige (706/03 og 85/06) godkendte undersøgelsen, og skriftligt informeret samtykke blev opnået fra alle deltagere. Dette er den eneste myndighed, hvori etisk tilladelse til forskning på mennesker i Sverige, og det er ikke direkte forbundet til hospitaler eller universiteter. Female C57BL /6 mus blev købt fra Charles River Laboratories (Sulzfeld, Tyskland), eller i tilfælde af forsøg vaccinationen fra Taconic (Ejby, Danmark). Mus blev inficeret i en alder af 8-12 uger. H. pylori Mus fik fire 10 pi doser på 500 ug H. pylori Vurdering af bakteriel kolonisering Til kvantitativ vurdering af bakteriel kolonisering i immuniseringsforsøg, den ene halvdel af maven blev forsigtigt vasket med PBS og homogeniseret under anvendelse af en Ultra Turrax homogenisator ( IKA Laboratory Technology, Staufen, Tyskland). Serielle fortyndinger af homogenatet blev udpladet på Skirrow agarplader. Når gastrisk lamina propria celler blev isoleret fra hele mave kunne ikke udføres en kvantitativ estimering af mavens bakteriel belastning. I dette tilfælde blev maven, som var skåret langs den største krumning og vasket i PBS, forsigtigt udstrøget på Skirrow agarplader. Tilstedeværelsen af H. pylori Isolering af gastrisk lamina propria celler kirtelmaven blev skåret i 5 mm stykker og inkuberes i alt tre gange med H.
udløser en kronisk gastrisk betændelse, der kan udvikle sig til atrofi og gastrisk adenocarcinom. Polarisering af makrofager er karakteristisk for både cancer og infektion, og kan fremme progression eller opløsning af sygdom. Men den rolle makrofager og deres polarisering under H. pylori
infektion er ikke veldefineret.
infektion ved flowcytometri og real-time PCR. Vi fandt en sekventiel rekruttering af neutrofiler, eosinofiler og makrofager til maveslimhinden af inficerede mus. Gen-ekspression analyse af mave væv og sorteres makrofager afslørede, at gastrisk makrofager blev polariseret til M1 efter H. pylori
infektion, og denne proces blev væsentligt accelereret efter forudgående vaccination. Menneskelig H. pylori
infektion var præget af en blandet M1 /M2 polarisering af makrofager. Men i H. pylori
associeret atrofisk gastritis, ekspressionen af inducerbare nitrogenoxidsyntase blev markant forøget sammenlignet med ukompliceret gastritis, indikerer en forbedret M1 makrofag polarisering i denne præmaligne læsioner.
forstærker M1 polarisering af gastriske makrofager, og at en tilsvarende forbedret M1 polarisering er til stede i human H. pylori
-induceret atrofisk gastritis
associeret atrofisk gastritis og i vaccinerede mus. PLoS ONE 5 (11): e15018. doi: 10,1371 /journal.pone.0015018
kolonisere maven epitel på mere end halvdelen af verdens befolkning [1]. Infektionen er ofte livslang og udløser en kronisk inflammation i maveslimhinden, hvilket i omkring 1-2% af inficerede individer efterhånden udvikler sig til gastrisk [1] adenocarcinom. Udvikling af gastrisk cancer, især intestinale type, er en multi-trins proces, der udvikler sig over årtier gennem præmaligne læsioner i den gastriske slimhinde, såsom atrofisk gastritis, intestinal metaplasi og dysplasi [2]. Resultatet af infektionen afhænger virulensen af det inficerende H. pylori
stammen, miljømæssige faktorer såsom rygning og kost, og være vært for genetiske faktorer, der har indflydelse på typen og intensiteten af den inflammatoriske respons [1].
i seks måneder har en øget frekvens af gastriske mutationer i forhold til ikke-inficerede mus [5]. Desuden mus, der er deficiente for enzymet inducerbar nitrogenoxidsyntase (iNOS) har en reduceret forekomst af mavekræft efter H. pylori
infektion og kræftfremkaldende udfordring sammenlignet med normale mus [6]. Mens iNOS bidrager til udviklingen af mavekræft, er et højt niveau af kemokinet CCL18 i gastriske tumorer er forbundet med langvarig overlevelse mavecancerpatienter [7]. Interessant er iNOS produceret af klassisk aktiverede /M1 makrofager henviser CCL18 produktion er et kendetegn for alternativt aktiverede /M2 makrofager [8]. Tilsammen tyder disse resultater på, at makrofag polarisering kan have en vigtig rolle i udviklingen af H. pylori
associeret gastrisk cancer.
infektion, er makrofager rekrutteret til maveslimhinden, hvor de bidrager til produktionen af pro-inflammatoriske cytokiner og chemokiner [10], [11], [12], [13], [14], [15] . Desuden viste en nylig undersøgelse, at liposommedieret udtømning af makrofager reducerede gastriske patologi H. pylori
-inficerede mus [16]. På trods af dette, den funktion af makrofager under in vivo H. pylori
infektion fortsat relativt dårligt defineret. Funktionen af makrofager er nært koblet til deres polarisationstilstand, som også synes at spille en rolle i udviklingen af gastrisk cancer [6], [7]. Derfor har vi undersøgt makrofag polarisering i maveslimhinden af H. pylori
inficerede mus og mennesker. Vi viser, at vaccination af mus mod H. pylori
hastigheder og forstærker M1 polarisering af gastrisk makrofager. Desuden er den præ-kræft læsion atrofisk gastritis karakteriseret ved en forbedret makrofag M1 polarisering hos mennesker.
Resultater Salg
infektion
infektion, vi inficerede C57BL /6 mus med musen tilpassede H. pylori
Sydney stammen en (SS1), og efter fire, otte og 26 uger, vi analyserede den gastriske inflammatoriske infiltrat af individuelle mus ved flerfarvede flowcytometri. Det samlede antal lamina propria celler isoleret fra maven ændrede ikke i de første fire uger af infektion, men på otte uger efter infektion det totale antal celler isoleret fordoblet, og efter 26 ugers infektion var der en otte gange stigning i det samlede antal af celler isoleret i forhold til ikke-inficerede mus (fig. 1A). Blandt de celler, rekrutteres til maven var makrofager, eosinofile og neutrofile. Gastriske makrofager blev identificeret som celler, der udtrykker CD11 og større histokompatibilitetskompleks klasse II (MHC-II), men mangler ekspression af Gr1 (neutrofil markør), CD103 (udtrykkes af en undergruppe af dendritiske celler (DC'er)) og sialinsyre-bindende immunoglobulin- ligesom lectin (Siglec-F, eosinofil markør) (fig. 1B). Disse celler udtrykte makrofag markør F4 /80 (fig. 1E), og baseret på cellemorfologi blev bekræftet som makrofager (fig. 1B). Hyppigheden af makrofager i maveslimhinden forblev uændret efter fire og otte uger H. pylori
infektion (fig. 1F). Men efter 26 uger frekvens af gastriske makrofager blev øget i forhold til ikke-inficerede mus (fig. 1 F).
infektion er der en sekventiel ophobning af neutrofiler og eosinofiler, efterfulgt af makrofager i den gastriske lamina propria.
DC'er yderligere, da disse celler er blevet impliceret som vigtigt antigenpræsenterende celler i mucosale væv [18]. Gastric CD103 + DCs blev let identificeret ved farvning for CD11 c og CD103 (Fig. 2B). Den gastriske CD103 + DC'er udtrykte høje niveauer af MHC-II, og bestod af en CD11b lav og en CD11b høj delmængde (fig. 2C). Til sammenligning, mavens CD103 - DC'er blev alle CD11b høj (figur 2D.). Derudover CD103 + DC'er manglede ekspression af CD8a og F4 /80 (fig. 2C). Men hyppigheden af CD103 + DCs ændrede sig ikke væsentligt i maveslimhinden efter infektion (fig. 2E).
Gastric makrofager og CD103 + DC'er undlader at opregulere costimulerende molekyler efter H. pylori
infektion
infektion på ekspressionen af costimulerende molekyler og MHC-II ved gastriske makrofager og CD103 + DC'er blev ekspressionen af disse markører analyseret ved flowcytometri efter fire, otte og 26 ugers infektion. I steady state, makrofager og CD103 + udviklingslandene i den gastriske lamina propria udtrykte samme indhold af costimulerende molekyle CD86 samt MHC-II (fig. 3A). Overraskende blev ekspressionen af CD86 og MHC-II af enten gastrisk makrofager eller CD103 + udviklingslandene ikke steget efter infektion med H. pylori
forhold til alder-matchede naive mus analyseret parallelt (fig. 3B). Således makrofager og CD103 + DC'er i den gastriske lamina propria undlader at opregulere CD86 og MHC-II efter H. pylori
infektion, trods den igangværende inflammatorisk reaktion.
infektion
infektion, vi karakteriseret disse celler yderligere ved at undersøge deres M1 /M2 polarisering. Til bestemmelse makrofag polarisering under H. pylori
infektion, vi brugte real-time PCR for at måle ekspressionen af gener associeret med M1 eller M2 polarisering af makrofager i det gastriske væv [8], [9]. Vi målte også ekspressionen af IL-10, som kan fremstilles af regulerende makrofager [9]. Ingen af de analyserede markører var differentielt udtrykt fire uger efter H. pylori
infektion i forhold til naive mus (fig. 4A). Ved otte uger efter infektion ekspressionen af M1 Markers iNOS og CXCL11 øgedes signifikant, og disse markører blev yderligere opreguleres ved 26 ugers infektion (fig. 4A). Derudover blev ekspression af IL-10 opreguleres på otte og 26 ugers infektion i forhold til naive mus (fig. 4A). I modsætning hertil M2 markører fundet i inflammatorisk zone 1 (FIZZ1) og arginase-1 blev ikke differentielt udtrykt i maven på fire, otte eller 26 ugers infektion sammenlignet med naive mus (fig. 4A).
i 26 uger (fig. 4B). MRNA ekspression af iNOS og CXCL11 i sorterede cellepopulationer fra inficerede mus såvel som i de samlede gastrisk lamina propria-celler fra både naive og inficerede mus blev derefter bestemt ved real-time PCR. Et tilstrækkeligt antal sorterede makrofager kunne ikke opnås fra naive mus til pålidelig analyse af mRNA-ekspression. Gastric makrofager udtrykte det højeste niveau af iNOS og CXCL11 sammenlignet med de andre sorterede cellepopulationer og totale gastriske lamina propria celler før sorteringen (fig. 4C). Tilsammen viser disse resultater, at gastrisk makrofager er polariseret til M1 under H. pylori
infektion.
forstærker makrofag M1 polarisering
er generelt forbundet med den hurtige udvikling af en gastrisk Th1 respons [19]. Da Th1 cytokin interferon-γ inducerer makrofag M1 polarisering [9], vi undersøgte, om vaccination kan påvirke makrofag polarisering under H. pylori
infektion. Til dette formål blev mus immuniseret sublingualt med H. pylori
lysat og kolera toksin adjuvans og efterfølgende udfordret med H. pylori
SS1. Denne immunisering regime ført til en betydelig reduktion i bakteriel belastning i maven fire uger efter udfordring (fig. 5A). Samtidig blev ekspressionen af M1 og M2 markører i maven analyseret ved real-time PCR. I ikke-immuniserede mus, blev kun ekspressionen af CXCL11 signifikant opreguleret fire uger efter infektion sammenlignet med naive mus (fig. 5B). I modsætning hertil udviste immuniserede mus en stor opregulering af både M1 markørerne iNOS og CXCL11 henviser ekspressionen af M2 markører FIZZ1 og arginase-1 blev ikke ændret, fire uger efter challenge (fig. 5B). Den forøgede ekspression af iNOS og CXCL11 i immuniserede /udfordrede mus ikke skyldtes alene immuniseringen, eftersom immuniserede men ikke-udfordrede mus ændrede ikke ekspressionen af nogen af de analyserede M1 eller M2 markører i forhold til helt ubehandlede mus (data ikke vist ).
lysat og kolera toksin, makrofager ophobes i maveslimhinden og hurtigt polariseret til M1 efter infektion.
infektion og atrofisk gastritis for makrofag polarisering i den humane gastriske slimhinde. Til dette formål blev ekspressionen af humane M1 (iNOS, CXCL11) og M2 markører (CCL17, CCL18, CD206) målt i biopsier fra antrum ved real-time PCR. H. pylori
-inficerede individer med ukompliceret gastritis viste en signifikant forhøjede ekspression af mRNA for både M1 (iNOS, 8-fold; CXCL11, 20-fold) og M2 markører (CCL17, 30-fold; CCL18, 70-fold, CD206 , 2-fold) sammenlignet med ikke-inficerede frivillige (fig. 6A). Men personer med atrofisk gastritis (4/6 havde intestinal metaplasi udover atrofi) udtrykt endnu højere niveauer af iNOS mRNA sammenlignet med dem med ukompliceret gastritis (20-fold), mens CXCL11 og markører for M2 polarisering ligeledes blev udtrykt (fig. 6A). Faktisk ekspressionen af iNOS var, 180 gange højere i individer med atrofisk gastritis sammenlignet med ikke-inficerede kontroller (fig. 6A), hvilket indikerer en forøget M1 polarisering af gastriske makrofager hos patienter med atrofisk gastritis.
-inficerede individer havde påviselige niveauer af iNOS protein i antrum mens koncentrationen af iNOS var under detektionsgrænsen i alle ikke-inficerede individer (fig. 6B). Ekspressionen af iNOS mRNA og iNOS protein blev signifikant korreleret (R 2 = 0,88, P
< 0,01), hvilket indikerer, at mRNA analyse afspejler proteinekspression, selv når proteinet er lavt. Koncentrationen af M2 markør CCL18 blev øget i det gastriske væv fra H. pylori
-inficerede individer sammenlignet med ikke-inficerede kontroller (fig. 6B). Desuden blev koncentrationen af CCL18 protein signifikant korreleret med ekspressionen af CCL18 mRNA (R 2 = 0,754, P
< 0,01).
inficerede individer. Endvidere er atrofisk gastritis forbundet med en stærk forstærkning af iNOS-ekspression i maveslimhinden, hvilket indikerer en forøget M1 polarisering af makrofager.
Discussion
infektion. Vi viser, at H. pylori
-inficerede individer udtrykker mRNA i maveslimhinden indikerer en blandet M1 /M2 polarisering af makrofager, og dette blev yderligere bekræftet på proteinniveau. Men i H. pylori
-induceret atrofisk gastritis var der en markant stigning i ekspressionen af iNOS i forhold til ukompliceret gastritis. Atrofisk gastritis giver en øget risiko for at udvikle gastrisk cancer i forhold til ukompliceret H. pylori
associeret gastritis [20]. Den forøgede ekspression af iNOS i atrofisk gastritis kan bidrage til gastrisk cancerudvikling via produktion af reaktive nitrogenforbindelser, som kan fremme carcinogenese ved induktion af DNA-beskadigelse, afbrydelse af DNA-reparation, posttranslationel modifikation af proteiner, og p53-mutationer [4]. Faktisk iNOS-deficiente mus har en reduceret forekomst af gastrisk adenocarcinom efter H. pylori
infektion og udfordring med en kemisk carcinogen sammenlignet med normale mus [6]. Også polymorfier i promotorregionen af iNOS, hvilket fører til en højere transkriptionsaktivitet, korrelerer med en højere forekomst af intestinal type gastrisk cancer hos japanske kvinder [21].
infektion, SS1-inficerede C57BL /6-mus viste en genekspressionsprofilen i maveslimhinden indikerer makrofag M1 polarisering. Genekspressionsanalyse af sorterede makrofager isoleret fra maveslimhinden af inficerede mus bekræftede, at ekspression af M1 markørerne iNOS og CXCL11 blev beriget i den sorterede makrofag befolkning. Endvidere blev M1 polarisering af gastrisk makrofager væsentligt accelereret efter forudgående vaccination. Allerede fire uger efter angreb, immuniserede mus opreguleres ekspressionen af iNOS og CXCL11 til et lignende niveau som det ses efter 26 uger i inficerede kun for mus. Studier af iNOS-deficiente mus har vist, at iNOS fremmer udvikling af atrofi og kræft i maveslimhinden under Helicobacter
infektion [6], [22]. Desuden clearance H. pylori
efter vaccination sker uafhængigt af iNOS [23]. Således iNOS synes at bidrage til vært patologi snarere end beskyttelse under infektion med H. pylori
. Hvis derfor forøget produktion af iNOS i maveslimhinden bevares efter vaccination, kan det være en uønsket bivirkning, der kan forøge alvorligheden af H. pylori
induceret inflammation og malignitet, medmindre der opnås steril immunitet. Men for at den relative bidrag iNOS vært patologi versus beskyttelse under forskellige stadier af H. pylori
infektion kræver yderligere undersøgelse.
[15]. Desuden blev antallet af makrofager steg igen ved 60 og 120 dage efter infektion i forhold til naive mus [15]. Vi udvider disse resultater ved at vise, at ansættelsen af disse medfødte cellepopulationer opretholdes indtil 26 uger efter infektion. Desuden beskriver vi akkumulering af eosinofiler i maveslimhinden, en cellepopulation, at langt overstiger antallet af gastriske makrofager og neutrofiler (fig. 1). Faktisk rolle eosinofiler i H. pylori
induceret gastritis bør undersøges yderligere. Eosinofiler og makrofager andel ekspression af flere markører, herunder CD11b og F4 /80 (fig. 1, [25]). Derfor skal analyseres samtidig for at skelne disse medfødte cellepopulationer flere markører.
infektion. I modsætning til vores undersøgelse, en nylig undersøgelse fra Kao et al. kunne ikke detektere CD103 + DC'er i maveslimhinden af uinficerede mus [26]. Snarere CD103 + DCs opstået 24 timer efter H. pylori
infektion. Da de tider af analysen varierer mellem denne undersøgelse og vores eksperimenter, er det svært direkte at sammenligne resultaterne.
med humane monocytter [27], humane monocytafledte DCs [28], [29], [30], [31], murine knoglemarv-afledte DCs [32], [33], eller human primær gastrisk DC'er [34], inducerer opregulering af costimulerende molekyler og MHC-II. Derfor den manglende opregulere MHC-II og CD86 på gastrisk makrofager og CD103 + DC'er i kronisk H. pylori
infektion kan være forårsaget af inflammatoriske miljø og ikke af bakterier i sig selv. Faktisk er vekselvirkningen mellem DC'er og H. pylori
in vitro afspejler ikke nødvendigvis, hvad der sker in vivo, hvor den lokale mikromiljø på stedet for antigen erhvervelse og antigen præsentation samt DC delmængde involveret i antigen-præsentation af H. pylori
, vil påvirke svaret. For eksempel regulatoriske T-celler, som er fremherskende i H. pylori
-inficerede gastrisk mucosa [35], [36], kan forhindre opregulering af costimulerende molekyler og MHC-II på DC'er [37]. Derudover kan IL-10 forhindrer opregulering af costimulerende molekyler og MHC-II på makrofager og DC'er [38].
eller Listeria monocytogenes
inducerer M1 polarisering af makrofager, som er nødvendig for styring af infektionen [39]. Opløsning af inflammation er karakteriseret ved et skift i makrofag polarisering til M2, der fremmer vævsheling. Tuberkulosepatienter vise en forøget produktion af Th2-cytokiner som infektionen skrider frem [40], [41], som kan inducere M2 polarisering af makrofager. Hos mus, M1 polarisering af makrofager udgør den tidlige reaktion på Mycobacterium tuberculosis
, mens alveolære makrofager er polariseret til M2 under sent infektion [42]. Men skiftet i makrofag polarisering induceret af kroniske infektioner resulterer ofte i en reduceret kapacitet i makrofager til at dræbe invaderende bakterier [39], [43]. På den anden side er kronisk inflammation med vedvarende M1 makrofag polarisering forbundet med en øget risiko for udvikling af cancer [4].
? I modsætning neutrofiler, er makrofager ikke ofte ses i mavens lumen efter translokation over slimhinder [44]. Da H. pylori
fortrinsvis opholde sig i den gastriske slimlag eller er knyttet til gastriske epitelceller, kan makrofager ikke kommer i direkte kontakt med hele bakterier. Faktisk, udtømning af makrofager ved lægemiddel-liposomer havde ingen effekt på H. pylori
kolonisering [16], hvilket tyder på, at makrofager kan ikke bidrager direkte til at være vært for forsvar mod H. pylori
. I modsætning hertil kan makrofager fremme gastrisk patologi. For eksempel, liposommedieret udtømning af makrofager lindres det gastritis induceret af H. pylori
infektion [16]. Desuden selektiv deletion af I-KB-kinase β i myeloide celler, som forhindrer aktivering af NF-KB i disse celler, inhiberede udviklingen af gastrisk atrofi efter H. felis
infektion [45]. Således behøver makrofager ikke synes at bidrage til Helicobacter
clearance, men kan snarere fremme gastrisk patologi.
forstærker M1 polarisering af gastrisk makrofager. Et lignende fænomen ses i human atrofisk gastritis, hvor den blandede M1 /M2 polarisering til stede i ukomplicerede gastritis er erstattet af en M1-domineret polarisering. Dette kan inducere en tumorfremmende inflammation, og skiftende makrofag polarisering af M1 til M2 kunne derfor repræsentere et terapeutisk mål i kronisk H. pylori
infektion.
Mus
Bakterier og infektion af mus
SS1 blev dyrket på Columbia ISO agarplader i 2 dage ved 37 ° C, hvorefter de blev overført til Brucella-bouillon suppleret med 5% føtalt kalveserum (FCS) og antibiotika (Vancomycin, 10 ug /ml; polymyxin B , 20 U /ml; Trimethoprim, 5 ug /ml) og inkuberet omrystning natten over ved 37 ° C under mikroaerofile betingelser. Før infektion blev motiliteten af bakterierne bekræftet ved mikroskopi. Koncentrationen af bakterier blev vurderet spektrofotometrisk. Mus modtog 3 × 10 8 kolonidannende enheder af SS1 intragastrisk.
Sublingual immunisering
lysat (fremstillet ud fra stamme Hel305 som tidligere beskrevet [46]) kombineret med 10 ug choleratoksin (List Biological Laboratories Inc., Madison, NJ) sublingualt ved 1 uges mellemrum [47], [48]. To uger efter den sidste immunisering blev musene udfordret intragastrisk med 3 × 10 8 kolonidannende enheder af H. pylori
SS1.
kolonier blev bekræftet af en urease test. På den måde kunne vi bekræfte H. pylori
kolonisering og stadig bruge hele maven for celle isolation.
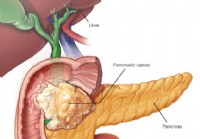 Bugspytkirtelkræft (adenokarcinom)
Bugspytkirtelkræft (adenokarcinom)
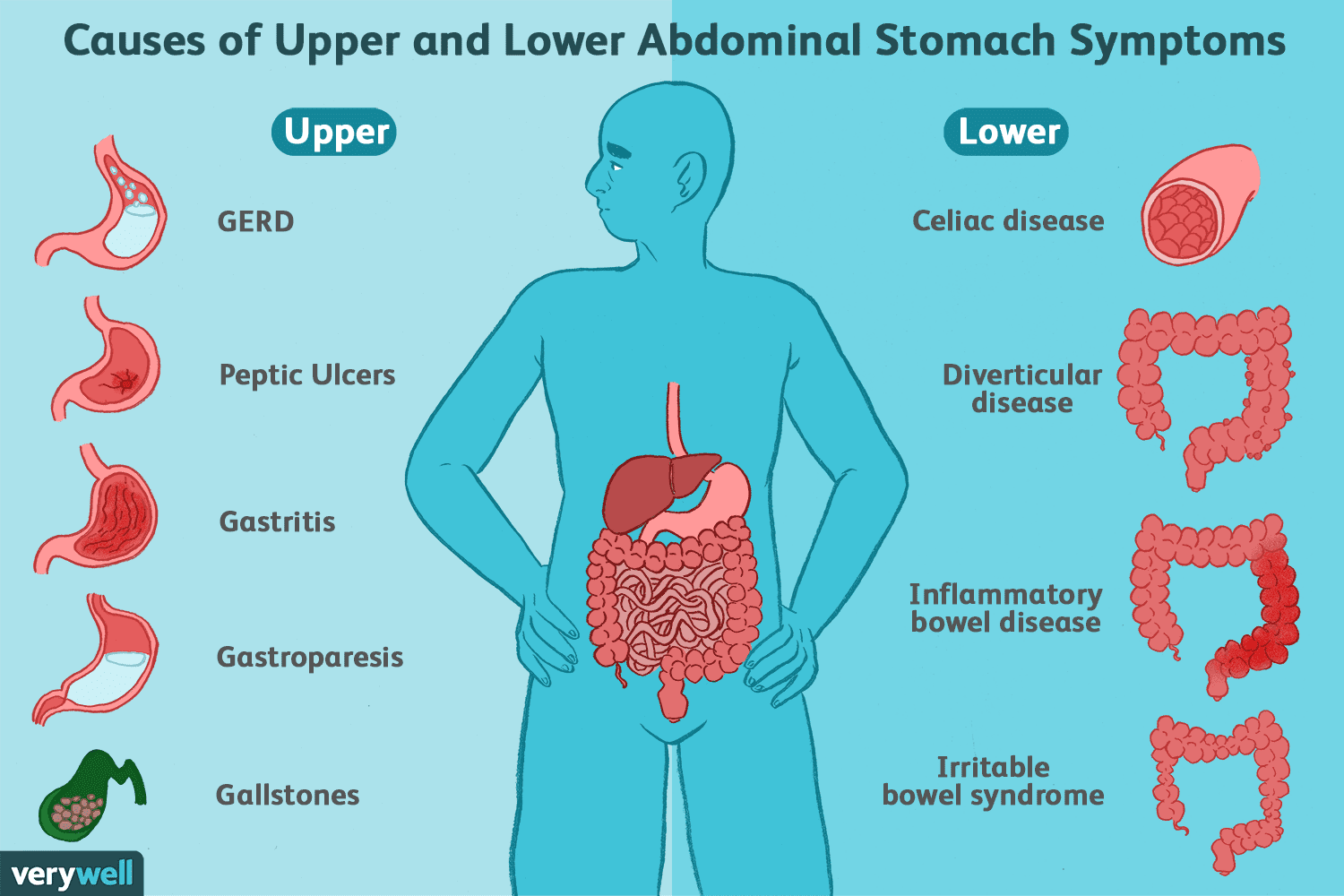 Tarmsygdomme og -lidelser (som ikke er IBD)
Tarmsygdomme og -lidelser (som ikke er IBD)
 Hvad kvalificerer som en screening versus en diagnostisk koloskopi?
Hvad kvalificerer som en screening versus en diagnostisk koloskopi?
 Forskellen mellem gode og gode praktiserende læger (det reddede mit liv)
Forskellen mellem gode og gode praktiserende læger (det reddede mit liv)
 Dengang jeg fyrede min læge (og vigtige ændringer i private konsulenttjenester)
Dengang jeg fyrede min læge (og vigtige ændringer i private konsulenttjenester)
 10 måder at gå videre end glutenfri
10 måder at gå videre end glutenfri
 Typen af øvre luftvejsbakterier kan påvirke astmaens sværhedsgrad
En ny undersøgelse øger muligheden for at modulere astmasymptomer via de bakterier, der normalt lever i de øvre luftveje. Arbejdet, som blev offentliggjort den 16. december, 2019, i journalen Naturko
Typen af øvre luftvejsbakterier kan påvirke astmaens sværhedsgrad
En ny undersøgelse øger muligheden for at modulere astmasymptomer via de bakterier, der normalt lever i de øvre luftveje. Arbejdet, som blev offentliggjort den 16. december, 2019, i journalen Naturko
 Bystkræftbevidsthed:Statistik, fakta og forebyggelse
Resumé:Brystkræft er en bekymrende helbredstilstand, der påvirker mange i USA. Det er vigtigt at gennemgå rutinemæssige screeninger for at diagnosticere sygdommen tidligt. Brystkræft er et sundheds
Bystkræftbevidsthed:Statistik, fakta og forebyggelse
Resumé:Brystkræft er en bekymrende helbredstilstand, der påvirker mange i USA. Det er vigtigt at gennemgå rutinemæssige screeninger for at diagnosticere sygdommen tidligt. Brystkræft er et sundheds
 GERD (Acid Reflux) hos spædbørn og børn
GER (gastroøsofageal refluks), GERD (gastroøsofageal reflukssygdom) definitioner og fakta Tegn og symptomer på GER eller GERD hos spædbørn og børn overlapper hinanden. Spædbørn og børn med GER har
GERD (Acid Reflux) hos spædbørn og børn
GER (gastroøsofageal refluks), GERD (gastroøsofageal reflukssygdom) definitioner og fakta Tegn og symptomer på GER eller GERD hos spædbørn og børn overlapper hinanden. Spædbørn og børn med GER har