En tre-gen signatur som potentiel prædiktiv biomarkør for irinotecan følsomhed i mavekræft
Abstract
Mål
Personlig kemoterapi baseret på molekylære biomarkører kan maksimere anticancer effektivitet. Vi tilstræber at undersøge prædiktive biomarkører, der kan forudsige respons på irinotecan-baseret behandling i gastrisk cancer.
Metoder
Vi undersøgte genekspression af APTX, BRCA1, ERCC1, ISG15, Topo1 og methylering af SULF2 i formalin-fikseret paraffin- indlejret mavekræft væv fra 175 patienter og vurderet sammenhængen mellem genekspression niveauer eller methylering status og in vitro
følsomhed over for irinotecan. Vi brugte multipel lineær regressionsanalyse til at udvikle et gen-udtryk model til at forudsige irinotecan følsomhed i gastrisk kræft og valideret denne model in vitro
vivo
.
Resultater
Gene ekspressionsniveauer af APTX, BRCA1 og ERCC1 var signifikant lavere i irinotecan-følsomme mavekræft prøver end de irinotecan-resistente prøver (P
< 0,001 for alle gener), mens ISG15 (P
= 0,047) og Topo1 (P
= 0,002) var signifikant højere. På grundlag af disse gener, blev en tre-gen signatur etableret, der blev beregnet som følger: Index = 0,488 - 0.020 × ekspressionsniveauet af APTX + 0,015 × ekspressionsniveauet af Topo1 - 0,011 × ekspressionsniveau af BRCA1. De tre-genet signatur var signifikant associeret med irinotecan følsomhed (rho = 0,71, P
< 0,001). Sensitivitet og specificitet til forudsigelse af irinotecan følsomhed baseret på tre-genet signatur nåede 73% og 86%, hhv. I et andet uafhængige test sæt, de irinotecan hæmning satser i gastrisk prøver med følsom-signatur var meget højere end dem med resistent-signatur (65% vs. 22%, P
< 0,001). Irinotecan behandling med 20 mg /kg pr uge til immunsvækkede mus bærer xenografter med følsom-signatur dramatisk anholdt væksten af tumorer (P
< 0,001), men havde ingen effekt på mus, der bærer xenografter med resistent-signatur
. konklusioner
tre-gen signatur etableret heri er en potentiel prædiktiv biomarkør for irinotecan følsomhed i mavekræft.
Nøgleord
Personlig kemoterapi irinotecan mavekræft HDRA immunsvækkede mus Introduktion
mavekræft er stadig en af de førende årsager af kræft død på verdensplan [1, 2]. Der er ingen "gold standard" kemoterapi for fremskreden mavekræft indtil nu. I de seneste år, nye generation kemoterapeutiske midler, såsom docetaxel, oxaliplatin, irinotecan, capecitabin og S-1 er blevet undersøgt i fase III studier [3]. Men den mediane overlevelse forblev under en om året [2], og svarprocenten var kun ca. 30% -50% [4]. Irinotecan (CPT-11) er et semisyntetisk derivat af camptothecin (CPT), der interfererer med DNA-replikation og celledeling gennem sin potente interaktion med enzymet topoisomerase I (Topo1). Både irinotecan og CPT tilhører Topo1 inhibitorer. Irinotecan anvendes hovedsagelig i kolorektal cancer og også ofte anvendes til behandling af gastrisk kræft, viser svarprocenter varierende fra 14% til 23% som enkeltstof og ca. 50% i kombination [5].
En række molekylære biomarkører stand forudsige sandsynligheden for reaktion på kemoterapeutiske midler er blevet undersøgt i de seneste årtier [6]. Vores tidligere undersøgelser har identificeret brystkræft modtagelighed gen 1 (BRCA1) som potentiel prædiktiv biomarkør for cisplatin og docetaxel følsomhed [7, 8], thymidylatsyntase (TS) for 5-FU og raltitrexed [9, 10], og excision reparation tværs supplere en (ERCC1) for platin [11]. Imidlertid har der været begrænsede fremskridt i identifikationen af biomarkører, som kan forudsige respons på irinotecan-baseret behandling i gastrisk cancer. Topo1 regulerer DNA supercoiling under replikation gennem den måde forårsage enkeltstrengede pauser og religering [12]. Irinotecan og dets aktive metabolit SN-38 inducerer DNA-skader ved at stabilisere en forbigående kovalente kompleks mellem DNA og Topo1, som så resulterer i DNA-strenge pauser, replikering anholdelse og apoptose [13]. Høje tumor niveauer af Topo1 protein er for nylig blevet rapporteret til at identificere en undergruppe af patienter med metastatisk kolorektal cancer med god respons på irinotecan [14]. Reparation af irinotecan-associerede og Topo1-medieret DNA skade kræver fjernelse af den strandede Topo1 og opløsning af den tilhørende DNA pause. Under denne proces, er en bred vifte af reparation proteiner, herunder aprataxin (APTX), BRCA1 og ERCC1, involveret, hvoraf nogle kan have klinisk potentiale som prædiktive biomarkører [15].
Ud af kandidatlandene biomarkører nævnt ovenfor seneste undersøgelser foreslog, at methylering af heparansulfat 6-O-endosulfatase (SULF2) promotoren blev forbundet med følsomhed over for Topo1 inhibitorer i Non-småcellet lungekræft (NSCLC) [16]. INF-inducerbar regulator af ubiquitinering (ISG15) kunne blokere ubiquitin /26S proteasomalaktivitet, der fører til akkumulering af CPT-induceret DNA-beskadigelse, hvilket resulterede i en øget apoptose [17]. SULF2 methylering (SULF2M) og høj ISG15 udtrykkende NSCLC cellelinjer udviste 134 gange følsomhed over for CPT end SULF2 unmethylation (SULF2U) og lave ISG15 udtrykkende cellelinier [16].
Baseret på ovenstående beviser, vi den hypotese, at APTX, BRCA1 , ERCC1, ISG15, SULF2, og Topo1 eller deres kombination kunne spille en vigtig rolle i at forudsige irinotecan følsomhed i mavekræft. I den aktuelle undersøgelse undersøgte vi hvert gen som prædiktiv biomarkør af sig selv, og derefter etableret algoritme kombinerer de gener sammen for mere præcist at forudsige irinotecan følsomhed. Vi valideret også modellen i en anden uafhængig sæt mavekræft prøver og to kohorter af immundefekte mus modeller. Formålet med denne undersøgelse var at identificere en klinisk anvendelig klassifikation signatur, kunne forudsige irinotecan følsomhed i mavekræft.
Materialer og metoder
Patientprøver
Alle prøver og relevante kliniske data blev indhentet fra afdelingen for onkologi og almen kirurgi, Drum Tower Hospital Tilknyttet til Medical School of Nanjing Universitet i perioden fra august 2010 til juni 2012. prøverne omfatter 175 frisk fjernede gastriske tumorer, der tilfældigt blev klassificeret som enten uddannelse sæt (n = 100) eller test sæt (n = 75) ved hjælp af computergenererede tilfældige tal. Hver tumor væv blev delt i to dele, når det fjernes i kirurgi: (1) den ene del blev holdt i 4 ° C Hanks balancerede saltopløsning med 1% penicillin /streptomycin og påvist kemosensitivitet in vitro
efter histoculture lægemiddelrespons assay (HDRA); (2) resten del blev efterladt i formalin og gjort til formalin-fikserede paraffin-indlejrede (FFPE) tumorblokke for patologisk observation og gentest. Diagnose af patienter med gastrisk tumor blev bekræftet ved histopatologi. Kliniske og histopatologiske data, herunder alder, køn, histologi tumorstedet, stadium, histologisk bedømmelse og lymfeknudemetastase blev alle samlet. Kliniske karakteristika for de patienter blev opsummeret i tabel 1. Informeret samtykke blev opnået fra alle patienter og protokollerne til denne undersøgelse blev godkendt af Human Research Beskyttende Komité Drum Tower Hospital Tilknyttet til Medical School of Nanjing Universitet. Alle eksperimenter dyr blev udført i overensstemmelse med den kinesiske koordineringsudvalg kræftforskningsinitiativ Regler for dyrevelfærd og dyrebeskyttelse Law.Table 1 Patient karakteristika
Karakteristisk
Training sæt (N = 100)
Uafhængig test sæt (N = 75)
I alt (N = 175)
Age, y median (interval)
63 (29-83)
63 (29-83)
63 (29-83)
≥ 63
51 (51%)
40 (53%)
91 (52%)
< 63
49 (49%)
35 (47%)
84 (48%)
Sex
Mand
74 (74%)
57 (76%)
131 (75%)
Female
26 (26%)
18 (24%)
44 (25%)
tumor
Distal mave
34 ( 34%)
28 (37%)
62 (35%)
proksimale mave
41 (41%)
29 (39%)
70 (40%)
Hele mave
25 (25%)
18 (24%)
43 (25%)
Stage
jeg
13 (13%)
7 (9% )
20 (11%)
II
20 (20%)
21 (28%)
41 (23%)
III
65 (65%)
45 (60%)
110 (63%)
IV
2 (2%)
2 (3%)
4 (3%)
Histologisk kvalitet
2
20 (20%)
16 (21%)
36 (21%)
3
47 (47%)
34 (46%)
81 (46%)
Blandet 1-2
3 (3%)
3 (4%)
6 (3%)
Blandet 2-3
30 (30%)
22 (29%)
52 (30%)
lymfeknudemetastase
nr
21 (21%)
19 (25%)
40 (23%)
Ja
79 (79%)
56 (75%)
135 (77%)
HDRA
HDRA procedurer blev udført som tidligere beskrevet [18]. Kort fortalt blev frisk tumorvæv vasket og hakket i små stykker til ca. 0,5 mm i diameter, som derefter blev anbragt på tilberedt collagen (Health Design, Rochester, NY) overflader i 24-brønds mikroplader. Der var 8 parallelle kultur brønde til irinotecan følsomhed test og 8 parallelle kultur brønde til kontrol. Efter inkubation i 7 dage ved 37 ° C (i fugtig atmosfære indeholdende 95% luft -5% CO
2) i nærvær af stoffer opløst med RPMI 1640 medium indeholdende 20% føtalt kalveserum, 100 pi type I collagenase ( 0,1 mg /ml, Sigma) og MTT (5 mg /ml, Sigma) blev tilsat til hver kultur brønd og inkuberet i yderligere 16 timer. Koncentration af irinotecan var 20 ug /ml i henhold til dens maksimale plasmakoncentration (PPC) hos patienter [19]. Efter ekstraktion med dimethylsulfoxid (DMSO, Sigma), blev absorbansen af opløsningen i hver brønd aflæses ved 540 nm. Absorbans per gram dyrket tumorvæv blev beregnet ud fra den gennemsnitlige absorbans af væv fra 8 parallelle dyrkningsbrønde, og det tumor-væv blev bestemt før kultur. Hæmningen blev beregnet ved hjælp af følgende formel: Hæmning
sats
%
=
1
-
T-service /
C
×
100
%
T er den gennemsnitlige absorbans af behandlede tumor /Vægt
C er den gennemsnitlige absorbans af kontrol tumor /Vægt
mRNA-ekspression niveau detektion
Total RNA ekstraktion fra FFPE væv
Seks 7 um snit blev fremstillet fra FFPE tumorblokke der indeholdt mindst 80% tumorceller. Efter hæmatoxylin-eosin-farvning blev de ondartede dele mikrodissekeres og overført til et mikrocentrifugerør. RNA blev isoleret i overensstemmelse med en proprietær procedure (europæisk patent nummer EP1945764-B1). Kort beskrevet paraffin blev fjernet ved xylen og mikrodissekeres ondartede dele blev lyseret i en proteinase K-puffer ved 60 ° C i 16 timer. RNA blev oprenset ved phenol og chloroform-ekstraktioner efterfulgt af udfældning med isopropanol i nærværelse af natriumacetat ved -20 ° C. RNA-pelleten blev vasket i 70% ethanol og resuspenderet i 53 pi RNase-frit vand efterfulgt af behandling med DNase I (Life Technologies).
QPCR vurdering af genekspression
M-MLV revers transkriptase (Invitrogen) blev anvendt til at generere cDNA for kvantitativ polymerase-kædereaktion (qPCR) til påvisning af β-actin (ACTB), APTX, BRCA1, ERCC1, ISG15 og Topo1. Hver batch af reaktionen omfattede en positiv kontrol fra kommercielt humant lunge og lever RNA (Stratagene, La Jolla, CA, USA) som kalibratorer og negative kontroller uden RNA og revers transkriptase. Totalt RNA 1 ug blev anvendt til hver RT-reaktionen. Template cDNA blev amplificeret med specifikke primere og prober til ACTB, APTX, BRCA1, ERCC1, ISG15 og Topo1 vha Taqman Universal Master Mix (Applied Biosystems, Foster City, CA). Den Assay id'er (Applied Biosystems, Foster City, CA) for primere og prober var som følger: Hs99999903_m1 (ACTB), Hs00214452_m1 (APTX), Hs00157415_m1 (ERCC1), Hs00192713_m1 (ISG15), Hs00243257_m1 (Topo1), BRCA1 (NM_007294) : frem 5'GGCTATCCTCTCAGAGTGACATTTTA 3 ', omvendt 5'GCTTTATCAGGTTATGTTGCATGGT 3', og sonde 6FAM -5 'CCACTCAGCAGAGGG 3' MGB. QPCR blev udført for at kvantificere genekspression under anvendelse af ABI Prism 7900HT Sequence Detection System (Applied Biosystems). PCR-betingelserne var 50 ° C i 2 minutter, 95 ° C i 15 minutter, efterfulgt af 40 cyklusser ved 95 ° C i 15 s og 60 ° C i 1 min. Relativ genekspression kvantificeringer blev beregnet efter den sammenlignende Ct-metoden ved hjælp ACTB som en endogen kontrol, baseret på vores tidligere erfaringer at sammenligne forskellige husholdning gener [7, 20] og kommercielle humane lunge og lever RNA (Stratagene, La Jolla, Californien, USA ) som kalibratorer, som gør det muligt at sammenligne genekspressionsniveauer mellem forskellige patienter. De endelige resultater blev bestemt ved formlen mRNA-ekspression niveau = 2 - (DCT prøve-DCT kalibrator) (DCT = Ct gene- Ct ACTB) [7, 21] og blev analyseret med Stratagene analyse software.
DNA methylering detektion
DNA-ekstraktion og modifikation
Tre 7-um sektioner blev fremstillet fra primære tumorblokke som indeholdt mindst 80% tumorceller. Efter hæmatoxylin-eosin-farvning blev de ondartede dele mikrodissekeres og overført til et mikrocentrifugerør. DNA blev isoleret rutinemæssigt og blev derefter kemisk modificeret ved natriumbisulfit at konvertere alle ikke-methylerede cytosiner til uraciler mens methylcytosines uforandret [16]. Derefter blev de opbevaret ved -20 ° C til yderligere analyse.
Methyleringsspecifik polymerasekædereaktion (MSP)
MSP blev udført for at bestemme methylering af SULF2 anvendelse af ABI Prism 7300HT Sequence Detection System (Applied Biosystems). Hver PCR reaktion indeholdt genomisk DNA 2 pi, SYBR Green PCR Mix (Takara, Japan) 10 pi, vand 7,7 pi, og primere 0,15 pi (10 pmol /l). PCR-betingelserne var 95 ° C i 10 minutter, efterfulgt af 45 cykler ved 59 ° C i 30 s, 72 ° C i 30 s og 95 ° C i 30 s. Primere til SULF2 methylerede PCR (Takara, Japan) var som følger: fremad 5'TAAGTGTTTTTTTTATAGCGGC 3 ', omvendt 5'TACCGTAATTTCCGCTATC 3'. Primere til SULF2 umethyleret PCR (Takara, Japan) var som følger: sende 5'GTTTATAAGTGTTTTTTTATAGTGGT3 «, omvendt 5'TACCATAATTTCCACTATCCCT 3 '. Hver batch af reaktionen omfattede en positiv kontrol fra methyltransferase (M.SssI) -behandlede humant genomisk DNA (fuldt methyleret), en negativ kontrol fra DNA-prøver, som er blevet bekræftet methyleret og en anden negativ kontrol uden DNA. Alle tests blev udført i to eksemplarer.
Etablering og validering af genet-udtrykket model for irinotecan følsomhed forudsigelse
Vi vedtog multipel lineær regressionsanalyse for at etablere den optimerede gen-udtryk model baseret på uddannelse sæt af 100 gastrisk kræft [22]. Ifølge resultaterne af trinvis regression (post: α = 0,10, fjerne: α = 0,15), model bestod af APTX, Topo1 og BRCA1 er den optimerede én. Vi tildelt hver patient et indeks efter den lineære kombination af ekspressionsniveauet af mRNA vægtet med regressionskoefficienten af træningen prøver. Indekset af genet-udtryk model blev beregnet som følger: Index = 0,488-0,020 × udtryk niveau APTX + 0,015 × udtryk niveau Topo1 - 0,011 × udtryk niveau af BRCA1. Denne model blev senere valideret i en anden uafhængig test sæt af 75 patienter med mavekræft. I sættet test blev patienterne rangeret efter deres gen signatur indeks og opdelt i følsomme signatur og modstandsdygtig signatur grupper ved hjælp af median indeks som cutoff point. Den irinotecan følsomhed af disse to grupper blev testet ved HDRA og sammenlignet med hinanden. Salg In viv
o validering af genet-udtrykket model for irinotecan følsomhed forudsigelse
At etablere immundefekte mus modeller med patient-afledt gastrisk cancer xenotransplantater, hver frisk fjernet kirurgisk tumorvæv blev skåret i stykker af 3 × 3 × 3 mm 3, som blev transplanteret inden for 30 min til 12 athymiske immunsvækkede mus, betegnes som en "kohorte" [23]. I hver kohorte, når tumoren voksede til en størrelse på 50-100 mm 3, mus med xenografter blev randomiseret til behandling med irinotecan 20 mg /kg /w, ip (n = 6) eller ingen behandling som kontrol ( n = 6). Individuelle tumorvolumener (V) blev beregnet ved formlen "V = (længde x bredde x bredde) /2" og sammenlignet med værdierne ved starten af behandlingen for at opnå den relative tumorvolumen. Mus blev observeret hver anden dag i tumorvækst.
For at evaluere den konsekvente inhibering af irinotecan i de følsomme signatur mus, tre uger efter første administration, alle tumorerne blev separeret fra den første generation mus og passeret til anden generation mus. I anden generation, blev intet lægemiddel administreret. Mus blev observeret hver dag i yderligere to uger.
Statistisk analyse
Mann-Whitney U-test og Kruskal-Wallis testen blev anvendt til at teste associationen mellem mRNA ekspressionsniveauer og kliniske karakteristika, og sammenhængen mellem irinotecan følsomhed og patienternes klinisk-patologiske parametre. Spearman rang metode blev anvendt til at vurdere sammenhængen af mRNA ekspressionsniveauer mellem forskellige gener samt sammenhængen mellem mRNA-niveauer og in vitro
irinotecan følsomhed. Mann-Whitney U-test blev anvendt til at sammenligne irinotecan følsomhed mellem SULF2M og SULF2U grupper, irinotecan-følsomme og irinotecan-resistente patienter og mellem sensitiv-signatur og modstandsdygtig-signatur grupper. Receiver Operating karakteristik (ROC) kurver blev genereret for at beregne følsomheden og specificiteten af forudsigelse baseret på forskellige gener og genekspression model i form af irinotecan følsomhed. Forbundne Students t-test blev anvendt til at vurdere forskellene mellem tumor størrelser af følsomme signatur mus eller resistent signatur mus og kontroller. En P
< 0,05 blev betragtet som statistisk signifikant (to-sidet). Statistisk analyse blev udført under anvendelse af SPSS version 16.0.
Resultater
patientkarakteristika
Karakteristik af alle patienter er vist i tabel 1. I de 175 patienter, de fleste patienter var mænd (75%), og histologi hver prøve var adenocarcinom. I 62 (35%) patienter, blev tumoren placeret i den distale mave, i 70 (40%) i den proximale mave, og i 43 (25%) i hele mave. Et hundrede og ti (63%) patienter havde stadium III-sygdom. Lymfeknudemetastase var til stede i 135 (77%) patienter.
Genekspressionsniveauer
mRNA ekspressionsniveauer af APTX, BRCA1, ERCC1, ISG15 og Topo1 blev detekteret i alle tumorer, med median genekspression niveau i forhold til husholdning ACTB af 4,32 for APTX (interval fra 0,26 til 17,99, 95% konfidensinterval (CI): 3,78-5,19), 7,91 for BRCA1 (interval fra 0,37 til 29,04, 95% CI: 7,07-9,51), 14,03 for ERCC1 (interval fra 0,33 til 46,30 , 95% CI: 13,01-17,07), 5,07 for ISG15 (interval fra 0,04 til 34,24, 95% CI: 3,94-6,21), og 7,51 for Topo1 (interval fra 1,07 til 37,81, 95% CI: 6,38-9,17) (Figur 1) . En signifikant sammenhæng blev observeret mellem APTX mRNA ekspressionsniveauerne og histologiske bedømmelse (P
= 0,03), og ISG15 mRNA og køn (P
= 0,017). Ingen anden forbindelse mellem kliniske karakteristika og tumor mRNA niveauer blev fundet (tabel 2). Dog blev der observeret en stærk sammenhæng mellem mRNA ekspressionsniveauer af APTX og BRCA1 (rho = 0,53, P
< 0,001), APTX og ERCC1 (rho = 0,73, P
< 0,001), BRCA1 og ERCC1 (rho = 0,48, P
< 0,001) i tumor. Figur 1 Gene ekspressionsniveauer af APTX, BRCA1, ERCC1, ISG15 og Topo1 i 175 patienter analyseret ved kvantitativ RT-PCR. Værdier af genekspression blev beregnet efter den sammenlignende Ct-metoden ved hjælp ACTB som en endogen kontrol. Den blå linje stod for gennemsnitlig med 95% CI.
Tabel 2 Foreningen af genet udtryk og patologiske karakteristika
Karakteristisk
No. af patienter
APTX mRNA
BRCA1 mRNA
ERCC1 mRNA
ISG15 mRNA
Topo1 mRNA
middelværdi ± SD
middelværdi ± SD
middelværdi ± SD
middelværdi ± SD
middelværdi ± SD
Age , y
≥ 63
91 (52%)
4,81 ± 3,78
8,61 ± 5,73
15,28 ± 10,01
4.48 ± 3.69
8.03 ± 7.30
< 63
84 (48%)
4,09 ± 3,76
7,90 ± 5,95
14,75 ± 9,28
5.79 ± 6,90
7,47 ± 5,81
Sex
Mand
131 (75%)
4,77 ± 3,33
8,41 ± 5,57
15,74 ± 10,19
5,54 ± 5,62
7,95 ± 7,17
Female
44 (25%)
3,58 ± 3,29
7,92 ± 6,67
12.77 ± 7.30
3.53 ± 4.27 *
7,21 ± 4,62
Tumor site
Distal mave
62 (35%)
4,79 ± 2,87
8.97 ± 6,52
16,12 ± 10,36
7,05 ± 7,75
8.09 ± 5.93
proksimal mave
70 (40%)
4.16 ± 3.10
8,33 ± 5.72
13,97 ± 9.09
3,61 ± 2,64
7,40 ± 6,63
Hele mave
43 (25%)
4,60 ± 4,44
7.12 ± 4,74
15,31 ± 9,70
4,61 ± 3,43
7,06 ± 7,94
Stage
jeg
20 (11%)
4,25 ± 4,47
5,91 ± 3,40
13.40 ± 7.07
1.89 ± 0,83
5,89 ± 4,03
II
41 (23%)
4,19 ± 3,01
8,58 ± 5,09
14,70 ± 9,56
6,76 ± 7,96
8,91 ± 6,35
III
110 (63%)
4,66 ± 3,38
8.19 ± 5,75
15,56 ± 10,16
4,67 ± 4,01
7,70 ± 7,07
IV
4 (3%)
4,20 ± 4,61
15,88 ± 17,90
11.01 ± 5.00
7,25 ± 6,33
4,03 ± 1,63
Histologisk klasse
2
36 (21% )
5.05 ± 3.54 *
10,97 ± 7,33
15,78 ± 9,52
4.86 ± 4.75
8,08 ± 6,61
3
81 (46%)
3,92 ± 3,55
7,81 ± 5,16
14,30 ± 9,64
3,68 ± 2,75
7.18 ± 6.08
Blandet 1-2
6 (3%)
3,63 ± 4,51
7,17 ± 2.13
15.17 ± 12.40
8,00 ± 8,94
8,42 ± 6,02
Blandet 2-3
52 (30%)
4,55 ± 2,53
7,06 ± 5,27
15,65 ± 9,96
7,16 ± 7,74
8,44 ± 7,18
lymfeknudemetastase
Ingen
40 (23%)
4,58 ± 3,39
8,70 ± 5,08
14,68 ± 7,31
5,97 ± 8.17
7,48 ± 4,47
Ja
135 (77%)
4,46 ± 3,35
8.16 ± 6.05
15,16 ± 10,33
4,78 ± 4,12
7,87 ± 7,23
* P
< . 0,05
Forholdet mellem genekspression og kemosensitivitet til irinotecan Salg In træningssættet, blev irinotecan følsomhed succes testet i alle tumorer, med median hæmning på 43,3% (interval 2% -89%, CI: 39 % -47%). Der var ingen signifikant sammenhæng mellem irinotecan følsomhed og kliniske karakteristika (tabel 3), herunder alder (P =
0,51), køn (P =
0,77), tumorstedet (P =
0,64), trin ( P =
0,41), histologisk bedømmelse (P =
0,48) og lymfeknudemetastaser (P =
0,47). Men mRNA niveauer af APTX (rho = -0,48, P
< 0,001), BRCA1 (rho = -0,49, P
< 0,001), ERCC1 (rho = -0,42, P
< 0,001), ISG15 (rho = 0,34, P
= 0,001), og Topo1 (rho = 0,43, P
< 0,001) viste en korrelation til irinotecan følsomhed. Patienterne blev rangordnet efter deres irinotecan hæmning satser og opdelt i irinotecan-følsomme og irinotecan-resistente grupper ved hjælp af median hæmning sats som cutoff punkt [19]. Gene ekspressionsniveauer af APTX (P
< 0,001), BRCA1 (P
< 0,001) og ERCC1 (P
< 0,001) var signifikant lavere i irinotecan-følsomme patienter end i irinotecan-resistente patienter , mens ISG15 (P
= 0,047) og Topo1 (P
= 0,002) var signifikant højere (figur 2A-E). ROC-kurver blev genereret for at beregne følsomheden og specificiteten af hvert gen forudsige irinotecan følsomhed (Figur 2G-J). Arealerne under ROC-kurven (AUC), sensitivitet og specificitet for forudsigelse af irinotecan følsomhed baseret på APTX, BRCA1, ERCC1, ISG15 og Topo1 mRNA niveauer blev opført i tabel 4.Table 3 associering mellem irinotecan følsomhed og kliniske karakteristika
karakteristisk
Irinotecan hæmning sats
Irinotecan hæmning rate
betyde (95% CI)
betyde (95% CI)
Training sæt (N = 100)
Uafhængig test sæt (N = 75)
Age, y median (område)
≥ 63
42% ( 36-47%)
44% (31-57%)
< 63
45% (39-51%)
44% (34-54%)
Sex
Mand
43% (38-47%)
42% (33- 51%)
Female
45% (36-55%)
50% (31-68%)
tumor
Distal mave
42% (35-49%)
44% (28-60%)
proksimal mave
44% (38-51%)
47% (35-58%)
Hele mave
43% (35 -51%)
37% (16-59%)
Stage
jeg
34% (21-47%)
36% (3-70%)
II
49% (40-57%)
50% (31-68%)
III
43% (38-48%)
44% (34-54%)
IV
33%
34%
Histologisk klasse
2
41% (33-49%)
44% (21-68%)
3
42 % (36-48%)
39% (27-51%)
Blandet 1-2
54%
58%
Blandet 2-3
46% (38- 54%)
49% (35-62%)
lymfeknudemetastase
Ingen
42% (33-51%)
46% (27-65%)
Yes
44% (39-48%)
44% (34-53%)
Signature indeks
> 0,43
57% (52-63%) **
65% (61-70%) **
≤ 0,43
31% (27-36%)
22% (17 -28%)
** P
< . 0.001
Figur 2 Gene ekspressionsniveauer af APTX (P < 0,001), BRCA1 (P < 0,001) og ERCC1 (P < 0,001) var signifikant lavere i irinotecan-følsomme patienter end i irinotecan-resistente patienter, mens ISG15 (P = 0,047) og Topo1 (P = 0,002) var signifikant højere. Box plots viste mRNA ekspressionsniveauer af APTX (A), BRCA1 (B), ERCC1 (C), ISG15 (D) og Topo1 (E) i irinotecan-følsomme og irinotecan-resistente grupper henholdsvis (n = 100). Linjerne inde kasserne betegnet medianerne. De whiskers af kassediagrammer: Min til Max. Grafer af ROC-kurve viste AUC for APTX (F), BRCA1 (G), ERCC1 (H), ISG15 (I) og Topo1 (J) til at forudsige irinotecan følsomhed. Følsomhed (Y-aksen) blev afsat mod falsk-positive fraktion. (1 - specificitet)
Tabel 4 Følsomheden og specificiteten af fem genekspression niveauer til forudsigelse af irinotecan følsomhed
Gener
Chemotheraputic agenter
Følsomhed
Specificitet
AUC (95% CI)
P
APTX
Irinotecan
73%
74%
0,758 (0,669-0,847)
< 0,001
BRCA1
Irinotecan
91%
58%
0.760 (0,673 til 0,846)
< 0,001
ERCC1
Irinotecan
64%
79%
0,726 (0,632 til 0,821)
< 0,001
ISG15
Irinotecan
59%
73%
0,617 (0,494-0,740)
0,047
Topo1
Irinotecan
48%
94%
0,664 (0,563-0,765)
0,002
forholdet mellem SULF2 methylering og følsomhed over for irinotecan Salg In træningssættet blev methylering status SULF2 held påvist i alle patienter, med treogtredive (28%), der bærer SULF2M og fireogfirs (72%), der bærer SULF2U. Der var ingen signifikant sammenhæng mellem SULF2 methylering status og kliniske karakteristika. De irinotecan hæmning satser var 49,8% (interval 2% -89%, 95% CI: 41% -59%) for SULF2M gruppen og 40,2% for SULF2U gruppe (interval 2% -84%, 95% CI: 34% - 46%, P
= 0,08).
etableringen af genet-udtryk model og dens association med følsomhed over for irinotecan
Baseret på ekspressionsniveauet af fem gener og status SULF2 methylering, vi konstrueret en signatur ved multipel lineær regressionsanalyse som nævnt i fremgangsmåderne. Indekset for de tre-genet signatur varierede fra 0,08 til 0.99 med middelværdi på 0,43 ± 0,16. Der var en signifikant sammenhæng mellem indekset og irinotecan følsomhed (rho = 0,71, P
< 0,001) (figur 3A). ROC-kurve blev genereret til at beregne følsomheden og specificiteten af de tre-genet signatur forudsige irinotecan følsomhed (figur 3B). AUC var 0,828 (95% CI: 0,755-0,901, P
< 0,001). Med grænseværdien på 0,43, følsomheden og specificiteten til forudsigelse af irinotecan følsomhed baseret på tre-genet signatur nåede 73% og 86%, hhv.
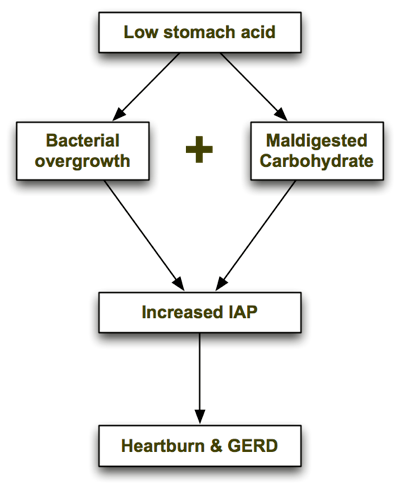 Den specifikke kulhydratdiæt helbreder GERD?
Konventionel visdom fortæller os mange ting, der viser sig at være forkerte; Det er vi et levende bevis på i SCD-samfundet. Hvorfor tror du, at så mange af vores familie, venner og læger kan lide at t
Den specifikke kulhydratdiæt helbreder GERD?
Konventionel visdom fortæller os mange ting, der viser sig at være forkerte; Det er vi et levende bevis på i SCD-samfundet. Hvorfor tror du, at så mange af vores familie, venner og læger kan lide at t
 Hvad er gastrisk (mave) cancer? Tegn, symptomer, årsager
Defineret mavekræft (mavekræft) En malignitet i maven Mavekræft, eller mavekræft, er en malignitet (uhæmmet vækst af unormalt væv) i maveslimhinden. Infektion med bakterien, Helicobacter pylori (H.
Hvad er gastrisk (mave) cancer? Tegn, symptomer, årsager
Defineret mavekræft (mavekræft) En malignitet i maven Mavekræft, eller mavekræft, er en malignitet (uhæmmet vækst af unormalt væv) i maveslimhinden. Infektion med bakterien, Helicobacter pylori (H.
 Er den specifikke kulhydratdiæt forældet? (Giv mening med alle tarmhelende diæter)
Jeg havde to meget vigtige samtaler i weekenden. De gik begge sådan noget. “Jeg prøvede Paleo, Low-FODMAP, GAPS og glutenfri. Men intet har fungeret som dette!” To nye venner, jeg for nylig mødte, f
Er den specifikke kulhydratdiæt forældet? (Giv mening med alle tarmhelende diæter)
Jeg havde to meget vigtige samtaler i weekenden. De gik begge sådan noget. “Jeg prøvede Paleo, Low-FODMAP, GAPS og glutenfri. Men intet har fungeret som dette!” To nye venner, jeg for nylig mødte, f