Jedoch, Die Toleranz des Wirts gegenüber einer Infektion mit Krankheitserregern ist nicht bei allen Organismen gleich ausgeprägt. Zum Beispiel, es ist bekannt, dass das Darmmikrobiom von Mäusen effektiver vor einer Infektion mit bestimmten Krankheitserregern schützt, wie das Bakterium Salmonella typhimurium, als das menschliche Darmmikrobiom.
Dies wirft die interessante Möglichkeit auf, dass die Analyse von Unterschieden zwischen Wirt-Mikrobiom-Interaktionen beim Menschen und anderen Arten, wie Mäuse, und das Auffinden einzelner Bakterienarten, die gegen bestimmte Krankheitserreger entweder schützen oder sensibilisieren, könnte zu völlig neuen Therapieansätzen führen.
Jedoch, während die Zusammensetzung des Darmmikrobioms und seine Wirkung auf die Immunantwort des Wirts bei Mäusen gut untersucht wurden, es ist nicht möglich zu untersuchen, wie das Mikrobiom unter genau definierten Bedingungen direkt mit den Epithelzellen des Darms interagiert, und decken dadurch spezifische Bakterienstämme auf, die eine Wirtstoleranz gegenüber infektiösen Krankheitserregern induzieren können.
Jetzt, ein kollaboratives Team unter der Leitung von Wyss-Gründungsdirektor Donald Ingber, M. D., Ph.D. am Wyss Institute for Biologically Inspired Engineering in Harvard und Dennis Kasper, M.D. an der Harvard Medical School (HMS) hat die mikrofluidische Organs-on-Chip (Organ Chip)-Technologie von Wyss genutzt, um die verschiedenen anatomischen Abschnitte des Mausdarms und ihre Symbiose mit einem komplexen lebenden Mikrobiom in vitro zu modellieren.
Die Forscher rekapitulierten die zerstörerischen Auswirkungen von S. typhimurium auf die Darmepitheloberfläche in einem konstruierten Maus-Colon-Chip. und in einer vergleichenden Analyse von Maus- und Humanmikrobiomen konnten bestätigen, dass das kommensale Bakterium Enterococcus faecium zur Wirtstoleranz gegenüber S. typhimurium-Infektionen beiträgt. Die Studie ist veröffentlicht in Grenzen der Zell- und Infektionsmikrobiologie .
Das Projekt wurde im Rahmen eines DARPA-geförderten Projekts "Technologies for Host Resilience" (THoR) am Wyss Institute gestartet, deren Ziel es war, durch die Untersuchung von Unterschieden, die bei bestimmten Tierarten und beim Menschen beobachtet wurden, Schlüsselbeiträge zur Infektionstoleranz aufzudecken. Mit einem menschlichen Dickdarm-Chip, Ingbers Gruppe hatte in einer früheren Studie gezeigt, dass Metaboliten, die von Mikroben aus Maus- und menschlichem Kot produziert werden, ein unterschiedliches Potenzial haben, die Anfälligkeit für Infektionen mit einem enterohämorrhagischen E. coli-Erreger zu beeinflussen.
Die biomedizinische Forschung hängt stark von Tiermodellen wie Mäusen, die zweifellos enorme Vorteile haben, aber keine Gelegenheit bieten, normale und pathologische Prozesse innerhalb eines bestimmten Organs zu studieren, wie der Darm, Nahaufnahme und in Echtzeit. Diese wichtige Machbarkeitsstudie mit der Gruppe von Dennis Kasper unterstreicht, dass unsere entwickelte Maus-Darm-Chip-Plattform genau diese Fähigkeit bietet und die Möglichkeit bietet, Wirt-Mikrobiom-Interaktionen mit Mikrobiomen verschiedener Spezies unter stark kontrollierbaren Bedingungen in vitro zu untersuchen ."
Donald Ingber, MD, Ph.D., Gründungsdirektor, Wyss Institute for Biologically Inspired Engineering in Harvard
"Angesichts der tiefen Charakterisierung der Mausimmunologie, Diese Fähigkeit könnte die Arbeit von Forschern, die diese Tiere derzeit zur Erforschung von Mikrobiom- und Wirtsreaktionen einsetzen, erheblich voranbringen. Es ermöglicht ihnen, ihre Ergebnisse in Zukunft direkt mit menschlichen Darm-Chips zu vergleichen, so dass der Fokus darauf liegen kann, für den Menschen relevante Merkmale der Wirtsreaktion zu identifizieren." Ingber ist auch Judah Folkman Professor für Gefäßbiologie an der HMS und Bostoner Kinderkrankenhaus, und Professor für Bioingenieurwesen an der Harvard John A. Paulson School of Engineering and Applied Sciences.
In ihrer neuen Studie das Team konzentrierte sich auf den Darmtrakt der Maus. „Es war traditionell extrem schwierig, Wirt-Mikrobiom-Interaktionen außerhalb eines Organismus zu modellieren, da viele Bakterien streng anaerob sind und unter normalen atmosphärischen Sauerstoffbedingungen sterben. Die Organ-Chip-Technologie kann diese Bedingungen wiederherstellen. und es ist viel einfacher, primäre Darm- und Immunzellen aus Mäusen zu gewinnen, als auf menschliche Biopsien angewiesen zu sein, “ sagte Erstautorin Francesca Gazzaniga, Ph.D., ein Postdoktorand, der zwischen Ingbers und Kaspers Gruppen arbeitet und das Projekt leitete.
Gazzaniga und ihre Kollegen isolierten Darmkrypten aus verschiedenen Regionen des Darmtrakts der Maus, einschließlich des Zwölffingerdarms, Leerdarm, Ileum, und Doppelpunkt, ihre Zellen durch einen "organoiden" Zwischenschritt in der Kultur gebracht haben, in dem sich kleine Gewebefragmente bilden und wachsen, die sie dann in einen von zwei parallelen mikrofluidisch perfundierten Kanälen der Wyss-Organ-Chips gesät haben, um regionenspezifische Darm-Chips zu erzeugen.
Der zweite unabhängig perfundierte Kanal ahmt das Blutgefäßsystem nach, und ist von der ersten durch eine poröse Membran getrennt, die den Austausch von Nährstoffen ermöglicht, Metaboliten, und sezernierte Moleküle, die Darmepithelzellen verwenden, um mit Gefäß- und Immunzellen zu kommunizieren.
Anschließend ging das Team auf S. typhimurium als Krankheitserreger ein. Zuerst, sie führten den Erreger in das Epithellumen des gentechnisch veränderten Maus-Colon-Chips ein und rekapitulierten die aus Mausstudien bekannten Schlüsselmerkmale im Zusammenhang mit dem Zusammenbruch der Darmgewebeintegrität. einschließlich der Unterbrechung von normalerweise festen Adhäsionen zwischen benachbarten Epithelzellen, verminderte Schleimproduktion, ein Anstieg der Sekretion eines entzündlichen Schlüsselchemokins (dem Maushomolog von humanem IL-8), und Veränderungen in der epithelialen Genexpression. Parallel zu, Sie zeigten, dass der Maus-Colon-Chip das Wachstum und die Lebensfähigkeit komplexer bakterieller Konsortien unterstützt, die normalerweise im Darmmikrobiom von Mäusen und Menschen vorkommen.
Diese Fähigkeiten zusammenführen, die Forscher verglichen die Wirkung von spezifischen mikrobiellen Konsortien von Mäusen und Menschen, die zuvor stabil im Darm von „gnotobiotischen“ Mäusen gehalten wurden, die vom Kasper-Team unter keimfreien Bedingungen gehalten wurden. Durch das Sammeln komplexer Mikrobiome aus dem Stuhl dieser Mäuse, und dann in die Dickdarm-Chips geimpft, die Forscher beobachteten eine Variabilität von Chip zu Chip in der Zusammensetzung des Konsortiums, was es ihnen ermöglichte, die Mikrobenzusammensetzung mit funktionellen Wirkungen auf das Wirtsepithel in Verbindung zu bringen.
"Die 16s-Sequenzierung gab uns ein gutes Gefühl für die mikrobielle Zusammensetzung der beiden Konsortien, und hohe Zahlen einer einzelnen Art, Enterococcus faecium, erzeugt von nur einem von ihnen im Colon Chip, ließ das Darmgewebe die Infektion besser tolerieren, “, sagte Gazzaniga. sowie infektiöse Prozesse mit anderen Krankheitserregern."
„Die Mäusedarm-on-a-Chip-Technologie bietet einen einzigartigen Ansatz, um die Beziehung zwischen der Darmmikrobiota, Wirtsimmunität, und ein mikrobieller Krankheitserreger. Diese wichtige Wechselbeziehung am lebenden Tier zu untersuchen ist schwierig, da es so viele unkontrollierbare Faktoren gibt.
Das Schöne an diesem System ist, dass im Wesentlichen alle Parameter, die Sie untersuchen möchten, kontrollierbar und leicht zu überwachen sind. Dieses System ist ein sehr nützlicher Schritt vorwärts, “ sagte Kasper, der William Ellery Channing Professor für Medizin und Professor für Immunologie an der HMS ist.
Die Forscher glauben, dass ihr vergleichender In-vitro-Ansatz spezifische Wechselwirkungen zwischen Krankheitserregern und kommensalen Bakterien mit Darmepithel- und Immunzellen aufdecken könnte. und dass identifizierte toleranzsteigernde Bakterien in zukünftigen Therapien verwendet werden könnten, wodurch das Problem der Erhöhung der antimikrobiellen Resistenz pathogener Bakterienstämme umgangen werden kann.
 Langfristige Ernährung kann die entzündlichen Wirkungen des Darmmikrobioms stärker beeinflussen als bestimmte Nahrungsmittel allein
Wie das Sprichwort sagt, ein Apfel am Tag hält den Arzt fern, aber herauszufinden, wie sich langfristige Ernährungsgewohnheiten genau auf die Rolle des Darmmikrobioms bei der Regulierung von Entzündun
Langfristige Ernährung kann die entzündlichen Wirkungen des Darmmikrobioms stärker beeinflussen als bestimmte Nahrungsmittel allein
Wie das Sprichwort sagt, ein Apfel am Tag hält den Arzt fern, aber herauszufinden, wie sich langfristige Ernährungsgewohnheiten genau auf die Rolle des Darmmikrobioms bei der Regulierung von Entzündun
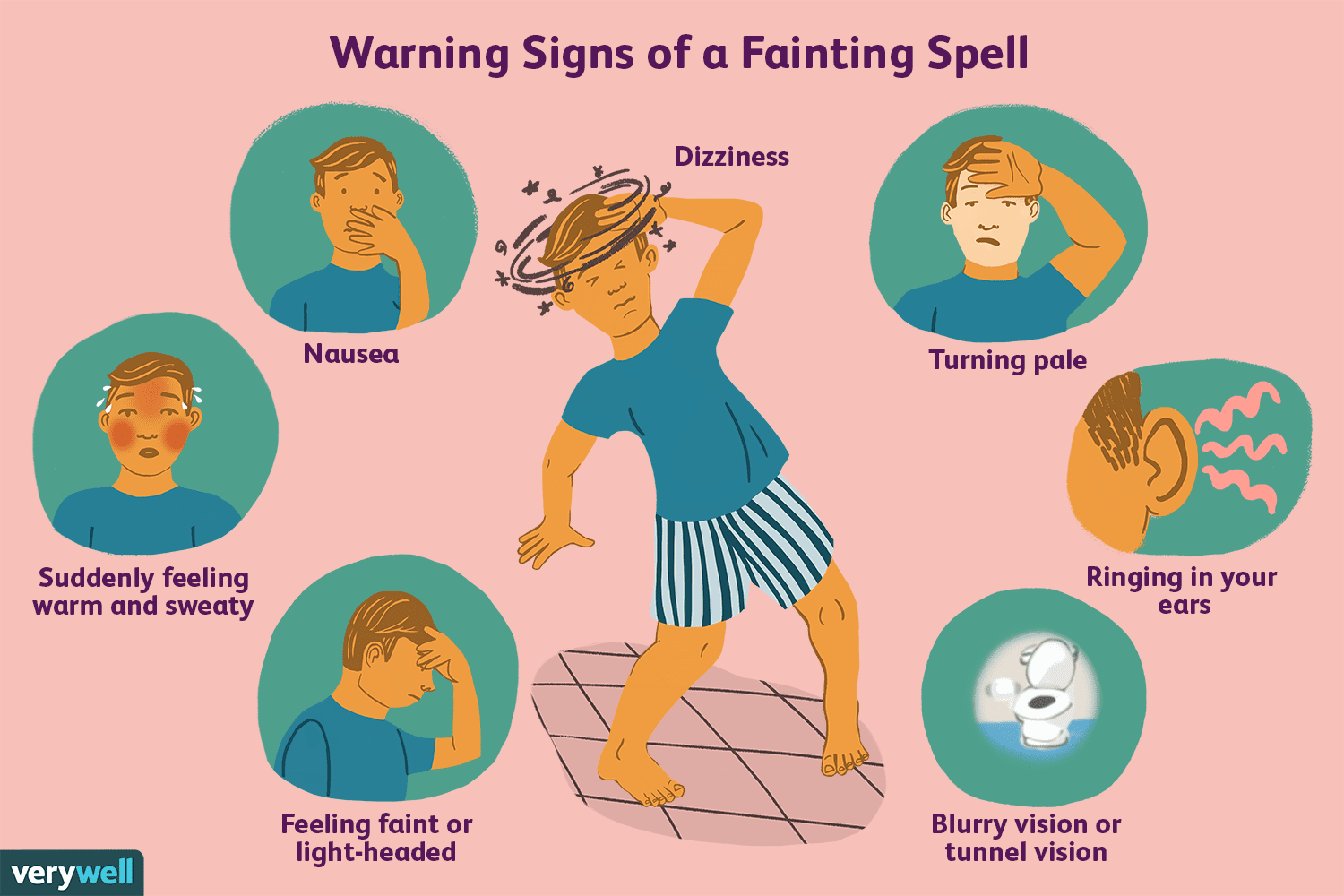 Überblick über den vasovagalen Reflex
Fangen Sie manchmal an zu schwitzen und haben das Gefühl, beim Stuhlgang ohnmächtig zu werden, oder fühlen Sie sich beim Anblick von Blut schwach? Es ist möglich, dass Ihr Vagusnerv dieses Gefühl veru
Überblick über den vasovagalen Reflex
Fangen Sie manchmal an zu schwitzen und haben das Gefühl, beim Stuhlgang ohnmächtig zu werden, oder fühlen Sie sich beim Anblick von Blut schwach? Es ist möglich, dass Ihr Vagusnerv dieses Gefühl veru
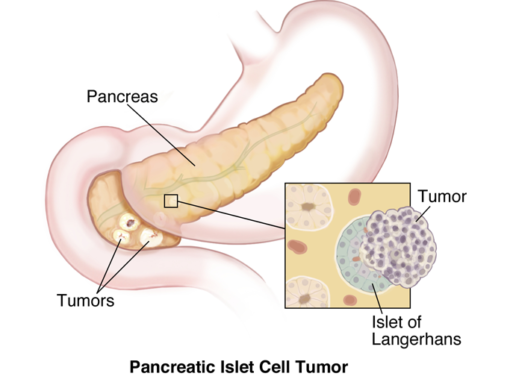 Neuroendokriner Tumor der Bauchspeicheldrüse (PNET)
Neuroendokrine Bauchspeicheldrüse Tumor (PNET) ist definiert als Inselzelltumor der Bauchspeicheldrüse, der Hormone vom Inselzelltyp bildet. PNET kann funktionsfähig oder nicht funktionsfähig sein. Fu
Neuroendokriner Tumor der Bauchspeicheldrüse (PNET)
Neuroendokrine Bauchspeicheldrüse Tumor (PNET) ist definiert als Inselzelltumor der Bauchspeicheldrüse, der Hormone vom Inselzelltyp bildet. PNET kann funktionsfähig oder nicht funktionsfähig sein. Fu