Ein markantes Beispiel für artspezifische Unterschiede in der Infektionstoleranz ist die Reaktion auf enterohämorrhagische E coli (EHEC) Bakterien, die für mehr als 100 verantwortlich sind, 000 Infektionen pro Jahr allein in den USA, und die Ursache von blutigem Durchfall (Reisedurchfall), Kolitis und hämolytisch-urämisches Syndrom (HUS) – eine schwere Erkrankung, die zum Versagen der Nieren führt, nachdem sie auf das Shiga-Toxin von EHEC gestoßen sind. Seit Jahren ist bekannt, dass es 100, 000-fach höhere Zahl von pathogenen EHEC-Bakterien, um Mäuse im Vergleich zu Menschen zu infizieren, und dass Mäuse keine Krankheitssymptome entwickeln, es sei denn, die Tiere werden unter speziellen keimfreien Bedingungen gezüchtet, in denen ihnen ein normales kommensales Darmmikrobiom fehlt.
Ein multidisziplinäres Team von Bioingenieuren, Mikrobiologen, und Systembiologen am Wyss Institute for Biologically Inspired Engineering in Harvard, die am DARPA-unterstützten Projekt "Technologies for Host Resilience" (THoR) des Instituts arbeiten, deren Ziel es ist, die Ursachen der Infektionstoleranz bestimmter Individuen oder Arten aufzudecken, ist es nun gelungen, die Infektion des menschlichen Dickdarms mit EHEC in vitro mit einem mikrofluidischen Organ-on-a-Chip (Organ Chip)-Kulturgerät zu modellieren. Überraschenderweise, Ihr Ansatz ermöglichte die Identifizierung von Hauptunterschieden zwischen den Metaboliten, die von den komplexen Gemeinschaften kommensaler Bakterien produziert werden, die das Mikrobiom der Maus und des menschlichen Dickdarms umfassen. Sie fanden heraus, dass vier Metaboliten, die vom menschlichen Darmmikrobiom in höheren Konzentrationen produziert werden, dazu beitragen können, die erhöhte Empfindlichkeit des menschlichen Dickdarms gegenüber EHEC zu erklären. Die Studie wurde veröffentlicht in Mikrobiom .
„Uns hat die Beobachtung motiviert, dass es oft enorme Unterschiede in der Sensitivität zwischen menschlichem und Mausdarm gibt, wenn sie mit dem gleichen Erreger herausgefordert werden, und frühere Arbeiten, die gezeigt haben, dass einige dieser Unterschiede in der Infektionstoleranz durch Unterschiede im Darmmikrobiom zwischen diesen Arten erklärt werden können, " sagte der Gründungsdirektor des Wyss Institute, Donald Ingber, M. D., Ph.D., der das Studium leitete. "Um dieses Problem direkt anzugreifen, wir nutzten unsere Human-Organ-Chip-Technologie und kombinierten sie mit mikrobiellen Metaboliten, die in Bioreaktoren hergestellt wurden, sowie metabolomische Analyse, um Einblicke in die molekularen Grundlagen für diesen artspezifischen Unterschied in der Empfindlichkeit gegenüber EHEC zu gewinnen." Ingber ist außerdem Judah Folkman Professor of Vascular Biology an der Harvard Medical School (HMS) und das Vascular Biology Program am Boston Children's Hospital, sowie Professor für Bioengineering an der John A. Paulson School of Engineering and Applied Sciences in Harvard.
Da EHEC hauptsächlich den menschlichen Dickdarm infiziert, Das Team stellte zunächst einen Colon-Chip mit seiner mikrofluidischen Kulturtechnologie zusammen und nutzte seine jüngsten Fortschritte bei der Verwendung von Darmgewebefragmenten, die als Organoide bekannt sind, als Zwischenprodukte zur Bildung eines hochfunktionellen Darmepithels, das spontan fingerartige Vorsprünge bildet, die Darmzotten genannt werden. Im Dickdarm-Chip, das Dickdarmepithel kleidet einen von zwei parallelen Kanälen (der "Darm-Luminal-Kanal") aus, die durch eine poröse Membran getrennt sind, die mit einer extrazellulären Matrix (ECM) beschichtet ist, an die Zellen vorzugsweise anhaften. Der gegenüberliegende Kanal (der "vaskuläre Kanal") wird von menschlichen Darm-Endothelzellen ausgekleidet, die ein Blutgefäß nachahmen, das das Dickdarmepithel unterstützt und mit ihm kommuniziert.
Das Team testete, ob die volle Komplexität löslicher Moleküle, die von komplexen mikrobiellen Gemeinschaften von Mäusen und Menschen produziert werden, die in Bioreaktoren kultiviert werden, die das Dickdarmmilieu nachahmen, die EHEC-Infektiosität in den menschlichen Dickdarmchips unterschiedlich beeinflusst. "Es war auffallend - nach Zugabe von humanen mikrobiomspezifischen Metaboliten wurde das menschliche Dickdarmepithel schwer verletzt, wobei große Läsionen auftraten, wo Zellen starben und sich vom Gewebe ablösten. während das gleiche menschliche Epithel, das mikrobiomspezifischen Metaboliten der Maus ausgesetzt war, viel weniger betroffen war, “ sagte Erstautor Alessio Tovaglieri, der seine Diplomarbeit im Team von Ingber als Student an der ETH Zürich in der Schweiz durchführte. "Interessant, die pathogenen EHEC-Bakterien haben das Dickdarmgewebe in Abwesenheit von Mikrobiom-Metaboliten nicht geschädigt, und die komplexen Metabolitengemische selbst hatten in Abwesenheit von EHEC keine Wirkung."
Das Team konnte zeigen, dass die Unterschiede bei den durch menschliche und Maus-Mikrobiom-Metaboliten ausgelösten Verletzungen nicht auf Veränderungen der entzündlichen Zytokine zurückzuführen sind. Unterschiede in der Shiga-Toxin-Produktion, oder Veränderungen in der Fähigkeit von EHEC, das Dickdarmepithel zu besiedeln. Um den eigentlichen Ursachen näher zu kommen, sie führten Transkriptomanalysen durch, Analyse von Veränderungen der Genexpression in den EHEC-Bakterien bei Exposition gegenüber den menschlichen und Maus-Mikrobiom-Metaboliten und Metabolomik-Analyse, um Unterschiede in der chemischen Zusammensetzung der beiden Metaboliten-Mischungen zu identifizieren.
„Gene, die für Proteine kodieren, die bei der EHEC-Chemotaxis und der Flagellenmotilität wirken, erzielten die höchsten Werte unter allen Genen, die spezifisch durch die Metaboliten des menschlichen Mikrobioms hochreguliert wurden, die die Pathogenität zu verstärken schienen, und, interessant, Wir fanden heraus, dass EHEC-Bakterien, die den Metaboliten des menschlichen Mikrobioms ausgesetzt waren, viel beweglicher waren, “ sagte Tovaglieri. Flagellen sind die komplexen schlanken Anhängsel, die viele Bakterien wie Motoren benutzen, um sich in Richtung Nahrungsquellen zu bewegen (Chemotaxis).
Von 426 Metaboliten, die in den beiden Metabolitengemischen in unterschiedlichen Konzentrationen vorhanden waren, eine Kombination von vier menschlichen Mikrobiom-Metaboliten, die alle im Vergleich zu ihren Spiegeln im Mausmikrobiom erhöht waren, war ausreichend, um die EHEC-Motilität in einer Schale zu erhöhen. Wichtig, sie reichten auch aus, um die Metabolitenmischung des normalerweise harmlosen Maus-Mikrobioms in eine Mischung umzuwandeln, die die Schädigung des Dickdarmgewebes im menschlichen Colon Chip-Gerät erleichtert, Damit ist es so effektiv wie die Metaboliten des menschlichen Mikrobioms. Einige dieser Metaboliten werden in viel höheren Konzentrationen bei Kindern gefunden, von denen auch bekannt ist, dass sie empfindlicher auf EHEC-Infektionen reagieren.
„Diese Arbeit hat potenzielle molekulare Ziele aufgedeckt, die helfen könnten, das Leiden von Patienten mit EHEC zu lindern, wenn wir Wege entwickeln könnten, ihre Produktion zu unterdrücken oder ihre Entfernung beim Menschen zu verbessern. Der gleiche Ansatz mit menschlichen Organchips in Kombination mit Metabolomik könnte dazu beitragen, andere Metaboliten zu identifizieren, die vermitteln schützende Wirkung und erhöhen in Zukunft die Toleranz gegenüber anderen Infektionen. “ sagte Ingber.
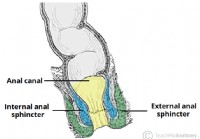 Der Analkanal
1 anatomische Position 2 Anatomische Struktur 2.1 Analschließmuskeln 2.2 Interne Struktur 3 Anatomische Beziehungen 4 Neurovaskuläre Versorgung und Lymphgefäße 5 Klinische Relevanz – Hämorrhoiden
Der Analkanal
1 anatomische Position 2 Anatomische Struktur 2.1 Analschließmuskeln 2.2 Interne Struktur 3 Anatomische Beziehungen 4 Neurovaskuläre Versorgung und Lymphgefäße 5 Klinische Relevanz – Hämorrhoiden
 Was verursacht Steatorrhoe?
Steatorrhoe oder Fettstuhl tritt auf, wenn zu viel Fett vorhanden ist, das das Verdauungssystem nicht aufnehmen kann. Erfahren Sie mehr über 15 häufige Ursachen von Steatorrhoe Steatorrhoe oder Fetts
Was verursacht Steatorrhoe?
Steatorrhoe oder Fettstuhl tritt auf, wenn zu viel Fett vorhanden ist, das das Verdauungssystem nicht aufnehmen kann. Erfahren Sie mehr über 15 häufige Ursachen von Steatorrhoe Steatorrhoe oder Fetts
 Wie Luftqualität und Trinkwasser unsere Darmgesundheit beeinflussen
In den letzten Jahren sind die Auswirkungen, die wir auf die Umwelt haben, zu einem der wichtigsten Anliegen der heutigen Welt geworden. Wir alle kennen die Auswirkungen der Umweltverschmutzung auf un
Wie Luftqualität und Trinkwasser unsere Darmgesundheit beeinflussen
In den letzten Jahren sind die Auswirkungen, die wir auf die Umwelt haben, zu einem der wichtigsten Anliegen der heutigen Welt geworden. Wir alle kennen die Auswirkungen der Umweltverschmutzung auf un