Der Co-entwickelt Helicobacter pylori
und Magenkrebs: Trinität von bakteriellen Virulenz, Host-Anfälligkeit und Lifestyle
Abstrakt Helicobacter pylori
ist ein wichtiger, aber nicht bewiesen Erreger von Magenkrebs. H. pylori
Infektion ist häufiger in den asiatischen Ländern wie Indien entwickelt und es ist in der Regel in einem frühen Alter erworben. Es hat zwei Jahrzehnte seit Marshall und Warren (1984) erste gekrümmte Bazillen im Magen von Geschwüren und Gastritis Patienten beschrieben. Diese Entdeckung hat sie den Nobelpreis vor kurzem gewonnen, aber die Debatte, ob H. pylori
ist ein Erreger oder ein symbiotischer Organismus ist noch heiß. Verbände mit krankheitsspezifischen Faktoren bleiben illusorisch Jahre, nachdem die Genomsequenzen zur Verfügung gestellt wurden. Cytotoxin-assoziiertes Antigen A (CagA
) und die sogenannte Plastizitätsbereich Cluster-Gene sind in der Pathogenese des Karzinoms des Magens beteiligt ist. Ein weiterer Virulenzfaktor VacA, deren Aufgabe es ist nach wie vor umstritten, hat vor kurzem in der Pathologie von Magenkrebs projiziert worden. Studien der Evolution durch genetische Variation in der H. pylori
Populationen haben ein Fenster in die Geschichte der menschlichen Bevölkerung Migrationen und eine mögliche Co-Evolution des Erregers mit seinem menschlichen Wirt zur Verfügung gestellt. Mögliche symbiotischen Beziehungen wurden seit der Entdeckung des Erregers ernsthaft diskutiert. Die Debatte wurde weiter intensiviert, da einige Studien H. pylori-Infektion
vorgeschlagen, bei manchen Menschen von Vorteil sein. In diesem Kommentar, wir versuchen, kurz zu diskutieren über H.
als Humanpathogen pylori, und einige der wichtigen Fragen im Zusammenhang mit ihrer Pathophysiologie in verschiedenen Hosts verbunden.
"Wir tanzen in einem Ring um und nehmen wir an, das Geheimnis der Mitte sitzt in und weiß "- Robert Frost
Hintergrund
Barry J. Marshall und Robin Warren, zwei australische Forscher, die das Bakterium Helicobacter pylori
1982 entdeckt Nobelpreis 2005 für Physiologie oder Medizin ausgezeichnet wurden . Diese "altmodische medizinische Detektivarbeit" beeindruckte die Nobelversammlung des Karolinska-Institut, von der Grundlagenforschung weg zu bewegen [1, 2] und die Forschung zu belohnen, die eine viel umstrittene bakteriellen Organismus als gefährliche Erreger schlägt. Es war ein langjähriges Dogma in der medizinischen Wissenschaft, dass Stress und Lifestyle-Faktoren zu Gastritis und Magengeschwüren führen. Warren und Marschall entkräftet, dass Dogma und machte deutlich, dass gekrümmten Bazillen genannt Campylobacter pyloridis
(später als Helicobacter pylori
genannt) waren die Hauptursache für Magen-Darm-Geschwüren, distalen Adenokarzinom des Magens und Magenlymphom [3]. Bald danach wurde H. pylori
Kolonisationsmodell eines der besten erforschten Beispiele für Erreger Evolution und ihre Rolle in der Infektionsbiologie. Dies markiert auch den Beginn eines Wettbewerbs, wie lange H. pylori
hatte menschlichen Magen gewesen kolonisieren, die Analogie eines symbiotischen Organismus zu fördern mit ihrem menschlichen Wirt coevolved.
H. pylori
als Marker für die menschliche peopling und Migration: Beispiel für Koevolution
H. pylori
ist vermutlich mit seinem Wirt und daher Ursprünge und den Ausbau von mehreren Populationen und Unterpopulationen von H. pylori
Spiegel alten menschlichen Migrationen co-entwickelt. Antike Ursprünge von H. pylori
in der Welt und in Indien sind nicht klar und umstritten. Es ist nicht klar, wie verschiedene Wellen der menschlichen Migrationen in verschiedenen Kontinenten auf die Entwicklung der Stamm Vielfalt von H. pylori beigetragen
. Unsere Gruppe hat vor kurzem versucht, diese Probleme durch die Erfassung der genetischen Ursprünge von H. pylori zu adressieren
von einheimischen Peruaner (von indianischer Abstammung) [4] und Inder (Devi et al
., Nicht veröffentlichte Daten) und ihre genomische Vergleich mit Hunderte von Isolaten aus verschiedenen geografischen Regionen. Zu diesem Zweck wurde der genetischen Identität der Stämme durch fluoreszierende Aflp (FAFLP) Analyse, multilocus Sequenz Typisierung (MLST) der Housekeeping-Gene und die Sequenzanalysen der B Adhäsin und oip
A Gene
bab seziert . Die ganze cag
Pathogenität-Insel (cag
PAI) aus diesen Stämmen wurde auch analysiert, PCR und Gen-Sequenzierung verwendet. Bei der südamerikanischen H. pylori
Populationen, wurde beobachtet, dass während europäische Genotyp (hp
-Europe) in nativer peruanischen Stämme vorherrschte, etwa 20% dieser Stämme eine Subpopulation mit einer indianischen Abstammung vertreten ( hsp-Amerind
). umgebenden Jedoch wurden alle diese Stämme gezeigt, um eine vollständige, "westlichen" Typ cag
PAI, und zwar unabhängig von ihrer Vorfahren Zugehörigkeit und die Motive zu verweisen. Dies zeigte eine mögliche Akquisition von cag
PAI durch die hsp-Amerind
Stämme aus den europäischen Stämmen, während Jahrzehnten der Co-Kolonisation. Diese Beobachtungen daher vorgeschlagen Anwesenheit von Ahnen H. pylori
(hsp-Amerind
) in der peruanischen Indianer, die möglicherweise geschafft zu überleben und im Wettbewerb gegen die spanischen Stämme, die vor etwa 500 Jahren in die Neue Welt kamen. Es wurde vorgeschlagen, dass diese nach dem einheimischen peruanischen H. pylori hätte geschehen können, Stämme erworben cag
PAI-Sequenzen, entweder durch neue Akquisition in cag
-negativen Stämme oder durch Rekombination in cag
positive indianischer Stämme. Bei der indischen Stämme, fast alle analysierten Isolate zeigten eine europäische Herkunft und gehörte zu MLST Genogruppe hp-Europa. Die cag
PAI von indischen Stämmen beherbergte zeigte auch europäische Funktionen auf PCR-basierte Analyse und vollständige PAI-Sequenzierung. Diese Beobachtungen legen nahe, dass H. pylori-Hotels in Indien haben antike Ursprünge in Europa (Devi et al
, nicht veröffentlichte Daten). Diese Ergebnisse dürften Spekulationen zu stärken im Zusammenhang mit groß angelegten Austausch der alten indigenen Bevölkerung Indiens von indoarische Nomaden, bringen erste neolithische Praktiken und Sprachen aus dem Fruchtbaren Halbmond.
H. pylori
in Magenerkrankungen
H. pylori
Magen-Darm-Geschwüren, Adenokarzinom des Magens verursacht, und Magen-Lymphom. Adenokarzinom des Magens ist die zweithäufigste Ursache für Todesfälle durch Krebs weltweit in erster Linie wegen der hohen Inzidenz, aggressiven Krankheitsverlauf und der Mangel an wirksamen Behandlungsmöglichkeiten zu einer Todesrate von einer Million pro Jahr weltweit führenden [3]. H. pylori
im distalen Adenokarzinom des Magens beteiligt, die häufiger als das proximale ist. H. pylori
auch B-Zell-assoziierten lymphatischen Schleimhaut Gewebe (MALT) Lymphom des Magens [3], aber zugleich negativ assoziiert mit schwereren Formen der Reflux-Ösophagitis und ihre Folgen verursacht - Barrett-Ösophagus und Adenokarzinom des Ösophagus [5 , 6]. Diese negative Korrelation ist der Hauptgrund, dass H. pylori
ein kleineres Übel macht. Es hat eine aktuelle Interesse zu sehen, ob H. pylori in oder in menschlichen Erkrankungen des Darms als dem oberen Gastrointestinaltrakt oder Syndromen wie idiopathische thrombozytopenische Purpura erleichtert bewirkt [5, 6], Hauterkrankungen, Lebererkrankungen und Herz-Kreislauf und zerebrovaskuläre Krankheit. Aber viele von ihnen wurden häufiger mit Helicobacters andere als H. pylori-assoziierten
[7, 8].
Bakterielle codiert proinflammatorische und karzinogenen Faktoren
Studien zeigen, dass das Risiko für die Entwicklung von Magenkarzinom war viel größer mit der H. pylori-Infektion
[9]. Die cag
Ein Gen von H. pylori Was ist der Haupt Virulenzfaktors, die durch Störung der zellulären Architektur und die Signalisierung für die Entwicklung von Adenokarzinom des Magens führt. Das Vorhandensein eines funktionellen cag
A-Gens bestimmt die H. pylori-Stamm
Typ aggressiv oder mild zu sein. Die cag TÜV-positive Stämme verursachen viel intensiver Geschwüre von Magen oder Zwölffingerdarm und sind schädlicher als die cag
A-negativen [10] führt zu atrophischen Gastritis und Magenkarzinom [11, 12]. CagA, die Effektor-Protein-Produkt von cag
A, Tyrosin durch SRC phosphoryliert Kinasen nach seiner Sekretion auf die intestinale Schleimhautoberfläche [13]. Epiya Motive in der CagA Proteinsequenz eine kritische Rolle in Tyrosinphosphorylierung spielen, was wiederum eine SHP2 Phosphatase als Onkoprotein handeln aktiviert. Als SHP2 in das Zellwachstum und die Beweglichkeit hilft, ist die Deregulierung von CagA ein wichtiger onkogenen Mechanismus von H. pylori kodiert
. CagA basierend auf Sequenzvariation an der SHP2-Bindungsstelle ist untergliedert sich in zwei Haupt epidemiologische Typen - ostasiatischen CagA (mit stärkeren SHP2 Bindung und eine größere biologische Aktivität) und West CagA (verminderte SHP2 Bindung und milder Colitis Potentiale). Stämme mit mehreren CagA Tyrosinphosphorylierung Motive sind häufiger mit Magenkrebs als diejenigen mit weniger C-Typ-Motive assoziiert [14-16].
Inzidenz der Infektion mit H. pylori
biologisch aktiver CagA tragen könnte das hohe Vorkommen erklären von Magenkarzinom in einigen Ländern wie Japan und Korea. Aber auch andere Populationen mit extrem hohen Infektionsraten, wie Indianer haben fast vernachlässigbar Inzidenz von Magenkarzinom [17]. Mögliche Gründe für eine solche merkwürdige Unterschiede der Krankheitsverlauf könnte unter Wirtspopulationen, Umweltfaktoren wie Ernährungsgewohnheiten und Stamm Unterschiede von H. pylori
.
H. pylori im Lichte der Unterschiede in der genetischen Anfälligkeit erklären
hat eine einzige Kopie des vac
ein Gen, das VacA-Protein, eine sekretierte 95 kDa Peptid. Die vac
A-Gens variiert in der Signalsequenz (Allele s1a, s1b, S1C, s2) und /oder seinem Mittelbereich (Allele m1, m2) zwischen verschiedenen H. pylori
Populationen. Die verschiedenen Allotypen von s und m Regionen bestimmen das Ausmaß der Zytotoxizität von VacA. Stämme mit vac
Ein Genotyp s1 /m1 sind häufiger mit Magenkrebs als die anderen Typen [18] verbunden. Unter anderen Funktionen VacA wurde die Apoptose in Epithelzellen induzieren. Vor kurzem hat die angepasst Immunsystem zu unterdrücken Targeting lokale Immunreaktionen zu verlängern, das Ergebnis einer Infektion und damit verhindern Clearance durch das Immunsystem des Wirts [19] ein potenter immunomodulatory Toxin sein, VacA vorgeschlagen wurde. Die VacA ist Gegenstand intensiver Biochemie gewesen, aber es fehlte solide Beweise, dass es in der Tat in der Pathogenese beteiligt ist. Eine kürzlich veröffentlichte Studie argumentiert, dass Vaca miniscule Rolle als Virulenzfaktor bei der Zell Umgehung von H. pylori
hat. Sie zeigten, dass die vac
ein Null-Mutante von H. pylori
der Lage war, bestimmte Zelllinien zu entziehen, als Wildtyp hat [20]. Daher ist die VacA Beteiligung noch Teil einer Debatte über die eine wahre Virulenzfaktor ist und weitere Untersuchungen erwartet.
Neben der Kardinal Virulenzfaktoren CagA und VacA, mehrere andere Proteine der cag
PAI, äußeren Membranhülle . Protein (NAP), Porine, LPS, Urease und einige Mitglieder der sogenannten Plastizität Region Cluster möglicherweise spielen eine wichtige Rolle bei entzündlichen Prozessen
Mikroevolution während der Kolonisation Proteine, Flagellin, Adhäsine, Neutrophilen-Aktivierung: kann es zur Virulenz verknüpft werden Optimierung?
Es ist seit langem angenommen, dass i) die stabile charakteristische Virulenzfaktoren sind inmitten einer ansonsten schnell entwickelnden und rekombinieren Genom und ii)
H. pylori, dass diese Faktoren bis zur Krankheitsprogression oder das Ergebnis verknüpft werden können, auf jeder Zeit. Jedoch mehrere Berichte vorliegenden Daten gegen diese Annahmen. Zwei Subklone eines H. pylori-Stamm
Co-kolonisiert einen einzigen Patienten mit Variationen in vac
Ein mittleren Bereich, wodurch einer der beiden Subklone nicht toxisch [21]. Der Grund dafür war eindeutig der Mikroevolution über
Rekombination im Magen. Unsere Gruppe hat schon früher eine große Deletion in vac
A-Gen gezeigt in einer der beiden Isolate von einer gemeinsamen Vorläuferstamm in einem Französisch Patienten auftreten, 9 erhalten Jahre auseinander liegen [22]. Dies war wahrscheinlich ein Fall von Anpassung oder Entwicklung in vivo
. Eine Vervielfältigung oder Löschung des cag
A-Gen wurde von Aras et al
gezeigt. [23] in zwei Isolate in einem einzelnen bestehenden und erholte 7 Jahre auseinander. Kersulyte et al
haben vollständige Löschung von cag
PAI durch Rekombination gezeigt [24]. Darüber hinaus können verschiedene Methoden angewendet Genotypisierung auf zwei oder mehr H. pylori
Isolate aus dem gleichen Patienten ergab ähnliche Fingerabdrücke, mit kleinen Unterschieden erhalten [25, 26]. Dies kann möglich sein, aufgrund der Tatsache, dass zwei oder mehr Isolate von einem Patienten gewonnen wird, kann eine uralte Beziehung mit einem Gründerstammes teilen, sondern haben unabhängige genomische Veränderungen durchgemacht. Dieses Phänomen wurde als "Mikroevolution '[25, 27] bezeichnet. Allerdings ist Folge Beweise notwendig, die Lage und das Ausmaß der Mikroevolution und phänotypische Bestätigung [16] zu bestätigen ist erforderlich, um festzustellen, ob eine solche Mikroevolution zu Veränderung oder Optimierung der Virulenz führt in Reaktion auf die Magen-Umgebung zu ändern.
Genetische Faktoren Host-in H. pylori
induziertem Karzinom
Wirtsfaktoren spielen auch eine wichtige Rolle bei der Veranlagung zur H. pylori
bedingten Krankheiten und Anfälligkeiten zu schweren pathologischen Ergebnisse spielen. Die Wirtsfaktoren relevant bei H. pylori
induzierten Erkrankungen gehören vor allem Komponenten von Magen-Sekretionssystem und die Immunapparat. Interessanterweise ist die Gastritis und Magengeschwüren, die durch bakterielle Infektion führen, haben verschiedene klinische Profile und sind umgekehrt mit einem hohen Grad der Säuresekretion assoziiert, während, sind Magenkrebs mit niedrigen Säuresekretion assoziiert durch den Verlust der Masse Belegzellen [28, 29 ]. In einer aktuellen Studie eine ostindischen Bevölkerung beteiligt, schlug Autoren einer Assoziation zwischen den IL1β-Gen-Polymorphismen und vermittelter Zwolffingerdarmgeschwur Risiko
H. pylori. Sie weitere Effekte spezifischer IL1β Genotypen auf die Expression von IL1β mRNA in der Magenschleimhaut beobachtet. Ihre in vivo
Studien wurden weiter untermauert, zum ersten Mal, durch in vitro
Experimente, die die gegenüberliegenden homozygot Risiko Genotypen darstellen, die in Zwölffingerdarmgeschwür Patienten beobachtet wurden [30]. So könnte dies die Tatsache erklären, dass die Unterschiede in der Karzinogenese Risiko bei Menschen aus verschiedenen geographischen Gebieten Unterschiede in ihrer genetischen Make-up, beeinträchtigen könnten
Entwicklungsland Rätsel.? Inder, Ernährung und Veranlagung für Magenkrebs
Was rätselhaft ist über der Magenkrebs-Szenario in Indien? Die Antwort ist nicht einfach. Dieses Land hat eine hohe Prävalenz von H. pylori-Infektionen
und ein geringes Risiko von Magenkrebs im Gegensatz zu einigen der entwickelten Länder mit einem niedrigen H. pylori
Kolonisationsrate wie China und Japan. Indien ist für eine sehr hohe Inzidenz von H. pylori-Infektion
[31, 32] bekannt. Biologisch inaktive CagA könnte ein Faktor in geringen Prävalenz von Magengeschwüren und Krebs in Indien sein. Allerdings basiert Phänotypisierung Studien über In-vitro-
Beurteilung von CagA-Funktion in der indischen Isolate nicht getan worden. Unserer Meinung nach wird es unangemessen, CagA Funktionalität allein zu verwickeln. Das Spektrum und die Ergebnisse der Pathologie in der H. pylori-Infektion
ist eng mit allen drei Faktoren bestimmt - Virulenz, Wirts Genetik und die Umwelt. Es scheint, dass die Umgebung des Magens (Säure, Pufferung und Schleimgehalt) bestimmt durch Faktoren der Lebensweise (Ernährung, Ernährungsgewohnheiten, Alkoholismus, Mundhygiene, Wasserhygiene, Körperpflege, die Nähe bäuerlichen Gemeinschaften und Tiere) und die genetischen Determinanten der Anfälligkeit sind Cheffahrer des pathologischen Ergebnis. Obwohl Armut-assoziierten Faktoren (Überbelegung, schlechte Hygiene, niedriger sozioökonomischer Status, beeinträchtigt die Wasserhygiene etc.) in Ländern wie Indien erleichtern hohe Frequenz von H. pylori
Kolonisation, schnelle Wiederbesiedlung Post Tilgung und niedrigere Erwerbsalter [33 ]; eine überraschende Tatsache ist, daß solche Bereiche zu niedrigsten Risiko der Entwicklung von Magenkrebs sind [34]. Die Korrelation zwischen H.-pylori-Infektion
und Magenkrebs hat in Indien bisher erfolglos gewesen [35]. Eine aktuelle Studie aus Indien beteiligt 279 Patienten mit Magen-Tumoren konnte eine höhere Prävalenz von H. pylori
Infektion bei Patienten mit Magen-Tumoren zeigen als Vergleich zu den Kontrollen (101 Nicht-Ulkus Dyspepsie und 355 gesunden Probanden) [36]. Diese Beobachtungen fordern die Vielseitigkeit von vereinfachten Modellen von Magen Karzinogenese basierend auf H. pylori-Infektion
. Wir glauben, dass in der indischen Kontext, Ernährung als wichtiger Umweltfaktor die Dynamik von Magenkrebs Demografie regelt in erster Linie durch physiologische Integrität der Magenschleimhaut Nischen zu regulieren. Und das ist, wo; die Ernährungspraktiken und Lifestyle-Faktoren werden wichtig, im Rahmen der Weiterentwicklung von Gastritis Magenkrebs. Diäten niedrig in Gemüse, Fasern und Obst und hoch in Salz-Konserven oder salz verarbeitetes Fleisch das Risiko von Magenkrebs zu erhöhen [37].
Dementsprechend wird in solchen Situationen scheint es einen Unterschied in der Verteilung Häufigkeit von Magen zu sein Krebsinzidenz. Die südlichen und östlichen Teilen Indiens haben eine höhere Frequenz von Magenkrebs als Rest des Landes [38]. Reis ist das Grundnahrungsmittel in Süden, während Fisch, Fleisch, Gewürze und Salze die wichtigsten Lebensmittel im östlichen Teil sind [37-39]. Im Gegensatz dazu ist die große vegetarische Bevölkerung in Nordindien bei geringerem Risiko von Magenkrebs. Aber die Zeiten ändern sich; schnelle Flourish der Post Globalisierung Unternehmenskultur gebracht Fast Food, keimfreies Wasser in Flaschen, pasteurisierte Milch und Fleischkonserven Gegenstände auf den heutigen Tag Lebensstil in den großen indischen Städten. Allerdings wird es noch zu früh, um es zu verbinden mit Magenkrebserkrankungen in den Städten in Indien steigen [39].
Umgekehrt niedrig zu vernachlässigen Inzidenz von Magenkrebs als für ländliche Gebiete in Indien vom nationalen Krebsregister erfasst [39] zu spekulieren, führt uns, warum in Bezug auf weniger Schäden von H. pylori-Infektion
deutliche Vorteile ländlichen Gemeinden haben. Es muss untersucht werden, ob diese Vorteile aufgrund ihrer Ernährung aus frischen landwirtschaftlichen Produkten und ihre "Freundschaft" mit den so genannten "alten Freunden", die Gruppe von Bakterien, die Ebenen der regulatorischen Immunzellen das Verbleiben der Bevölkerung werden könnten und haben während die meisten der Evolution der Säugetiere kompliziert verbunden.
Erklärungen
Danksagung
Autoren möchte Prof. Seyed Hasnain für seine Führung und für Diskussionen.
YA Empfänger von Junior-Forschungsstipendium von Rat von Scientific & Industrielle Forschung (CSIR), Govt. Indiens. Forschung im Labor von NA wurde durch Zuschüsse aus dem Department für Biotechnologie, Regierung unterstützt. Indiens.
Interessen
Der Autor Konkurrierende (n) erklären, dass sie keine Interessenkonflikte haben.
 Was sind die Symptome des Dumping-Syndroms? Früh vs. spät
Was sind die Symptome des Dumping-Syndroms? Früh vs. spät
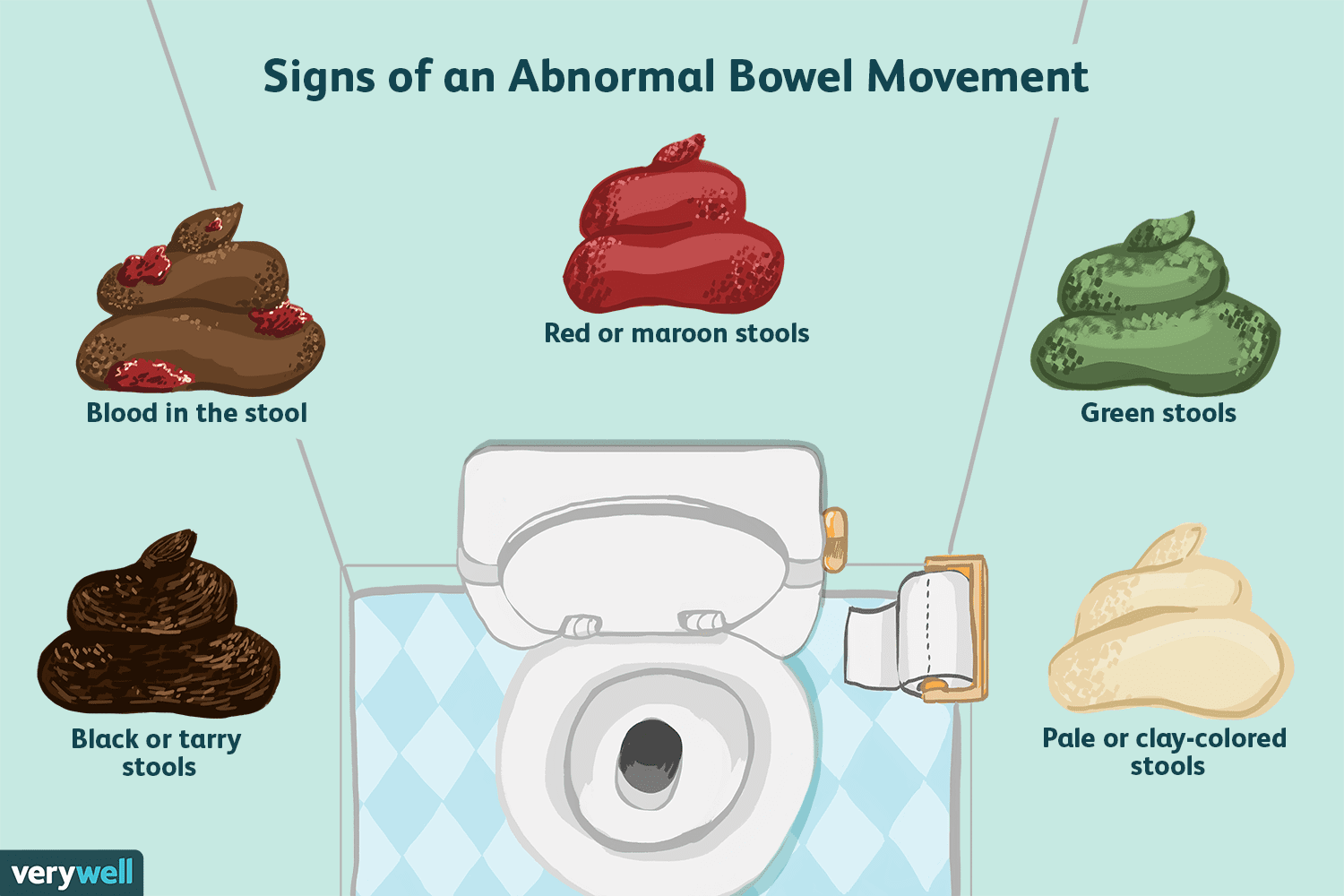 Was es bedeutet, einen normalen Stuhlgang zu haben
Was es bedeutet, einen normalen Stuhlgang zu haben
 Verdauungsstörungen:Symptome von Leberproblemen
Verdauungsstörungen:Symptome von Leberproblemen
 Ebola-Virus:Ausbrüche, Epidemien und Symptome
Ebola-Virus:Ausbrüche, Epidemien und Symptome
 Mikrobiom-Tests auf Parasiten, Viren, Infektionen, IBS und Leaky Gut?
Mikrobiom-Tests auf Parasiten, Viren, Infektionen, IBS und Leaky Gut?
 Wie man mit der Low-FODMAP-Diät beginnt
Wie man mit der Low-FODMAP-Diät beginnt
 Blähungen und Völlegefühl bei RDS
Blähungen Völlegefühl ist definiert als die Wahrnehmung eines erhöhten Drucks im Unterleib. Blähungen sind ein ziemlich universelles Phänomen, das häufiger von Frauen als von Männern berichtet wird,
Blähungen und Völlegefühl bei RDS
Blähungen Völlegefühl ist definiert als die Wahrnehmung eines erhöhten Drucks im Unterleib. Blähungen sind ein ziemlich universelles Phänomen, das häufiger von Frauen als von Männern berichtet wird,
 Können Pepto-Bismol oder Kaopectate Ihren Stuhl schwarz machen?
Magenverstimmung ist ein häufiges Problem, und viele Menschen nehmen eine übertriebene Gegenmittel, um etwas Linderung zu bekommen. Zu den verschiedenen Arzneimitteln, die bei Magenproblemen verwendet
Können Pepto-Bismol oder Kaopectate Ihren Stuhl schwarz machen?
Magenverstimmung ist ein häufiges Problem, und viele Menschen nehmen eine übertriebene Gegenmittel, um etwas Linderung zu bekommen. Zu den verschiedenen Arzneimitteln, die bei Magenproblemen verwendet
 Die Verwendung von CT-Scans bei Kindern fiel über das letzte Jahrzehnt
Neueste gesunde Kindernachrichten Fütterungsprobleme des Babys im Zusammenhang mit Entwicklungsverzögerungen Ihr Arm hat sich im Laufband der Familie verfangen Sind Sie besorgt über die Nutzung sozia
Die Verwendung von CT-Scans bei Kindern fiel über das letzte Jahrzehnt
Neueste gesunde Kindernachrichten Fütterungsprobleme des Babys im Zusammenhang mit Entwicklungsverzögerungen Ihr Arm hat sich im Laufband der Familie verfangen Sind Sie besorgt über die Nutzung sozia