Im März 2012 Fischer in einem Fjord in Nord-Norwegen Betrieb berichtet Kabeljau fangen, einen einheimischen Fisch eine wirtschaftlich wichtige Meeresfischerei in dieser Region, mit ungewöhnlichen Beute in ihren Mägen zu bilden. Es wurde spekuliert, dass diese Atlantischen Lachs sein könnte, die zu dieser Zeit des Jahres, in der Küstenzone nicht typische Beute für Kabeljau ist. Diese Beobachtungen wurden deshalb an die norwegische Fischereidirektion gemeldet als mutmaßlicher Interaktion zwischen einem lokalen Fischfarm und dieser kommerziellen Fischerei. Statistische Analysen der genetischen Daten von 17 Mikrosatelliten-Marker genotypisiert auf 36 teilweise abgebauten Beute, Proben von Lachs aus einem lokalen Fischfarm, und Proben von der nächsten Wildpopulation erlaubt die folgenden Schlussfolgerungen: 1. Die Beute Atlantischen Lachs waren, 2. Diese Lachs nicht von der lokalen Wildpopulation stammen, und 3. die lokalen Farm war die wahrscheinlichste Quelle dieser Beute. Weitere Tests zeigten, dass 21 der 36 Opfer wurden mit piscine Reovirus infiziert. Während die mögliche Verbindung zwischen piscine Reovirus und der Krankheit Herz- und Skelettmuskelentzündung noch unter wissenschaftlichen Debatte ist, hatte diese Krankheit Sterblichkeit von einer großen Anzahl von Lachs in der Farm im Monat vor der Beobachtungen der Fischer verursacht. Diese Analysen liefern neue Einblicke in die Wechselwirkungen zwischen domestizierten und wild lebenden Fischen
Citation:. Glover KA, Sørvik AGE, Karlsbakk E, Zhang Z, Skaala Ø (2013) molekulargenetische Analyse des Mageninhalts enthüllt Wilder Kabeljau Fütterung auf Piscine Reovirus (PRV) Infizierte Atlantischen Lachs mit Ursprung von einer kommerziellen Fischfarm. PLoS ONE 8 (4): e60924. doi: 10.1371 /journal.pone.0060924
Redaktion: Martin Krkosek, University of Toronto, Kanada
Empfangen: 3. Oktober 2012; Akzeptiert: 4. März 2013; Veröffentlicht: 19. April 2013
Copyright: © 2013 Glover et al. Dies ist eine Open-Access-Artikel unter den Bedingungen der Lizenz Creative Commons, die uneingeschränkte Nutzung erlaubt, die Verteilung und Vervielfältigung in jedem Medium, vorausgesetzt, der ursprüngliche Autor und Quelle genannt werden
Finanzierung:. Diese Studie wurde von der norwegischen Fischereiministerium finanziert. Die Geldgeber hatten keine Rolle in Studiendesign, Datenerfassung und Analyse, Entscheidung oder Vorbereitung des Manuskripts zur Veröffentlichung
Konkurrierende Interessen:.. Die Autoren haben erklärt, dass keine Interessenkonflikte bestehen
Einführung
Einer der wichtigsten ökologischen Herausforderungen im Zusammenhang mit der kommerziellen Kultur des Atlantischen Lachs ( Salmo salar Die Anwendung molekulargenetischer Methoden für Artenschutz und die Fischereiwirtschaft, einschließlich forensischer Fällen für die Strafverfolgung und Regulierung erweitert [13]. Typische Tierwelt forensischer Anwendungen reichen von der Spezies Identifikationen für morphologisch nicht identifizierbare Gewebe und Proben, zur Bevölkerung Ursprungsbezeichnungen für Personen im Verdacht, von Stellen aufgenommen wurden, in denen Ernte geregelt ist oder illegal [14] oder sogar fälschlicherweise behauptet [15]. Analyse von Magen und Fäkalien Inhalt von Räubern wurde auch ausgiebig durchgeführt worden, und die Identifizierung von Beutetieren in der Art zur Verfügung gestellt [16] - [20]., Familie [21], und sogar einzelne Sample-Ebene [22] die NDF sind für die Entwicklung und Umsetzung der Aquakultur Verordnung in Norwegen verantwortlich. Während Hemmung von Fisch aus kommerziellen Aquakulturanlagen nicht illegal in Norwegen ist, sind die Landwirte gesetzlich zu berichten Hemmung von ihren Höfen gebunden. Trotzdem stellt eine große Dunkelziffer von der NDF als Herausforderung. Als Antwort auf diese Situation haben genetische Methoden zur Identifizierung von Ausreißern zurück in ihre Ursprungsbetrieb eingerichtet worden und führte zu Strafen für einen Verstoß gegen Vorschriften gefunden Unternehmen [23], [24]. Im März 2012 , lokale Fischer in einem Fjord in Nord-Norwegen Betrieb berichtet Atlantic cod ( Gadus morhua Materialien und Methoden Methodischer Ansatz die vorliegende Studie wurde entworfen, um die drei Fragen in der Einleitung vorgestellt zu werden. Diagnostische Marker zur Identifizierung von stark degradierten Atlantischen Lachs und Regenbogenforelle ( Oncorhynchus mykiss Diese Studie in einem Fjord in Nordnorwegen basiert. Aus rechtlichen Gründen wird in dieser Studie die genauen Standorte der Kabeljau gefangen, und der lokalen Fischfarm, aus denen Proben entnommen wurden, bleiben anonym. Unter Aufsicht der NDF, von Kabeljau Mägen von den lokalen Fischern (1-3 Beute pro Kabeljau Magen, alle Kabeljau gefangen in der Zeit von März bis April 2012) Stichprobe insgesamt 36 Opfer wurden. Diese Kabeljau wurden im Rahmen einer kommerziellen Ernte gefangen genommen und waren tot auf dem Bauch abgetastet werden. So wurden keine speziellen Genehmigungen erforderlich, die Kabeljau Mägen in dieser Studie für die Probenahme. Sowohl Nordosten arktische Kabeljau (NEAC) und die norwegische Küstendorsch (NCC) sind dafür bekannt, zu diesem Zeitpunkt des Jahres in dieser Region die Grundlage dieser kommerziellen Fischerei zu bilden. keine Proben noch Daten wurden jedoch von diesen Kabeljau aufgezeichnet und als solcher ist es nicht möglich, diese Fische beider Typen auszuschließen. Alle Kabeljau wurden bei einer von sechs Standorten in unmittelbarer Nähe des einzigen Fisch gefangen Bauernhof in der Region Lachs überlappend in der Größe mit der Beute enthält, oder bis zu einem Maximum von 20 km weiter in den Fjord. Neben der Beute 36 in Dorsch Mägen gefangen, ein einzelner Lachs Post smolt, im Überwachungsnetz sofort in dieser Region neben dem einzigen Lachsfarm gefangen, wurde als Probe entnommen (das einzelne Fisch wird im Folgenden als "Ausreißer" und war ähnlich wie die Beute in der Größe). Aus allen diesen Proben zwei Gewebeproben pro Einzel wurden für eine spätere genetische Analyse entnommen. Die Proben von Lachs aus dem nur Farm in diesem Fjord, die Fische überlappend in der Größe mit der Beute enthalten waren auch gesammelt. Diese Fische wurden von Personen an der NDF beschäftigt abgetastet. Keine besonderen Genehmigungen erforderlich waren diese Fische zu probieren, obwohl der Fischzüchter Zugang zu ihren Hof gab. Die nächste Alternative Bauernhof Aufzucht von Fischen überlappend in der Größe mit der Beute wurde über 100 km entfernt liegt (120 km für den entferntesten Aufnahmen des Kabeljau) und nicht als wahrscheinliche Quelle gesehen und deshalb nicht abgetastet. Von der lokalen Farm, insgesamt drei Proben, die jeweils aus etwa 47 Fische wurden aus drei getrennten Käfigen genommen. Dies stellte die drei genetischen Gruppen von Fischen auf dem Bauernhof, und ist mit dem Probenahmeprotokoll konsistent eine genetische Basis für Identifizierung von Ausreißern zurück in ihre Ursprungsbetrieb für den Aufbau [23], [24]. Eine Probe von wilden Atlantischen Lachs mit Ursprung vom nächsten Fluss und in unmittelbarer Nähe, wo der Kabeljau mit Beute in ihren Mägen wurden gefangen genommen wurde auch in die Studie einbezogen. Diese Wildlachs Probe gefangen von 101 Erwachsenen bestand durch in den Jahreszeiten des Jahres 2007 im Fluss angeln und 2008. Da diese Fische gefangen genommen wurden und in der Folge für den Verzehr durch Sportfischer getötet, keine Genehmigungen für die Aufnahme Skala Proben aus diesen toten Fische waren nicht erforderlich. Krankheitsstatus auf dem Bauernhof Herz- und Skelettmuskelentzündung (HSMI) ist eine Infektionskrankheit [30] durch umfangreiche Entzündung und multifokale Nekrose von Myozyten in Herz und rote Muskulatur charakterisiert [31]. Ein neuartiges Virus, piscine Reovirus (PRV) hat vor kurzem in Fisch mit HSMI nachgewiesen worden. Dieses Virus ist mit der Krankheit verbunden sind, zeigt erhöhte Viruslast in erkrankten Fische und ist potentiell für die Krankheit verantwortlich [32], [33]. Allerdings sind PRV-Infektionen in Zuchtlachs in Norwegen üblich, und hat auch bei gesunden Fischen, einschließlich Wildlachs [34] dokumentiert. Daher bleibt die Rolle von PRV in HMSI diskutiert [34]. In der Zeit von Januar bis Februar 2012 (das heißt, ein paar Wochen vor der Entdeckung von lachsartigen Beute in den Mägen von wilden Kabeljau) der lokalen Farm, berichtet Verluste von etwa 55000 Fische (Daten aus NDF Farm Biomasse-Register). Das verursachende Krankheit wurde in der Folge als HMSI im Februar 2012 wurde auf der Basis klinischer Analysen von Fisch aus dem Hof von einem lokalen Tierarzt, diese Diagnose diagnostiziert und wurde anschließend von der norwegischen Veterinärinstitut mit Histopathologie (daher das Vorhandensein oder Fehlen von PRV bestätigt in diesen kranken Fische ist nicht bekannt). Durch die Hintergrundinformationen in Bezug auf die Krankheitsstatus auf dem Bauernhof, Proben aus der Beute in Kabeljau Mägen gefangen, und der einzige Ausreißer, wurden auf das Vorhandensein von PRV analysiert. Dies war auf der Grundlage, dass PRV in der Beute sein könnte und der Ausbrecher, wenn sie aus dem Hof entstanden, wo HMSI Sterblichkeit verursacht hatte. PRV ist auch in wilden norwegischen Lachs (auch in Fisch HMSI nicht angezeigt), wenn auch mit einer niedrigeren Frequenz als in bewirtschafteten entkam Lachs (13,4% vs. 55,2% Prävalenz bzw.) [34]. Während dieses Virus typischerweise in Herz oder Kopf-Nierenproben identifiziert wird, aufgrund der herabgesetzten Zustand der Beute wurden nur Muskelproben für diesen Test zur Verfügung. Die Analysen wurden durch eine Echtzeit-PCR-Analyse-Unternehmen durchgeführt, patogen Analyse AS, akkreditiert nach der internationalen Norm ISO 17025. Die Proben wurden für PRV-RNA bei patogen in Übereinstimmung mit ihren in-house Methoden für Real Time PCR unter Verwendung eines Assays analysiert ( "PRV -ST '), um das Gen-Targeting L3, sequenziert vorher [32]. Die Sequenzen der Vorwärts- und Rückwärtsprimer für diesen Test sind 5'-TCAACCACCTCCACACAAAAGA-3 'und 5'-AACGAGTTGTGCGTGTGCC-3' bzw., und die Sonde VIC-5'-TTGGGATGTCGACGTTCT-3 '. Die Standardkurve basierend auf das Zehnfache Verdünnungen in dreifacher Ausfertigung eine Steigung von -3,25 (R 2 = 0,998) hatte und die Effizienz (E = [10 1 /(- Steigung)] - 1) war 1,030. Der Cut-off C T-Wert betrug 37,0. Die PRV-ST-Analyse wurde nicht zum Zeitpunkt der Analyse akkreditiert und diese Arbeit ist das erste Mal diese Marker, produziert von patogen AS, wurden veröffentlicht. DNA-Extraktion war in 96-Well-Format mit einem im Handel erhältlichen Kits (; Tissue Kit Qiagen DNeasy®96 Blood &) mit durchgeführt. Jede 96-Well-Platte enthalten zwei leere Brunnen als negative Kontrollen. Routine Genotypisierung Kontrolle spielt eine Standardrolle in Genotypisierung im Labor bei IMR [35], [36]. Somit ist jede der einzelnen Beute und dem escapee wurden zweimal isoliert Genotypisierung Konsistenz zu steuern. DNA-Menge und Qualität wurde nicht gemessen. Alle Proben mit einem Satz von 18 Mikrosatelliten-Genotypisierung unterworfen waren, die für Atlantischen Lachs Genetik Projekte im Labor eingesetzt werden. Diese Loci wurden in drei Multiplexe verstärkt, unter Verwendung von Standardprotokollen für frisches Gewebe (full Genotypisierung Bedingungen erhältlich von Autoren auf Anfrage); SSsp3016 Nachdem wurde ein DNA-Profil für die einzelnen Beute, die einzelne Ausreißer, der lokalen Farm und Wildlachs aus einem erfolgreich etabliert Bevölkerung in der Region, mehrere statistische Tests implementiert üblicherweise in Studien genetics Population, wurden an diesen Daten durchgeführt. Dies war in erster Linie um drei Fragen in der Einführung ergeben, zu bewältigen. Für diese Tests wurde die einzige Ausreißer mit den Beutefische auf Pilotanalyse gepoolt dokumentieren sie auf die Beute (siehe Ergebnisse) genetisch sehr ähnlich zu sein. Damit für diese Analysen auch die Beute Probe die einzige Ausreißer enthalten. Als erstes wurden die Daten in einer Populationsgenetik Programm angeordnet (MSA) [45], die verwendet wurde, eine Reihe von Auswertungsstatistiken zu berechnen, und Input-Dateien für andere Programme. Danach wurde der Daten in Genepop V3.3 analysiert [46] Gen Verschiedenartigkeiten, Hardy Weinberg-Gleichgewicht, und Kopplungsungleichgewichts zwischen Paaren von Loci innerhalb Proben zu berechnen. Die Fishers Exact Test (demorization 10 000; 100 Chargen; 5000 Iterationen) wurde die statistische Signifikanz zu testen umgesetzt. Das Programm LDNE [47], wie verwendet, um die effektive Populationsgröße ( Ne Die genetische Identifizierung der Opfer wurde durch zwei verschiedene, aber kostenlose methodische Ansätze durchgeführt. Zunächst genetische Zuordnung mit Hilfe der Rannala & Bergberechnungsverfahren [48], wie im Programm implementiert GeneClass2 [49] durchgeführt wurde. Dabei werden die Proben aus den Betrieben und der wild lebenden Fischen wurden als die vorgegebene potentielle Quellen der Beute (das heißt die genetische Ausgangswert) verwendet. Danach wurde direkte genetische Zuordnung durchgeführt. Dieses Verfahren stellt jeder unbekannten Fisch (d.h. die einzelnen Beutefische) in die Ausgangsprobe, dass es am meisten ähnelt. Eine Begrenzung mit direkte Zuordnung ist, dass es eine potentielle Quelle Population zu jedem der unbekannten Proben unabhängig auf den absoluten Ähnlichkeitsgrad zuweist. Dies kann in "geschlossene Systeme", in der alle möglichen Quellen der unbekannten Proben sind dargestellt, jedoch in Situationen wie der vorliegenden akzeptabel, wenn nicht alle möglichen Quellen in der Basislinie enthalten sind, ist es wichtig, eine Abschätzung des Grades erhalten von Ähnlichkeit zwischen der unbekannten Probe (n) und jeder Basisprobe. Dies wird durch Ausschluss erreicht, und jede einzelne ist an jedem Basisprobe verglichen wird und eine Wahrscheinlichkeit der Zugehörigkeit (oder richtiger, Wahrscheinlichkeit nicht gehören) berechnet. In der besonderen Situation hier, Ablehnung von allen Basisproben würde vorschlagen, dass die Beute aus einer Quelle stammt nicht abgetastet. Der zweite Ansatz, um die Beute zu identifizieren war Beimischung zu berechnen (auch als Bayes-Clusteranalyse bezeichnet) unter Verwendung von die Programmstruktur 2.2 [50], [51]. Einzelne Beimischung erlaubt die Identifizierung und Zuordnung der einzelnen Fische zu genetischen Cluster (das heißt, Populationen oder genetischen Gruppen) ohne "vor" in Bezug auf die Bevölkerung oder Standort, von dem jede einzelne Probe stammt. Dies ermöglicht beispielsweise die Identifizierung von Individuen, die aus gemischten genetischen Ursprungs sind, und die Identifizierung von Individuen, wenn sie in Proben überwiegend von anderen genetischen Gruppen gemischt. Das Programm wurde mit einer Beimischung Modell mit korrelierten Allelfrequenzen und ohne vorherige laufen. Läufe bestand aus einem Burn-in von 250 000 MCMC Schritten von 250 000 Schritten gefolgt. Das Programm ausgeführt wurde mit allen Proben Detail enthalten, mit der Zahl der Bevölkerung festgelegt zwischen k
L.) in marinen Netzgehegen ist Haltung. In Norwegen, wo Statistiken über die Zahl der gemeldeten Ausreißer von der norwegischen Fischereidirektion aufgezeichnet werden (NDF), die jährliche Zahl der Ausreißer hat für die meisten Jahre in die Hunderttausende gewesen in der Zeit von 2000 bis 2011 [1]. Allerdings hat die wahre Zahl der jährlichen Ausreißer in die Millionen aufgrund Dunkelziffer zu sein geschätzt worden [2]. Bewirtschaftete Ausreißer können lange Strecken verteilen über [3], [4], kann geben Flüsse [5], und eine Reihe von ökologischen darstellen kann [6] und der genetischen Wechselwirkungen [7] - [12] mit wilden Artgenossen. Somit ist es allgemein anerkannt, dass der Zucht Ausreißer eine potenzielle Bedrohung für die Integrität der einheimischen Bevölkerung darstellen.
L.) zu kontrollieren, die eine wichtige kommerzielle Fischerei in dieser Region bildet, mit ungewöhnlichen Beutefische in ihren Mägen. Die meisten dieser Beute, die etwa 30-35 cm lang waren, wurden teilweise oder stark verschlechtert, und als solches war es eine Herausforderung, alle von ihnen morphologisch zu identifizieren (Fig. 1). Trotzdem sie nicht aussehen wie Hering ( Clupea harengus
L.) oder kleiner gadoid Arten, die einen wichtigen Teil der in dieser Region Ernährung Kabeljau bilden [25], [26], und es wurde von mehreren spekuliert Fischer, die diese könnten Atlantischen Lachs sein. Während Dorsch bekannt wurden Atlantischen Lachs smolts bei der Migration von Süßwasser in Mündungs- und Meeresumwelt [27], [28], innerhalb weniger Wochen nach Eingabe der Meeresumwelt in den späten Frühling und Frühsommer zu sich zu nehmen, smolts haben Fjord typischerweise links Flächen und in Richtung ozeanischen Nahrungsgründe wandern. Als solche Kabeljau Wildlachs der beobachteten Größe und Zeit des Jahres an diesem Ort wurde die Einnahme von den einheimischen Fischern ungewöhnlich betrachtet, und die Situation berichtet daher auf die NDF als mutmaßlicher Interaktion zwischen einem lokalen Lachsfarm und diese kommerzielle Fischerei. Hier haben wir die Analyse der Beute, damit wir die folgenden Fragen zu beantworten: 1. Welche Art diese Beute sind, 2. Wenn sie Lachs sind, ist es möglich, sie so wild zu identifizieren oder gezüchtet (dh, dies ist eine seltene Natur Phänomene oder ist es eine vom Menschen verursachte) und 3. Wenn sie gezüchtetem Atlantischen Lachs sind, werden sie von einem Bauernhof stammte?
) Gewebe wurden kürzlich entwickelt [29]. Allerdings war der erste Versuch, Identifizierung der Opfer mit hochpolymorphen Mikrosatelliten-Marker durchgeführt häufig in Atlantischen Lachs Populationsgenetik Projekte umgesetzt. Die Begründung hierfür war zweifach. Erstens, um die Fragen 2 und 3, ein Allel-Frequenzprofil zu beantworten würde für jeden der Beute werden, um benötigte gegen die Allelfrequenz Profile von Zucht- und Wildlachs in der Region zu entsprechen. Zweitens wird eine Kombination aus vergangenen Erfahrungen mit diesen Mikrosatellitenmarker auf teilweise abgebauten Proben zusammen mit Inspektion der Beute vorgeschlagen, dass, wenn sie in der Tat Atlantic salmon waren, es möglich sein kann erfolgreich mit diesen Mikrosatelliten, die Proben zu genotypisieren.
Die Proben
Die molekulargenetische Analysen
(Genbank Nr. AY372820), SSsp2210
, SSspG7
, SSsp2201
, SSsp1605
, SSsp2216
[37], Ssa197
, Ssa171
, Ssa202
[38], SsaD157
, SsaD486
, SsaD144
[39], Ssa289
, Ssa14
[40], SsaF43
[41], SsaOsl85
[42 ], MHC I
[43] und MHC II
[44]. PCR-Produkte wurden auf einem ABI 3730 Genetic Analyser analysiert und Größe durch eine 500LIZ ™ size-Standard. Die Rohdaten wurden manuell zweimal vor dem Export für die statistische Analyse kontrolliert. Keine Genotypisierung Inkonsistenzen wurden unter diesen Wieder analysierten Proben beobachtet.
Die statistische Analyse
) für jede der Proben zu berechnen. Dieses Programm verwendet einen Ein-Probe Ansatz zur Abschätzung Ne
nach dem Grad der LD in einer Probe beobachtet basiert.
= 1-8 mit 3 Läufen pro k
. Die Wahrscheinlichkeit der Daten wurde aufgetragen, und die am besten geeignete k
wurde an dem Punkt bestimmt, wo die Steigung ein Plateau erreicht [50].
Ergebnisse
 7 Anzeichen dafür, dass Ihr IBS SIBO sein könnte
7 Anzeichen dafür, dass Ihr IBS SIBO sein könnte
 Die 5 häufigsten Verdauungskrankheiten und wie sie behandelt werden
Die 5 häufigsten Verdauungskrankheiten und wie sie behandelt werden
 Ernährung und chronische Verstopfung:Was Sie wissen müssen
Ernährung und chronische Verstopfung:Was Sie wissen müssen
 Motilitätsstörungen und Motilitätsstörungen
Motilitätsstörungen und Motilitätsstörungen
 Dekadente Beeren-Apfel-Schweinekoteletts zum Sterben (keine Reste für diese Mahlzeit)
Dekadente Beeren-Apfel-Schweinekoteletts zum Sterben (keine Reste für diese Mahlzeit)
 Was Sie essen sollten, wenn Sie GERD haben
Was Sie essen sollten, wenn Sie GERD haben
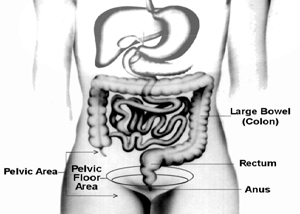 Dyssynergischer Stuhlgang:Über eine häufige Ursache chronischer Verstopfung
Einführung Es gibt keine einheitliche Definition von Verstopfung. Eine Person kann ein oder mehrere Probleme haben, wie z. B. seltener Stuhlgang, harter und schwer zu passierender Stuhl, unvollständi
Dyssynergischer Stuhlgang:Über eine häufige Ursache chronischer Verstopfung
Einführung Es gibt keine einheitliche Definition von Verstopfung. Eine Person kann ein oder mehrere Probleme haben, wie z. B. seltener Stuhlgang, harter und schwer zu passierender Stuhl, unvollständi
 Alles, was Sie über SIBO (bakterielle Überwucherung des Dünndarms) wissen müssen
Da die Real-Food-Bewegung weiter wächst, konzentrieren sich immer mehr Menschen auf die Gesundheit ihres Darms, indem sie fermentierte Lebensmittel essen und Probiotika einnehmen. Laut einem Global
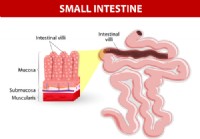
Alles, was Sie über SIBO (bakterielle Überwucherung des Dünndarms) wissen müssen
Da die Real-Food-Bewegung weiter wächst, konzentrieren sich immer mehr Menschen auf die Gesundheit ihres Darms, indem sie fermentierte Lebensmittel essen und Probiotika einnehmen. Laut einem Global
 Was ist eine Hiatushernie?
Haben Sie es mit ständigem Sodbrennen zu tun? Ist Sodbrennen alltäglich? Fühlen Sie sich nach dem Essen schnell satt? Wenn ja, könnten dies alles Anzeichen einer Erkrankung sein, die als Hiatushernie
Was ist eine Hiatushernie?
Haben Sie es mit ständigem Sodbrennen zu tun? Ist Sodbrennen alltäglich? Fühlen Sie sich nach dem Essen schnell satt? Wenn ja, könnten dies alles Anzeichen einer Erkrankung sein, die als Hiatushernie