Ahora, investigadores del Instituto Wyss de la Universidad de Harvard, Escuela de Medicina de Harvard (HMS), y Brigham and Women's Hospital han diseñado con éxito un sistema de transmisión de señales genéticas en el que una señal molecular enviada por la bacteria Salmonella Typhimurium en respuesta a una señal ambiental puede ser recibida y registrada por E. coli en las entrañas de un ratón, acercando a los científicos un paso más al desarrollo de un "microbioma sintético" compuesto de bacterias que están programadas para realizar funciones específicas. El estudio se informa en Biología sintética ACS .
"Para mejorar la salud humana a través de bacterias intestinales modificadas, tenemos que empezar a descubrir cómo hacer que las bacterias se comuniquen, "dijo Suhyun Kim, estudiante de posgrado en el laboratorio de Pamela Silver en el Instituto Wyss y HMS, quien es el primer autor del artículo. "Queremos asegurarnos de que, a medida que se desarrollan los probióticos de ingeniería, tenemos un medio para coordinarlos y controlarlos en armonía ".
El equipo aprovechó una habilidad que ocurre naturalmente en algunas cepas de bacterias llamada "detección de quórum, "en el que las bacterias envían y reciben moléculas de señal que indican la densidad general de la colonia bacteriana y regulan la expresión de muchos genes involucrados en las actividades del grupo. Un tipo particular de detección de quórum conocido como detección de acil-homoserina lactona (acil-HSL) ha aún no se ha observado en el intestino de los mamíferos, por lo que el equipo decidió ver si podían reutilizar su sistema de señalización para crear un sistema de transferencia de información bacteriana utilizando ingeniería genética.
Los investigadores introdujeron dos nuevos circuitos genéticos en diferentes colonias de una cepa de E. coli bacterias:un circuito "señalizador", y un circuito de "respuesta". El circuito de señalización contiene una única copia de un gen llamado luxI que es activado por la molécula de anhidrotetraciclina (ATC) y produce una molécula de señalización con detección de quórum. El circuito de respuesta está estructurado de tal manera que cuando la molécula de señalización se une a él, un gen llamado cro se activa para producir la proteína Cro, que luego enciende un "elemento de memoria" dentro del circuito de respuesta. El elemento de memoria expresa dos genes adicionales:LacZ y otra copia de cro. La expresión de LacZ hace que la bacteria se vuelva azul si se coloca en un agar especial, produciendo así una confirmación visual de que se ha recibido la molécula señal. La copia adicional de cro forma un bucle de retroalimentación positiva que mantiene activado el elemento de memoria, asegurándose de que la bacteria continúe expresando LacZ durante un período prolongado de tiempo.
Los investigadores confirmaron que este sistema funciona in vitro tanto en E. coli y S. Typhimurium bacterias observando que las bacterias que respondieron se volvieron azules cuando se añadió ATC a las bacterias señalizadoras. Para ver si funcionaría in vivo, administraron tanto al comunicador como al respondedor E. coli bacterias a ratones, y luego les dio a los ratones ATC en su agua potable durante dos días. Cuando se analizaron las muestras fecales de los ratones, más de la mitad de los ratones mostraron signos claros de transmisión de señales de 3OC6HSL que persistieron después de dos días con ATC.
"Fue emocionante y prometedor que nuestro sistema, con circuitos basados en una sola copia, puede crear una comunicación funcional en el intestino del ratón, "explicó Kim." La ingeniería genética tradicional introduce múltiples copias de un gen de interés en el genoma bacteriano a través de plásmidos, lo que coloca una alta carga metabólica sobre las bacterias modificadas y hace que otras bacterias del huésped las superen fácilmente ".
Finalmente, el equipo repitió el experimento in vivo, pero le dio la señal a los ratones S. Typhimurium bacterias y E. coli bacterias que responden, para ver si la señal podría transmitirse a través de diferentes especies de bacterias dentro del intestino del ratón. Todos los ratones mostraron signos de transmisión de señales, confirmando que los circuitos diseñados permitían la comunicación entre diferentes especies de bacterias en el complejo entorno del intestino de los mamíferos.
Los investigadores esperan continuar esta línea de investigación mediante la ingeniería de más especies de bacterias para que puedan comunicarse, y buscando y desarrollando otras moléculas de señalización que puedan usarse para transmitir información entre ellas.
"Por último, nuestro objetivo es crear un microbioma sintético con especies de bacterias completamente o en su mayoría modificadas en nuestro intestino, cada uno de los cuales tiene una función especializada (por ejemplo, detectar y curar enfermedades, creando moléculas beneficiosas, mejorando la digestión, etc.) pero también se comunica con los demás para asegurarse de que todos estén equilibrados para una salud humana óptima, "dijo el autor correspondiente Silver, Doctor., miembro fundador de la facultad principal del Wyss Institute, que también es profesor Elliot T. y Onie H. Adams de bioquímica y biología de sistemas en HMS.
"El microbioma es la próxima frontera en la medicina y el bienestar. Diseñar nuevas tecnologías para mejorar los microbios intestinales mientras se aprecia que funcionan como parte de una comunidad compleja, como se hizo aquí, representa un gran paso adelante en esta dirección, "dijo el director fundador de Wyss, Donald Ingber, MARYLAND., Doctor., quien también es el Profesor Judah Folkman de Biología Vascular en HMS y el Programa de Biología Vascular en el Boston Children's Hospital, así como Profesor de Bioingeniería en SEAS.
 Hemorroidectomía con grapas
Hemorroidectomía con grapas
 La verdad tóxica sobre los alimentos sin gluten y la enfermedad celíaca
La verdad tóxica sobre los alimentos sin gluten y la enfermedad celíaca
 receta fácil de escalope de ternera
receta fácil de escalope de ternera
 Las infecciones intestinales que pueden causar la enfermedad de Hashimoto
Las infecciones intestinales que pueden causar la enfermedad de Hashimoto
 ¡No necesita una limpieza de colon, una limpieza intestinal o una limpieza intestinal!
¡No necesita una limpieza de colon, una limpieza intestinal o una limpieza intestinal!
 Radiodiagnóstico de una úlcera perforada - Diagnóstico de abdomen agudo
Radiodiagnóstico de una úlcera perforada - Diagnóstico de abdomen agudo
 El microbioma del pene es un reservorio de bacterias asociadas a la vaginosis bacteriana
Entre las infecciones de transmisión sexual (ITS), La vaginosis bacteriana afecta a más del 20 por ciento de las mujeres en todo el mundo. La afección se debe a la proliferación de ciertas bacterias e
El microbioma del pene es un reservorio de bacterias asociadas a la vaginosis bacteriana
Entre las infecciones de transmisión sexual (ITS), La vaginosis bacteriana afecta a más del 20 por ciento de las mujeres en todo el mundo. La afección se debe a la proliferación de ciertas bacterias e
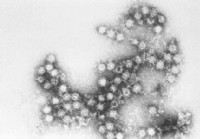 Virus Coxsackie
Datos sobre el virus Coxsackie Imagen del virus coxsackie; FUENTE:CDC Los virus Coxsackie son virus ARN que pueden causar la enfermedad de manos, pies y boca (HFMD, por sus siglas en inglés), así com
Virus Coxsackie
Datos sobre el virus Coxsackie Imagen del virus coxsackie; FUENTE:CDC Los virus Coxsackie son virus ARN que pueden causar la enfermedad de manos, pies y boca (HFMD, por sus siglas en inglés), así com
 Estudio ve mejorar las probabilidades de supervivencia para el cáncer de ovario
Últimas noticias sobre el cáncer No es necesario ser fumador para tener cáncer de pulmón El progreso en el cáncer de pulmón impulsa el declive general Fármaco de base inmunitaria combate el cáncer de
Estudio ve mejorar las probabilidades de supervivencia para el cáncer de ovario
Últimas noticias sobre el cáncer No es necesario ser fumador para tener cáncer de pulmón El progreso en el cáncer de pulmón impulsa el declive general Fármaco de base inmunitaria combate el cáncer de