Makrofagit ovat immuunipuolustussoluja, osa synnynnäistä immuunijärjestelmää, joka tarkkailee infektioita. Kuitenkin, niiden vaste kaikenlaisille patogeeneille voi laukaista myös kroonisen tai liiallisen tulehduksen. Tällainen epänormaali makrofagien aktivaatio näkyy nivelreumassa (RA) ja muissa autoimmuunisairauksissa. Yksi RA -hoidon tavoite on modifioida makrofagien aktivointitiloja ja vähentää makrofagien tunkeutumista tulehtuneeseen kudokseen.
Keuhkoissa, liian, infektio voi aiheuttaa makrofagien aiheuttamaa tulehdusta, mikä johtaa keuhkokudoksen tuhoutumiseen. Se voi myös laukaista sytokiinimyrskyn, todettu akuutissa hengitysvaikeusoireyhtymässä (ARDS). Makrofagien aktivointi riippuu reseptoreista, jotka puolestaan reagoivat erilaisiin ulkoisiin signaaleihin. Suurin osa näistä on mikrobien läsnä olevien sytokiinien ja antigeenien välittämiä.
Yksi tunnetuimmista ja tärkeimmistä makrofagiaktivaattorimolekyyleistä on interferoni-y (IFN-γ). IFN-y-altistuksella alustetut makrofagit reagoivat voimakkaammin myöhempään stimulaatioon. Toinen samanlainen aktivaattoriluokka sisältää TLR-agonisteja, jotka alkavat makrofageja siten, että ne erittävät molekyylejä, jotka muodostavat tulehduksellisen kehon, jota kutsutaan tulehdukselliseksi. Tulehduksellisten komponenttien aktivointi saa solun kuolemaan pyroptoosin seurauksena yhdessä interleukiini -1β:n (IL -1β) vapautumisen kanssa.
Tutkijoiden sanoin, " Tärkeä komponentti makrofagivasteessa primaariseen signaaliin on sekundaarisen superaktivaattorireseptorin ylössäätely, joka voi sitten muuttaa nämä esitäytetyt makrofagit räjähteeksi, mahdollisesti patogeeninen tulehdustila . ”
Tutkijat tutkivat useita tulehduksellisia tiloja, kuten RA, Crohnin tauti ja vaikea COVID-19, uuden toissijaisen superaktivoivan makrofagireseptorin SLAMF7 löytäminen. Tämä, he sanovat, on avain näiden sairauksien patogeneesiin.
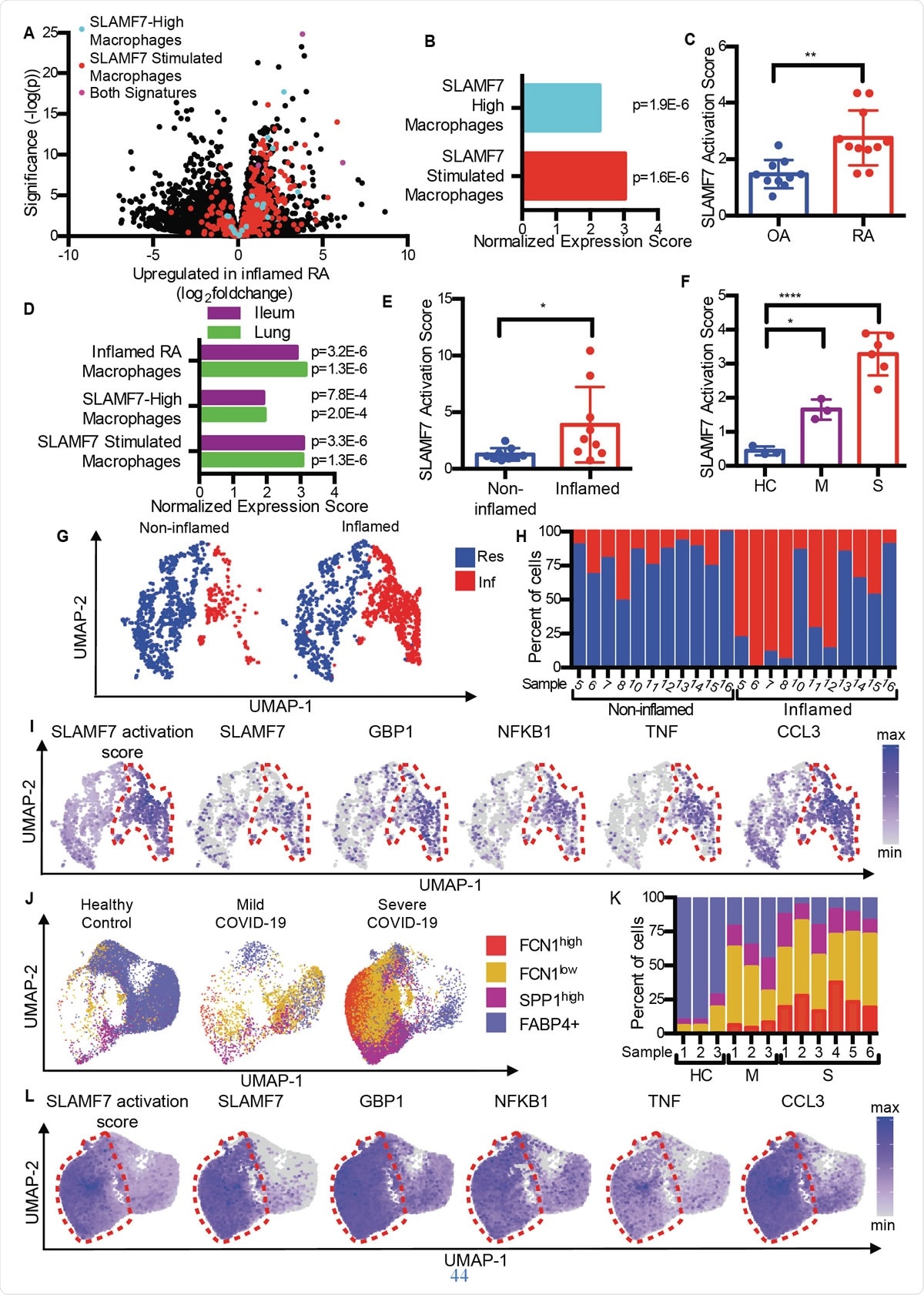 SLAMF7-superaktivoidut makrofagit ajavat tulehdusta autoimmuuni- ja tartuntatauteissa. A) Tulivuoren kuvaaja 1A korostaa geenejä "SLAMF7-High Macrophage Signature, "" Macrophage SLAMF7 -stimulaation allekirjoitus, "Ja geenit sisältyvät molempiin allekirjoituksiin. B) Geenijoukon rikastamisanalyysi, jossa verrataan RA:n ja OA:n erilaista geeniekspressiota "SLAMF7-High Macrophage Signature" ja "Macrophage SLAMF7 Stimulation Signature". C) SLAMF7-aktivaatiopistemäärä RNA-seq-massatiedoille nivelkalvon makrofageista potilailta, joilla on OA (n =10) tai RA (n =11). Tiedot edustavat keskiarvoa ± SD. D) Geenijoukkojen rikastamisanalyysi, jossa verrataan geenien ilmentymistä tulehtuneista ilealikudoksista peräisin olevista makrofageista Crohnin tautia sairastavilla potilailla tai COVID-19-potilaiden keuhkoilla, joilla on ”Inflamed RA Macrophage Signature”, "SLAMF7-High Macrophage Signature" ja "Macrophage SLAMF7 Stimulation Signature". E) SLAMF7 -aktivaatiopistemäärä makrofageille tulehtumattomilta (n =9) ja tulehtuneilta ilealikudoksilta (n =9). F) SLAMF7 -aktivointipiste bronchoalveolaarisen huuhtelun makrofageille terveistä verrokeista (n =3), tai henkilöillä, joilla on lievä (n =3) tai vaikea COVID-19 (n =6). E-F:n tiedot edustavat keskiarvoa ± SD. G) UMAP -käyrä makrofagiklustereista mukana olevista ja osallistumattomista ilealikudoksista. H) Prosenttiosuus makrofageista kustakin luovuttajasta kullekin klusterille. I) UMAP -käyrät, jotka osoittavat ileaalisten makrofagipopulaatioiden geeniekspressiota. J) UMAP -käyrä bronkoalveolaarisen huuhtelun makrofagipopulaatioista. K) Jokaisen luovuttajan makrofagien prosenttiosuus kullekin populaatiolle. L) UMAP -käyrät, jotka osoittavat geeniekspression bronchoalveolaarisen huuhtelun makrofagipopulaatioille. Paritettua t-testiä käytettiin kaksisuuntaiseen tilastolliseen vertailuun, ja yksisuuntaista ANOVAa Dunnettin moninkertaisen vertailutestin avulla verrattiin lievää ja vaikeaa COVID-19-tautia terveisiin kontrolleihin.*, p <0,05; **, p <0,01; ****, p <0,0001; Res, Asuva makrofagiryhmä; Inf, Tulehduksellinen makrofagiryhmä; HC, terve hallinta; M, lievä COVID-19; S, vakava COVID-19.
SLAMF7-superaktivoidut makrofagit ajavat tulehdusta autoimmuuni- ja tartuntatauteissa. A) Tulivuoren kuvaaja 1A korostaa geenejä "SLAMF7-High Macrophage Signature, "" Macrophage SLAMF7 -stimulaation allekirjoitus, "Ja geenit sisältyvät molempiin allekirjoituksiin. B) Geenijoukon rikastamisanalyysi, jossa verrataan RA:n ja OA:n erilaista geeniekspressiota "SLAMF7-High Macrophage Signature" ja "Macrophage SLAMF7 Stimulation Signature". C) SLAMF7-aktivaatiopistemäärä RNA-seq-massatiedoille nivelkalvon makrofageista potilailta, joilla on OA (n =10) tai RA (n =11). Tiedot edustavat keskiarvoa ± SD. D) Geenijoukkojen rikastamisanalyysi, jossa verrataan geenien ilmentymistä tulehtuneista ilealikudoksista peräisin olevista makrofageista Crohnin tautia sairastavilla potilailla tai COVID-19-potilaiden keuhkoilla, joilla on ”Inflamed RA Macrophage Signature”, "SLAMF7-High Macrophage Signature" ja "Macrophage SLAMF7 Stimulation Signature". E) SLAMF7 -aktivaatiopistemäärä makrofageille tulehtumattomilta (n =9) ja tulehtuneilta ilealikudoksilta (n =9). F) SLAMF7 -aktivointipiste bronchoalveolaarisen huuhtelun makrofageille terveistä verrokeista (n =3), tai henkilöillä, joilla on lievä (n =3) tai vaikea COVID-19 (n =6). E-F:n tiedot edustavat keskiarvoa ± SD. G) UMAP -käyrä makrofagiklustereista mukana olevista ja osallistumattomista ilealikudoksista. H) Prosenttiosuus makrofageista kustakin luovuttajasta kullekin klusterille. I) UMAP -käyrät, jotka osoittavat ileaalisten makrofagipopulaatioiden geeniekspressiota. J) UMAP -käyrä bronkoalveolaarisen huuhtelun makrofagipopulaatioista. K) Jokaisen luovuttajan makrofagien prosenttiosuus kullekin populaatiolle. L) UMAP -käyrät, jotka osoittavat geeniekspression bronchoalveolaarisen huuhtelun makrofagipopulaatioille. Paritettua t-testiä käytettiin kaksisuuntaiseen tilastolliseen vertailuun, ja yksisuuntaista ANOVAa Dunnettin moninkertaisen vertailutestin avulla verrattiin lievää ja vaikeaa COVID-19-tautia terveisiin kontrolleihin.*, p <0,05; **, p <0,01; ****, p <0,0001; Res, Asuva makrofagiryhmä; Inf, Tulehduksellinen makrofagiryhmä; HC, terve hallinta; M, lievä COVID-19; S, vakava COVID-19. Vertaamalla nivelrikkoa (OA) nivelreumaan, tutkijat havaitsivat, että RA -kudos sisältää makrofageja, joilla on tulehdusmerkki, mukaan lukien interferonin indusoimien geenien sekä kehossa tulehduskemikaaleja koodaavien geenien ylössäätely. Geeni, jonka ekspressio kasvoi eniten näistä, oli SLAMF7.
Tämä todettiin alhaisina pitoisuuksina nivelkudoksessa nivelissä, jotka ovat tulehtuneet OA:sta, mutta korkealla tasolla RA -potilailla. Sitä esiintyi 55%:ssa makrofageista jälkimmäisessä, mutta <6% potilaista, joilla on OA. Sitä esiintyi kaksi kertaa korkeammilla tasoilla RA -ryhmän nivelnesteen makrofageissa verrattuna OA -ryhmään, ja noin puolella ja neljänneksellä kunkin ryhmän makrofageista, vastaavasti. Kuitenkin, tämä ei pitänyt paikkaansa toisessa SLAM -reseptorissa, osoittaa SLAMF7:n olevan spesifinen tulehduksellisille makrofageille RA:ssa.
IFN-y:n havaittiin olevan tämän reseptorin ensisijainen indusoija makrofageilla, yhdessä IFN-β:n kanssa IL-1β ja TNF-a alemmilla tasoilla. Kuitenkin, tulehdusta edistävä sytokiini IL-6 ei onnistunut indusoimaan SLAMF7:n ilmentymistä. Uudelleen, entiset sytokiinit alensivat toisen SLAM -reseptorin tasoja, CD84, puoleen.
Tutkijat vahvistivat myös, että JAK-reitillä oli tärkeä rooli SLAMF7-välitteisessä makrofagien aktivoinnissa. JAK -estäjä ruksolitinibi tukahdutti sen tehokkaasti. Itse asiassa, tätä lääkettä käytetään myelofibroosin hoitoon, missä, uudelleen, aktivoituja SLAMF7:ää ilmentäviä makrofageja löytyy. Se myös kaksinkertaistaa CD84 -tasot, mikä voi tarkoittaa, että IFN-y:llä on vastakkaisia ja vastavuoroisia vaikutuksia näihin kahteen SLAM-reseptoriin.
Seuraavassa vaiheessa SLAMF7 -ilmentyminen indusoitiin korkeilla tasoilla makrofageilla, IFN-γ:n avulla. Myöhemmin, aktivoiva monoklonaalinen vasta -aine tai yhdistelmä -SLAMF7 -proteiini lisättiin sitoutumaan reseptoreihin. Tutkijat havaitsivat, että tämä sitova tapahtuma aiheutti dramaattisia muutoksia geenien ilmentymisessä.
Lähes 600 geeniä - Macrophage SLAMF7 -stimulaation allekirjoitus - säädettiin ylöspäin, ja useiden tulehduksellisten sytokiinien ja kemokiinien määrä lisääntyi, jopa pelkästään IFN-γ:n aiheuttaman nousun jälkeen. Esimerkiksi, TNF-a- ja IL-6-tasot nousevat tällä hetkellä pikomolaarisista nanomolaaritasoiksi. Lisäksi, itse SLAMF7:n ilmentyminen lisääntyi edelleen, ehdottaa positiivista palautetta.
Makrofagien sitoutuminen SLAMF7:ään saa myös myelooisen tulehdussyklin liikkeelle, sen lisäksi, että tulehdus valmistellaan vastaamaan voimakkaasti mikrobien TLR:ää sitoviin antigeeneihin, tai sytokiineille, massiivisella IL-1β-vapautumisella. Toisaalta, kun makrofagien aktivoimiseksi käytettiin IFN-y + LPS:n (voimakas bakteerimolekyyli) yhdistelmää, SLAMF7:n sitoutumiselle ominaista sytokiiniprofiilia ei havaittu. Kuitenkin, oli osittainen samankaltaisuus sytokiinivasteen ja geeniekspressioprofiilin välillä, joka ilmeni, kun IFN-y:tä käytettiin ensimmäisen kerran, jota seuraa LPS -altistus.
Tutkijat sanoivat, " Tämä SLAMF7-aktivointiohjelma perustuu ja on erillinen vaihe makrofagien ensisijaisen stimulaation jälkeen IFN-y:n tai muiden M1-erilaistumis- ja aktivointitekijöiden jälkeen . ” Tämän aktivointiohjelman ominaispiirre-SLAMF7-sitoutumisen (SAM7) aiheuttama superaktivoitu makrofagien tulehdustila-on makrofagien ensimmäinen tehostuminen IFN-y:n, jolloin SLAMF7 on dramaattisesti ylössäädetty. Sitoutumistapahtumat tällä reseptorilla viimeistelevät nyt esitäytettyjen makrofagien aktivoitumisen makrofagien aktivoitumisen hyper-inflammatorisen tilan aikaansaamiseksi.
Tätä reittiä näyttää ylläpitävän ja vahvistavan edelleen autokriininen palautesilmukka, johon liittyy TNF-α, joka indusoituu nopeasti (kahden tunnin kuluessa) SLAMF7 -kytkennän jälkeen ja sitten kasvaa edelleen ajan myötä. Todisteita tästä ovat TNF-a-ekspression puolittuminen anti-TNF-vasta-aineella, tai vaimentamalla TNF -reseptoreita siRNA:lla.
He havaitsivat, että keskimääräinen SLAMF7 -aktivaatiopiste RA:ssa oli lähes kaksinkertainen verrattuna OA -potilaisiin, osoittaa, että tämä reseptori liittyy läheisesti tulehdukseen RA -potilailla.
Samoin, päällekkäisiä makrofagien aktivointigeeniprofiileja luotiin sekä tulehduksellisessa suolistosairaudessa (IBD) että COVID-19:ssä, verrattuna RA:han. Itse asiassa, bronkoalveolaarisen huuhtelunesteen solut ja tulehtuneen suolistokudoksen solut COVID-19:ssä ja IBD:ssä osoittivat samat makrofagien aktivointimerkit. He havaitsivat myös kaksinkertaisen SLAMF7 -aktivaatiopisteen tulehtuneessa suolistossa verrattuna normaaliin suolistokudokseen. Ja vakavassa COVID-19:ssä pisteet olivat kuusi kertaa korkeampi verrattuna lievään COVID-19-tautiin. Kaikki tämä viittaa makrofagien aktivaation SAM7 -ohjelman dominoivaan tulehdukselliseen tilaan, varsinkin kun SLAMF7 -reseptoria ei löydy normaalin kudoksen makrofageista.
Tutkia erilaisia makrofagien osajoukkoja, he havaitsivat, että tulehduksellisilla makrofageilla oli erittäin korkeat aktivoitumispisteet verrattuna kotimaisiin makrofageihin. Uudelleen, kolme erillistä makrofagien alaryhmää COVID-19-potilailla kasvoi silmiinpistävästi suhteessa, kaksi näistä ryhmistä osoittaa vakavan sairauden laajenemista. Mielenkiintoista, näillä oli korkeimmat aktivointitulokset, ja vakavasti sairaiden COVID-19-potilaiden makrofageilla oli erittäin korkea SLAMF7-ilmentymistaso, yhdessä monien muiden tulehduksellisten ja interferonilla indusoituvien merkkiaineiden ja reseptorien kanssa.
Lyhyesti, SAM7-tila voi olla tärkeä osa COVID-19-keuhkokuumeessa havaittua hyperinflammatorista vastetta, sekä RA:ssa, ja IBD. Kuitenkin, peräkkäinen tapa, jolla tällainen aktivointi saavutetaan, mahdollistaa myös useiden erilaisten terapeuttisten vastatoimenpiteiden käytön. Näitä ovat JAK -estäjät, kuten ruksolitinibi, TNF-a-estäjät, tai Elotuzumabin SLAMF7 -saarto. Viimeinen luokka on erityisen hyödyllinen siinä mielessä, että se voi sallia SAM7 -ohjelman estämisen valikoivasti samalla, kun se sallii makrofagien suorittaa normaalit olennaiset immuunitoimintonsa.
bioRxiv julkaisee alustavia tieteellisiä raportteja, joita ei ole vertaisarvioitu, ja siksi, ei pidä pitää ratkaisevana, ohjaa kliinistä käytäntöä/terveyteen liittyvää käyttäytymistä, tai käsitellään vakiintuneina tietoina.
 Rotavirusinfektio
Rotavirusinfektio
 Onko C. diff (Clostridium difficile) tarttuva?
Onko C. diff (Clostridium difficile) tarttuva?
 Mikrobiomien häviäminen antibioottien käytöstä vaikuttaa vasteeseen influenssarokotteeseen
Mikrobiomien häviäminen antibioottien käytöstä vaikuttaa vasteeseen influenssarokotteeseen
 Rakas äiti, 7 askelta rintasyövän riskin vähentämiseen
Rakas äiti, 7 askelta rintasyövän riskin vähentämiseen
 Kuinka valmistaa ravitsevaa naudanlihalientä suoliston parantamiseksi
Kuinka valmistaa ravitsevaa naudanlihalientä suoliston parantamiseksi
 Onko ei-keliakiaa aiheuttava gluteeniherkkyys todellinen?
Onko ei-keliakiaa aiheuttava gluteeniherkkyys todellinen?
 SIBOn joululahjaopas
Joululahjojen ostaminen henkilölle, jolla on ohutsuolen bakteerikasvua, ärtyvän suolen oireyhtymä tai jokin muu suolistosairaus, voi tuntua ylivoimaiselta. Olemme koonneet palautteen SIBO-potilailta i
SIBOn joululahjaopas
Joululahjojen ostaminen henkilölle, jolla on ohutsuolen bakteerikasvua, ärtyvän suolen oireyhtymä tai jokin muu suolistosairaus, voi tuntua ylivoimaiselta. Olemme koonneet palautteen SIBO-potilailta i
 Kodun syöpä (kohdun syöpä tai endometriumin syöpä)
Tietoja kohdun syövästä* Kohdunsyöpä on kohtukudoksen muodostavien solujen epänormaalia kasvua. *Kohdun syöpää koskevat tosiasiat lääketieteen kirjoittaja:Charles Patrick Davis, MD, PhD Kohtu on n
Kodun syöpä (kohdun syöpä tai endometriumin syöpä)
Tietoja kohdun syövästä* Kohdunsyöpä on kohtukudoksen muodostavien solujen epänormaalia kasvua. *Kohdun syöpää koskevat tosiasiat lääketieteen kirjoittaja:Charles Patrick Davis, MD, PhD Kohtu on n
 Paljon punaista lihaa saattaa liittyä miesten suolistohäiriöihin
Viimeisimmät Digestion-uutiset Kun munuaissiirto epäonnistuu, on parasta yrittää uudelleen Älä anna närästyksen pilata lomajuhlasi Maksansiirtojen kysyntä kasvaa jyrkästi Pieniannoksiset TT-skannauks
Paljon punaista lihaa saattaa liittyä miesten suolistohäiriöihin
Viimeisimmät Digestion-uutiset Kun munuaissiirto epäonnistuu, on parasta yrittää uudelleen Älä anna närästyksen pilata lomajuhlasi Maksansiirtojen kysyntä kasvaa jyrkästi Pieniannoksiset TT-skannauks