tiivistelmä
kitinaaseja hydrolysoimaan β-1-4-glykosidisidoksin kitiini, joka on suuria rakenteellisia osa sieniä, äyriäisiä ja hyönteisiä. Vaikka nisäkkäät eivät tuota kitiini tai syntaasi, he ilmaisevat kaksi aktiivista kitinaaseja, chitotriosidase (Chit1) ja happamien nisäkkäiden kitinaasiaktiivisuuden (AMCase). Nämä nisäkkäiden kitinaaseja ovat herättäneet runsaasti huomiota johtuen niiden lisääntyneen ilmentymisen potilailla, joilla on useita patologisia tiloja, mukaan lukien Gaucherin tauti, Alzheimerin tauti ja astma. Kuitenkin osuus näiden entsyymien patofysiologiaan näiden sairauksien vielä määrittämättä. Kun määritellään, kuinka Chit1 ja AMCase mRNA-tasoja ja vertailu näiden tasojen kanssa tasot tunnettu viittaus geenit voivat tuottaa hyödyllisiä ja biolääketieteellisesti olennaiset tiedot. Alussa, loimme kvantitatiivinen reaaliaikainen PCR-järjestelmä, joka käyttää standardia DNA tuottaa ligoimalla cDNA-fragmentit kohdegeenien. Tämän järjestelmän avulla voimme määrittää ja vertailla ilmentymistasojen kitinaaseja ja viittaus geenit samassa mittakaavassa. Olemme havainneet, että AMCase mRNA: ta syntetisoitiin erittäin korkealla tasolla hiiren vatsassa. Taso tämän mRNA: n hiiren vatsa oli 7- 10-kertaa korkeampi kuin tasot housekeeping geenien ja oli verrattavissa tasoon mRNA pepsinogeeni C (progastricsin), merkittävä osa mahalaukun limakalvon. Siten AMCase mRNA on suuri kopio hiiren vatsassa, mikä viittaa siihen, että AMCase toimii ruoansulatus entsyymi, joka hajottaa polymeeriset Kitiini ja osana isännän puolustuksen vastaan kitiini-taudinaiheuttajia sisältäviä mahalaukun sisällön. Menetelmämme on sovellettavissa kvantifiointia mRNA: iden useiden geenien useiden yksilöiden samalla asteikolla.
Citation: Ohno M, Tsuda K, Sakaguchi M, Sugahara Y, Oyama F (2012) kitinaasiaktiivisuuden-mRNA-tasojen Quantitative PCR käyttäminen Standard DNA: Hapan Nisäkkäiden kitinaasiaktiivisuuden on merkittävä Transcript hiiri Vatsa. PLoS One 7 (11): e50381. doi: 10,1371 /journal.pone.0050381
Editor: Dominik Hartl, Tübingenin yliopistossa, Saksa
vastaanotettu: 06 elokuu 2012; Hyväksytty: 19 lokakuu 2012; Julkaistu: 21 marraskuu 2012
Copyright: © 2012 Ohno et ai. Tämä on avoin pääsy artikkeli jaettu ehdoilla Creative Commons Nimeä lisenssi, joka sallii rajoittamattoman käytön, jakelun ja lisääntymiselle millä tahansa välineellä edellyttäen, että alkuperäinen kirjoittaja ja lähde hyvitetään.
Rahoitus: Tämä työ tukivat projektin Research Grant päässä Research Institute of Science and Technology, Kogakuin yliopisto. Rahoittajat ollut mitään roolia tutkimuksen suunnittelu, tiedonkeruu ja analyysi, päätös julkaista tai valmistamista käsikirjoituksen.
Kilpailevat edut: Kirjoittajat ovat ilmoittaneet, etteivät ole kilpailevia intressejä ole.
Kitiini, lineaarinen polymeeri on β-1-4-kytketty N Chit1 taso on merkittävästi kohonnut plasman sairastavien potilaiden Gaucherin tauti, joka on peittyvästi periytyvä lysosomaalinen häiriö [4]. Chit1 oli ensimmäinen nisäkkään kitinaasia voidaan puhdistaa ja kloonata [5], [6]. Peittyvästi perinnöllinen puute Chit1 aktiivisuuden havaitaan yleisesti valkoihoisista [7]. AMCase löydettiin koska sen korvaava rooli ja nimettiin sen happamassa pH optimi [8]. Nämä nisäkkäiden kitinaaseja pidetään osana isännän puolustusmekanismi vastaan kitiini-taudinaiheuttajia sisältäviä ja loiset [3], [9]. Sekä Chit1 ja AMCase erittyy proteiineja, joiden molekyylipainot ovat noin 50 kDa. Molemmat proteiinit sisältävät N-terminaalisen katalyyttisen domeenin, joka on sarana-alueen, ja C-terminaalinen kitiiniä sitova domeeni [6], [8]. Hiiren AMCase osoittaa sekvenssihomologia Chit1, joiden identiteetti on 52% ja samanlaisuus oli 60% [10]. Huolimatta näistä rakenteelliset samankaltaisuudet, nämä entsyymit vaihdella huomattavasti suhteessa niiden entsymaattisen käyttäytymisen happamassa pH: ssa. AMCase osoittaa selvän pH-optimi pH: ssa 2 ja vähemmän ilmeistä optimi pH: ssa 4-7 [8], kun taas Chit1 näyttää vain laaja pH-optimi on noin pH 5: [5], [11]. Mammalian kitinaaseja ovat herättäneet runsaasti huomiota johtuen niiden kohonneen ekspression yksilöiden eri sairauksiin. Chit1 on lisääntynyt yksilöiden Gaucherin tauti [4], keuhkoahtaumatauti (COPD) [12], ja Alzheimerin taudin [13] ja tupakoitsijoilla [14]. AMCase ilme ja toiminta ovat myös upregulated aikana allergisia hengitystiereaktioita hiirimalleissa astman [15]. Lisäksi polymeeriset kitiini indusoi AMCase ilmaisun ja immuunisolujen liittyy allergia ja astma [16]. Nämä tulokset viittaavat vahvasti siihen, että kitiiniä entsyymit tärkeä rooli monissa patofysiologisissa olosuhteissa. Kuitenkin osuus näiden entsyymien patofysiologiaan näiden sairauksien vielä määrittämättä. Kun määritellään, kuinka Chit1 ja AMCase mRNA-tasoja ja vertailu näiden tasojen kanssa tasot tunnettu viittaus geenit ovat tärkeitä vaiheet saamaan käsityksen in vivo Esillä olevassa tutkimuksessa olemme kehittäneet kvantitatiivisen tosiaikaisen RT-PCR: llä, joka käyttää standardia DNA tuotetaan ligoimalla cDNA-fragmentit kohdegeenien. Tämän järjestelmän avulla voimme määrittää ja vertailla ilmentymistasojen kitinaaseja ja viittaus geenit samassa mittakaavassa. Tuloksemme osoittavat, että AMCase on suuri kopio hiiren vatsassa, mikä viittaa siihen, että vastaava proteiini toimii ruoansulatus entsyymi, joka hajottaa kitiiniä sisältäviä ruokia ja osana isännän puolustuksen vastaan kitiini-taudinaiheuttajia sisältäviä mahalaukun sisällön. Materiaalit ja menetelmät RNA, RNA: n eristäminen ja cDNA: n valmistaminen hiiren kokonais-RNA Master Panel (Clontech Laboratories) käytettiin tutkimaan kudosjakauman selostukset. Analysoimme neljä eri alkion vaiheissa ja kahdeksan aikuisen kudoksissa. Lisäksi RNA eristettiin keuhkoihin ja vatsat 3 kuukauden ikäisiä urospuolisia hiiriä. C57BL /6J-hiirten (CLEAR Japani) oli kasvatettu klo RIKEN Brain Science Institute Animal Facility. Kaikki eläinkokeet suoritettiin noudattaen vakiintuneiden ohjeiden. Protokolla hyväksyi valiokunnan Ethics eläinkokeiden RIKEN Brain Science Institute (hyväksynnän nro H19-2B013). Kaikki Leikkaus suoritettiin käyttäen dietyylieetteriä anestesia, ja yritettiin minimoida kärsimyksen. Ne kudosten mRNA valmistelua toimitti Drs. Miyazaki ja Nukina at RIKEN Brain Science Institute. Kokonais-RNA valmistettiin keuhkot ja maha käyttämällä TRIzol-reagenssia (Invitrogen) mukaisesti valmistajan ohjeiden mukaisesti. Poistaa pieniä määriä kontaminoivia perimän DNA koko RNA-näytteet käsiteltiin RQ1 RNase-Free DNaasia (Promega) mukaan valmistajan suositteleman protokollan. Pitoisuudet nukleiinihappojen määritettiin mittaamalla absorbanssi 260 nm: ssä käyttäen BioPhotometer Plus (Eppendorf). Kukin koko RNA-näytteet (3 ug) altistettiin käänteistranskriptio satunnaisia heksameerejä alukkeina. Reaktioseoksen (15 ui) sisälsi entsyymiä puskurissa [50 mM Tris-HCI (pH 8,3), 75 mM KCI, ja 3 mM MgCl 2], 100 ng satunnaisia heksameerejä, 10 mM ditiotreitolia ja 0,5 mM deoksinukleotidin trifosfaattia (dNTP). Kun liuos oli kuumennettu 60 ° C: ssa 5 min ja inkuboimalla seosta 37 ° C: ssa 5 min, 200 U yhdistelmä-hiiren leukemiaviruksen käänteistranskriptaasia (Invitrogen) lisättiin, ja seosta inkuboitiin 37 ° C: ssa 45 minuutin ajan . Käänteiskopiointireaktio lopetettiin kuumentamalla 95 ° C: ssa 5 minuutin ajan. pohjustajat reaaliaikaisen RT-PCR suunniteltiin perustuen Primer Express Software (Applied Biosystems) ja syntetisoitiin kaupallisesti (Sigma-Genosys, Sigma-Aldrich). PCR-reaktiot suoritettiin lopputilavuudessa 13 ui, joka sisälsi 2 x SYBR Green Master Mix (Brilliant II SYBR Green QPCR Master Mix, Agilent), 2,7 ng hiiren cDNA: ta tai sopivia laimennoksia ulkoisia standardeja (katso alla), ja sopivina pitoisuuksina, että alukkeet kitinaaseja, pepsinogeeni C, glyseraldehydi-3-fosfaattidehydrogenaasi (GAPDH) tai β-aktiini. Standard reaaliaikainen PCR-olosuhteet järjestelmän (Mx3005P, Agilent) käytettiin: ensimmäinen denaturaatio ja polymeraasin aktivoinnin vaiheessa 10 minuutin ajan 95 ° C: ssa, mitä seurasi 40 sykliä denaturointi 95 ° C 1 min, 55 ° C: ssa 30 s, ja 72 ° C 1 min. Sulamiskäyrät muodostettiin vahvistuksen jälkeen. PCR-tuotteet ajettiin elektroforeesissa 10% polyakryyliamidigeelillä ja analysoidaan käyttämällä Luminescent Image Analyzer (ImageQuant LAS 4000, GE Healthcare). PCR-liuosta käsiteltiin ExoSAP-IT (USB Products) mukaisesti valmistajan ohjeiden poistaa rekisteröimätön alukkeita ja dNTP: itä, ja tuotteet sekvensoitiin käyttämällä ABI PRISM Big-Dye Terminator v3.1 Cycle Sequencing Kit ja 3130 Genetic Analyzer ( Applied Biosystems). Nukleotidisekvenssit Alukkeiden valittu reaaliaikainen PCR on esitetty taulukossa S1. Oletustyylitaulukon cDNA (913 emästä) kvantifiointiin transkriptipitoisuuksissa reaaliaikaisella PCR rakennettiin seuraavasti. CDNA-fragmentit, jotka kattavat PCR-kohdealueen plus 9-120 perustaa reunustavien alueiden AMCase, Chit1, pepsinogeeni C, GAPDH, ja β-aktiini monistettiin hiiren mahalaukun cDNA PCR: llä käyttämällä KOD Plus DNA -polymeraasia (Toyobo) ja oligonukleotidit pohjamaali, joka sisältää restriktiokohdat on Bgl Validoida ehdoton reaaliaikainen PCR-menetelmällä, valmistimme täysi koodaava cDNA PCR: llä käyttäen alukesarjoja, jotka on lueteltu taulukossa S3. Viisi cDNA, joka kattaa koko koodaavan alueen kaksi kitinaasit (Chit1 ja AMCase) ja viite-geenien (GAPDH, β-aktiini ja pepsinogeeni C) monistettiin PCR: llä hiiren mahalaukun cDNA käyttäen KOD Plus DNA-polymeraasia ja subkloonattiin pGEM-T- helppo vektoriin TA-kloonausvektoriin, kuten edellä on kuvattu. Sekvenssit cDNA: iden varmistettiin sekvensoimalla, kuten on kuvattu kuviossa S1. Alakloonattu fragmentit monistettiin uudelleen plasmidista DNA: t, joilla on sama alukkeita ja käytettiin sitten koko koodaavan alueen cDNA. molaarinen konsentraatio monigeenisiin-DNA: ta sisältävää standardia laskettiin perustuva pitoisuus ja moolimassa. Sarjalaimennukset valmistettiin lähtien standardin templaattikonsentraation, joka tuotti Ct noin 13 (Ct = murto kynnyssyklin arvo). Standardi-DNA: ta alistettiin 10-kertainen sarjalaimennoksia, jotka vaihtelevat 10 0-10 7 molekyylejä, ja alikvootteja pidetään jäädytettyinä -20 ° C: ssa käyttöön asti. jokainen näyte monistettiin kolmena kappaleena, ja jokainen koe toistettiin ainakin kaksi kertaa. Käyttämällä standardikäyrä, numerot Chit1, AMCase, GAPDH, β-aktiini, ja pepsinogeeni C mRNA-molekyylien ekstrapoloitiin automaattisesti käyttämällä MxPro QPCR ohjelmiston versio 4.10 (Agilent). Kaikki arvot ilmaistaan molekyylejä, per 10 ng kokonais-RNA: ta. Joissakin tapauksissa, arvot normalisoitiin suhteessa tasot GAPDH tai β-aktiini-mRNA: n. arvioida, kuinka esillä olevan menetelmän, myös käytti ΔΔ Ct menetelmällä [21], joka vaatii mittaukseen syklin kynnys (Ct) kohdegeenien. Ct-arvot laskettiin MxPro QPCR Ohjelmiston avulla GAPDH tai β-aktiini kuin normalisoija. perustaminen Reaaliaikainen PCR-määritys perustaminen luotettava menetelmä mittaamiseen ilmaus kitinaasiaktiivisuuden transkriptien on tärkeä askel tutkinnassa merkitystä hiiren kitinaaseja. Reaaliaikainen RT-PCR on tällä hetkellä herkin kvantitatiivinen menetelmä havaitsemiseksi sekä matala-runsaus mRNA: iden ja runsas transkriptit. Ensin verrataan geenin ilmentymisen tasot Chit1 ja AMCase geeneistä (katso kuvio 1). Arvioida kitinaasia tasoilla, käytimme kahta housekeeping geenejä, GAPDH ja β-aktiini, kuten viite-geenit, koska ne ovat konstitutiivisesti korkeilla tasoilla useimmissa kudosten ja solujen [22]. Lisäksi, päätimme pepsinogeeni C (tunnetaan myös nimellä progastricsin), kuten viite-geenin vatsassa. Pepsinogeeni C on asparagiiniproteaasi, joka toimii ruoansulatus entsyymin ja tuotetaan vatsassa. Tämä entsyymi on tärkeä osa mahalaukun limakalvon [23]. Käyttämällä näitä kolmea viittaus geeneistä, arvioimme geenin ilmentymistä Chit1 ja AMCase hiiren kudoksissa (kuvio 1). ensimmäinen suunniteltu useita eri alukkeiden kvantitatiivinen PCR ja arvioitiin niiden soveltuvuutta sen mukaan, onko ne antoivat yksittäisiä tuotteita kuten näkyy yhden sulamislämpötila (Tm) ja yhden juovan 10% polyakryyliamidigeelillä. Nukleotidisekvenssit, että tuotteet olivat myös vahvistettu. Tutkia spesifisyyden alukkeita, kukin PCR-tuotteiden monistettiin mukaisesti reaaliaikainen PCR-olosuhteissa käyttämällä hiiren cDNA-seos, joka koostuu kudosten neljän alkion vaihetta ja kahdeksan aikuisen kudoksissa, ja sen määritettiin yhdessä eri menetelmillä. Kuten on esitetty kuviossa 2A-E, vain yksi piikki esiintyi dissosiaation käyriä Chit1 (Tm = 79,7 ° C), AMCase (Tm = 79,1 ° C), GAPDH (Tm = 81,4 ° C), β-aktiini (Tm = 82,0 ° C) ja pepsinogeeni C (Tm = 81,4 ° C). Lopussa PCR, olemme analysoineet tuotteita 10% polyakryyliamidigeelillä. Geelielektroforeesi osoitti selkeää yksittäistä bändejä odotetun koot Chit1 (69 emäsparia), AMCase (81 emäsparia), GAPDH (77 emäsparia), β-aktiini (71 emäsparia) ja pepsinogeeni C (82 bp) (kuvio 2F). Nukleotidisekvenssit PCR-tuotteiden määritettiin suoraan, kuten on kuvattu Materiaalit ja menetelmät osassa. Olemme vahvisti, että PCR-tuotteet monistettiin kohde cDNA (katso kuvio 3B). Nämä tulokset osoittavat, että PCR-tuotteet ovat erityisiä amplikoneihin kohdetietokoneesta cDNA ja joka virhepariutumisesta on merkityksetön alle meidän koeolosuhteissa. vertasi ekspressiotasoja kaksi kitinaaseja ja kolme viite-geenit samassa mittakaavassa (kuvio 1). Tätä tarkoitusta varten olemme perustaneet kvantitatiivinen reaaliaikainen PCR-järjestelmä, jolle vakiomallin oli tarpeen tarkka kvantifiointi (kuvio 3A). Rakensimme standardin templaatti-DNA reaaliaikainen PCR-ligoimalla viiden tavoite fragmenttien yksi-yhteen-suhde, ja sitten tämä Ligatoitu DNA-fragmentti kloonattiin plasmidivektoriin, kuten on kuvattu osassa Materiaalit ja menetelmät (kuvio 3A) . 913 nukleotidin mittainen templaatti-DNA sisälsi viisi cDNA-fragmentteja, jotka kattavat PCR-kohdealueen plus 9-120 emästä reunustavat alueet ja sisälsivät restriktiokohtien Bgl validointi standardikäyrän ja kvantitatiivinen reaaliaikainen PCR System kvantifiointi sekä kitinaaseja ja viittaus mRNA: t nojaa standardin käyriä. Sarjalaimennoksia standardin templaatti-DNA oli käytetty standardikäyrän vertailla ja arvioida reaaliaikaisen RT-PCR määrän strategioita, joita on käytetty analysoimaan viisi mRNA: t. Kukin Standardikäyrä muodostettiin käyttäen 10-kertainen laimennussarja standardin DNA ja viisi erilaista alukeparia (kuvio 4A-E, vasemmalla). Eksponentiaalinen monistaminen pidettiin laajalla syklit, jolloin saadaan dynaaminen alue seitsemän suuruusluokan (kuvio 4A-E, vasemmalla). Käyttämällä Oletustyylitaulukon DNA, joka sisältää viisi cDNA-fragmentit, yhtä suuret määrät voidaan määrittää kaikki viisi geeniä jokaiseen laimennettuna rakentaa standardin käyriä (kuva 4A-E, oikealla). Voit testata absoluuttisen tasa käyrien, jonka pitoisuus tunnetaan koko koodaavan cDNA monistettiin ja sen jälkeen analysoidaan tuntematon näyte. Tämä määritys suoritettiin sen varmistamiseksi, että jokainen testattu laimennus johti odotettu määrä. Kuten on esitetty kuviossa 4A-E, oikea, yhtä suuret määrät havaittiin kutakin testattua laimennosta käytetään muodostamaan standardikäyrä (katso kuvio S2). Kvantifiointia alhaisen runsaus selostukset ja runsas selostukset voimme vahvistaa herkkyys ja luotettavuus reaaliaikaisen PCR, mikä osoittaa, että meidän reaaliaikainen PCR-menetelmällä tarjoaa laajan dynamiikan määritysrajan, korkea tarkkuus ja suuri herkkyys (kuva 4a- E, oikealla). Siten meidän reaaliaikainen PCR menetelmä antaa luotettavia arvoja kaksi kitinaasia geenien ja viite geenien samassa mittakaavassa. Tutkia in vivo vertasi suhteet AMCase että Chit1. Kopioluku kunkin mRNA määritettiin käyttäen samaa standardia laimennoksia. Huomasimme, että vatsa ja alaleuan rauhanen pääasiassa ilmaisi AMCase mRNA (kuvio 5C, yläpaneeli). Muut kudokset tutkittiin tässä tutkimuksessa tuotti enemmän AMCase kuin Chit1, ja Chit1 vallitsi vain silmissä (kuvio 5C, alempi paneeli). tarkastellaan seuraavaksi suhteellisen kvantifioinnin alkuperäisen datan esitetty kuviossa 5, joka ilmaistaan molekyylejä, per 10 ng kokonais-RNA: ta, käyttäen siivous geenejä, kuten on kuvattu Materiaalit ja menetelmät. Tulokset esitetään tukeminen Information kuvassa S3 (data normalisoitiin GAPDH) ja Kuva S4 (normalisoitu β-aktiini). Sitten me analysoitua tietoa kuvassa 5, jonka ΔΔ Ct menetelmä [21] ja esitetään Täydentäviä tietoja kuvassa S5 (normalisoitu GAPDH) ja kuvassa S6 (normalisoitu β-aktiini). Kun suhteellista ilmentymistä havaitaan esillä olevan absoluuttinen ja suhteellinen kvantifiointimenetelmät, ei ollut merkitsevää eroa välillä tietoja kuin Chit1 mRNA: n ekspression, joka on runsaimmin ilmaistu silmissä suhteutettuna β-aktiini (kuva 5, kuva S3 ja kuvio S4). Samanlaisia tuloksia saadaan myös suhteellisen kvantifioinnin avulla ΔΔ Ct menetelmällä [21] (katso kuvio 5, kuvio S5 ja kuvio S6). Emme kuitenkaan voi suoraan arvioida keskinäistä ekspressiotasot Chit1 ja AMCase kun analysoitiin ΔΔ Ct menetelmällä. Monissa tutkimuksissa on suoritettu patofysiologiassa nisäkkään kitinaaseja keuhkojen kudoksiin. Tässä tutkimuksessa olemme osoittaneet, että AMCase mRNA ekspressoituu pääasiassa hiiren mahan kudoksissa (kuvio 5). Vertasimme myös ekspressiotasojen kitinaaseja ja viite-geenit käyttäen cDNA valmistettiin keuhkojen ja mahan kudoksissa 3 kuukauden ikäisiä hiiriä (n = 5). Määrälliset tiedot on esitetty kuviossa 6. Kun Chit1 tasot asetettiin 1,0, suhteellinen ekspressiotasot cDNA oli AMCase, 14; GAPDH, 196; ja β-aktiini, 681 hiiren keuhkokudoksessa (kuvio 6A). Tämä tulos osoittaa, että keuhkojen kudokset ilmentävät enemmän AMCase kuin Chit1, vaikka AMCase ilmentymisen taso oli pienempi kuin kaksi siivous geenejä. mahan kudoksissa, kun Chit1 asetettiin arvoon 1,0, suhteellinen ekspressiotasot oli AMCase, 721; pepsinogeeni C, 2261; GAPDH, 61; ja β-aktiini, 127 (kuvio 6B). Sekä GAPDH ja β-aktiini geenit ovat tunnettuja siivous geenit ja konstitutiivisesti korkeilla tasoilla useimmissa kudosten ja solujen. Pepsinogeeni C (progastricsin) on asparagiiniproteaasi, joka toimii ruoansulatus entsyymin ja tuotetaan vatsassa. Tämä entsyymi on tärkeä osa mahalaukun limakalvon [23]. Ilmentymisen taso AMCase oli paljon suurempi kuin GAPDH ja β-aktiini ja oli verrattavissa tasoon pepsinogeeni C. Nämä tulokset osoittavat, että vatsan AMCase on suuri kopio mahalaukun limakalvon ja viittaavat siihen, että tämä entsyymi on todennäköisesti olla tärkeä fysiologiset tehtävät vatsassa. tutkittiin uudelleen myös suhteellinen ilmentyminen Chit1, AMCase ja pepsinogeeni C on esitetty kuviossa 6 käyttäen siivous geenien esillä olevalla menetelmällä, kuten edellä on kuvattu. Tulokset esitetään tukeminen Information kuvassa S7 (normalisoitu GAPDH) ja kuvassa S8 (normalisoitu β-aktiini). Ei ollut merkittävää eroa keskuudessa Kuva 6, Kuva S7 ja Kuva S8. Sekä Chit1 ja AMCase ajatellaan tukea vastaanottavassa puolustautua kitiini-taudinaiheuttajia sisältäviä [3], [ ,,,0],9]. Lisäksi, AMCase on efektorimolekyylin on allergisen tulehduksen. Nämä kitiiniä entsyymit tärkeitä rooleja patofysiologiassa allergisten hengitystiereaktioita hiirimalleissa astma. Suhteellisen vähän tiedetään kuitenkin noin in vivo Quantitative reaaliaikainen RT-PCR on merkittävä edistysaskel määrällisesti mRNA: ta ja mahdollistaa havaitsemisen ilmaisu tietyn kiinnostavan geenin molekyylitasolla . On monia raportteja havaitsemisen äärimmäisen alhainen mRNA käyttämällä tätä tekniikkaa. Kuitenkin reaaliaikainen RT-PCR: llä ei ole laajalti käytetty, koska se on vielä rajoituksia määrällisesti useita mRNA: iden samalla asteikolla. Olemme rakentaneet Oletustyylitaulukon DNA, joka käsittää viisi cDNA-fragmentit (kukin noin 200 emästä pitkä). Nämä fragmentit sisältyvät fragmentit kahdelle kitinaaseja, yksi merkki ja kaksi siivous geenejä ja yhdistettiin one-to-one-suhteet (kuvio 3A). GAPDH ja β-aktiini, yleisimmin käytetty siivous geenejä, sisällytettiin sisäisen valvonnan ja viittaukset PCR-monistamiseen. Lisäksi käytimme pepsinogeeni C markkerigeeninä koska se on valmistettu korkealla tasolla mahassa [23]. Tämä menetelmä mahdollisti absoluuttisia määrä Chit1 ja AMCase mRNA-molekyylien, kuten myös lukumäärä viite mRNA-molekyylien, per 10 ng kokonais-RNA: ta (mol /10 ng) (kuvio 5 ja kuvio 6). Lisäksi voimme tutkia suhteellinen kvantifiointi Chit1 ja AMCase mRNA-tasot kahdella taloudenhoito geenejä, GAPDH ja β-aktiini (tukeminen Information Kuva S3 ja kuva S4). suhteellinen kvantitointi on helpompi suorittaa kuin absoluuttisia, koska Kalibrointikäyrä ei ole tarpeen. Suhteellisen kvantitointiin, mRNA-tasot on mielenkiinnon kohteena olevan geenin on verrattu kuin housekeeping geenien [21]. Kuitenkin tämä kvantitointimenetelmä ei verrata tasoa eri geenin transkriptien samassa mittakaavassa. Vaikka menetelmä vaatii useita vaiheita, jotka liittyvät rakentamiseen standardin DNA ja kanssa validointiprosessit, tämä menetelmä voi tarjota geenin ilmentyminen tietoja, jotka ovat suoraan verrattavissa geenien välillä (kuvat 5 ja 6). Reaaliaikainen PCR tarjotaan laaja dynaaminen alue määritysrajan ja suuri herkkyys, ja kvantifiointia alhaisen runsauden selostukset pystyimme vahvistaa herkkyys ja luotettavuus meidän menetelmän (kuva 4). Tämä tekniikka soveltuu erittäin hyvin kvantifiointia ja vertailu mRNA-tasojen useiden geenien samalla asteikolla. Nykyinen menetelmä on sovellettavissa lääketieteen tekniikan sekä kliinistä ja käytännön käyttötarkoituksia. Tässä tutkimuksessa olemme huomanneet, että AMCase mRNA syntetisoitiin erittäin korkealla tasolla hiiren vatsassa suhteessa tasot taloudenhoito geenien (kuvio 5 ja kuvio 6). Taso AMCase mRNA on verrattavissa pepsinogeeni C (progastricsin) mRNA, joka on tärkein komponentti mahan limakalvon mahassa (kuvio 6B). Lisäksi vatsan, alaleuan rauhaset todettiin myös ilmaista suuria määriä AMCase (kuvio 5). Kuten syntetisoimiseksi nisäkkään kitinaasia mRNA: t, sekä mahan ja alaleuan rauhaset pidetään merkittävinä kudosten tuottaa valtavasti AMCase hiiren. suolahappoa erittyy vatsassa, luoda happamissa olosuhteissa proteiinien sulatuksessa pepsiinillä noin pH 2 [23], [24]. Hiiri AMCase esittää syvän happostabiilius ja on aktiivisin pH 2,0, joka erottaa sen muista hiiren entsyymeistä [8]. Epätavallinen pH vakautta ja riippuvuus hiiren AMCase happamassa olosuhteet sallivat tehokkaan ruoansulatusta kitiinistä materiaalien happamissa olosuhteissa. Se havainto, että AMCase ilmentyy pääasiassa mahassa viittaa sen mahdolliseen toiminto elintarvikkeiden jalostuksessa. Wild hiiret syö kitiini sisältäviä elintarvikkeita, kuten hyönteisiä, kun taas hiiret pidetään laboratoriossa syödä keinotekoinen ruokavalion sisältävät kuivattuja panimohiivan, joka sisältää myös kitiini soluseinämän. Siten AMCase voi toimia ruoansulatus entsyymi, joka hajottaa polymeerinen kitiini mahalaukun sisällön. Korkein Chit1 myös ilmaistu hiiren vatsassa. Kuitenkin Chit1 ekspressiotaso vatsa oli 1/721 kuin AMCase ekspressiotason ja oli pienempi kuin ekspressiotasot kaksi siivous geenejä, GAPDH ja β-aktiini (kuvio 6A). Lisäksi, Chit1 hallussa ei ole kitiiniä aktiivisuus pH: ssa mahalaukun mehut, joka on noin pH-arvoon 2 [5], [11]. On osoitettu, että Chit1 tuotetaan paikkoihin lähellä neutraalia pH: ta, kuten ei-glandular osan mahassa ja ohutsuolessa [25]. Siten Chit1 ei edistä kitinaasiaktiivisuuden hiiren vatsassa. Vaikka AMCase ilmaistaan pääasiassa mahassa ja alaleuan rauhaset, kaikki muut kudokset tutkitaan tässä tutkimuksessa ilmaistu pieni, mutta havaittavissa, tasot Chit1 ja AMCase . Ilmentymistasojen Chit1 ja AMCase olivat alhaisemmat kuin housekeeping geenien näissä kudoksissa. Chit1 on leveä pH-optimi on noin pH 5: [5], kun taas ensisijainen optimaalinen pH AMCase on pH-arvoon 2 ja toissijainen pH-optimi on pH 4-7, ja AMCase säilyttää alle 30% aktiivisuudestaan pH: ssa 2 tällä pH-alueella [8]. Sekä Chit1 ja AMCase sulattaa luonnon kitiini ja kitosaani kautta endo-kitinaasiaktiivisuuden ja tuottaa chitobiose [8], [26]. Vaikka AMCase on hallitseva yli Chit1 monissa hiiren kudoksissa, voi olla mitään merkittäviä eroja niiden kitiiniä aktiivisuus hiiren kudoksissa. Lisää AMCase mRNA kuin Chit1 mRNA havaittiin useimmissa hiirikudoksissa, paitsi silmät. Tuloksemme osoittavat myös, että geenien ilmentyminen on Chit1 voidaan säädellä kehityksellisesti, mikä viittaa siihen, että se on rooli ontogeny. Opiskelu säätelyyn ilmentymisen nisäkkään kitinaaseja voisi antaa oivalluksia fysiologisia rooleja näiden entsyymien. Yksityiskohtainen luonnehdinta promoottorialueiden Chit1 ja AMCase geenejä sekä tunnistaminen cis Vaikka nisäkkäät eivät tuota kitiini tai kitiini syntaasi, ne ovat jatkuvasti alttiina tälle polymeeriin altistumisen kautta kitiini sisältäviä loisia ja taudinaiheuttajia. Alustan nisäkkäiden kitinaaseja on oletettavasti ympäristön kitiini, kuten todettua sienten tai sukkulamatoja. Keuhkoissa, molemmat entsyymit voivat toimia osana isännän puolustusmekanismi vastaan kitiini-taudinaiheuttajia sisältäviä, kuten ympäristö- hometta ja punkit, jotka aiheuttavat hengitysteiden allergia.
-asetyyli-D-glukosamiini, on toiseksi yleisin polysakkaridi löytyy luonnosta. Se toimii merkittävä rakenteellinen osa sienet, äyriäiset, ja hyönteisten, mutta ei löydy nisäkkäissä [1]. Kitinaaseja hydrolysoimaan β-1-4-glykosidisidoksin kitiinin polymeerin. Vaikka nisäkkäät eivät tuota kitiini tai syntaasi, he ilmaisevat kaksi aktiivista kitinaaseja, chitotriosidase (Chit1) ja happamien nisäkkäiden kitinaasiaktiivisuuden (AMCase) [2], [3].
sääntelyn nisäkkäiden kitinaaseja. Äskettäin reaaliaikainen RT-PCR on käytetty määrittämään mRNA-tasot monissa geeniekspressiotutkimuksissa [17] - [20], koska tämä menetelmä on riittävän herkkä havaitsemaan mRNA jopa yhden solun. Reaaliaikainen PCR yleisesti liittyy normalisoitumista ekspressiotasot kiinnostavan geenin kanssa kuin housekeeping geenejä, joiden ajatellaan johdonmukaisesti ilmaistaan kaikissa näytteissä. Kuitenkin tämä kvantitointimenetelmä ei verrata tasoa eri geenin transkriptien samassa mittakaavassa.
Reaaliaikainen PCR
Rakentaminen standardin DNA
II, Xho
I, Pst
I, tai Ei
I (at 5'- ja 3 ' - päissä) mukaisesti valmistajan protokollaa. Eteenpäin ja käänteinen alukkeet on lueteltu taulukossa S2. PCR-tuotteet puhdistettiin käyttämällä Wizard SV Gel ja PCR Clean-Up System (Promega) ja sitten pilkottiin vastaavan restriktioentsyymeillä. DNA-fragmentit puhdistettiin käyttämällä agaroosigeelielektroforeesilla ja Clean-Up System ja sitten ligatoidaan yhteen T4 DNA-ligaasia (Toyobo). Ligatoidut fragmentit monistettiin käyttäen eteenpäin-aluketta 5'-GTGGATTCTGTGCCGACAAAGCAGATGGCC-3 'ja reverse-aluketta 5'-TGGGTACATGGTGGTACCACCAGACAGCAC-3', jossa KOD Plus DNA-polymeraasi. 3'-dA lisättiin monistetun DNA: n käyttäen Takara Taq HS (Takara Bio), ja tuote puhdistettiin geelielektroforeesilla kuten edellä on kuvattu. Saatu DNA kloonattiin pGEM-T-Easy -vektoriin (Promega) kautta TA-kloonausvektoriin, mukaan valmistajan ohjeiden mukaisesti. Nukleotidisekvenssi tuloksena plasmidi varmistettiin sekvensoimalla. Linearisoitu monigeenisiin sisältävä DNA-fragmentti valmistettiin reamplification plasmidista DNA samoja alukkeita PCR: llä käyttäen KOD Plus DNA-polymeraasia. Fragmentit puhdistettiin ja kvantitoitiin edellä kuvatulla tavalla ja käytettiin standardina DNA.
valmistaminen Viisi cDNA peittävät koko koodausalueen
Standard Käyrät
kvantifiointi mRNA Real-time PCR: llä käyttämällä standardikäyriä tai ΔΔ Ct menetelmä
Tulokset
rakentaminen standardin Template DNA kvantifiointiin ja vertailu Gene Expression joukossa viisi geeniä
II, Xho
I Pst
I ja Ei
I (katso yksityiskohdat kuviossa 3B).
ilmentäminen Chit1 ja AMCase vuonna hiirikudoksissa
sääntelyn Chit1 ja AMCase geeniekspressiota, yhteensä RNA-näytteet uutetaan neljä alkion vaihetta ja eri aikuisen kudoksissa, analysoitiin kvantitatiivisen reaaliaikaisen PCR-määrityksen käyttäen yhtä standardia DNA (kuva 3). Tulokset ilmaistaan molekyylejä, per 10 ng kokonais-RNA: ta (kuvio 5 ja kuvio 6). Sekä Chit1 ja AMCase mRNA: t ilmennetään laajasti hiiren kudoksissa (kuvio 5A ja 5B). Kirkas kudosspesifisyyksien havaittiin ekspressiokuvioita molempien kitinääsi mRNA: iden. Korkea Chit1 mRNA havaittiin hiiren mahassa (kuvio 5A, ylempi paneeli), jonka jälkeen silmät ja keuhkoissa. Chit1 mRNA havaittiin matalalla, mutta helposti havaittavissa, tasot muissa kudoksissa (kuvio 5A, alempi paneeli). AMCase mRNA pääasiassa havaittu vatsassa, jonka jälkeen leuanalussylkirauhasesta (kuvio 5B, ylempi paneeli), mutta oli läsnä myös muissa kudoksissa (kuvio 5B, alempi paneeli).
Analyysi Chit1, AMCase, pepsinogeeni C, GAPDH, ja β-aktiini in Lung ja Maha kudokset
Keskustelu
keskinäistä ekspressiotasot Chit1 ja AMCase. Kvantifiointi mRNA voi tuottaa hyödyllisiä ja biolääketieteellisesti olennaiset tiedot. Tässä tutkimuksessa olemme perustaneet kvantitatiivinen reaaliaikainen PCR-järjestelmä pystyy määrittämään mRNA-tasojen kahden nisäkkäiden kitinaaseja ja vertaamalla näitä tasoja kuin viittaamalla geenien samalla asteikolla. Tuloksemme osoittavat, että AMCase ilmentyy pääasiassa hiiren vatsassa.
- ja trans
faktorilla tarvitaan ymmärtää valikoiva näiden entsyymien ilmentymää.
 Mikä soija on vähällä FODMAP-ruokavaliolla?
Mitä tulee vähäisen FODMAP-ruokavalion eliminaatiovaiheeseen, soija on lueteltu monilla vältä -luetteloilla. Mutta onko soija aina kiellettyä niille, jotka poistavat FODMAP:t IBS:ään? Lyhyt vastaus:se
Mikä soija on vähällä FODMAP-ruokavaliolla?
Mitä tulee vähäisen FODMAP-ruokavalion eliminaatiovaiheeseen, soija on lueteltu monilla vältä -luetteloilla. Mutta onko soija aina kiellettyä niille, jotka poistavat FODMAP:t IBS:ään? Lyhyt vastaus:se
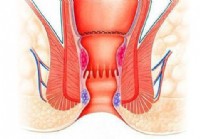 Mitä eroa on nidotulla hemorrhoidopeksialla ja peräpukamanpoistolla?
Mitä peräpukamat ovat? Peräpukamat ovat turvonneet suonet peräsuolen ja peräaukon alimmassa osassa. Niitä kutsutaan myös paaluiksi. Peräpukamia voidaan hoitaa hemorrhoidektomialla tai nidotulla hem
Mitä eroa on nidotulla hemorrhoidopeksialla ja peräpukamanpoistolla?
Mitä peräpukamat ovat? Peräpukamat ovat turvonneet suonet peräsuolen ja peräaukon alimmassa osassa. Niitä kutsutaan myös paaluiksi. Peräpukamia voidaan hoitaa hemorrhoidektomialla tai nidotulla hem
 Tutkimuksessa tarkastellaan aerobiomeja,
puut ja vaikutukset kansanterveyteen Ympäristömikro -organismeilla on keskeinen rooli ihmisten terveydessä - monipuolinen konsortio, parempi. Mikro -organismien monimuotoisuus auttaa immuunijärjestelm
Tutkimuksessa tarkastellaan aerobiomeja,
puut ja vaikutukset kansanterveyteen Ympäristömikro -organismeilla on keskeinen rooli ihmisten terveydessä - monipuolinen konsortio, parempi. Mikro -organismien monimuotoisuus auttaa immuunijärjestelm