Résumé
Contexte
L'infection par Helicobacter pylori Méthodologie /Principales constatations En utilisant un modèle de souris de l'infection et des biopsies gastriques de 29 personnes, nous avons analysé le recrutement des macrophages et la polarisation pendant H. pylori de l'infection par cytométrie de flux et de PCR en temps réel. Nous avons trouvé un recrutement séquentiel des neutrophiles, les éosinophiles et les macrophages de la muqueuse gastrique des souris infectées. Gene analyse de l'expression des tissus de l'estomac et les macrophages triés a révélé que les macrophages gastriques ont été polarisées à M1 après H. pylori Conclusions /Importance Ces résultats montrent que la vaccination des souris contre H. pylori Citation:. Quiding-Järbrink M, Raghavan S, M Sundquist (2010) Enhanced M1 Macrophage Polarisation dans Human Helicobacter pylori Editeur: Niyaz Ahmed, Université de Hyderabad, en Inde Reçu le 26 Août 2010; Accepté 7 Octobre 2010; Publié le 23 Novembre, 2010 Droit d'auteur: © 2010 Quiding-Järbrink et al. Ceci est un article en accès libre distribué sous les termes de la licence Creative Commons Attribution, qui permet une utilisation sans restriction, la distribution et la reproduction sur tout support, à condition que l'auteur et la source originelle sont crédités Financement:. Cette étude a été soutenue par le centre d'excellence MIVAC, financé par la Fondation suédoise pour la recherche stratégique, le Adlerbert Research Foundation, Wilhelm & la fondation de Martina Lundgren, Inga-Britt & la fondation Arne Lundberg, et l'hôpital universitaire Sahlgrenska. Les bailleurs de fonds ont joué aucun rôle dans la conception de l'étude, la collecte et l'analyse des données, la décision de publier, ou de la préparation du manuscrit Intérêts concurrents:.. Les auteurs ont déclaré aucun conflit d'intérêts existent Introduction Helicobacter pylori Une réponse pro-inflammatoire forte est associée à des niveaux accrus de des espèces d'oxygène et d'azote réactif dans la muqueuse gastrique [3], ce qui peut favoriser le développement du cancer [4]. Par exemple, les souris infectées avec H. pylori macrophages M1 prennent généralement part à la réponse immunitaire initiale à l'invasion des micro-organismes et de promouvoir T helper (Th) 1 immunité, alors que les macrophages M2 sont induits pendant la phase de résolution de l'inflammation et sont impliqués dans les débris de balayage, le remodelage des tissus, et la promotion de l'immunité Th2 [8], [9]. La polarisation des macrophages est dirigé par le microenvironnement. macrophages M1 sont induites par l'interféron-y et microbiennes des produits tels que le lipopolysaccharide [9]. D'un autre côté, les macrophages M2 sont induites par Th2 ou des cytokines anti-inflammatoires et des facteurs de croissance, y compris l'IL-4, IL-10 et de facteur de croissance transformant β [8], [9]. Pendant H. pylori de l'infection, les macrophages sont recrutés pour la muqueuse gastrique, où ils contribuent à la production de cytokines pro-inflammatoires et de chimiokines [10], [11], [12], [13], [14], [15] . En outre, une étude récente a montré que l'épuisement des liposomes des macrophages réduit la pathologie gastrique H. des souris infectées par des pylori [16]. Malgré cela, la fonction des macrophages in vivo lors de H. pylori de l'infection reste relativement mal définie. La fonction des macrophages est intimement couplée à leur état de polarisation, ce qui semble également avoir un rôle dans le développement du cancer gastrique [6], [7]. Par conséquent, nous avons examiné la polarisation des macrophages dans la muqueuse gastrique de H. pylori Résultats des macrophages, les éosinophiles et les neutrophiles dans la muqueuse gastrique après H. infection de Le recrutement de cellules innées sur le site de l'infection est une condition préalable pour le contrôle infectieux. Non seulement peut innée des cellules telles que les macrophages et les neutrophiles, participent à la destruction des bactéries; ils produisent aussi des médiateurs inflammatoires, qui fixent la scène pour la réponse immunitaire qui a suivi. Pour étudier l'accumulation de cellules innées dans la muqueuse gastrique pendant H. pylori de l'infection, on a infecté C57BL /6 avec la souris adaptée H. pylori Les éosinophiles ont été définis comme CD11b + Siglec-F + cellules (Fig. 1C, [17]). Ces cellules ont exprimé des niveaux intermédiaires de F4 /80 et avait lors de l'analyse par cytométrie en flux (Fig. 1E) un profil de dispersion du côté haut. Le violet de crésyl coloration de tri CD11b + Siglec-F + cellules confirmé la morphologie des éosinophiles (Fig. 1C). La fréquence des eosinophiles dans la muqueuse gastrique a été doublé au bout de huit semaines, et encore augmenté après 26 semaines d'infection (Fig. 1F). Les neutrophiles ont été définis comme CD11b + Gr1 + cellules (fig . 1D). Comme l'anticorps Gr1 reconnaît à la fois l'épitope Ly6C et Ly6G nous avons confirmé que les cellules + Gr1 + tous les CD11b exprimé le neutrophile marqueur spécifique Ly6G (Fig. 1D et E). La fréquence des neutrophiles a augmenté de 10 fois huit semaines après l'infection et a encore augmenté après 26 semaines (Fig. 1F). Ainsi, au cours de H. pylori de l'infection il y a une accumulation séquentielle de neutrophiles et éosinophiles, suivie par les macrophages dans la lamina propria gastrique. Caractérisation des PED gastrique Pour caractériser les DC gastriques, nous avons d'abord identifié une population de CD11c + MHC-II + cellules (Fig. 2A). Lorsque ces cellules ont ensuite été analysées pour l'expression de F4 /80 et la chaîne aE intégrine CD103, la moitié du CD11c + du CMH-II + cellules ont été identifiées comme F4 /80 + macrophages (Fig. 2A ). Cependant, parmi les CD11c + MHC-II + cellules qui ne disposaient pas de l'expression F4 /80, deux populations de DC putatifs avec l'expression différentielle de CD103 peuvent être distingués (Fig. 2A). En raison des nombreux fluorochromes nécessaires, nous avons choisi de caractériser seulement le CD103 gastrique + Afin d'étudier les effets possibles de H. pylori de l'infection sur l'expression des molécules co-stimulatrices et du CMH-II par les macrophages gastriques et CD103 + PED, l'expression de ces marqueurs a été analysée par cytométrie de flux après quatre, huit et 26 semaines d'infection. Dans l'état stationnaire, les macrophages et CD103 + DC dans la lamina propria gastrique exprimé des niveaux similaires de la costimulation molécule CD86, ainsi que du CMH-II (Fig. 3A). Étonnamment, l'expression de CD86 et CMH-II soit par les macrophages gastriques ou CD103 + DC n'a pas augmenté après l'infection par H. pylori M1 polarisation des macrophages gastriques pendant H. pylori de l'infection Puisque nos résultats suggèrent que les macrophages gastriques pourraient ne pas être pleinement activés pendant H. pylori de l'infection, nous avons caractérisé ces cellules encore en enquêtant sur leur polarisation M1 /M2. Pour déterminer la polarisation des macrophages pendant H. pylori de l'infection, nous avons utilisé la PCR en temps réel pour mesurer l'expression des gènes associés à M1 ou M2 polarisation des macrophages dans le tissu gastrique [8], [9]. Nous avons également mesuré l'expression de l'IL-10, qui peut être produit par des macrophages de régulation [9]. Aucun des marqueurs analysés étaient différentiellement exprimés quatre semaines après H. Pour identifier la source de iNOS et CXCL11 dans la muqueuse gastrique, les macrophages (CD11b + Gr1 -Siglec-F -MHC-II +), éosinophiles (CD11b + Gr1 -Siglec-F + MHC-II -) et les cellules restantes après gating sur les macrophages et les éosinophiles (CD11b - et CD11b + Gr1 +) ont été triés du commun gastriques cellules de la lamina propria de souris infectées par H. pylori Vaccination contre la H. pylori vaccination de protection contre les H. pylori en outre, nous avons analysé la fréquence des macrophages dans la muqueuse gastrique de souris immunisées et contestées par cytométrie en flux. Par rapport à-seulement infectées souris, les souris immunisées ont une fréquence significativement accru de macrophages gastriques trois semaines après la provocation (Fig. 5C). Cependant, malgré que les macrophages ont été recrutés pour la muqueuse gastrique de souris immunisées et contestées, les macrophages ne régulent positivement l'expression de CD86 ou du CMH-II par rapport à infecté seule souris (Fig. 5D). Ces résultats montrent que, après la vaccination réussie avec H. lysat et le choléra de la toxine de pylori, les macrophages accumulent dans la muqueuse gastrique et sont rapidement polarisée à M1 après l'infection. Augmentation du macrophage polarisation M1 dans la gastrite atrophique humaine Nous avons ensuite étudié le rôle de H. Afin de déterminer si la augmentation de l'expression de l'ARNm de marqueurs M1 et M2 se traduit également par une augmentation des teneurs en protéines, les protéines totales ont été extraites à partir d'échantillons de biopsies antrales, et la concentration de iNOS et CCL18 a été déterminée par ELISA. biopsies gastriques de personnes souffrant de gastrite atrophique était disponible uniquement pour l'extraction de protéines à partir d'un volontaire, qui est différentiellement indiqué à la figure 6B. La moitié de la H. de personnes infectées par le pylori présentaient des niveaux détectables de protéine iNOS dans le sinus maxillaire tandis que la concentration de iNOS était inférieure à la limite de détection dans tous les individus non infectés (Fig. 6b). L'expression de iNOS ARNm et la protéine iNOS était significativement corrélée (R 2 = 0,88, P Pris ensemble, ces résultats indiquent la présence des deux macrophages M1 et M2 dans la muqueuse gastrique de H. pylori Dans cette étude, nous avons étudié la polarisation de l'estomac macrophages pendant chronique H. pylori Contrairement à l'humain H . pylori de l'infection, SS1 infectées C57BL /6 ont montré un profil d'expression génique dans la muqueuse gastrique indicative de macrophage polarisation M1. Analyse de l'expression génique des macrophages triées isolées de la muqueuse gastrique des souris infectées a confirmé que l'expression de l'iNOS et de marqueurs M1 CXCL11 a été enrichi dans la population triée macrophage. En outre, la polarisation M1 des macrophages gastriques a été considérablement accélérée par la vaccination préalable. Déjà quatre semaines après la provocation, les souris immunisées upregulated l'expression de iNOS et CXCL11 à un niveau similaire à celui observé après 26 semaines seulement-infectés souris. Des études sur des souris déficientes en iNOS ont montré que iNOS favorise le développement de l'atrophie et le cancer dans la muqueuse gastrique lors de Helicobacter de l'infection [6], [22]. De plus, la clairance de la H. pylori Nous avons observé un recrutement séquentiel des cellules innées à la muqueuse gastrique de souris SS1-infectées, avec les macrophages accumulant assez tard au cours de l'infection (26 semaines). En revanche, les fréquences des neutrophiles et des eosinophiles gastriques dans la muqueuse gastrique a augmenté de huit semaines après l'infection et est restée élevée à 26 semaines. L'accumulation de macrophages est produit beaucoup plus rapidement chez les souris vaccinées, auquel cas la fréquence des macrophages gastriques a déjà augmenté trois semaines après la provocation. Auparavant, les neutrophiles se sont révélés être recrutés pour la muqueuse gastrique de souris SS1-infectées en deux phases, une première phase avec un pic 1-2 jours après l'infection et une phase tardive à partir de 2-3 semaines après l'infection [24]. Un schéma de recrutement, similaire à celle des neutrophiles a également été décrit pour les macrophages gastriques [24]. Cependant, les macrophages ont été définis comme CD11b + Gr1 - cellules [24], une population de cellules qui dans nos mains se compose principalement d'eosinophiles (voir figure 1 et 2).. Asim et al. macrophages définis comme CD11b + F4 /80 + cellules, et a observé un pic au début de nombre macrophage dans la muqueuse gastrique 1-2 jours après l'infection par H. pylori Nous avons pu identifier deux populations des PED dans la muqueuse gastrique de souris. Les deux sous-ensembles ont exprimé des niveaux élevés de CD11c et MHC-II, manquait l'expression du marqueur F4 macrophage /80, mais diffèrent en ce qui concerne l'expression de CD103. La fréquence de CD103 gastrique + DC n'a pas changé après quatre, huit ou 26 semaines de H. pylori Malgré que les macrophages M1 régulent positivement typiquement CMH-II et des molécules costimulatrices, nous ne pouvions pas détecter une expression accrue de MHC -II ou CD86 sur les macrophages gastriques ou CD103 + DC provenant soit des souris non immunisées ou immunisées après l'infection. En revanche, l'incubation in vitro de H. pylori Au cours des réactions inflammatoires aiguës, les macrophages sont généralement polarisés à M1 et exercent des effets anti-microbiens efficaces. Par exemple, l'infection par Salmonella typhimurium Est-ce que les macrophages contribuent à accueillir la défense contre H. pylori En conclusion, cette étude montre que la vaccination des souris contre H. pylori Matériel et méthodes Éthique déclaration L'étude a été approuvée par le comité d'éthique des animaux du gouvernement (Göteborgs djurförsöksetiska nämnd, 328/2008 et 254 /2009). Le comité régional de l'éthique humaine de Västra Götaland en Suède (de 706/03 et 85/06) a approuvé l'étude, et le consentement éclairé écrit a été obtenu de tous les participants. Ceci est la seule autorité donnant l'autorisation éthique pour la recherche sur les êtres humains en Suède, et il est pas directement associé à des hôpitaux ou des universités. Femme C57BL /6 ont été achetées auprès de Charles River Laboratories (Sulzfeld, Allemagne), ou dans le cas des expériences de vaccination auprès de Taconic (Ejby, Danemark). Les souris ont été infectées à l'âge de 8-12 semaines. H de la souris. Les souris ont reçu quatre doses de 10 pi de 500 ug H. pylori de la lysat (préparé à partir de la souche Hel305 comme décrit précédemment [46]) en combinaison avec 10 pg de toxine cholérique (List Biological Laboratories Inc., Madison, NJ) par voie sublinguale à des intervalles de 1 semaine [47], [48]. Deux semaines après la dernière immunisation, les souris ont été provoquées par voie intragastrique avec 3 x 10 8 unités formant colonie de H. Évaluation de la colonisation bactérienne Pour une évaluation quantitative de la colonisation bactérienne dans les expériences d'immunisation, une moitié de l'estomac a été lavé avec précaution avec du PBS et on les homogénéise en utilisant un homogénéisateur Ultra Turrax ( IKA Technology Laboratory, Staufen, Allemagne). Des dilutions en série de l'homogénat ont été étalées sur des plaques d'agar Skirrow. Lorsque les cellules de la lamina propria gastrique ont été isolés de l'ensemble de l'estomac une estimation quantitative de la charge bactérienne gastrique n'a pu être effectuée. Dans ce cas, l'estomac, qui a été coupée le long de la grande courbure et on le lave dans du PBS, a été doucement stries sur des plaques d'agar Skirrow. La présence de H. Les colonies pylori de a été confirmée par un test uréase. De cette façon, nous avons pu confirmer H. pylori de la colonisation et continuent d'utiliser l'ensemble de l'estomac pour l'isolement cellulaire. L'isolement des cellules de la lamina propria gastrique L'estomac glandulaire a été découpé en 5 morceaux mm et incubé un total de trois fois avec H.
déclenche une chronique de l'estomac l'inflammation qui peut évoluer vers une atrophie et l'adénocarcinome gastrique. La polarisation des macrophages est une caractéristique du cancer et de l'infection et peuvent favoriser la progression ou la résolution de la maladie. Cependant, le rôle des macrophages et leur polarisation pendant H. pylori de l'infection n'a pas été bien défini.
infection, et ce processus a été considérablement accélérée par la vaccination préalable. Human H. pylori de l'infection a été caractérisée par une polarisation M1 /M2 mixte des macrophages. Cependant, dans H. pylori de gastrite atrophique -Associated, l'expression de la synthase inductible de l'oxyde nitrique a été nettement augmenté par rapport à la gastrite simple, indicatif d'un M1 macrophage polarisation renforcée dans cette lésion précancéreuse.
M1 amplifie la polarisation des macrophages gastriques et qu'une polarisation M1 similaire amélioré est présent chez l'être humain H. pylori de gastrite atrophique induite
-Associated atrophique Gastrite et Souris vacciné. PLoS ONE 5 (11): e15018. doi: 10.1371 /journal.pone.0015018
colonisent l'épithélium de l'estomac de plus de la moitié de la population mondiale [1]. L'infection est souvent long de la vie et déclenche une inflammation chronique de la muqueuse gastrique, qui dans environ 1-2% des personnes infectées se développe finalement dans adénocarcinome gastrique [1]. Développement du cancer gastrique, en particulier le type intestinal, est un processus en plusieurs étapes qui progresse au fil des décennies par des lésions précancéreuses de la muqueuse gastrique, telles que la gastrite atrophique, la métaplasie intestinale et la dysplasie [2]. Le résultat de l'infection dépend de la virulence de l'infection de H. pylori de la souche, les facteurs environnementaux tels que le tabagisme et l'alimentation, et d'accueillir des facteurs génétiques qui influencent le type et l'intensité de la réponse inflammatoire [1].
pendant six mois ont une fréquence accrue de mutations gastriques par rapport à des souris non infectées [5]. En outre, les souris qui sont déficientes pour la synthase inductible de l'oxyde nitrique de l'enzyme inductible (iNOS) présentent une réduction de l'incidence du cancer gastrique après H. infection et cancérogène défi de pylori par rapport à des souris normales [6]. Alors que iNOS contribue au développement d'un cancer gastrique, un niveau élevé de la chimiokine CCL18 dans des tumeurs gastriques est associée à une survie prolongée des patients atteints d'un cancer gastrique [7]. Fait intéressant, iNOS est produit par classiquement activés macrophages /M1 alors que la production CCL18 est une caractéristique pour alternativement activées macrophages /M2 [8]. Pris ensemble, ces résultats suggèrent que la polarisation macrophage peut avoir un rôle important dans le développement de H. cancer gastrique -Associated pylori de.
souris et les humains infectés par. Nous montrons que la vaccination des souris contre H. pylori
vitesses et amplifie M1 polarisation des macrophages gastriques. En outre, la lésion pré-cancéreuse gastrite atrophique est caractérisée par un macrophage polarisation M1 améliorée chez les humains.
Augmentation de la fréquence
pylori
souche Sydney 1 (SS1), et après quatre, huit et 26 semaines, nous avons analysé l'infiltrat inflammatoire gastrique des souris individuelles par multi-couleurs de cytométrie en flux. Le nombre total de lamina cellules propria isolées à partir de l'estomac n'a pas changé au cours des quatre premières semaines de l'infection, mais à huit semaines après l'infection, le nombre total de cellules isolées a été doublé, et à 26 semaines de l'infection a augmenté huit fois le nombre total de cellules isolées par rapport aux souris non infectées (Fig. 1A). Parmi les cellules recrutées à l'estomac étaient les macrophages, les éosinophiles et les neutrophiles. macrophages gastriques ont été identifiés comme des cellules exprimant CD11b et majeur d'histocompatibilité de classe II (CMH-II), mais manquant expression de Gr1 (marqueur de neutrophiles), CD103 (exprimé par un sous-ensemble de cellules dendritiques (DC)) et immunoglobulin- de liaison aux acides sialique comme lectine (Siglec-F, marqueur éosinophiles) (Fig. 1B). Ces cellules ont exprimé le marqueur de macrophage F4 /80 (Fig. 1E), et en fonction de la morphologie cellulaire ont été confirmés comme les macrophages (Fig. 1B). La fréquence des macrophages dans la muqueuse gastrique est restée inchangée après quatre et huit semaines de H. pylori de l'infection (Fig. 1F). Cependant, après 26 semaines, la fréquence des macrophages gastriques a été augmenté par rapport à des souris non infectées (Fig. 1F).
DC plus, puisque ces cellules ont été impliqués comme antigène important de présenter les cellules dans les tissus des muqueuses [18]. Gastric CD103 + CD ont été facilement identifié par coloration pour CD11c et CD103 (Fig. 2B). Le CD103 gastrique + DC ont exprimé des niveaux élevés de CMH-II, et se composait d'un CD11b bas et un CD11b haute sous-ensemble (Fig. 2C). En comparaison, le CD103 gastrique - PED étaient tous CD11b haute (Fig 2D.). En outre, le CD103 + DCs manquait expression de CD8a et F4 /80 (Fig. 2C). Toutefois, la fréquence de CD103 + DC n'a pas changé de manière significative dans la muqueuse gastrique après l'infection (Fig. 2F).
macrophages gastriques et CD103 + DC ne parviennent pas à upregulate molécules costimulatrices après H. infection de
pylori
par rapport à des souris naïves appariés selon l'âge analysés en parallèle (Fig. 3B). Ainsi, les macrophages et les CD103 + DC dans la lamina propria gastrique ne parviennent pas à upregulate CD86 et CMH-II après H. pylori
infection, en dépit de la réponse inflammatoire en cours.
pylori infection par rapport à des souris naïves (Fig. 4A). A huit semaines après l'infection l'expression de la M1 Marqueurs iNOS et CXCL11 a été augmenté de façon significative, et ces marqueurs ont été encore surexprimés à 26 semaines de l'infection (Fig. 4A). En outre, l'expression d'IL-10 a été régulée à la hausse à huit et 26 semaines après l'infection par rapport à des souris naïves (Fig. 4A). En revanche, les marqueurs M2 trouvés dans la zone inflammatoire 1 (FIZZ1) et arginase-1 ne sont pas exprimés de manière différentielle dans l'estomac à quatre, huit ou 26 semaines après l'infection par rapport aux souris naïves (Fig. 4A).
pendant 26 semaines (Fig. 4B). L'expression de l'ARNm de iNOS et CXCL11 dans des populations cellulaires triées de souris infectées, ainsi que dans le total des cellules gastriques lamina propria de souris à la fois naïve et infectée a ensuite été déterminée par PCR en temps réel. Un nombre suffisant de macrophages triés n'a pu être obtenu à partir de souris naïve pour une analyse fiable de l'expression de l'ARNm. macrophages gastriques ont exprimé le plus haut niveau de iNOS et CXCL11 par rapport aux autres populations de cellules triées et les cellules de la lamina propria gastriques totales avant le tri (Fig. 4C). Pris ensemble, ces résultats montrent que les macrophages gastriques sont polarisées à M1 pendant H. pylori de l'infection.
amplifie macrophage M1 polarisation
est généralement associé avec le développement rapide d'une réponse Th1 gastrique [19]. Depuis la Th1 cytokine interféron-γ induit macrophage polarisation M1 [9], nous avons examiné si la vaccination pourrait influencer la polarisation macrophage pendant H. pylori
infection. A cette fin, des souris ont été immunisées par voie sublinguale avec H. pylori
lysat et la toxine du choléra adjuvant, et par la suite contesté avec H. pylori
SS1. Ce schéma d'immunisation a conduit à une réduction significative de la charge bactérienne dans l'estomac quatre semaines après la provocation (Fig. 5A). Dans le même temps, l'expression des marqueurs M1 et M2 dans l'estomac a été analysé par PCR en temps réel. Chez les souris non immunisées, seule l'expression de CXCL11 était significativement régulée positivement quatre semaines après l'infection par rapport à des souris naïves (Fig. 5B). En revanche, les souris immunisées ont présenté une excellente régulation positive des deux marqueurs M1 iNOS et CXCL11 alors que l'expression de marqueurs M2 FIZZ1 et arginase-1 n'a pas été modifié, quatre semaines après la provocation (Fig. 5B). L'augmentation de l'expression de iNOS et CXCL11 chez la souris immunisée /défié n'a pas été due à la vaccination seule, étant donné que immunise mais les souris non attaquées ne changent pas l'expression de l'un quelconque des marqueurs M1 ou M2 analysés par rapport à des souris complètement non traitées (données non présentées ).
pylori infection et la gastrite atrophique pour la polarisation des macrophages dans la muqueuse gastrique humaine. À cette fin, l'expression de marqueurs humains M1 (iNOS, CXCL11) et M2 (CCL17, CCL18, CD206) a été mesurée dans les biopsies de antrum par PCR en temps réel. H. les personnes infectées par des pylori avec la gastrite simple a montré une expression significativement élevée de l'ARNm pour les deux M1 (iNOS, 8 fois, CXCL11, 20 fois) et des marqueurs M2 (de CCL17, 30 fois; CCL18, 70 fois, CD206 , 2 fois) par rapport à des volontaires non infectés (Fig. 6A). Toutefois, les personnes souffrant de gastrite atrophique (4/6 avaient une métaplasie intestinale, en plus de l'atrophie) ont exprimé des niveaux encore plus élevés de iNOS ARNm par rapport à ceux avec la gastrite simple (20 fois), alors que CXCL11 et des marqueurs de M2 polarisation ont été exprimées de façon similaire (Fig. 6A). En effet, l'expression de iNOS était 180 fois plus élevé chez les personnes ayant une gastrite atrophique par rapport aux témoins non infectés (Fig. 6A), ce qui indique une polarisation M1 accrue des macrophages gastriques chez les patients souffrant de gastrite atrophique.
< 0,01) indiquant que l'analyse de l'ARNm reflète l'expression des protéines, même lorsque les taux de protéines sont faibles. La concentration du marqueur CCL18 M2 a été augmentée dans le tissu gastrique de H. les personnes infectées par des pylori par rapport à des témoins non infectés (Fig. 6B). En outre, la concentration de la protéine CCL18 était significativement corrélée avec l'expression de l'ARNm CCL18 (R 2 = 0,754, P
< 0,01).
personnes infectées par. En outre, la gastrite atrophique est associée à une forte amplification de l'expression de iNOS dans la muqueuse gastrique, ce qui indique une polarisation M1 accrue des macrophages.
Discussion
infection. Nous montrons que H. de personnes infectées par le pylori expriment l'ARNm dans la muqueuse gastrique indicative d'une polarisation M1 /M2 mixte des macrophages, et ceci a été confirmé au niveau de la protéine. Cependant, dans H. pylori, de la gastrite atrophique induite par y avait une élévation marquée de l'expression de iNOS par rapport à la gastrite non compliquée. gastrite atrophique confère un risque accru de développer un cancer gastrique par rapport à simple H. gastrite -Associated de pylori [20]. L'augmentation de l'expression de iNOS dans la gastrite atrophique peut contribuer au développement du cancer de l'estomac par la production d'espèces réactives de l'azote, ce qui peut favoriser la carcinogenèse par induction des lésions de l'ADN, la perturbation de la réparation de l'ADN, une modification post-traductionnelle des protéines, et des mutations de p53 [4]. En effet, les souris iNOS déficientes ont une incidence réduite de l'adénocarcinome gastrique après H. pylori
infection et le défi avec un produit chimique cancérigène par rapport à des souris normales [6]. De plus, les polymorphismes dans la région promotrice de l'iNOS, conduisant à une activité transcriptionnelle plus élevée, en corrélation avec une plus forte incidence du type intestinal du cancer gastrique chez des femmes japonaises [21].
après la vaccination se produit indépendamment de iNOS [23]. Ainsi, iNOS semble contribuer à accueillir la pathologie plutôt que la protection lors de l'infection avec H. pylori
. Par conséquent, si la production accrue d'iNOS dans la muqueuse gastrique est maintenue après la vaccination, il peut être un effet secondaire indésirable qui peut augmenter la sévérité de H. pylori
inflammation induite par une tumeur maligne et, à moins que l'immunité stérile est atteint. Toutefois, la contribution relative de iNOS pour accueillir la pathologie par rapport à la protection au cours des différentes étapes de H. infection Les bons de souscription pylori plus d'enquête.
[15]. En outre, le nombre de macrophages est augmentée à nouveau à 60 et 120 jours après l'infection par rapport à des souris naïves [15]. Nous étendons ces résultats en montrant que le recrutement de ces populations cellulaires innées est maintenue jusqu'à 26 semaines après l'infection. En outre, nous décrivons l'accumulation des eosinophiles dans la muqueuse gastrique, une population de cellules qui, de loin les plus nombreux que les macrophages et les neutrophiles gastriques (Fig. 1). En effet, le rôle des éosinophiles dans H. gastrite induite par pylori devrait être étudiée plus loin. Les éosinophiles et les macrophages part l'expression de plusieurs marqueurs, y compris CD11b et F4 /80 (Fig. 1, [25]). Par conséquent, plusieurs marqueurs doivent être analysés simultanément afin de distinguer ces populations cellulaires innées.
infection. Contrairement à notre étude, une étude récente de Kao et al. n'a pas pu détecter CD103 + DC dans la muqueuse gastrique de souris non infectées [26]. Au contraire, le CD103 + DC est apparu 24 heures après H. pylori
infection. Depuis les temps d'analyse diffèrent entre cette étude et nos expériences, il est difficile de comparer directement les résultats.
avec des monocytes humains [27], les DC dérivées de monocytes humains [28], [29], [30], [31], les DC dérivées de la moelle osseuse de souris [32], [33], ou humain gastrique primaire DC [34], induit une régulation positive de molécules costimulatrices et MHC-II. Par conséquent, le défaut de upregulate MHC-II et CD86 sur les macrophages gastriques et CD103 + DC en chronique H. pylori de l'infection peut être provoquée par le milieu inflammatoire et non par les bactéries en soi. En effet, l'interaction entre les PED et H. pylori
in vitro ne reflète pas nécessairement ce qui se passe in vivo, où le microenvironnement local sur le site de l'acquisition de l'antigène et la présentation de l'antigène, ainsi que le sous-ensemble DC impliqué dans la présentation de l'antigène de H. pylori
, aura une influence sur la réponse. Par exemple, les cellules T régulatrices, qui sont répandues dans le H. muqueuse gastrique infecté par des pylori [35], [36], peut empêcher la surexpression des molécules costimulatrices et MHC-II sur les DC [37]. En outre, l'IL-10 peut prévenir la régulation positive de molécules co-stimulatrices et du CMH-II sur les macrophages et les DC [38].
ou Listeria monocytogenes
induit M1 polarisation des macrophages, qui est nécessaire pour le contrôle de l'infection [39]. Résolution de l'inflammation est caractérisée par un changement de polarisation macrophage M2, ce qui favorise la cicatrisation des tissus. Les patients tuberculeux présentent une production accrue de cytokines Th2 comme l'infection progresse [40], [41], ce qui peut induire une polarisation M2 des macrophages. Chez les souris, M1 polarisation des macrophages constitue la réponse précoce à Mycobacterium tuberculosis
, alors que les macrophages alvéolaires sont polarisées à M2 lors de l'infection à un stade avancé [42]. Cependant, le changement de polarisation des macrophages induite par les infections chroniques se traduit souvent par une capacité réduite des macrophages pour tuer les bactéries envahissantes [39], [43]. D'autre part, l'inflammation chronique avec persistance M1 macrophage polarisation est associée à un risque accru de développement du cancer [4].
? A la différence neutrophiles, les macrophages ne sont pas fréquemment observés dans la lumière gastrique après la translocation à travers l'épithélium [44]. Depuis H. pylori
préférentiellement résident dans la couche de mucus gastrique ou sont liés aux cellules épithéliales gastriques, les macrophages ne peuvent pas venir en contact direct avec des bactéries entières. En effet, l'épuisement des macrophages par des liposomes chargés de médicament n'a eu aucun effet sur H. pylori de la colonisation [16], ce qui suggère que les macrophages peuvent ne pas contribuer directement à accueillir la défense contre H. pylori
. En revanche, les macrophages peuvent favoriser la pathologie gastrique. Par exemple, l'appauvrissement médiée par des liposomes de macrophages amélioré la gastrite induite par H. pylori de l'infection [16]. En outre, la suppression sélective de la β I-kB-kinase dans les cellules myéloïdes, ce qui empêche l'activation de NF-kB dans ces cellules, inhibe le développement d'une atrophie gastrique après H. felis
infection [45]. Ainsi, les macrophages ne semblent pas contribuer à Helicobacter
jeu, mais peuvent plutôt promouvoir la pathologie gastrique.
M1 amplifie la polarisation des macrophages gastriques. Un phénomène similaire est observée dans la gastrite atrophique humaine où le mélange M1 /M2 polarisation présente dans la gastrite simple est remplacé par une polarisation M1 dominée. Cela peut induire une tumeur favorisant l'inflammation, et le décalage de polarisation macrophage de M1 à M2 pourrait donc représenter une cible thérapeutique dans chronique H. pylori de l'infection.
Souris
Les bactéries et infection de
pylori SS1 a été cultivée sur des plaques de gélose Columbia ISO pendant 2 jours à 37 ° C, après quoi ils ont été transférés dans un bouillon Brucella complété avec du sérum de 5% de foetus de veau (FCS) et des antibiotiques (vancomycine, 10 ug /ml; polymyxine B , 20 U /ml; triméthoprime, 5 ug /ml) et incubé en secouant pendant la nuit à 37 ° C dans des conditions microaérophiles. Avant l'infection, la motilité des bactéries a été confirmée par microscopie. La concentration des bactéries a été estimée par spectrophotométrie. Les souris ont reçu 3 × 10 8 unités formant des colonies de SS1 intragastrique.
vaccination sublinguale
pylori SS1.
 Les 5 maladies digestives les plus courantes et leur traitement
Les 5 maladies digestives les plus courantes et leur traitement
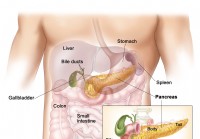 Syndrome de Zollinger-Ellison
Syndrome de Zollinger-Ellison
 Partie 3 :Comment arrêter le régime élémentaire et pourquoi cela doit être fait lentement
Partie 3 :Comment arrêter le régime élémentaire et pourquoi cela doit être fait lentement
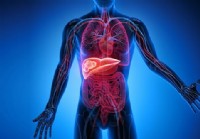 Cancer du foie (carcinome hépatocellulaire)
Cancer du foie (carcinome hépatocellulaire)
 Un champignon commun trouvé sur la peau peut provoquer une maladie inflammatoire de l'intestin
Un champignon commun trouvé sur la peau peut provoquer une maladie inflammatoire de l'intestin
 12 causes courantes de diarrhée que la plupart des gens ignorent
12 causes courantes de diarrhée que la plupart des gens ignorent
 Les diététiciens comme ambassadeurs de la santé intestinale
Les mecs. Ce nest pas mon poste habituel. Aujourdhui, je partage avec vous mon entretien avec Gut Microbiota for Health. Jai assisté à leur conférence à Rome en mars et jai parlé à un groupe de diétét
Les diététiciens comme ambassadeurs de la santé intestinale
Les mecs. Ce nest pas mon poste habituel. Aujourdhui, je partage avec vous mon entretien avec Gut Microbiota for Health. Jai assisté à leur conférence à Rome en mars et jai parlé à un groupe de diétét
 Mise à jour des dépistages du cancer du côlon
Le cancer du côlon (cancer colorectal) survient lorsque des cellules malignes se développent autour de votre rectum ou de la paroi interne de votre côlon. Il est essentiel dobtenir un diagnostic préci
Mise à jour des dépistages du cancer du côlon
Le cancer du côlon (cancer colorectal) survient lorsque des cellules malignes se développent autour de votre rectum ou de la paroi interne de votre côlon. Il est essentiel dobtenir un diagnostic préci
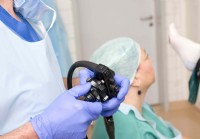 Qu'est-ce qu'un coloscope ?
Un coloscope est un instrument long, mince et flexible qui est inséré dans lanus pour une inspection visuelle du côlon et du rectum. Il est doté dun appareil photo numérique et dune source de lumière
Qu'est-ce qu'un coloscope ?
Un coloscope est un instrument long, mince et flexible qui est inséré dans lanus pour une inspection visuelle du côlon et du rectum. Il est doté dun appareil photo numérique et dune source de lumière