Depuis 22 ans, Kibow ® s'est concentré sur la recherche et le développement de produits de compléments alimentaires pour la santé rénale basés sur le concept de compensation de la fonction rénale défaillante en utilisant le microbiome du BOWel (d'où le nom KIBOW) pour éliminer les toxines. Ceci est basé sur les propriétés de probiotiques et de prébiotiques hautement spécifiques et sélectifs de la souche pour plusieurs applications de modulation intestinale. Kibow ® est bien reconnu pour son produit phare Renadyl™ (un pré/probiotique pour la santé rénale), Kibow Fortis ® (une multifibre pour le bien-être), Kibow Flora™ (un probiotique pour la santé immunitaire) pour les humains, et Azodyl™, un produit vétérinaire contre l'insuffisance rénale conçu spécialement pour les chats et les chiens (licence exclusive à Vetoquinol USA depuis juillet 2006). La société explore également le développement de nouveaux produits de compléments alimentaires ciblés sur la fonction des organes et élargit ainsi son portefeuille de produits au cours de l'année à venir.
Le Kibow actuellement commercialisé ® les suppléments pour humains et animaux de compagnie sont classés par la FDA des États-Unis comme des compléments alimentaires. Bien que les produits aient été développés avec une validation de type Pharma (https://kibowbiotech.com/rd/) (https://kibowbiotech.com/journal-publications/) sur deux décennies, l'utilisation potentielle de ces produits est limitée par la réglementation américaine FDA/FTC, car aucune réclamation de soins de santé ou de traitement de maladie ne peut être faite. Aussi, ces produits, comme compléments alimentaires, ne sont pas qualifiés pour obtenir un remboursement médical. Compte tenu de ces limites et d'un désir d'atteindre et d'aider plus de patients atteints d'insuffisance rénale chronique, Kibow ® a développé une formulation biothérapeutique vivante (LBP) plus récente et plus avancée qui sera scientifiquement avancée en tant que produit pharmaceutique approuvé par la FDA des États-Unis et validé cliniquement.
Comme les probiotiques sont des microbes vivants, ce nouveau produit relèvera des médicaments Live Biotherapeutic Product (LBP) du Center for Biological Evaluation Research (CBER) et des réglementations de la FDA des États-Unis. Ce sera le premier médicament contre la LBP pour les patients atteints d'IRC aux États-Unis et serait admissible à un remboursement médical. La société lance le processus IND et planifie les essais cliniques requis. Après avoir réussi la randomisation proposée, études cliniques contrôlées chez des patients CKD III/IV et soumission des données à la FDA pour examen et approbation, Kibow ® se préparera à lancer son produit médicamenteux LBP en 2023 aux États-Unis ainsi que dans d'autres pays. Cela contribuera à garantir qu'un plus grand nombre de patients pourront accéder à cette nouvelle option de traitement et se les payer.
Kibow ® prévoit également des essais cliniques supplémentaires chez des patients sous dialyse pour explorer de meilleurs résultats et le potentiel de réduction de la durée et/ou de la fréquence de la dialyse. Cet essai clinique devrait également être achevé avant 2023. Kibow ® attend avec impatience cette prochaine étape qui pourrait grandement bénéficier aux patients dialysés et réduire considérablement les dépenses de Medicare pour le système de santé américain de plusieurs milliards de dollars. Kibow ® Le lancement par Biotech de sa division pharmaceutique en propriété exclusive et son action pour aller de l'avant pour obtenir le statut de médicament anti-LBP est conforme à la mission du programme HHS/ASN KidneyX (https://www.kidneyx.org/) récemment créé ainsi qu'au programme décret signé par le président pour faire progresser la santé rénale (https://www.whitehouse.gov/presidential-actions/executive-order-advancing-american-kidney-health/).
 10 façons dont les symptômes du SCI sont différents pour les femmes
10 façons dont les symptômes du SCI sont différents pour les femmes
 Le gingembre peut-il réellement soulager vos maux d'estomac ?
Le gingembre peut-il réellement soulager vos maux d'estomac ?
 Comment traiter l'impaction fécale
Comment traiter l'impaction fécale
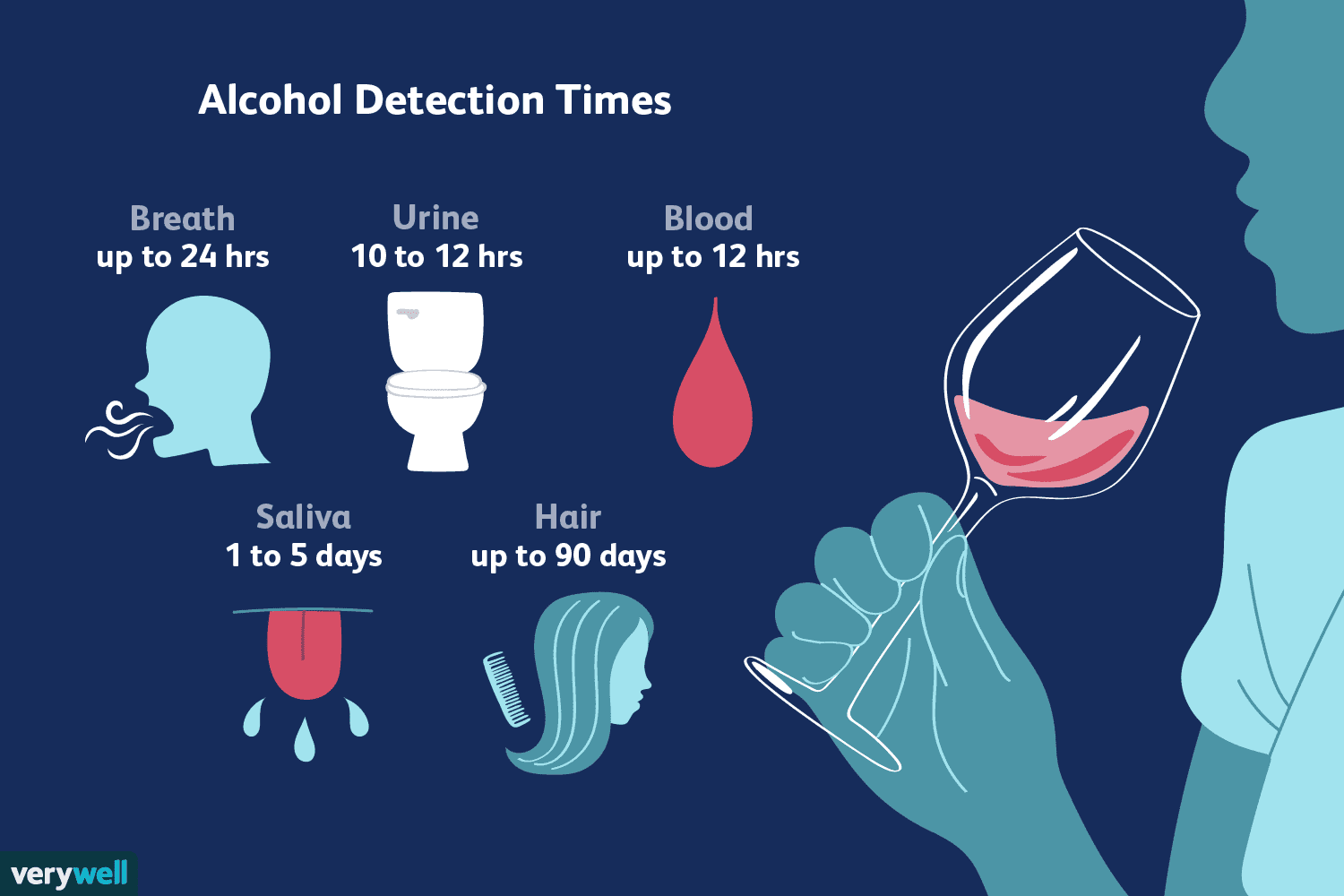 Combien de temps l'alcool reste-t-il dans votre système ?
Combien de temps l'alcool reste-t-il dans votre système ?
![Meilleurs médecins gastro-entérologues (GI) en Floride Mise à jour [sep 19]](https://www.stomachillness.com/article/uploadfiles/202201/2022011910313996.png) Meilleurs médecins gastro-entérologues (GI) en Floride Mise à jour [sep'19]
Meilleurs médecins gastro-entérologues (GI) en Floride Mise à jour [sep'19]
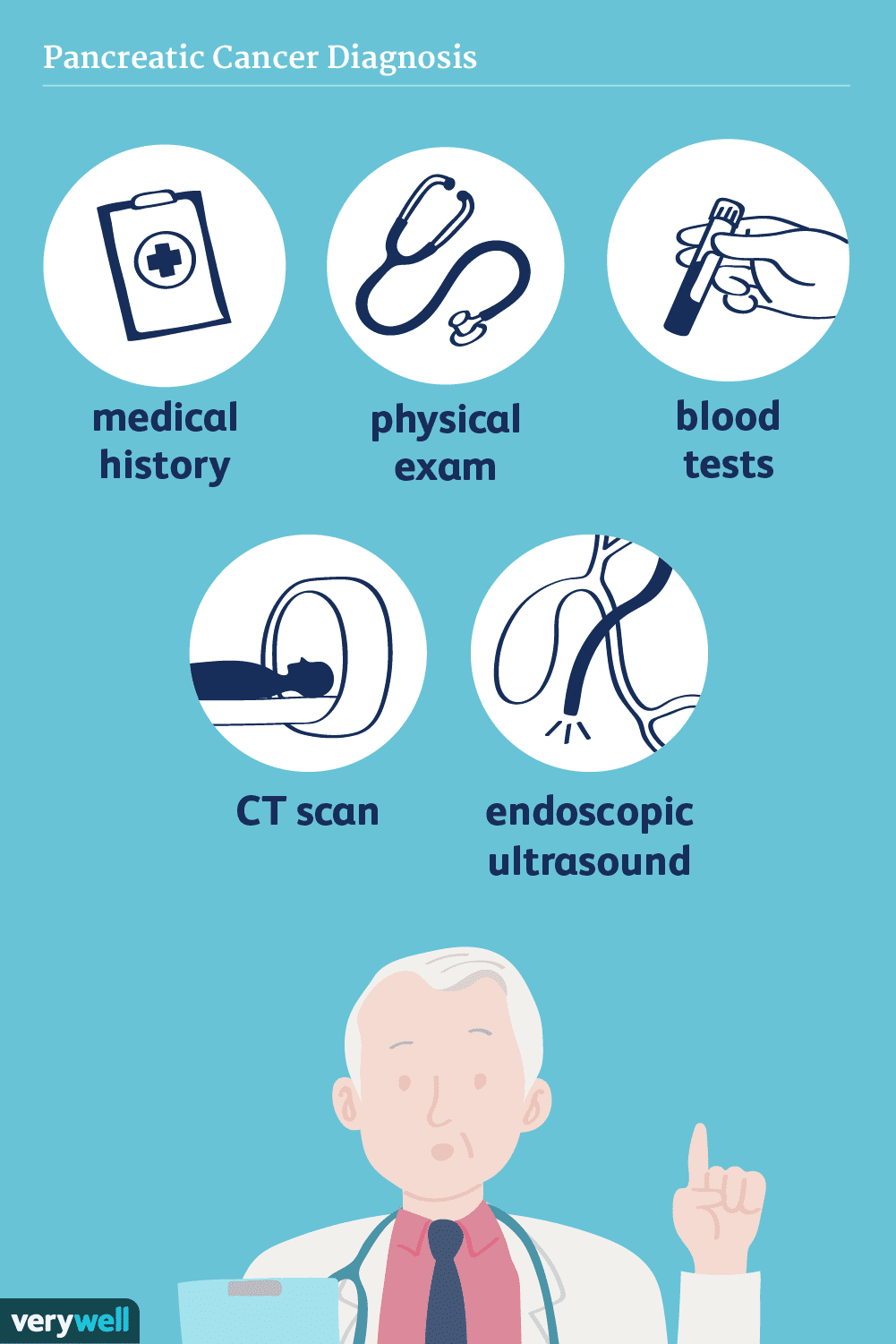 Comment le cancer du pancréas est-il diagnostiqué
Comment le cancer du pancréas est-il diagnostiqué
 Les causes de la douleur abdominale
Quest-ce qui cause la douleur abdominale ? La douleur abdominale est une douleur ou un inconfort quune personne ressent nimporte où entre le bas de la poitrine et laine distale. Certains professionne
Les causes de la douleur abdominale
Quest-ce qui cause la douleur abdominale ? La douleur abdominale est une douleur ou un inconfort quune personne ressent nimporte où entre le bas de la poitrine et laine distale. Certains professionne
 Atopie et maladie atopique
Atopique est un terme utilisé pour décrire une réponse médiée par les IgE dans le corps suite à une exposition à des irritants externes. La différence entre latopie et lallergie La plupart dentre
Atopie et maladie atopique
Atopique est un terme utilisé pour décrire une réponse médiée par les IgE dans le corps suite à une exposition à des irritants externes. La différence entre latopie et lallergie La plupart dentre
 Comprendre les brûlures d'estomac
Brûlures destomac, la sensation de brûlure qui se produit soit dans la poitrine, soit dans la gorge, est généralement un problème temporaire - peut-être avez-vous mangé de la nourriture épicée - mais
Comprendre les brûlures d'estomac
Brûlures destomac, la sensation de brûlure qui se produit soit dans la poitrine, soit dans la gorge, est généralement un problème temporaire - peut-être avez-vous mangé de la nourriture épicée - mais