MicroARN-645, régulée à la hausse dans le adencarcinoma humain de jonction oesophagienne gastrique, inhibe l'apoptose en ciblant suppresseur de tumeur IFIT2
Résumé de l'arrière-plan
Un nombre croissant de preuves indique que miARN ont un rôle essentiel dans la carcinogenèse et le cancer progression; Cependant, le rôle des miARN dans la tumorigenèse de adencarcinoma de jonction gastrique oesophagien (AGEJ) reste largement incertaine.
Méthodes
Le SGC7901 et BGC-823 lignées cellulaires de cancer gastrique ont été utilisés. Les expressions de miR-645 et IFIT2 (protéine Interferon-induites avec tétratricopeptide répète 2) ont été examinés par qRT-PCR, les expressions de IFIT2 a été examiné par western blot et le dosage de l'immunohistochimie. L'apoptose cellulaire a été déterminée par FACS. MiR-645, un inhibiteur imite et transfections plasmide IFIT2 ont été réalisées pour étudier l'déficitaire et le gain-fonction. Résultats de l'activité caspase-3/7 a été examiné par un dosage de la caspase-3/7.
Dans la présente étude, nous avons rapporté une augmentation de l'expression de miR-645 dans des échantillons cliniques AGEJ par rapport aux tissus non cancéreux appariés. Nous avons également observé une importante miR-645-régulation dans deux cancer gastrique (GC) des lignées cellulaires, SGC7901 et BGC-823, qui ont été utilisés comme modèles cellulaires parce qu'il n'y avait pas de lignées cellulaires AGEJ disponibles établies à ce jour. Nous avons trouvé que l'inhibition de miR-645 peut sensibiliser considérablement SGC7901 et BGC-823 cellules à la fois starvation- sérique et chimiothérapeutique l'apoptose induite par un médicament en régulant à la hausse IFIT2, un médiateur de l'apoptose par l'intermédiaire d'une voie mitochondriale, avec un site de liaison potentiel pour le miR -645 à 3'UTR de l'ARNm. Une enquête plus poussée a exposé que l'expression IFIT2 diminue dans SGC7901 et BGC-823 cellules et tissus AGEJ. l'expression ectopique de IFIT2 conduit à la promotion de l'apoptose des cellules, ce qui indique que IFIT2 peut fonctionner comme un suppresseur dans le développement de AGEJ. Conclusions de plus, l'inhibition de miR-645 induit une régulation des IFIT2 et augmentation de l'activité de la caspase-3/7 par rapport aux groupes témoins.
Nos données suggèrent que miR-645 fonctionne comme un oncogène dans AGEJ humaine par, au moins partiellement à travers, en ciblant IFIT2
.
Mots-clés
Adencarcinoma de jonction gastrique oesophagien microARN-645 IFIT2 apoptose Contexte
des études récentes ont suggéré que adencarcinoma de jonction gastrique oesophagien (AGEJ) est distincte de celle de distale l'estomac, avec différents facteurs de risque, les caractéristiques de la tumeur, et le comportement biologique [1-4]. En outre, l'incidence de AGEJ a augmenté au cours des 30 dernières années, en particulier dans les États-Unis et au nord de la Chine [5-9].
MicroARN (miARN) sont un groupe de manière endogène exprimée, non codante petits ARN, 20- 25 nucléotides de longueur, qui sont connus pour réguler négativement l'expression génique par la suppression de la traduction ou en diminuant la stabilité de l'ARNm en se liant directement à la région 3 'non traduite (3' UTR) de l'ARNm cibles [10, 11]. L'accumulation des données indique que les miARN ont des rôles importants dans la régulation des processus physiologiques et pathologiques, y compris le développement [12], le métabolisme [13], la prolifération cellulaire [14], la différenciation [15] et de l'apoptose [16]. En outre, la régulation post-transcriptionnelle aberrante des ARNm par miARN est liée à la tumorigenèse [17, 18]. Les profils d'expression anormale de miARN ont été rapportés être détectés dans divers types de tumeurs humaines, y compris le poumon [19], du sein [20], de la prostate [21], le foie [18], du colon [22] et le cancer gastrique [23]. En outre, certains miARN peuvent agir comme des oncogènes [24-26] ou suppresseurs de tumeurs [27, 28], en régulant l'expression de leurs gènes cibles qui ont des rôles importants dans certaines filières clés impliquées dans la progression du cycle cellulaire, l'apoptose ou de la prolifération. miARN régulés à la baisse dans les échantillons de tumeur tels que miR-22 [29, 30], miR-101 [31, 32], et miR-7 [33, 34] fonctionnent habituellement comme miARN suppressives, tandis que miARN surexprimés dans des échantillons de tumeurs tels que miR-17 [35, 36], et miR-21 [37, 38] exercent habituellement des rôles oncogènes. Ces études suggèrent que la dysrégulation des miARN est fréquemment impliqué dans la carcinogenèse et la progression du cancer.
Une étude récente a indiqué que miR-645 peut exercer le rôle de suppresseur de tumeur dans le cancer de l'ovaire séreux avancé pour miR-645 est négativement associée à la survie globale des il [39]. Dans la présente étude, nous avons constaté que l'expression de miR-645 a été augmenté de façon significative dans les échantillons cliniques AGEJ par rapport aux tissus non cancéreux appariés utilisant des puces microARN. Cependant, le rôle de miR-645 dans la tumorigenèse de AGEJ n'a pas encore été étudié. Une étude plus poussée a montré que miR-645 était également significativement régulée à la hausse dans les deux cancer de l'estomac (GC) des lignées cellulaires, SGC7901 et BGC-823, qui ont été utilisés comme modèles cellulaires alternatives dans la présente étude. L'inhibition de miR-645 en SGC7901 et BGC-823 cellules supprimé de manière significative l'apoptose des SGC7901 et cellules BGC-823 dans l'état de privation de sérum ou d'un médicament chimiothérapeutique par up-régulation IFIT2, un médiateur de l'apoptose, avec un site de liaison potentiel pour miR -645 à 3'UTR de l'ARNm. Le profil d'expression de miR-645 et IFIT2 dans des échantillons cliniques AGEJ une corrélation négative, ce qui suggère en outre que IFIT2
est un gène cible de miR-645. En outre, l'inhibition de miR-645 conduit à une augmentation de la caspase-07.03 activité, qui est activé par IFIT2. Dans cette étude, nous avons examiné si miR-645 est régulée à la hausse dans adencarcinoma humaine de jonction gastrique oesophagien et inhibe l'apoptose en ciblant suppresseur de tumeur IFIT2.
Méthodes
éthique déclaration
Pour les échantillons de tissus, consentement éclairé a été obtenus à partir de patients. Les procédures utilisées dans cette étude ont été approuvées par le Conseil de l'Université du Henan de la science et de la technologie d'examen institutionnel et a été conformes à la Déclaration d'Helsinki et à la législation locale. Lignes
cellulaires et conditions de culture
lignées cellulaires de cancer gastrique SGC -7901, BGC-823 et immortalisé ligne normale des cellules épithéliales gastriques, GES-1 ont été aimablement accordé par Prof. Daiming Fan. Toutes les lignées cellulaires ont été maintenues dans notre institut selon les protocoles recommandés. Les cellules ont été cultivées dans un milieu RPMI-1640 (Invitrogen, Carlsbad, CA, USA) additionné de 10% de sérum de veau fœtal (FBS) (Invitrogen, Carlsbad, CA, USA) à 37 ° C dans un incubateur à 5% de CO2.
les échantillons humains
Toutes les procédures expérimentales ont été approuvées par le Conseil de l'Université du Henan de la science et de la technologie d'examen institutionnel. Le consentement éclairé écrit a été obtenu pour tous les échantillons de patients. spécimens AGEJ humains (n = 43) et de patients appariés spécimens non-cancéreuses ont été obtenus chez des patients au premier hôpital affilié, Henan Université des sciences et de la technologie, avec le consentement éclairé de chaque patient. purification
ARN, la synthèse d'ADNc, et quantitative ARN-PCR en temps réel (qRT-PCR)
total de cellules cultivées a été extrait avec le réactif Trizol (Invitrogen, Carlsbad, CA, USA) selon le protocole et les ARN du fabricant ont été stockés à -80 ° C avant l'analyse qRT-PCR . expression Mature miR-645 a été détecté en utilisant un kit MIRVANA TM qRT-PCR miRNA détection (Ambion Inc. Austin, Texas), avec U6 comme témoin interne. IFIT2 expression a été détectée avec des amorces F: 5'AGCGAAGGTGTGCTTTGAGA 3 ', R: 5'GAGGGTCAATGGCGTTCTGA3' (la longueur du produit: 125 pb; Tf: 60 ° C; GC% F-50% de R-55%; start-end: 643-748 pb) et la GAPDH a été utilisée comme contrôle interne. Les produits de PCR ont été séparés sur un gel d'agarose à 1,5% de bromure d'éthidium et colorées visualisées avec UV.
la transfection des cellules humaines The miR-645 agomir duplex (400 nM) antagomir (400 nM) et un contrôle négatif ont été conçus et fourni par Ribobio (Guangzhou, Guangdong, Chine). Le plasmide-IFIT2 et les plamid témoins négatifs ont été achetés chez Ribobio Inc (Guangzhou, Guangdong, Chine)
miRNA prédiction cible
Pour trouver des gènes cibles miARN potentiels, site TargetScanHuman (http:. //Www. Targetscan. org /) a été utilisé, l'énergie libre de liaison a été calculée et les sites Biding ont été analysées en utilisant http:.... //bibiserv techfak uni-bielefeld de /site rnahybrid
constructions vectorielles et rapporteur de luciférase dosage
Pour construire IFIT2-3'UTR plasmide, un type sauvage fragment de IFIT2 ARNm humain 3'-UTR (1226 à 1233 nt, Genbank no. NM_001547.4) contenant la séquence de liaison miR-645 putatif a été amplifié par RT-PCR et clone dans le site entre Xho I et Not I en aval du gène rapporteur de la luciférase du vecteur psiCHECK ™ (Promega, USA). Un mutant du site de liaison unique miR-645 (5'AGCCTAG -3 'à 5'TCGGATC -3') dans l'extrémité 3 'UTR de IFIT2 a été inclus par mutagenèse dirigée Kit (SBS Genetech, Beijing, Chine ). Les types sauvages et mutantes de vecteurs pmirGLO-IFIT2-UTR ont été validés par le séquençage d'ADN
Les séquences de nucleotides d'amorces pour IFIT2-3'UTR (WT) clone.
IFIT2XhoIF2. 5'CCGCTCGAG AGAATAGAGATGTGGTGCCCACTAGGCTACTGCTG 3 '
IFIT2NotIR2: 5'ATAAGAATGCGGCCGC TTAAAATGGAATCAGTGACTTTTATTTCTCATAACAGAG 3 '
Les séquences nucléotidiques des amorces pour IFIT2-3'UTR (MT) clone:.
mutIFIT2F2: 5'TTCTAGGTAGATGCTGAATTCGGATCACATCAAAGTTGGTGTGAAC 3'.
mutIFIT2R2: 5'GTTCACACCAACTTTGATGTGATCCGAATTCAAGEJTCTACCTAGAA 3 ' .
les cellules ont été transfectées avec les miR-645 imite, NC et pmirGLO plasmide dans des plaques à 24 puits en utilisant lipofectamine ™ 2000 (Invitrogen) selon les instructions. 48 h plus tard, les cellules ont été récoltées et analysées pour l'activité de luciférase en utilisant le Dual-Luciferase Reporter Assay System (Promega, USA) et détectés par le système de détection GloMaxTM 20/20 (E5331, Promega).
Dosage de la caspase 7/3
l'activité de la caspase 3 et la caspase-7 a été détectée dans un format de 96 puits (2 x 10
3 cellules /puits) en utilisant la caspase-Glo 3/7 Assay (Promega) selon les instructions. 100 ul Caspase-Glo 3/7 réactif ont été complétées dans chaque puits et ensuite mis en incubation à température ambiante pendant 1 h follwong la luminescence a été détectée en utilisant le lecteur de microplaques à fluorescence M200 (Tecan). La luminescence de fond associée à la culture cellulaire et réactif de dosage (réaction en blanc) a été soustraite de la valeur expérimentale.
Test MTT
cellules ont été transfectées avec 100 nM miR-645 inhibiteur (Genepharma, Shanghai, Chine), imite (Ribobio Inc ., Guangzhou, Guangdong, Chine) ou 100 nM plamid-IFIT2 (Ribobio Inc., Chine). Vingt-quatre plus tard, les cellules ont été ensemencées dans des plaques à 96 puits (2 x 10 3 /puits). La viabilité des cellules a été examiné par MTT (3-2, 5-diphényl tétrazolium) d'essai (Sigma, USA) conformément aux instructions fournies à l'heure indiquée.
Western Blot de protéine totale à partir de cellules cultivées ont été lysées par un tampon de lyse contenant PMSF sur la glace. Puis la protéine a été soumis à une électrophorèse à travers des gels de SDS à 12% de Polyacrylamide et ont été ensuite transférées sur une membrane de PVDF (Millipore). Les membranes ont été bloquées avec 5% de lait écrémé en poudre à la température ambiante pendant 1 h et on fait incuber pendant une nuit avec des anticorps primaires. Les membranes ont été incubées avec des anticorps secondaires marqués à la HRP pendant 1 h à température ambiante, après trois lavages de 10 min dans du TBS-T (solution saline triethanolaminebuffered avec du Tween). Enfin, les signaux ont été détectés en utilisant le kit ECL (Pierce Biotech., Rockford, IL, USA) et les membranes ont été scannées et analysées à l'aide d'un + système d'imagerie Bio-Rad ChemiDoc XRS avec le logiciel d'imagerie (version quantité 1). L'expression des protéines a été étalonnée par rapport à une référence endogène (tubuline) et par rapport au témoin. La Spectra multicolore large gamme de protéines échelle (Fermentas) a été utilisé comme marqueur moléculaire. Tous les anticorps utilisés dans le test de Western blot sont répertoriés dans les fichiers supplémentaires 1: Tableau S1
immunohistochimie et immunohistochimique notation
sections paraffiniques, 4 um d'épaisseur, ont été cuits pendant 2 h à 65 ° C et déparaffinées.. La récupération d'antigène a été effectuée en utilisant un tampon de citrate de sodium (pH 7,2) à 95 ° C pendant 15 minutes, puis lames ont été refroidis à la température ambiante pendant 30 minutes. Après avoir été traité avec 3% de peroxyde d'hydrogène pendant 15 minutes pour bloquer la peroxydase endogène, les sections ont été traitées avec du sérum de chèvre normal confinement du liquide pendant 30 minutes pour réduire la liaison non spécifique, puis polyclonal de lapin anti-IFIT2 (1: 500, HPA003408, Sigma-Aldrich. Shanghai, Chine) a été incubé les sections pendant 12 h à 4 ° C. Après le réchauffement pendant 1 h et lavage pendant 5 heures, les coupes ont été incubées avec un anticorps secondaire pendant 30 minutes à température ambiante. Diaminobenzidine (DAB) a été utilisée pour les réactions de couleur. Après coloration immunohistochimique a été marqué comme décrit précédemment statistique analyse [40].
Les données ont été exprimées en moyenne ± écart-type de trois expériences indépendantes. Pour les tests statistiques, progiciel statistique SPSS, version17.0 (SPSS, Chicago, IL, USA) a été utilisé. t de l'étudiant
-test, une ANOVA et deux voies test ANOVA ont été réalisées pour la densité de bande relative de western blot et les valeurs OD MTT. La corrélation entre miR-645 et IFIT2 a été analysée avec Spearman corrélation. valeurs <P;. Résultats de 0,05 ont été considérées comme statistiquement significatives
Expressions de miR-645 sont régulés à la hausse dans les échantillons cliniques AGEJ
Pour évaluer le rôle de miR-645 dans la tumorigenèse de AGEJ, nous avons utilisé la première qRT - PCR pour mesurer l'expression de miR-645 de 43 tissus humains cliniques AGEJ, et a découvert que miR-645 était significativement régulée à la hausse dans les tissus cliniques AGEJ par rapport aux patients apparié gastriques tissus non cancéreux cardiaques (figure 1A). Pour obtenir de nouvelles informations sur l'observation mentionnée ci-dessus, nous avons examiné la relation entre l'expression de miR-645 et les patients des paramètres cliniques. L'analyse a montré que l'expression de miR-645 était sans rapport avec l'âge, le sexe, la différenciation de la tumeur, ganglion métastases et le stade TNM (tableau 1: La relation entre les paramètres cliniques et miR-645 expression dans le primaire gastrique du cardia adénocarcinome), mais était en corrélation positive avec la taille de la tumeur, à savoir, la taille de la tumeur supérieure ou égale à 5 cm de groupe a montré importante augmentation de miR-645 d'expression par rapport à la taille de la tumeur inférieure à 5 groupe cm (figure 1B & le tableau 1, t
-test, * P
= 0,045). Figure 1 Expressions de miR-645 sont régulée à la hausse dans les échantillons cliniques AGEJ. R. expression de miR-645 dans des échantillons cliniques 43 AGEJ humain par rapport aux tissus adjacents par paires humains normaux gastriques cardiaques non cancéreuses, a été mesurée par RT-PCR quantitative (Les valeurs indiquent la moyenne ± SEM, n = 3, t
-test, * p < 0,05, ** p < 0,01, *** p < 0,001). B. comparaison de l'expression relative de miR-645 dans des échantillons cliniques de AGEJ humaine de taille de la tumeur différente. (Deux-tailed t
-test, * p < 0,05).
Tableau 1 La relation entre les paramètres cliniques et l'expression de miR-645 dans le primaire gastrique cardia adénocarcinome
paramètres cliniques
N (%)
parents expression
valeur p
âge (années)
(± SEM moyenne) ≥ 60
15 (50)
2,1286 ± 0,59201
0,568
< 60
15 (50)
18 (60)
2,1111 ± 0,42783 de
1,9571 ± 0,52402
Sexe Homme 12 (40)
2.3333 ± 0,65328
Taille de 0,462
Femme
≥5
13 (43,3)
2,7385 ± 100128
0,004 *
< 5
17 (56,7)
1,8235 ± 1,52214
différenciation histologiques
Well (W)
15 (50)
2.138 ± 0,1866 0,9427
mal (P)
15 (50)
2.198 ± 0,1903
lymphatique métastase
Oui
12 (40)
2,4583 ± 0,77864
< 0,001 **
Pas
18 (60)
1,4944 ± 1,36273
stade TNM
phase I /II
16 (53,3)
2,9125 ± 1,33660
< 0,001 **
Stage III /IV
14 (46,7)
1,4857 ± 0,73991
(* p <
0,05; ** P <. Depletion
0,001) de miR-645 favorise l'apoptose des cellules cancéreuses gastriques
Pour étudier le rôle de miR-645 dans les caractéristiques phénotypiques de la progression AGEJ, nous avons utilisé deux cancer de l'estomac ( GC) des lignées cellulaires, SGC7901 et BGC-823 en tant que modèles cellulaires. résultats qRT-PCR ont montré que miR-645 expression était significativement régulée à la hausse par rapport à la lignée cellulaire de GC immortalisées, GES-1 (fichier supplémentaire 2: Figure S1, P
< 0,001).
SGC7901 et BGC-823 les cellules ont été transitoirement transfectées avec matures miR-645 imite, inhibiteur, mock transfectées, ou miR-NC. Comme on le voit sur la figure 2A et D, les résultats RT-PCR quantitative montrent que l'expression de Mir- 645 mimétiques ou des inhibiteurs sensiblement réguler à la hausse ou réguler à la baisse le niveau de miR-645, l'expression respectivement, et SGC7901 BGC-823 cellules de la première à la cinquième jour après transfection (Figure 2A, P
< 0,001; Figure 2D, P
< 0,001) par rapport à NC et des contrôles simulés. Figure 2 Épuisement de miR-645 favorise l'apoptose du cancer gastrique (GC) cellules. A & D. Le niveau de miR-645 a été mesurée par PCR quantitative en temps désigné (One-way ANOVA, les valeurs indiquent la moyenne ± écart type, la figure 2A, F = 426,588, P < 0,001; figure 2D, F = 685,026, P < 0,001). B & E. des cellules GC transfectées avec miR-645 mimétiques et un inhibiteur soumis à un test MTT par jour pendant 6 jours (à deux voies ANOVA, la figure 2B, F = 52.602, p < 0,001; figure 2E, F = 42,847, p < 0,001). C & F. cellules cellules GC transfectées avec miR-645 imite et l'inhibiteur ont été recueillies pour l'analyse FACS après 72 h (Les valeurs indiquent la moyenne ± écart-type, n = 3, One-way analyse ANOVA, la figure 2C-a, F = 121,600, p < 0,001; Figure 2C-b, F = 250,400, p < 0,001; Figure Fa, F = 194,815, p < 0,001; Figure 2F-b, F = 412,741, p < 0,001)
SGC7901 et BGC-. 823 cellules transfectées avec miR-645 d'inhibiteurs et mimétiques ont montré des niveaux significativement inférieurs et supérieurs de la prolifération cellulaire, respectivement, comparaison avec le CN ou des groupes fictifs, en présence de l'ADR (0,2 pg /ml), tel que déterminé par un dosage MTT (figure 2B, P
< 0,001; Figure 2F, P
< 0,001) le dosage Anniex Vapoptosis de exposa significative accrue et une diminution des taux d'apoptose de miR-645 et l'épuisement des groupes d'expression ectopiques par rapport aux groupes NC dans le sans sérum. état ou en présence de médicament anticancéreux, adriamycine (ADR) (figure 2C ab, P
< 0,001; Figure 2 F ab, P
< IFIT2 de 0,001). Est une cible de miR-645
données antérieures suggèrent que miR-645 pourrait être un oncogène du cancer de l'ovaire séreux avancé. Ainsi nous avons encore recherché les cibles potentielles de miR-645 par l'algorithme de la cible à analyser humain. Parmi eux, IFIT2, un suppresseur de tumeur, a été constaté que des sites de liaison putatifs miR-645 au sein de son 3'UTR (figure 3A). Ensuite, nous avons effectué un essai rapporteur luciférase en utilisant des cellules SGC7901 et BGC-823 pour vérifier si IFIT2 était une cible directe de miR-645. De type sauvage et mutant IFIT2-3'UTR contenant le site de liaison putatif de miR-645 ont été clonées dans psiCHECK-2 vecteur en aval du gène de la luciférase (fichier additionnel 3: Figure S2). L'introduction de miR-645 a réduit l'activité de lucirferase du vecteur rapporteur IFIT2 3'UTR de manière significative (figure 3B, P
< 0,001; Figure 3C, P
< 0,001), mais n'a pas affecté l'activité de lucirferase de le vecteur mutant rapporteur IFIT2 3'UTR, soutenant l'interaction directe de miR-645 avec IFIT2. Ces résultats suggèrent en outre que miR-645 peut supprimer l'expression IFIT2 en ciblant l'extrémité 3 'UTR de IFIT2 ARNm. Figure 3 Validation des sites de liaison prévus entre miR-645 et IFIT2. A. Le schéma montre la construction de Luc-IFIT2 3'UTR et Luc-IFIT2 3'Mut UTR. Les deux-Luc IFIT2 3'UTR et Luc-IFIT2 3'Mut UTR ont été clonées dans un plasmide pmirGLO en aval de la luciférase de luciole région codante entre les sites Pmel et Xbal. B & C. SGC7901 cellules (B) ou BGC-823 cellules (C) ont été co-transfectées avec les psiCHECK-2 constructions contenant soit IFIT2 3'UTR ou IFIT2 3'Mut UTR et soit l'inhibiteur miR-645 ou le miR-645 imite pour 48 h. Les valeurs indiquent l'activité relative de luciférase après la normalisation de l'activité de la luciférase de Renilla (Les valeurs indiquent la moyenne ± écart type, n = 3, One-way ANOVA, la figure 3B, F = 283,244, figure 3C, F = 143,313. *** P <. expression de 0,001) de miR-645 et IFIT2 sont liés négativement dans des échantillons cliniques AGEJ
Pour mieux évaluer la relation entre miR-645 et IFIT2, nous avons examiné l'expression IFIT2 dans 43 AGEJ échantillons cliniques utilisant qRT-PCR . Il a été constaté des tissus AGEJ avaient un niveau d'expression plus faible remarquable de IFIT2 que les tissus non cancéreux appariées (figure 4A), et l'expression IFIT2 était inversement corrélée avec la taille de la tumeur (figure 4B, P = 0,0304
). À savoir, la taille de la tumeur supérieure ou égale à 5 cm de groupe significatif a montré l'expression régulée à la baisse IFIT2 rapport à la taille de la tumeur inférieure à 5 cm de groupe. Pour valider les données, nous avons ensuite mesuré l'expression des protéines de IFIT2 utilisant western blot (figure 4C a-b), et les résultats ont montré une tendance similaire aux observations trouvés par qRT-PCR. test immunohistochimique a montré une importante diminution de l'expression de IFIT2 dans les tissus AGEJ appariés tissus non cancéreux (Figure 4D a-b, P <
0,001). Ensuite, nous avons analysé la relation entre miR-645 et IFIT2 expression et constaté que le niveau d'expression IFIT2 était négativement corrélée avec celle de miR-645 (Figure 4E, P <
0,01). En outre, les cellules SGC7901 (Figure 4F de a) et BGC-823 (Figure 4F de b) transfectées avec miR-645 inhibiteur ont augmenté de façon significative l'expression IFIT2 à la protéine et les taux d'ARNm par rapport aux groupes simulacres et NC (Figure 4F ab, P <
0,01). Nos résultats indiquent que miR-645 peut directement réguler l'expression de IFIT2. Figure 4: Expression de miR-645 et IFIT2 corrélation négative dans les échantillons cliniques AGEJ et IFIT2 a été régulée à la baisse dans les tissus AGEJ par rapport aux tissus non cancéreux appariés. A. Expression de IFIT2
et miR-645 dans des échantillons cliniques AGEJ ont été analysés par PCR quantitative. B. comparaison de l'expression relative de IFIT2
dans des échantillons cliniques de AGEJ humains de la taille des tumeurs différentes. (T
-test, * p < 0,05). C. Expression de IFIT2 examiné par western blot (a, b: les valeurs indiquent la moyenne ± écart-type, normalisé à la tubuline, n = 3, t
-test, *** p
< 0,001) D. une. Des images représentatives sont montrées coloration immunohistochimique positive de IFIT2 dans des échantillons de AGEJ et de tissus humains normaux adjacents appariés (grossissement 200 ×). b. scores Coloration de IFIT2 (t
-test, *** p
< 0,001). E. emplacements d'éparpillement montrant la corrélation linéaire négative entre l'expression de l'ARNm du IFIT2
et celui de miR-645 dans 43 AGEJ échantillons cliniques. L'expression de F. IFIT2 et IFIT2 mesurée par western blot en SGC7901 (a) et BGC-823 cellules (b). (Les valeurs indiquent la moyenne ± écart-type, n = 3, One-way ANOVA, p ***
< 0,001) de IFIT2 médie la fonction de miR-645 par la promotion SGC7901 et BGC-823 cellules. apoptose
Pour confirmer que l'induction de l'apoptose cellulaire dans SGC7901 et BGC-823 cellules par miR-645 a été médiée par ciblage IFIT2
, nous avons effectué le plasmide de transfection de IFIT2 dans SGC7901 (figure 5A) et BGC-823 (figure 5B) des cellules à réguler à la hausse l'expression de IFIT2. Western blot et PCR quantitative a montré que la régulation de IFIT2 par le plasmide de transfection IFIT2 pourrait être diminué de façon significative par miR-645 mimétiques. test MTT a montré que les cellules transfectées avec le plasmide-IFIT2 prolifération a été supprimée, cependant, les cellules transfectées avec miR-645 imite la prolifération ont sensiblement augmenté par rapport avec le plasmide de contrôle et de plasmide IFIT2 + miR-645 groupes (Figure 5C ab, P <
0,001). En outre, l'introduction de l'apoptose des IFIT2 promu SGC7901 et BGC-823 cellules et miR-645 mimétiques réduit l'apoptose des cellules induites par IFIT2 régulation à la hausse par rapport au groupe CN en présence d'ADR (figure 5E-F, P <
0,001). Nos résultats suggèrent que IFIT2 médiée la fonction de miR-645 dans l'inhibition de SGC7901 et BGC-823 prolifération des cellules et induire l'apoptose des cellules. La figure 5 IFIT2 médie la fonction de miR-645 en favorisant l'apoptose des cellules GC. A & B. Expression de IFIT2 examiné par western blot (A:. SGC7901; B, BGC-823 a, normalisé à la tubuline, les valeurs indiquent la moyenne ± écart-type, l'analyse One-Way ANOVA, pour SGC7901, F = 189,307, pour les BGC-823, F = 85,374; b, les valeurs indiquent la moyenne ± écart-type, One-Way ANOVA analyse, pour SGC7901, F = 85,374, pour BGC-823, F = 219,921; *** p
< 0,001). C. SGC7901 (a) et BGC-823 (b) des cellules soumises à MTT par jour pendant 6 jours (les valeurs indiquent la moyenne ± écart-type, à deux voies d'analyse ANOVA, pour SGC7901, F = 13,768, pour BGC-823, F = 16,409, p ***
< 0,001). D & E. SGC7901 (D) et BGC-823 (E), les cellules ont été recueillies pour l'analyse FACS après 72 h en présence de l'ADR (0,05 pg /ml) (les valeurs indiquent la moyenne ± écart-type, n = 3, One-Way ANOVA; pour SGC7901, F = 361,749, pour BGC-823, F = 229,952; *** p
. < 0,001)
déplétion et la régulation de miR-645 modifié l'activité de la caspase-3/7
IFIT2 a été rapporté comme un gène suppresseur de tumeur par l'intermédiaire de la médiation de l'apoptose cellulaire par l'activation de l'activité de la caspase 3/7. Caspase-Glo 7/3 essai a montré que miR-645 déplétion significativement régulée à la hausse, tandis que miR-645 surexpression aval régulé l'activité de la caspase 7/3 par rapport aux groupes fictifs et NF en présence de l'ADR (0,2 pg /ml) (figure 6A et B, P <
0,001) ou l'état de privation de sérum (Figure 6C et D, P <
0,001). Ces résultats combinés aux observations indiquées ci-dessus suggèrent que miR-645, régulée à la hausse dans les tissus AGEJ humains, l'apoptose cellulaire inhibée et favorise la tumorigénicité via la suppression de la caspase-3/7 activité en ciblant IFIT2. La figure 6 caspase 3/7 activité. capacité anti-apoptotique des cellules SGC7901 et BGC-823 cellules après l'exposition à l'ADR (0,2 pg /ml) ou privation de sérum a été évaluée par l'activité des caspases-3/7. A & C, SGC7901 cellules; B & D, BGC-823 cellules. (Les valeurs indiquent la moyenne ± écart-type, n = 3, One-Way ANOVA analyse; A, F = 183,930, B, F = 1,093,797; C, F = 1861,50, D, F = 1483,604, *** Discussion et conclusions de 0,001)
Bien que l'accumulation de preuves ont montré que la déréglementation miARN est impliqué dans la carcinogenèse de la tumeur, la progression, la migration et l'invasion [41], les métastases [42, 43] et la multirésistance; p <
. [44-46]. On connaît peu le rôle des miARN dans le développement de adencarcinoma de jonction oesophagienne gastrique (AGEJ). Ici, nous avons montré que cette miR-645 l'expression est significativement augmentée dans les échantillons cliniques AGEJ par rapport aux tissus non cancéreux par paires et a été variante significativement régulée à la hausse dans les deux cancer gastrique (CG) des lignées cellulaires, SGC7901 et BGC-823, qui ont été utilisés modèles cellulaires, car aucune des lignées cellulaires AGEJ disponibles ont été établis à ce jour. L'inhibition de miR-645 en SGC7901 et BGC-823 cellules induit de manière significative l'apoptose des cellules SGC7901 et BGC-823 dans l'état de privation de sérum ou d'un médicament chimiothérapeutique par up-régulation IFIT2,
un médiateur de l'apoptose, avec un site de liaison potentiel pour miR-645 en 3'UTR de son ARNm. Le profil d'expression de miR-645 et IFIT2 dans SGC7901 et BGC-823 cellules et des échantillons cliniques ont été négativement corrélés, suggérant en outre que IFIT2
est un gène cible de miR-645. En outre, l'inhibition de miR-645 conduit à une augmentation de la caspase-07.03 activité, qui est activé par IFIT2. Tous ces résultats suggèrent un rôle fondamental de miR-645 dans la carcinogenèse, en particulier dans le développement de AGEJ.
Trop peu l'apoptose est une cause essentielle de la cancérogenèse, car les cellules malignes sont la mort remarquablement réduite [47, 48], ce qui entraîne une transformation maligne des cellules affectées, des métastases tumorales et la multirésistance des cellules cancéreuses. Par conséquent, l'apoptose est d'une grande importance dans le traitement du cancer et est une cible populaire de nombreuses stratégies de traitement. Dans cette étude, nous avons montré que miR-645 cellules cancéreuses ayant une déficience au sérum apoptose induite par la privation, alors que l'épuisement des miR-645 antagonise cet effet de miR-645, ce qui suggère que miR-645 peut jouer un rôle crucial dans l'adaptation du cancer cellules à faible nutrition. Un nombre croissant de miARN ont été impliqués dans l'apoptose des cellules cancéreuses. D'une part, les micro-ARN peuvent fonctionner en tant que suppresseur de tumeur via l'induction de l'apoptose, à savoir miR-421, qui induit la prolifération cellulaire et la résistance à l'apoptose dans le carcinome nasopharyngé humain via la régulation négative de FOXO4 [49]; miR-149, qui induit l'apoptose en inhibant Akt1 et E2F1 dans des cellules cancéreuses humaines [50] et miARN-31, ce qui induit l'apoptose dans les cellules de neuroblastome humain [51]. D'autre part, les micro-ARN peut fonctionner comme oncogènes en supprimant l'apoptose, à savoir miR-24, qui inhibe l'apoptose et refoule Bim dans les cardiomyocytes de souris [52]; miR-886-5p, qui inhibe l'apoptose par régulation de Bax expression dans des cellules de carcinome cervical humain [53], et miR-183, qui inhibe l'apoptose de TGF-β1 induit par la régulation négative de l'expression PDCD4 dans les cellules de carcinome hépatocellulaire humain [54] .
ISGs, IFN stimulés gènes, se référer à des gènes qui sont tanscribed par interférons induction. Parmi eux, 4 peuvent jouer des rôles importants qui affectent à la fois l'inhibition de la réplication virale et l'inhibition de la prolifération cellulaire [55, 56]. Tous les auteurs ont lu et approuvé le manuscrit final.
 De nombreux enfants autistes ont d'autres problèmes de santé, selon une étude
De nombreux enfants autistes ont d'autres problèmes de santé, selon une étude
 Pourquoi la santé intestinale revient-elle si souvent dans les conversations ?
Pourquoi la santé intestinale revient-elle si souvent dans les conversations ?
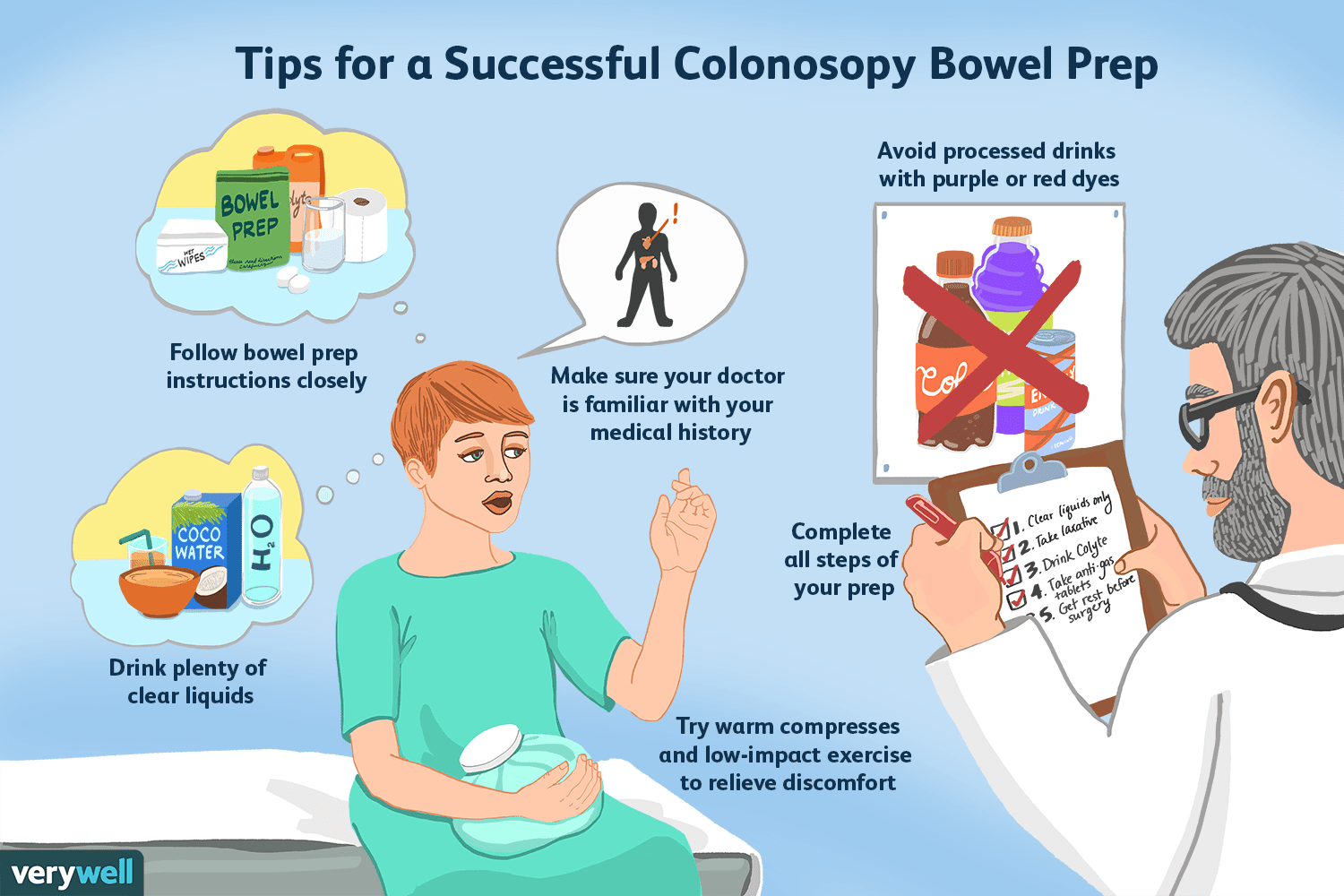 Comment savoir quand la préparation intestinale est terminée
Comment savoir quand la préparation intestinale est terminée
 Perfectus Biomed exposera à la conférence IPS à Liverpool
Perfectus Biomed exposera à la conférence IPS à Liverpool
 Signalement des prédicteurs moléculaires potentiels de la réponse aux thérapies biologiques dans la colite ulcéreuse
Signalement des prédicteurs moléculaires potentiels de la réponse aux thérapies biologiques dans la colite ulcéreuse
 Quel est le but d'une vagotomie ?
Quel est le but d'une vagotomie ?
 Remèdes naturels pour l'hypochlorhydrie et l'achlorhydrie
Lhypochlorhydrie et lachlorhydrie sont des conditions dans lesquelles la production dacide chlorhydrique dans les sucs digestifs de lestomac est respectivement faible ou absente. Lacide chlorhydrique
Remèdes naturels pour l'hypochlorhydrie et l'achlorhydrie
Lhypochlorhydrie et lachlorhydrie sont des conditions dans lesquelles la production dacide chlorhydrique dans les sucs digestifs de lestomac est respectivement faible ou absente. Lacide chlorhydrique
 La génétique peut influencer la composition du microbiome plus que les facteurs environnementaux
Des chercheurs qui étudient les souris au Technion-Israel Institute of Technology ont découvert que le microbiome est beaucoup plus influencé par la génétique que par lenvironnement de naissance de la
La génétique peut influencer la composition du microbiome plus que les facteurs environnementaux
Des chercheurs qui étudient les souris au Technion-Israel Institute of Technology ont découvert que le microbiome est beaucoup plus influencé par la génétique que par lenvironnement de naissance de la
 Quatre choses qui causent des douleurs à l'estomac | Arshad Malik, MD
Tout le monde ressent une douleur à lestomac de temps en temps, que ce soit en consommant quelque chose que votre corps naime pas ou en ayant des crampes menstruelles (chez les femmes). Mais si vous r
Quatre choses qui causent des douleurs à l'estomac | Arshad Malik, MD
Tout le monde ressent une douleur à lestomac de temps en temps, que ce soit en consommant quelque chose que votre corps naime pas ou en ayant des crampes menstruelles (chez les femmes). Mais si vous r