Istraživači Jeffrey Singer i Casey Weaver kažu, "Naši nalazi nude mogućnost racionalnog osmišljavanja i testiranja učinkovitih probiotičkih terapija za zaštitu nedonoščadi u riziku."
Infekcije koje se jave 3 ili više dana nakon rođenja označene su kao kasna sepsa. Znanstvenici su zaključili da se kasna pojava sepse često potiče hiperproliferacijom jedne vrste unutar crijeva. Ta se pojava naziva neonatalna disbioza. Kada se to dogodi, često dolazi do kasne sepse. Klinički rad koji pokazuje ovaj nalaz sada je potvrđen nalazima ove studije.
Znanstvenici kažu, "Naš bi model trebao pomoći u definiranju mehanizama pomoću kojih pionirske vrste mikrobioma u razvoju novorođenčadi sprječavaju ili ne uspijevaju spriječiti disbiozu koja predisponira LOS."
Trenutna studija koristila je miševe jer novorođeni miševi imaju crijeva koja se još uvijek razvijaju pri rođenju i nedugo nakon toga. To ih čini usporedivijima s nezrelim crijevima kod vrlo nedonoščadi.
Znanstvenici su koristili novorođena štenad izložena soju bakterije koji izaziva bolesti Klebsiella pneumoniae Kp-43816, koja im je umetnuta u nezrele želuce. Ti su mikrobi projektirani da nose biomolekule koje su luminiscentne. Kao rezultat, jasno se može vidjeti položaj bakterijskih izraslina unutar crijeva živih životinja. Štoviše, lako je pratiti njihovo širenje iz crijeva kako bi prodrlo u ostatak tijela. Bioluminiscencija je idealna za ovaj zadatak jer je vidljiva čak i kada je prekrivena gotovo jednim čvrstim centimetrom tkiva.
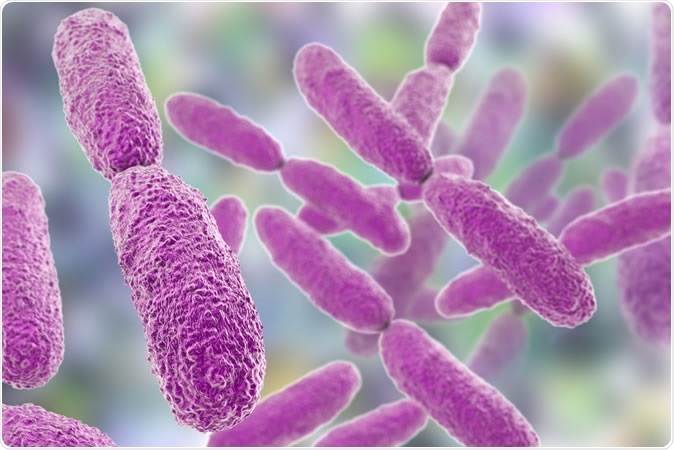 Bakterija Klebsiella, 3D ilustracija Zasluge:Kateryna Kon / Shutterstock
Bakterija Klebsiella, 3D ilustracija Zasluge:Kateryna Kon / Shutterstock Umetnuli su patogeni soj u dozi koja bi ubila 50% životinja u roku od 10 dana. U ovoj dozi, vidjeli su kako Klebsiella preselio iz crijeva upravo na onim mjestima gdje je formirao najgušće izrasline ili kolonije. U isto vrijeme, disbioza nije bila univerzalno povezana sa sepsom. To je povezano s ljudskom nedonoščadi, od kojih svi ne razviju kasnu sepsu.
Sljedeći korak bio je postavljanje soja iste bakterije koji ne uzrokuje bolesti, naime, Kp-39, u želudac novorođenog miša. U ovom trenutku istraživači su bili zapanjeni kad su vidjeli kako ovaj soj ne izaziva bolest, očekivano, ali je utvrđeno da su se pomaknuli iz crijeva u trbuh. Također je uzrokovao infekcije jetre ili mezenterija, vaskularna stabljika koja povezuje trbušne krvne žile s ostatkom tijela. Tijekom 9 dana, mladunci su očistili bakterije iz tijela.
Istraživači smatraju da dok oboje Klebsiella sojevi mogu migrirati kroz crijevnu stijenku, postoje jasne razlike u načinu na koji imunološki sustav domaćina uklanja te mikrobe iz tijela nakon što izvrši ovaj korak. Ova razlika se zadržala kada su sojevi ubrizgani ravno u peritoneum, tako da nisu morali migrirati iz lumena crijeva.
U slučaju peritonealne injekcije s Kp-43816, svi novorođeni miševi uginuli su u roku od 24 sata. Međutim, kada je korišten Kp-39, niti jedno štene miša nije uginulo, a bakterija se iz organizma očistila u roku od tjedan dana. Kapsularne varijacije između ovih sojeva pokazale su istraživačima da se kapsula oko virulentnijeg soja opirala djelovanju imunoloških stanica u hvatanju i uklanjanju ovih bakterija. Kao rezultat, uspjeli su uspješno zaraziti gnoj, za razliku od Kp-39.
Kao rezultat ovog eksperimenta, znanstvenici su uspjeli razlikovati i pratiti dva različita događaja:dok soj Kp-43816 slijedi put koji odražava kasnu sepsu nastalu kao posljedica disbioze u novorođenčadi, Kp-39 dopušta razvoj disbioze bez sepse ili smrti, što bi pokvarilo sliku.
Oni su nastavili ovo istraživanje promjenom sastava crijevnog mikrobioma kod mladunaca miša. Otkrili su da mogu promijeniti razinu osjetljivosti na crijevnu disbiozu i kasnu sepsu. Već je poznato da je normalan ili zdrav crijevni mikrobiom ključan u sprječavanju kolonizacije i invazije patogena. Kada populacija mladunaca miša bez klica, kojima nedostaje crijevni mikrobiom, bio izložen Kp-43816, svi su bili podjednako zaraženi bakterijom, što rezultira kasnom pojavom sepse.
Idući dalje, istraživači su sada davali antibiotike trudnim miševima od jednog dana prije poroda do nekoliko dana nakon toga, nakon čega Klebsiella uvedena je infekcija virulentnim sojem. Davana su dva različita antibiotika, naime, gentamicin i vankomicin. Budući da se oboje vrlo malo apsorbira, mala je vjerojatnost da će prisutnost antibiotika biti značajna kod miševa. Međutim, crijevna bakterijska populacija majke promijenila bi se na mnogo načina. Zauzvrat, to će značiti da su mladunci nakon rođenja izloženi drugoj vrsti crijevnog mikrobioma i da će razviti ovu vrstu mikrobioma.
Dogodilo se da su mladunci majki na gentamicinu bili vrlo skloni infekciji, ali ne i majke majki liječenih vankomicinom, u usporedbi s kontrolama. Ponavljanje pokusa s avirulentnim sojem Kp-39 rezultiralo je nultom smrtnošću, ali veća disbioza kod mladunaca gentamicina u usporedbi sa štencima vankomicina.
Sojevi Lactobacillus bili su prisutniji u crijevnoj flori mladunčadi vankomicina u odnosu na mladunce gentamicina. Tako, čini se da je Lactobacillus brojevi koreliraju s povećanom ili smanjenom ranjivošću na nastanak disbioze i kasnu sepsu u novorođenčadi.
DNK sekvenciranje radi identifikacije bakterija koje su dominirale crijevnim mikrobiomom to je pokazalo Lactobacillus murinus bio je prevladavajući u štenaca rođenih od majke na vankomicinu. Međutim, s gentamicinom, ovaj soj je bio gotovo odsutan kod mladunaca.
Još jedan intrigantan nalaz bio je to L. murinus osjetljiv je na djelovanje gentamicina, ali otporan na djelovanje vankomicina. Uklanjanje ove zaštitne i korisne vrste primjenom gentamicina otvorilo je put disbiozi kod novorođenčadi, blokiranjem prolaska ove 'dobre' bakterije iz majčinog crijeva u crijevo mladunaca.
Da bi potvrdili ove nalaze, istraživači sada upravljaju L. murinus štencima rođenim od majki liječenih gentamicinom, prije izlaganja ovih štenaca Kp-39. Učestalost disbioze naglo se smanjila u ovoj skupini u usporedbi s kontrolom. U drugom skupu eksperimentalnih miševa, također su otkrili da soj Escherichia coli (E. coli) bakterije koje se koriste u probioticima također mogu pružiti sličnu zaštitu ovoj skupini mladunaca, ali je ista radnja izostala kada je testirano nekoliko drugih uobičajenih sojeva Lactobacillus koji se koriste u probioticima.
Studija je također otkrila da su vrlo mladi štenci nalik na nedonoščad jer su fakultativni anerobi dominirali u njihovom crijevnom okruženju. Ove bakterije pripadaju različitim sojevima, ali su slične po tome što mogu živjeti i rasti sa ili bez kisika. To je karakteristično za crijeva vrlo nezrelih mladunaca i beba.
Rastom i sazrijevanjem, sastav mikrobioma se mijenja sve dok se ne usporedi s onom starijih ili nedonoščadi, s pretežno obligatnim anerobima. Ove bakterije rastu samo ako nema kisika i umiru u prisutnosti kisika. Stariji štenci koji su imali ovu vrstu zrelog mikrobioma nisu razvili neonatalnu disbiozu.
Tako, čini se da kada je kisik prisutan u crijevima novorođenih miševa, inhibirani su obligatni anerobi, dopuštajući rast drugih vrsta. To je možda razlog zašto se disbioza češće javlja kod vrlo male dojenčadi.
Autori zaključuju da su neke normalne bakterijske vrste bitne i odgovarajuće za sprječavanje prekomjernog rasta patogenih vrsta u crijevima novorođenčeta, i tako inhibiraju kasnu pojavu sepse kao posljedice disbioze. Istraživači Singer i Casey Weaver kažu, "Oni pružaju osnovu za razumijevanje zašto su neki probiotici zaštitni, dok drugi nisu. To može imati važne implikacije na kliničku praksu, gdje i majčinski i neonatalni antibiotici mogu promijeniti neobiološki mikrobiom, i gdje se dojenčadi s vrlo niskom tjelesnom težinom daju probiotici bez jasnih dokaza o preferiranim vrstama probiotika. "
 Samo naprijed,
Jedite kameru - endoskopija kapsule Kad god se uhvati veliki bijeli morski pas i smatra se da je stajao iza napada, ribi se razreže želudac. Sve vrste stvari obično izlaze iz želuca, uključujući hrpu
Samo naprijed,
Jedite kameru - endoskopija kapsule Kad god se uhvati veliki bijeli morski pas i smatra se da je stajao iza napada, ribi se razreže želudac. Sve vrste stvari obično izlaze iz želuca, uključujući hrpu
 Torzija cekuma - Dijagnoza akutnog abdomena
Osim torzija, u ovom odjelu crijevnog puta još i drugi uočeni su oblici neprohodnosti koji proizlaze iz raznih ekscesa slijepih i uzlaznih crijeva koji se kombiniraju s torzijama, ekscesima, zastavama
Torzija cekuma - Dijagnoza akutnog abdomena
Osim torzija, u ovom odjelu crijevnog puta još i drugi uočeni su oblici neprohodnosti koji proizlaze iz raznih ekscesa slijepih i uzlaznih crijeva koji se kombiniraju s torzijama, ekscesima, zastavama
 Vrištiš li na sladoled?
Tijekom Nacionalnog mjeseca sladoleda, ne vrište svi ZA sladoledom. Netolerancija na laktozu, probavni poremećaj koji se može pojaviti u bilo kojoj dobi1 , pogađa oko 25 posto SAD-a i 75 posto svjetsk
Vrištiš li na sladoled?
Tijekom Nacionalnog mjeseca sladoleda, ne vrište svi ZA sladoledom. Netolerancija na laktozu, probavni poremećaj koji se može pojaviti u bilo kojoj dobi1 , pogađa oko 25 posto SAD-a i 75 posto svjetsk