Tanulmányuk címe:„A tiopurinok aktiválnak egy vírusellenes, kibontott fehérjeválaszt, amely gátolja a vírus glikoprotein felhalmozódását a sejttenyészet fertőzési modelljében, ”Megjelent az interneten előnyomtatásként az oldalon bioRxiv* .
A kutatók kifejtették, hogy a burkolt vírusok, például a koronavírus, olyan genetikai anyaggal rendelkeznek, amely képes kódolni azokat a membránfehérjéket, amelyek szintetizálhatók és módosíthatók az endoplazmatikus retikulumban (ER), mielőtt a virion részeinek összeszerelési területeire szállíthatók.
Ha az ER fehérje hajtogatási képességét túl sok virion részecske borítja fel, a kihajtott fehérjék túlterheltek az ER -ben. Ez kihajtott fehérjeválaszt (UPR) vált ki. Ez aktiválja a transzkripciós faktor-6-ot (ATF6), inozit, amely enzim-1-t (IRE1) és PKR-szerű endoplazmatikus retikulum-kinázt (PERK) igényel. Ezek érzékelhetik, hogy az ER stressz alatt van, és így létrejön az alapvető leucin cipzár (bZIP) transzkripciós faktorok szintézise.
Amint az UPR aktiválódik, az ER fehérjehajtogató képessége megnő. Ez is kiváltja az ER-hez kapcsolódó degradációt (ERAD). Minden nem megfelelően összehajtogatott fehérje kivezetődik az ER -ből, és a 26S proteaszóma révén lebomlik.
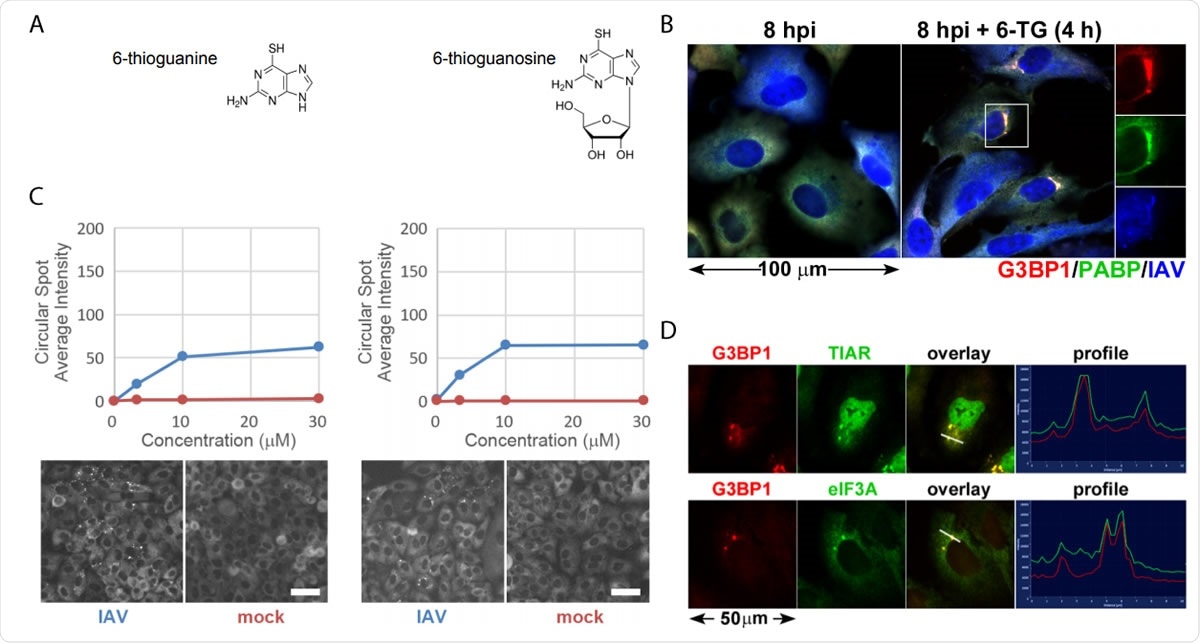 A 6-TG és 6-TGo tiopurin-analógok szelektíven stressz granulátumokat indukálnak az IAV-fertőzött sejtekben. (A) A képernyőn azonosított kis molekulák szerkezeti diagramjai. (B) Az EGFP-G3BP gócok képződésének számszerűsítése IAV-Udorn fertőzött (kék) vagy ál (vörös) fertőzött sejtekben, amelyeket növekvő 6-TG és 6-TGo dózisokkal kezeltek (felül), és a kezelt sejtek EGFP-csatornájának reprezentatív cellomikai képei 30 µM 6-TG-vel és 6-TGo-val (alul). 4 LE -vel, a sejteket 0 -val kezeltük, 1, 10 és 30 uM tiopurin-analóg dózis 6-tioguanin (6-TG) vagy 6-tioguanozin (6-TGo). 8 hpi -nál, A sejteket Hoeschst 33342 -gyel rögzítettük és festettük. Az automatikus képfelvételt Cellomics Arrayscan VTI HCS olvasóval végeztük. Minden egyes lyukhoz 15 képet készítettünk, és kiszámítottuk az átlagos pontszerű EGFP-G3BP1 intenzitást. (C) Az A549 sejteket IAV-CA/07-vel fertőztük MOI 1-nél. 4 hpi, a sejteket 6-TG-vel vagy ál-kezelték. 8 hpi -nál, a sejteket fixáltuk és immunfestéssel végeztük a G3BP1 (piros) stressz granulátum marker fehérjékre irányuló antitestekkel, PABP (zöld) és poliklonális IAV antitest (kék), amely kimutatja az antigéneket az NP -ből, M1, és HA, majd Alexa-konjugált másodlagos antitestekkel történő festést követ. (D) A549 sejteket IAV-CA/07-gyel fertőztünk 1-es MOI-val. 4 hpi, a sejteket 6-TG-vel (10 µM) kezeltük. 8 hpi -nál, a sejteket fixáltuk és immunfestéssel végeztük a G3BP1 (piros) stressz granulátum marker fehérjékre irányuló antitestekkel, TIAR (zöld) és eIF3A (zöld), majd Alexa-konjugált másodlagos antitestekkel történő festést követ. A képek Zeiss Axioimager Z2 fluoreszkáló mikroszkóppal készültek. Reprezentatív képek láthatók. A skála 20 µm.
A 6-TG és 6-TGo tiopurin-analógok szelektíven stressz granulátumokat indukálnak az IAV-fertőzött sejtekben. (A) A képernyőn azonosított kis molekulák szerkezeti diagramjai. (B) Az EGFP-G3BP gócok képződésének számszerűsítése IAV-Udorn fertőzött (kék) vagy ál (vörös) fertőzött sejtekben, amelyeket növekvő 6-TG és 6-TGo dózisokkal kezeltek (felül), és a kezelt sejtek EGFP-csatornájának reprezentatív cellomikai képei 30 µM 6-TG-vel és 6-TGo-val (alul). 4 LE -vel, a sejteket 0 -val kezeltük, 1, 10 és 30 uM tiopurin-analóg dózis 6-tioguanin (6-TG) vagy 6-tioguanozin (6-TGo). 8 hpi -nál, A sejteket Hoeschst 33342 -gyel rögzítettük és festettük. Az automatikus képfelvételt Cellomics Arrayscan VTI HCS olvasóval végeztük. Minden egyes lyukhoz 15 képet készítettünk, és kiszámítottuk az átlagos pontszerű EGFP-G3BP1 intenzitást. (C) Az A549 sejteket IAV-CA/07-vel fertőztük MOI 1-nél. 4 hpi, a sejteket 6-TG-vel vagy ál-kezelték. 8 hpi -nál, a sejteket fixáltuk és immunfestéssel végeztük a G3BP1 (piros) stressz granulátum marker fehérjékre irányuló antitestekkel, PABP (zöld) és poliklonális IAV antitest (kék), amely kimutatja az antigéneket az NP -ből, M1, és HA, majd Alexa-konjugált másodlagos antitestekkel történő festést követ. (D) A549 sejteket IAV-CA/07-gyel fertőztünk 1-es MOI-val. 4 hpi, a sejteket 6-TG-vel (10 µM) kezeltük. 8 hpi -nál, a sejteket fixáltuk és immunfestéssel végeztük a G3BP1 (piros) stressz granulátum marker fehérjékre irányuló antitestekkel, TIAR (zöld) és eIF3A (zöld), majd Alexa-konjugált másodlagos antitestekkel történő festést követ. A képek Zeiss Axioimager Z2 fluoreszkáló mikroszkóppal készültek. Reprezentatív képek láthatók. A skála 20 µm. Amikor a vírus részecske behatol egy sejtbe, igyekszik gyorsan utánozni, és ez megterheli az ER -t. A vírus olyan glikoprotein -sorozatokat bocsát ki, amelyek túlterhelik az ER -t. A vírus, azonban, képes megkerülni az UPR -t, és elősegíti a hatékony replikációt.
Az IAV három integrált membránfehérjét kódolhat:hemagglutinin (HA), neuraminidáz (NA), és mátrixfehérje 2 (M2). Míg az IAV replikáció az UPR szelektív aktiválását okozza, specifikus mechanizmusok aktiválhatják az UPR -t, de ezt megkerülve elősegítik a hatékony vírusreplikációt. A csapat elmagyarázza, hogy az NA és M2 fehérjék UPR -re gyakorolt hatása nem egyértelmű, de a HA elősegítheti az UPR -t.
Számos koronavírus (CoV) aktiválhatja az UPR -t. Ide tartozik a „fertőző hörghurut vírus (IBV)”, egér hepatitisz vírus (MHV), fertőző gasztroenteritis vírus (TGEV), emberi koronavírus (HCoV) -OC43, és SARS-CoV-1. ” Az egész genetikai szekvencia, azonban, nem reagál hasonlóan a CoV replikációra.
A csapat két FDA által jóváhagyott tiopurin-analógot azonosított:„6-tioguanin (6-TG) és 6-tioguanozin (6-TGo)”. Úgy találták, hogy blokkolják az IAV és a HCoV-OC43 replikációt, amikor dózisukat fokozatosan növelik.
A Pateamine A -t és a Silvestrol -t korábban már tesztelték. Ez a két tiopurin, azonban, Megállapították, hogy megzavarják a vírusos glikoproteinek felhalmozódásának folyamatát, amelyek aktiválhatják az UPR -t. A 6-TG-vel kezelt sejtekben a vírus glikoprotein szintézise részben helyreállítható az UPR kémiai gátlásával.
A CoV Spike (S) fehérjék, amelyek a vírus felszínén expresszálódnak, UPR aktivációt mutattak. Az új koronavírus S-fehérje vagy a SARS-CoV-2 S szintén UPR aktivációt okozott. A 6-TG gátolta a teljes hosszúságú S0 vagy a furinnal hasított S2 fúziós fehérjék felhalmozódását, - jegyezték meg. Nem befolyásolta az S1 ektodomént. A 6-TG UPR-t indukálhat, amely felgyorsítja a membránhoz rögzített S0 és S2 glikoproteinek ERAD-mediált forgalmát, a csapat megtalálta.
A kutatók kísérleteztek és megállapították, hogy egy kémiailag hasonló vegyület, a tiopurin 6-merkaptopurin (6-MP) kevés hatással volt az UPR-re, és nem befolyásolta az IAV HCoV-OC43 replikációját.
Elgondolkodva a 6-TG és 6-TGo tiopurin vegyületek UPR indukciójának mechanizmusán, a csapat azt írta, hogy ezeket a hatásokat valószínűleg nem a 6-TG DNS vagy RNS beépülése közvetíti több ok miatt. Az első ok az, hogy a vírusreplikációhoz kapcsolódó stressz nem indukálja kifejezetten az UPR -t. A második ok az, hogy a vírusfehérjék között a glikoproteinek felhalmozódása és feldolgozása szelektíven megszakadt. A harmadik ok az volt, hogy az IAV HA és NA hírvivő RNS szintjét nem befolyásolta jelentősen. 6 MP, másrészről, 6-tioguanozin-trifoszfáttá alakítható, de nem indukálta az UPR-t, és nem volt hatással az IAV glikoproteinekre vagy az OC43 replikációra.
A csapat azt írta, hogy adataikból kiderül, hogy „az UPR-indukáló molekulák hatékony gazdaszervezetre irányuló vírusellenes szerek lehetnek olyan vírusok ellen, amelyek az ER folyamatoktól függnek a hatékony replikáció támogatása érdekében.” Az UPR 6-TG és 6-TGo általi indukciója tehát új módszer lehet, amellyel a vírusellenes mechanizmust maga a gazdasejt válthatja ki. Ez egy korábban fel nem ismert egyedi cselekvési mechanizmus volt, - írta a csapat.
Zárásként azt írták, "... ezek az adatok azt mutatják, hogy a 6-TG és a 6-TGo hatékony, gazdaszervezetre irányuló vírusellenes szerek, amelyek kiváltják az UPR-t és megzavarják a vírusos glikoproteinek felhalmozódását."
A medRxiv előzetes tudományos jelentéseket tesz közzé, amelyeket nem vizsgálnak felül, és ezért, nem tekinthető döntőnek, irányítja a klinikai gyakorlatot/az egészséggel kapcsolatos viselkedést, vagy megállapított információként kezelik.
 Mi az a SIBO?
Mi is pontosan a vékonybélben a baktériumok túlszaporodása? Leegyszerűsítve, a vékonybél bakteriális túlszaporodása (SIBO) a normál baktériumok túlszaporodása a vékonybélben. Nem kórokozó baktériumok
Mi az a SIBO?
Mi is pontosan a vékonybélben a baktériumok túlszaporodása? Leegyszerűsítve, a vékonybél bakteriális túlszaporodása (SIBO) a normál baktériumok túlszaporodása a vékonybélben. Nem kórokozó baktériumok
 A betegeknek figyelniük kell a vastagbélműtét utáni problémákra
Rákellenes hírek Nem kell dohányosnak lenned ahhoz, hogy tüdőrákot kapj A tüdőrák okozta betegségek általános csökkenése terén elért haladás Immunalapú gyógyszerek küzdenek az endometriumrák ellen A
A betegeknek figyelniük kell a vastagbélműtét utáni problémákra
Rákellenes hírek Nem kell dohányosnak lenned ahhoz, hogy tüdőrákot kapj A tüdőrák okozta betegségek általános csökkenése terén elért haladás Immunalapú gyógyszerek küzdenek az endometriumrák ellen A
 Hasnyálmirigyrák
Milyen tényeket kell tudnom a hasnyálmirigyrákról? Az iStock képe egy hasnyálmirigyrákos férfiról A hasüregben található hasnyálmirigynek endokrin (hormonális) és exokrin (emésztési) funkciójú sejtj
Hasnyálmirigyrák
Milyen tényeket kell tudnom a hasnyálmirigyrákról? Az iStock képe egy hasnyálmirigyrákos férfiról A hasüregben található hasnyálmirigynek endokrin (hormonális) és exokrin (emésztési) funkciójú sejtj