22 évig, Kibow ® a vesekegészségügyi étrend -kiegészítő termékek kutatására és fejlesztésére összpontosított, amelyek a BOWel (innen a KIBOW elnevezés) mikrobiomjának felhasználásával a káros KIdney -funkció kiegyenlítésére szolgálnak. Ez a nagyon bélspecifikus és szelektív probiotikumok és prebiotikumok tulajdonságain alapul számos bélmoduláló alkalmazáshoz. Kibow ® jól ismert Renadyl ™ (pre-/probiotikum a vesék egészségére) zászlóshajója, Kibow Fortis ® (többrostos a wellness számára), Kibow Flora ™ (probiotikum az immunrendszer egészségére) az emberek számára, és Azodyl ™, kifejezetten macskáknak és kutyáknak tervezett állatgyógyászati veseelégtelenség elleni termék (2006 júliusa óta kizárólag a Vetoquinol USA engedélye). A vállalat új szervfunkciót célzó étrend-kiegészítő termékek kifejlesztését is vizsgálja, és így a következő évben bővíti termékportfólióját.
A jelenleg forgalmazott Kibow ® embereknek és háziállatoknak szánt kiegészítőket az USA FDA étrend -kiegészítőknek minősítette. Bár a termékeket két évtizede fejlesztették ki Pharma-szerű érvényesítéssel (https://kibowbiotech.com/rd/) (https://kibowbiotech.com/journal-publications/), e termékek lehetséges felhasználását az amerikai FDA/FTC előírások korlátozzák, mivel nem lehet egészségügyi vagy betegségkezelési állításokat benyújtani. Is, ezeket a termékeket, étrend -kiegészítőként, nem jogosultak orvosi költségtérítésre. Tekintettel ezekre a korlátokra és a vágyra, hogy több krónikus vesebeteget érjünk el és segítsünk, Kibow ® kifejlesztett egy újabb és fejlettebb élő bioterápiás (LBP) készítményt, amely tudományosan fejlett, mint az USA FDA által jóváhagyott és klinikailag validált gyógyszerkészítménye.
Mivel a probiotikumok élő mikrobák, ez az új termék a Biológiai Értékelési Kutatóközpont (CBER) és az USA FDA előírásai szerint az Élő Bioterápiás Termék (LBP) gyógyszerek alá tartozik. Ez lesz az első LBP gyógyszer a CKD betegek számára az Egyesült Államokban, és orvosi visszatérítésre jogosult. A vállalat kezdeményezi az IND folyamatot, és tervezi a szükséges klinikai vizsgálatokat. A javasolt randomizált sikeres befejezése után, kontrollált klinikai vizsgálatok CKD III/IV betegekben, és az adatok benyújtása az FDA -hoz felülvizsgálat és jóváhagyás céljából, Kibow ® 2023 -ban az Egyesült Államokban és más országokban is piacra dobja LBP -gyógyszerét. Ez segít biztosítani, hogy sokkal több beteg férhessen hozzá és engedhesse meg ezt az új kezelési lehetőséget.
Kibow ® további klinikai vizsgálatokat is tervez dialízisben részesülő betegeknél, hogy feltárja a jobb eredményeket és a dialízis időtartamának és/vagy gyakoriságának csökkentését. Ez a klinikai vizsgálat is várhatóan 2023 előtt fejeződik be. Kibow ® várakozással tekint a következő mérföldkő elé, amely rendkívül előnyös lehet a dialízisben szenvedő betegek számára, és több milliárd dollárral jelentősen csökkenti a Medicare költségeit az amerikai egészségügyi rendszer számára. Kibow ® A Biotech teljes tulajdonú gyógyszeripari részlegének elindítása és az LBP-gyógyszer státusz elérése érdekében tett lépések összhangban vannak a nemrégiben létrehozott HHS/ASN KidneyX (https://www.kidneyx.org/) program küldetésével, valamint végrehajtó parancsot írt alá az elnök a vese egészségének javítása érdekében (https://www.whitehouse.gov/presidential-actions/executive-order-advancing-american-kidney-health/).
 SIBO-mítoszok
A SIBO nem valós állapot Ezt az állítást túl gyakran hirdetik rosszul tájékozott egészségügyi szakemberek, akik nem értenek naprakészen a legújabb kutatásokat. A SIBO-t hosszasan tanulmányozták, és v
SIBO-mítoszok
A SIBO nem valós állapot Ezt az állítást túl gyakran hirdetik rosszul tájékozott egészségügyi szakemberek, akik nem értenek naprakészen a legújabb kutatásokat. A SIBO-t hosszasan tanulmányozták, és v
 Ízletes bivaly és brokkoli endíviával és sült útifűvel tálalva
Ha Ön elfoglalt ember (mint én), akkor a főzés gondolata egy hosszú munkanap után enyhén szólva ijesztő feladat. Nem fogom cukrozni (nem szándékos szójáték), a nagy ételek elkészítése eltart egy ideig
Ízletes bivaly és brokkoli endíviával és sült útifűvel tálalva
Ha Ön elfoglalt ember (mint én), akkor a főzés gondolata egy hosszú munkanap után enyhén szólva ijesztő feladat. Nem fogom cukrozni (nem szándékos szójáték), a nagy ételek elkészítése eltart egy ideig
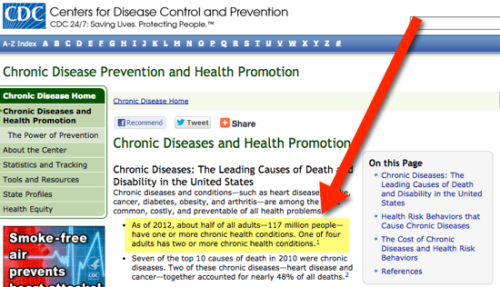 Ezek a krónikus egészségügyi trendek felborítják az elmédet (de van remény)
Az Egyesült Államok Betegségellenőrzési Központja becslései szerint 2020-ra 157 MILLIÓ amerikai él majd krónikus betegségben. Amennyire az adatokból meg tudom állapítani, ez a szám még az emésztési p
Ezek a krónikus egészségügyi trendek felborítják az elmédet (de van remény)
Az Egyesült Államok Betegségellenőrzési Központja becslései szerint 2020-ra 157 MILLIÓ amerikai él majd krónikus betegségben. Amennyire az adatokból meg tudom állapítani, ez a szám még az emésztési p