Lehetséges immunológiai következményei farmakológiai elnyomása gyomorsav termelés sclerosis multiplexben szenvedő betegek
Abstract
kortikoszteroidok standard kezelése sclerosis multiplexben szenvedő betegek tapasztalható akut visszaesés. Mivel emésztési fájdalom gyakori mellékhatása a beavatkozás, a beteg kap egy receptor-2 antagonista, protonpumpa gátló vagy savlekötő megelőzésére vagy enyhítésére ez zavar. Továbbá, a sclerosis multiplexes betegek által szedett ilyen gyógyszert független kortikoszteroid kezelést. Beavatkozások a gyomor-zavarok befolyásolhatják az aktiváló állam az immunrendszer, a fő mediátora patológia a sclerosis multiplex. Bár a hisztamin felszabadulását elősegíti a gyulladás, aktiválása a hisztamin-receptor-2 elnyomja egy proinflammatorikus immunválaszt, és blokkolja a hisztamin-receptor-2 antagonista is elmozdulhatnak az egyensúlyt inkább az immunrendszer stimulálása. Tanulmányok felhasználásával egy állati modelljének a szklerózis multiplex azt jelzik, hogy a hisztamin-receptor-2-antagonisták potenciálisan fokozza a betegség aktivitása betegeknél a sclerosis multiplex. Ezzel szemben, a protonpumpa-inhibitorok úgy tűnik, hogy előnyben immunszupresszió, de még nem vizsgálták modell a sclerosis multiplex. Savkötők hisztamin receptor-2 antagonisták és proton-pumpa inhibitorok is megváltoztathatta volna a bélflóra, amely közvetve vezetnek az immunrendszer stimulálása. Továbbá, a megemelkedett gyomor pH-ját is elősegíti a B12-vitamin-hiány, amely sclerosis multiplexben szenvedő betegek vannak kialakulásának kockázata. Itt áttekintjük lehetséges szerepei gyomorsav inhibitorok immunopathogenic mechanizmusok sclerosis multiplex. Katalógusa Kulcsszavak katalógusa Antacidum autoimmun dyspepsia kísérleti autoimmun agyvelőgyulladás GERD hisztamin receptor antagonisták 2 sclerosis multiplex protonpumpa inhibitor Bevezetés katalógusa A gyógyszerek használata a savtermelést csökkentő a gyomorban vált egyre rutin a betegellátásban. Krónikus fájdalom, kényelmetlenség és nyelési problémák társított gastrooesophagealis reflux betegség (GERD), vagy peptikus fekély betegség széles körben elterjedt a populációban. Használata savcsökkentő vegyületek egyre gyakoribbá vált, és az emberek elkezdték figyelembe őket rendszeresen a gyomorégés vagy emésztési zavar. Nem szteroid gyulladáscsökkentő gyógyszerek és más gyógyszerek okozhatnak diszpepszia és a peptikus fekélyek, hogy kapcsolatba hozható a fokozott savszekréció [1]. A kortikoszteroidok, amelyek, ha a betegnek sclerosis multiplexben (SM) megoldásának előmozdítása akut visszaesések [2] is okozhat emésztési fájdalom a has felső járó fokozott gyomorsav-szekréciót [3]. A gyomor zavarok rendszeresen kezeli a hisztamin-2 receptor (H2R) antagonista, protonpumpa-gátló (PPI), vagy egy savcsökkentő. Ezek a szerek beadhatók profilaktikusan vagy válaszként diszpepsziás fájdalmat, amikor a beteg kap egy folyamán nagy dózisú kortikoszteroidok [2, 4-6]. Az SM betegek is, hogy ezeket a gyógyszereket, mint része a napi rutin miatt folyamatos dyspepsia, GERD, vagy egyéb betegség. Sok ilyen szerek által előírt beteg háziorvosát, és rendelkezésre állnak a over-the-counter gyógyszereket, vagy emésztési kapcsolódó feltételeket. Ezek a beavatkozások általában biztonságosnak tekinthető. Javasoljuk, hogy ezeknek a használata szerek lehetnek nem szándékolt következményei a betegség folyamata SM betegek, és talán más autoimmun állapotokban. Katalógusa H2R PPI és savkötők közvetlenül vagy közvetve befolyásolják a gyulladásos válasz SM betegek. H2R antagonisták (például cimetidin, famotidin, nizatidin és ranitidin) törvény a gyomorban csökkentésével a bazális és az élelmiszer-stimulált parietális sejt-szekréció. H2R antagonisták is hatnak más sejttípusok, beleértve endoteliális sejtek, a vér-agy gáton (BBB), hízósejtek és a sejtek az immunrendszer (például a T-limfociták, monociták és dendritikus sejtek (DC-k)), hogy játszanak központi szerepek meghangszerelésénél immun-mediált patológiás SM-ben. Bár a hisztamin felszabadulás közvetíthet akut gyulladásos események, ez is befolyásolhatja a krónikus gyulladásos állapotok [7], és a bizonyítékok azt sugallják, hogy aktiválása H2R elnyomja az immunválaszt. Így a hatásait H2R antagonisták vezethet fokozásához proinflammatorikus állam, amely azt eredményezheti, hogy betegség aktivitásának fokozódását az MS-betegekben. PPI-k (például a lanzoprazol, az omeprazol, dexlansoprazole, az ezomeprazol, a pantoprazol és rabeprazol) irreverzibilisen gátolják a H
+ /K + ATP-áz in parietális sejtek, amelyek használják a szivattyú protonok a gyomor lumenbe. Ezen túlmenően, ezen inhibitorok működhet más sejttípusok, beleértve a sejtek az immunrendszer. Ellentétben H2R antagonisták, PPI elősegítheti az immunrendszer elnyomása. Antacidák, H2R antagonisták és a PPI-k összesített eredmény megnövekedett gyomor pH-ját. A hosszan tartó magassági gyomor pH vezethet megnövekedett szintű baktériumok a gyomorban és a vékonybélben, ami elméletileg súlyosbíthatja a gyulladást az MS-betegekben. Ebben az áttekintésben fogjuk összehasonlítani az immunológiai hatása a különböző módozatok irányul elnyomja a gyomorsav, és megvitatják a lehetséges következmények a betegség folyamata az MS. Katalógusa hisztamin-2 receptor antagonisták katalógusa hisztamin szintje a liquor (CSF ) magasabbak relapszáló-remittáló és progresszív MS kontroll csoporthoz viszonyítva [8, 9]. Aktiválása hisztamin receptorok serkentik mind a pro- és anti-gyulladásos útvonalakat, amely közvetíti a differenciális aktiválása a négy G-fehérje-kapcsolt receptorok, hisztamin-receptor-1 (H1R), H2R, H3R és H4R [7, 10]. A genetikailag manipulált egereket, nem képes a hisztamin [11], vagy hiányos egerek hisztamin-termelő hízósejtek [12], a klinikai és patológiai jelei kísérleti autoimmun encephalomyelitis (EAE), egy állati modelljének MS, jelentősen súlyosabb, mint a vad típusú egerek EAE. Ez azt sugallja, egy átfogó hatása hisztamin felé korlátozó autoimmun agy gyulladás, amely ellentétben a hisztamin szerepe egyéb gyulladásos állapotok, mint például allergiás választ. Mivel aktiválása H2R tűnik kulcsmechanizmusnak hisztamin által közvetített immunszuppresszió, felveti azt a kérdést, hogy a H2R antagonisták súlyosbítják a betegség aktivitása SM betegek. H2R expresszálódik a különböző sejtek, beleértve az endoteliális és szisztémás gyulladásos sejtek [7], és H2R fejezzük EAE által CNS gyulladásos beszűrődések és esetleg mikroglia és az asztrociták [13]. Mivel a H2R antagonisták kimutatták, hogy hozzáférjen az agy [14], akkor fejtenek ki hatást a gyulladásos sejtek a CNS valamint szisztémásan.
Hisztamin-receptor-2-jelzésű aktivációs elősegíti a T-helper sejtek 2 válasz
Aktív betegség az SM általában gondolják, hogy részt hiperaktív T helper sejtek (Th) 1 válasz és alulműködik Th2 választ. Például, a perifériás vér mononukleáris sejtek MS-betegekben szekretálnak megnövelt mennyiségű proinflammatorikus citokinek társított Th1-választ (például IFN-γ, IL-12 és TNF-α) és engedje csökkentett mennyiségű anti-gyulladásos citokin IL 10, a hozzájuk kapcsolódó Th2 és a szabályozó T-sejtek aktivitását [15-17]. Ezzel szemben, az immunrendszer tolerancia és /vagy a betegség elengedést társított túlszabályzását a Th2 citokinek (például, IL-4 és IL-10) és a TGF-β rágcsálókban EAE [18-22]. Az emelt EAE betegség aktivitásának megfigyelt hiányos egerek a hisztamin termelést feltételezik, hogy hiánya miatt a szuppresszió keresztül H2R aktiváció, ami fokozott Th1-választ [11]. Aktiválása H2R által dimaprit, egy szelektív H2R agonista, azt találták, hogy csökkentik a klinikai és patológiai jelei betegség súlyosságának EAE (mint például ataxia és CNS makrofág felhalmozódás) [23], és csökkenti enkefalitogén T sejt válaszok [24]. Ezzel szemben, a cimetidin, hogy blokkolja a H2R során EAE indukció tengerimalacoknál vezetett nagyobb előfordulási gyakorisága a betegség, összehasonlítva a előfordulási tengerimalacoknál adott sóoldatban [25]. A cimetidin is elősegítette a Th1 által közvetített késői típusú túlérzékenységi reakció, gyulladásos állapot némi hasonlóságot EAE [25-27]. In vitro katalógusa katalógusa vizsgálatok igazolják, hogy H2R agonisták utánozzák hisztamin [28], amely gátolja a váladék a proinflammatorikus citokinek és serkenti a gyulladásgátló citokinek humán perifériás vér mononukleáris sejtek [28-31] (1. táblázat). Továbbá a által kiváltott hisztamin elsősorban által közvetített H2R, bizonyítja az a tény, hogy ezek a hatások által blokkolt cimetidin [29, 30, 32]. Ezen túlmenően, a H2R közvetíti a TNF-α termelés hízósejtek által [33]. Így, hisztamin, keresztül stimulálása H2R, vezethet elmozdulás a Th1 /Th2 egyensúly felé Th2-dominancia (1. táblázat). Összefoglalva, ezek a tanulmányok felvetik a kérdést - nem szelektív H2R antagonizmust negatívan befolyásolhatja egy autoimmun állapot előmozdításával Th1 válaszok? 1. táblázat Példák az immunrendszer által kiváltott hisztamin vagy hisztamin-receptor-2-agonisták
Agent Matton organizmus /sejttípus Matton válasz Matton Referencia Matton Dimaprit katalógusa Egerek katalógusa csillapítása kísérleti autoimmun agyvelőgyulladás betegség aktivitása
[23]
Dimaprit
hisztamin
egér aktivált T-sejtek
elnyomja a T-sejt proliferációt, IL-6, IL-10, IL-17 és IFN-γ termelés katalógusa [24]
H2-agonista katalógusa hisztamin (megfordítható H2R antagonista) hotelben Humán neutrofil katalógusa Csökkenti neutrofil kemotaxis válasz katalógusa [44] katalógusa H2-agonista katalógusa hisztamin (megfordítható H2R antagonista) katalógusa humán T-sejtek
csökkenti a T-sejt proliferáció katalógusa [44]
H2R agonisták
hisztamin (megfordítható H2R antagonista) katalógusa humán perifériás vér mononukleáris sejtek
Gátolja az IL-1 és IL -12, és serkenti az IL-10
[28, 29, 31]
hisztamin
(megfordítható H2R antagonista) katalógusa humán perifériás vér mononukleáris sejtek
Gátolja szekréciójának TNF-α katalógusa [30] katalógusa hisztamin katalógusa (megfordítható H2R antagonista) hotelben emberi DC katalógusa elnyomja az IL-12 termelést követő lipopoliszaharid stimulálása dendritikus katalógusa [73] katalógusa hisztamin katalógusa (fordított által H2R antagonista)
Humán dendritikus
Elősegíti Th2 választ, hogy van, fokozza a Th2 kemokin termelés, az éretlen DC-k katalógusa [74]
hisztamin
(megfordítható H2R antagonista)
Rat hízósejtek
Elnyomja a TNF-α termelés katalógusa [33]
hisztamin
(megfordítható H2R antagonista) katalógusa Humán köldökvéna endoteliális sejteket
termelését serkenti az IL-6
[39] katalógusa DC: dendritikus sejt; H2R: hisztamin-receptor-2; IFN-γ: gamma-interferon; IL: interleukin; Th: T helper sejtek; A TNF-α: a tumor nekrózis faktor-alfa.
Hisztamin-receptor-2-jelzésű aktivációs elnyomja gyulladáskeltő T sejt válaszok
aktiválása és kereskedelem a T-sejtek a központi idegrendszerbe fontos lépést az MS patogenezisében. Tény, hogy a gyógyszereket, hogy a cél a következő lépéseket (például kopolimer 1, fingolimod és natalizumab) csökkenti a súlyosságát és gyakoriságát a klinikai visszaesések MS [34-36]. H2R-közvetített hatások képviselheti egy belső mechanizmust, amely önálló korlátok T-sejt aktiváció, proliferáció és az emberkereskedelem, különösen a beállítás az autoimmunitás. Például in vitro
beadása hisztamin vagy H2R agonista proliferációját gátolja, és az IFN-γ-termelés egér aktivált T-sejtek ellen enkefalitogén peptid alkalmazott EAE-indukciós [24].
Intravitális mikroszkópia modell utánozza a korai szakaszában gyulladás EAE, mind a H1R és H2R aktiválás csökkent a képessége, a mielin autoreaktív T-sejtek, hogy csatlakozzanak gyulladt agyi erek in vivo katalógusa, amely egy kritikus lépés a fejlesztés MS: [24]. Egy allergiás modellben, H2R aktiválás vezetett alulszabályozása leukocita infiltráció a gyulladásos szövetbe [37]. Egyes vizsgálatok arra utalnak, hogy H2R elősegítheti BBB szivárgás míg H1R lehet elnyomni [38], bár H2R vagy H1R aktiválás társított növekedésével endoteliális sejt termelt IL-6 [39], és az IL-6 hathat, hogy támogassák a karbantartási a BBB [40, 41].
Ha H2R aktiválás vezet elnyomása a T-sejt válaszokat, majd szelektív elzáródása H2R megvan a lehetőség, hogy támogassák a T-sejt immunválaszt. Valóban, antagonizmusa H2R, független megváltoztatják a hisztamin szintet, okozza az immunrendszer stimulálása és amplifikálására egy meglévő gyulladásos esemény (2. táblázat). A vizsgálatokban az emberi vagy egér sejtek, cimetidin javítja mitogénnel stimulált limfocita aktiválás [42, 43], csökkenti a hisztamin-indukált szuppresszió a T-sejt proliferáció [44], csökkenti a hisztamin-aktivált szuppresszor T-sejt-választ jelenlétében vagy távollétében mitogén [45, 46], elősegíti az átalakítás a monociták a makrofágok [47] és megfordítja a hisztamin által indukált szuppresszió proinflammatorikus citokin szintézis [29, 30, 32] (1. és 2. táblázat). Cimetidin fokozott antitest-függő celluláris citotoxicitás származó T-sejtek MS-páciensek ellen primer patkány oligodendrociták [48]. A cimetidin gátolja a szabályozó T-sejt-szerű aktivitás [49] és fokozza a gyulladásos választ, hogy egy DNS-vakcina például előmozdításával humorális és T-sejt-közvetített válaszokat, és indukáló IL-12-termelését, miközben termelődését gátló gyulladáscsökkentő citokinek [50 ]. A cimetidin is növeli az antitest termelést és proliferációját mitogén-stimulált lépsejtek válaszul egy immunogént [51]. A ranitidin okoz immunaktivációra betegek egy fejsérülés [52], megfordítja a műtét okozta immunszuppresszió [53-55], és beszámoltak egy esettanulmány súlyosbítják lymphocytás colitis [56]. Ezen túlmenően, H2R vannak jelen a bazofilek és a hízósejtek és a funkció, hogy elnyomja a hisztamin és proinflammatorikus citokinek [33, 57]. Együttesen ezek az adatok alátámasztják annak immunstimuláns szerepét H2R antagonisták, ami valószínűleg annak tudható be a elzáródása H2R által közvetített elnyomását utak (1. és 2. táblázat) .table 2 Példák az immunrendszer hatások hisztamin-receptor-2 antagonisták
Agent Matton Cell /egész állat Matton válasz Matton Referencia Matton cimetidin katalógusa tengerimalacok katalógusa Növeli aktivitás késleltetett típusú hiperszenzitivitás és kísérletes autoimmun encephalomyelitis előfordulási katalógusa [25]
cimetidin
egér T-sejtek
Gátolja indukciója a T-szuppresszor sejtek katalógusa [45]
cimetidin
egér lépsejtek
Növeli ellenanyag-termelés, és proliferációját mitogénaktivált lépsejtek válaszul tetanusz toxoid katalógusa [51]
cimetidin
egér T-sejtek
Gátolja szabályozó T-sejt-szerű aktivitás katalógusa [49 ] katalógusa cimetidin katalógusa humán T-sejtek katalógusa Csökkenti szuppresszor T-sejt választ katalógusa [46] katalógusa cimetidin katalógusa Humán limfociták katalógusa Növeli a mitogén-aktivált T-sejt választ katalógusa [42 43] katalógusa cimetidin katalógusa emberi DC katalógusa Növeli kapacitását antigén prezentáció dendritikus immunszuppresszált rákos betegek katalógusa [75] katalógusa Ranitidine katalógusa humán T-sejtek katalógusa Növeli a CD4 + T-sejtek és mitogén-stimulált IFN-γ-termelés betegek fejsérülés katalógusa [52]
ranitidin
Humán monocitákat, neutrofileket, a természetes killer-sejtek, késleltetett típusú hiperszenzitivitás
Visszafordítják sebészeti beavatkozással indukált immunszuppresszió katalógusa [54, 55] katalógusa DC: dendritikus sejt; IFN-γ: gamma-interferon.
Hisztamin-receptor-2-jelzésű aktivációs polarizálja a dendritikus sejtek és a monocita funkció irányában egy T-helper sejtek 2 válasz
NF professzionális antigénprezentáló sejtek, amelyek specializálódtak a felvételét antigének és azok szállítása a perifériás szövetekből a limfoid szervek. Ők is vándorolnak a CNS és /vagy megkülönböztetni mikroglia [58, 59], és jelen lehet a CSF-ben [60]. Mivel a képességüket, hogy stimulálják naiv T-sejtek, dendritikus sejtek központi szerepet játszanak a megindításához egy elsődleges immunválaszt. Emerging adatok azt jelzik, hogy a DC-k fontos szerepet játszanak a megindításához autoimmun támadások EAE és az MS. Pontosabban, a DC-eredetű citokin jeleket vesz részt a differenciálódását és proliferációját autoreaktív T-sejtek.
A profil és a szintek citokinek kiválasztódik a stimuláló dendritikus meghatározására, hogy egy naiv T-sejt lesz a Th1, Th17 vagy Th2 sejt. Th1 CD4 + T-helper sejtek szekretálnak proinflammatorikus citokinek, például az IL-1, IFN-γ és TNF-β, míg Th2 típusú CD4 + T-sejtek szekretálnak IL-4, IL-5, IL-13 és granulocita kolónia stimuláló faktor. Th1 sejtek és Th17 sejtek, amelyek szekretálnak IL-17, elősegítik a gyulladást MS: [61, 62]. Kísérleti vizsgálatok kimutatták, hogy a DC-ből származó jelek kritikusak toborzás és aktivitásának fenntartásához Th1 és Th17 sejtek [63]. Alatt a betegség aktivitásának vagy relapszus MS, van egy nagyobb arányban a keringő dendritikus szekretáló IL-12 és IL-23 [64, 65]. Fokozott szekréció az IL-12 és IL-23 DCS viszont egybeesik jelentős növekedésével patogén Th1 [66] és a Th17 [67, 68] aktivitás, ill. Így a relapszusok ideje alatt, a Th1 és Th17 sejtek hiperaktív és Th2 aktivitás downregulált. Fordítva, időszakokban betegség remisszió, feltehetően egy eltolódás DC-eredetű jeleket elősegíti csökkentését a Th17 sejtszám alacsony szintre [69], és a CD4 +
sejtek polarizálja be effektor IL-4 és IL- 10 termelő Th2 sejtek, így egy általános gyulladáscsökkentő környezet [66, 70].
hisztamin befolyásolja a profil a citokintermelés által lejáró DCS [71]. H2R tűnik meghatározó szerepet játszanak a szabályozásában DC funkció [71] a többszörös DC részhalmaza kifejezni a magas szintű H2R, míg a H1R és H4R egymástól eltérő módon fejeződnek [72]. Aktiválása H2R dendritikus eredményezi polarizáló a DC-k felé Th2 elősegítő környezet keresztül elnyomása IL-12-termelés [71, 73], és nőtt a IL-10-szintézis [71, 72]. Cimetidin kimutatták, hogy blokkolja a hisztamin hatását szabályozásában az IL-12-termelés és a Th2 polarizáció [73, 74]. Egy nemrégiben készült tanulmány azt is kimutatta, hogy a H2R aktiválás vezetett elnyomása monocita eredetű CD1a + sejtek egy részét a dendritikus rendelkező nagyobb gyulladásgátló tulajdonságokkal, mint a CD1a - részhalmaza, és famotidin volt képes blokkolni ezt a műveletet [72 ].
közvetlen szabályozása DC funkció H2R antagonisták nem mutatták ki az MS. Azonban, a cimetidin azt találták, hogy növeli az antigént bemutató kapacitás és esetleg az IL-12 szekrécióját dendritikus izolált immunszuppresszált betegeknél, colorectalis rák [75]. Ez burkolt leleplezése elnyomott DC funkció cimetidin sejtekben, ezeknél a betegeknél. A sclerosis multiplex, glükokortikoidok és INF-β csökkentheti az IL-12 szekréció éretlen emberi DS [76, 77], ami felveti annak lehetőségét, hogy a fordítottja DC elnyomás cimetidin SM betegek hasonló immunszupprimált betegek végbélrák. Az intézkedések a cimetidin daganatos betegeknél nem feltétlenül kizárólag közvetíti H2R, hiszen hasonló hatást nem észleltek a famotidin [75]. Katalógusa következményei hisztamin-2 receptor antagonisták sclerosis multiplexben szenvedő betegek katalógusa Bár H2R antagonisták potenciálisan zavarja immunszuppresszív utak, bizonytalan, hogy ezek befolyásolják a betegség lefolyását SM betegek. A megállapítások EAE tanulmányok támogató szerepe H2R antagonisták a betegség progressziójában esetleg nem lefordítani, hogy az MS, hogy van, hatásai H2R antagonisták különböző hatásai között egerekben és emberekben. Továbbá, vannak olyan több versengő tényezők diktálják, hogy az immunválasz állapotú lesz aktiválva, hogy támogassák patológia MS, és a hisztamin csak egy a sok mediátorok befolyásoló immunrendszer egyensúlyának és patogén természetesen. Így lehetséges, hogy a teljes rendszerben egy komplex betegség, elzáródása immunszuppresszió utak keresztül H2R antagonisták nem befolyásolja proinflammatorikus feltételek vagy ellensúlyozása immunszuppresszív tulajdonságokkal kortikoszteroidok. Akut fellángolása a betegség aktivitása emésztését követően H2R antagonisták nem valószínű; egyébként több jelentés várható lett volna, amely leírja ezeket az eseményeket. Ugyanakkor az a lehetőség, hogy a H2R blokkoló elősegítik általános növekedése a betegség aktivitása is, mert néhány patológia lehet klinikailag néma MS [78, 79], valamint az elegyítése hatásait több lézió éveket vehet igénybe hatással van a klinikai megjelenése MS [80 ]. Bár a mágneses rezonancia vizsgálat (MRI) is gyakran mutatnak fokozott aktivitás az arcát stabil klinikai jelenség fordítva is igaz; Más szóval, a fokozatos klinikai változás gyakran nem nyilvánvaló MRI. Így H2R antagonisták súlyosbíthatja folyamatos patológia egy szubklinikai szinten, vagy kimutatási határa alatt MRI. Továbbá, mivel a számos hisztamin válaszok a rendszerben, és a szám a közös kábítószer fejtenek ki bizonyos befolyást a hisztamin utak, H2R antagonisták befolyásolhatja a betegség aktivitása csak az egy meghatározott feltételek vagy csak összehangoltan más gyógyszerekkel, így hatásait nehéz felismerni. A helyzetet tovább bonyolítja tovább, néhány eredmények mérése során megfigyelt egyik különbség csak egy H2R antagonista, de nem egy másik antagonista [43, 75]. A nagyszámú szedő betegek H2R antagonisták, egy kicsi, de valószínűleg jelentős hatással könnyen lehet kihagyni.
Néhány esetben emelkedett autoimmun reakciók számoltak ezekkel a szerekkel. Ezek közé egy esetben az autoimmun májgyulladás egy betegben az MS társított újbóli kiváltás ranitidin [81], az új bőr elváltozások a beteg szisztémás lupus erythematosus társított cimetidin [82], lymphocytás infiltráció betegeknél mellrák társított famotidin [ ,,,0],83], és a psoriasis fellángolása társított H2R antagonisták [84].
protonpumpa-gátlók
PPI rutinszerűen kezelésére használják sav-peptikus rendellenességek. Ezek hatnak, hogy blokkolják a gyomorsav-szekréció gátlásán keresztül a H + /K + ATP-áz, a protonpumpa a gyomor parietális sejtek [85]. PPI-k is jár, monocitákon, neutrofilek és endoteliális sejtek és az eredmények javulását az immunválasz [86, 87]. Omeprazol [87], és esetleg más PPI át a vér-agy gát. PPI-k gátolhatják az aktivitását reaktív oxigénfajták [88], amely úgy gondolják, hogy elősegítik a betegség aktivitását a CNS-ben szenvedő betegek MS: [89]. A szerepek a PPI-k MS vagy állati modellben az SM nem vizsgálták megfelelően, de mint alább, ez elméletileg lehetséges, hogy a keresetük kedvez egy elnyomó szerepet a betegség aktivitása. Katalógusa protonpumpa-gátlók okozhat immunszuppresszió
számos in vitro
és in vivo
vizsgálatok kimutatták, hogy a PPI-k fejthetnek gyulladáscsökkentő hatását független az gátolja a gyomorsav termelés [90]. Ezek a gyulladásgátló hatás mutatkozik keresztül anti-oxidánsok aktivitás, citokin moduláció és képes megváltoztatni a adhéziós molekulák expresszióját keresztül közvetlen hatás a gyulladásos sejtek, mint a neutrofilek, monociták és endotél sejtekben [88]. Ezek a hatások is fennállhat után is a rövid távú szállítás. Amint azt az előző szakaszban, a megváltozott citokin szekréció és adhéziós molekulák kifejezések gyulladásos sejtek fontos szerepet játszanak az MS patogenezisében. Így lehetséges, hogy a gyulladásgátló tulajdonságai a PPI-k hozzájárulhat a jótékony hatását más gyulladásgátló vagy immunmodulátor gyógyszerek adagolásuk esetén az MS.
Protonpumpa-inhibitorok elnyomják gyulladásos válaszokat a neutrofilek és a perifériás vér monociták
neutrofilek már javasolták, hogy támogassák betegség aktivitásának EAE és TS [91-96]. EAE-ben, neutrofilek észleltek központi idegrendszeri gyulladásos beszűrődések [93, 94] és a neutrofil kimerülése enyhíthető EAE tevékenység [94]. A neutrofilek is feltételezik, hogy indukálja BBB szivárgás során az EAE kialakulását [96], és érintett lehet a kezdete axonális patológia [95]. A szerepe neutrofil MS kevésbé egyértelmű. Ők már javasolták, hogy a résztvevők a betegség korai fejlődés a CNS-ben [95], de nem lehet jelen a későbbi szakaszaiban. In állapotú sclerosis multiplex, perifériás neutrofil vannak beindított állapotban, ami a megnövelt aktivációs fertőzés után. Emelkedett az effektor mechanizmusok neutrofilek állapotú sclerosis multiplex közé tartozik a fokozott degranulációt, emelkedett oxidatív kitörés és a magasabb szintű neutrofil extracelluláris csapdák [97]. Katalógusa PPI elnyomja a reaktív oxigén gyökök által neutrofilek és monociták kultúra, csökkentse a kifejezése adhéziós molekulák, és csökkenti a kölcsönhatások endothel sejtek [86, 88, 98-101], amely szükséges a belépés a központi idegrendszerben. Nevezetesen, gyógyszerek, amelyek zavarják a sejt tapadását az endothelium használják, hogy elnyomja az előfordulása SM relapsus, például natalizumab [35]. Ezen túlmenően, a lansoprazol csökkentette az in vitro
termelés a gyulladásos citokinek TNF-α és IL-1β által a perifériás vér monociták [102]. Ezzel szemben, a cimetidin blokkolta a gátlása a neutrofil kemotaxist által indukált hisztamin [44].
A protonpumpa inhibitorok csökkentik a gyulladásos állapot mikroglia katalógusa Mivel néhány PPI-k, mint az omeprazol gyorsan behatolnak a vér-agy gát [87], akkor azokat a lehetőség, hogy kölcsönhatásba lépnek a mikroglia sejtek. Aktiválása mikroglia sejtek fontos szerepet játszanak a szabályozásában autoimmun gyulladás EAE és az MS [103, 104]. Aktivált mikroglia gondolják, hogy gyakoroljon toxicitás felé neuronok keresztül a termelés a potenciálisan neurotoxikus molekulák, mint például gyulladásos citokinek és a szuperoxid gyökök [105]. Például, lipopoliszacharid (LPS) - és IFN-γ-stimulált humán mikroglia mutatnak jelentős toxicitást felé neuronokkal kultúrában [106]. Azonban, amikor LPS és IFN-γ-aktivált humán mikroglia sejteket tettünk ki lansoprazol vagy az omeprazol, akkor jelenik meg kevesebb toxicitást felé neuroblasztóma sejtek tenyészetben [107]. Mikroglia is végezhet védelmi funkciók, mint például a szekrécióját neurotróf faktorok és a védő citokinek TGF-β és az IL-10 [103], így a szerepe a PPI-k a következő funkciókat érdemel további vizsgálatot.
Megemelkedett gyomor pH
alapvető funkciója az összes vegyületek tárgyalás alatt van, hogy növelje a gyomor pH-ját, akár közvetlenül, akár közvetve. Antacidák közvetlenül hatnak azáltal, hogy semlegesíti a gyomorsav míg H2R antagonisták és a PPI-k jogszabály enyhítve-termelés. Gyakori antacidok közé tartozik a kalcium-karbonát, magnézium-karbonát, nátrium-hidrogén-karbonát vagy alumínium-hidroxid, és mint a H2R antagonisták és a PPI-k azok rendelkezésre állnak over-the-counter számos készítmények. Függetlenül attól, hogy a mechanizmus, amellyel a pH-t növeljük, alacsonyabb szintű gyomorsav negatív következményekkel járhat a betegek számára az MS. Például van egy nagyobb túlélése baktériumok a gyomor és a vékonybél követően hosszan tartó kezelés egy savval szuppresszáló ágenst [108-110]. Érdekes, hogy egy alacsonyabb baktériumflóra a tápcsatornában találták, hogy csökkentse a EAE súlyosságát fejlesztés [111]. A bél mikroflórája kimutatták, hogy befolyásolja a veleszületett immunválasz [112], és az SM pácienseknek hiperaktív neutrofilek [97]. Fokozott neutrofil aktivitást javasolták, hogy bővítsék és meghosszabbítsák a gyulladás egy fertőzés során a relapszáló-remittáló és elősegítik a szövetek sérülése, gyulladás során MS [97]. Így a magasabb szintű baktériumok a tápcsatornában emelkedés után a gyomor pH lehetne elméletileg rontja a neutrofil válaszhoz SM-ben. Másrészt, a növekvő gyomor pH-járt együtt fokozott kockázata a fejlődő élelmiszer-allergia előmozdítása révén Th2 válaszok [113-116] és az alumínium alapú antacid szukralfát fokozhatja a Th2 hatás [117, 118]. Ebben a példában, egy nagyobb Th2 válasz miatt nagyobb a gyomor pH-megjósolhatóan, hogy csökkentse a betegség aktivitását az MS.
Beadva hosszú ideig, olyan szerek, amelyek növelik a gyomor pH-ját vezethet hiányt B12-vitamin, elsősorban idős személyeknél [119, 120]. MS-betegekben lehet alacsony B12-vitamin [121, 122], ami arra utal, hogy a gyógyszerek, amelyek blokkolják a gyomorsav-termelés lehetne hozzájárul ehhez a hiányos állapot.
Következtetések
Számos tényező modulálják az immunválaszt során különböző szakaszainak MS; kezelés a diszpepsziás fájdalom az egyik tényező, amely rendelkezik azzal a potenciállal, hogy befolyásolja az immunválaszt. Kezelése gyomorsav lehet visszatérő probléma szembe élettartama alatt SM betegek. Bár nem bizonyított, egyes beavatkozásokat képesek a betegség súlyosbodása, míg mások előnyben betegség elfojtása vagy lehetnek viszonylag semleges (3. táblázat). Bár a hisztamin felszabadulását eredményezheti gyulladás, aktiválása a H2R társított immun-szuppresszió; beadásával H2R antagonista közben egy korábban meglévő proinflammatorikus állapot, például akkor fordul elő az MS, vezethet, hogy további immunrendszer stimulálása. Így ez elméletileg lehetséges, hogy a H2R antagonisták súlyosbítják patogenezise vagy csökkenti a hatását az immunszuppresszív gyógyszerek. Távollét nyilvánvaló változások klinikai tünetek beadását követően H2R antagonisták nem elegendő ahhoz, hogy utasítsa el a lehetséges negatív hatásait ezeknek a gyógyszereknek, mert sok a folyamatban lévő patológiai maradhat klinikailag néma. Emellett H2R antagonisták, PPI-k és a savkötők beadhatjuk diszpepsziás fájdalom. Ezzel szemben a H2R antagonisták, PPI-k lehetnek immunszuppresszív tulajdonságokkal, bár ők is lehetnek nemkívánatos mellékhatásai, például a megnövekedett kockázata a gyomor fertőzés. Savkötők valamint H2R antagonisták és a PPI-k is közvetve befolyásolja az immunrendszert, lehetővé téve a fokozott bakteriális növekedés a gyomorban és a vékonybélben.
 Egészségügyi tipp:A rotavírus megelőzése
A legfrissebb Healthy Kids hírek fejlődési késleltetéssel összefüggő csecsemőtáplálási problémák A karja elakadt a család futópadján Aggódik a tinédzserek közösségi médiahasználata miatt? A „Irányíto
Egészségügyi tipp:A rotavírus megelőzése
A legfrissebb Healthy Kids hírek fejlődési késleltetéssel összefüggő csecsemőtáplálási problémák A karja elakadt a család futópadján Aggódik a tinédzserek közösségi médiahasználata miatt? A „Irányíto
 A probiotikumok segíthetnek az alultápláltság visszaszorításában a következő két évtizedben,
- mondja Bill Gates A probiotikumok vagy jó baktériumok ígéretesnek bizonyultak az egészséges bél fenntartásában. Számos tanulmány bizonyította a probiotikumok egészségügyi előnyeit. Most, a népszerű
A probiotikumok segíthetnek az alultápláltság visszaszorításában a következő két évtizedben,
- mondja Bill Gates A probiotikumok vagy jó baktériumok ígéretesnek bizonyultak az egészséges bél fenntartásában. Számos tanulmány bizonyította a probiotikumok egészségügyi előnyeit. Most, a népszerű
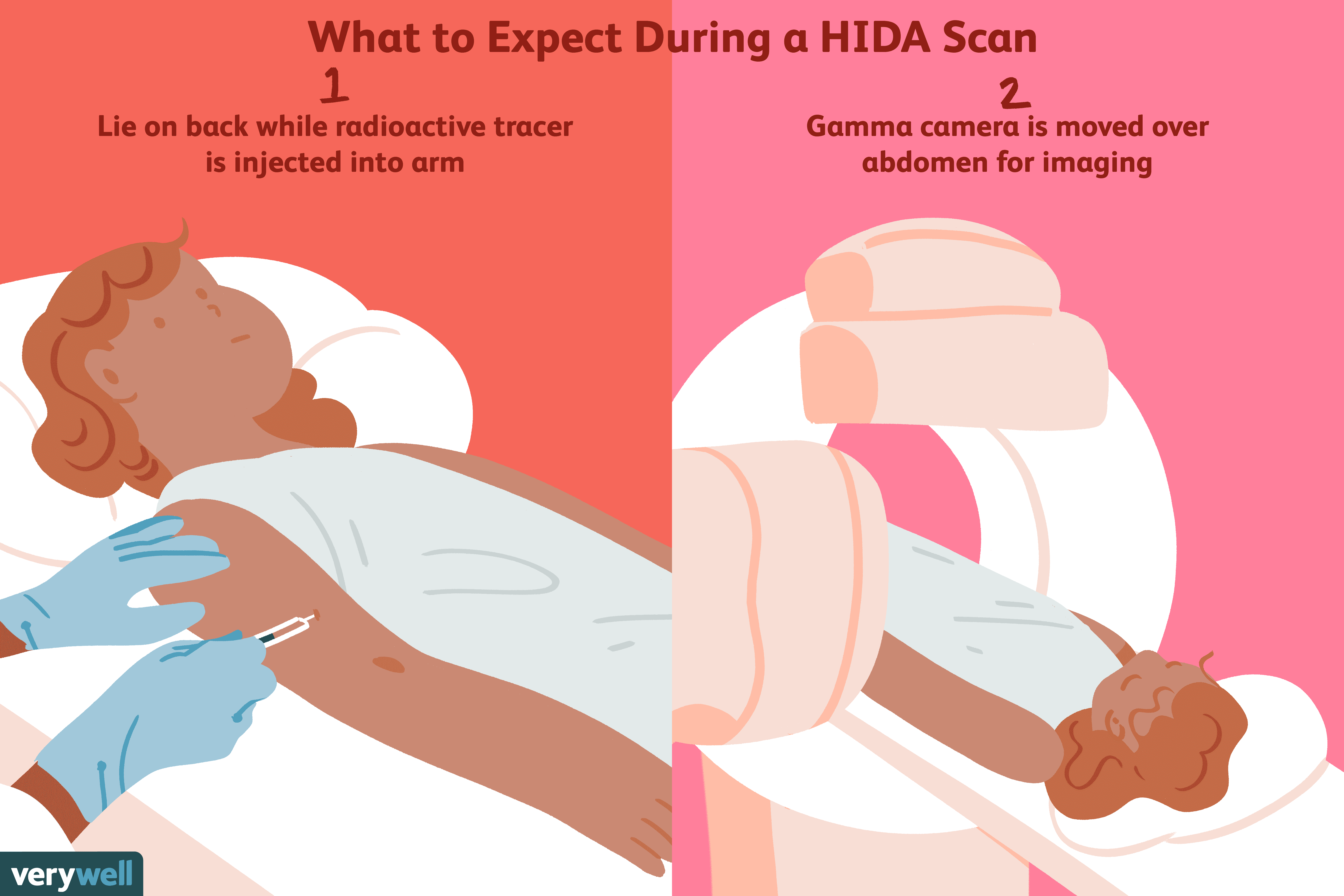 Mi az a hepatobiliáris imino-diecetsav (HIDA) vizsgálat?
A hepatobiliáris iminodiecetsav (HIDA) szkennelés, amelyet néha koleszkintigráfiának vagy hepatobiliáris szcintigráfiának is neveznek, egy olyan nukleáris képalkotó vizsgálat, amelyet elvégeznek. az e
Mi az a hepatobiliáris imino-diecetsav (HIDA) vizsgálat?
A hepatobiliáris iminodiecetsav (HIDA) szkennelés, amelyet néha koleszkintigráfiának vagy hepatobiliáris szcintigráfiának is neveznek, egy olyan nukleáris képalkotó vizsgálat, amelyet elvégeznek. az e