Il fegato è un organo cruciale per il metabolismo sistemico nel nostro corpo. Oltre al turnover delle biomolecole e al metabolismo dei farmaci, la funzione principale del fegato è la rimozione delle sostanze tossiche dall'organismo. Epatociti, o cellule epatiche, sono il tipo cellulare e l'unità funzionale più abbondanti del fegato. Sono centrali metaboliche nell'organismo sano, ma servono anche come importanti piattaforme di segnalazione immunitaria durante le infezioni. Come tale, hanno il potenziale per reagire a una serie di citochine, piccole molecole essenziali per il coordinamento delle risposte immunitarie.
Precedenti studi nel campo dell'immunologia e del metabolismo, o immunometabolismo, hanno svelato meccanismi rivoluzionari su come le cellule del sistema immunitario devono regolare il loro metabolismo per svolgere le loro funzioni per combattere gli agenti patogeni e il cancro. Basandosi su questo, Andreas Bergthaler e il suo gruppo al CeMM miravano a studiare i cambiamenti immunometabolici che si verificano nell'intero organismo durante l'infezione. Si sono concentrati in particolare sul fegato per il suo ruolo importante nel controllo del metabolismo sistemico.
Per sezionare i processi complessi coinvolti, gli autori hanno sfruttato il modello di riferimento dell'infezione cronica, il virus della coriomeningite linfocitica (LCMV). La ricerca con LCMV aveva già portato a intuizioni fondamentali sull'immunologia negli ultimi 80 anni, e in particolare ha contribuito a tre premi Nobel. Tra questi c'è il Premio Nobel 2018 per la Fisiologia o la Medicina, che è stato assegnato a James Allison e Tasuku Honjo per le loro scoperte relative alle nuove rivoluzionarie immunoterapie contro il cancro che sfruttano le cellule killer immunitarie del corpo, o cellule T CD8.
Il presente studio di Alexander Lercher, Anannya Bhattacharya et al. è il risultato di collaborazioni interdisciplinari con ricercatori dell'Università di Medicina di Vienna e dell'Università di Medicina Veterinaria di Vienna (Austria), nonché dalla Hannover Medical School (Germania), l'Ospedale Cantonale di San Gallo (Svizzera) e la società Bio-Cancer Treatment International Ltd (Cina). Lo studio è stato concepito come un approccio imparziale integrativo per studiare i cambiamenti molecolari nel fegato durante l'infezione cronica. Accanto ai cambiamenti infiammatori previsti, gli autori hanno identificato interessanti cambiamenti nel metabolismo degli epatociti. Molte vie metaboliche centrali, tra questi il ciclo dell'urea, sono stati trovati per essere repressi su infezione. Il ciclo dell'urea è essenziale per rimuovere l'ammoniaca tossica dal corpo per prevenire danni al cervello. Sorprendentemente, i ricercatori hanno identificato la via di segnalazione delle citochine antivirali degli interferoni di tipo I (IFN-I) come regolatore del ciclo dell'urea. Ciò ha provocato concentrazioni ematiche alterate degli amminoacidi arginina e ornitina. "Un esperimento chiave per noi è stato che quando abbiamo rimosso il recettore per l'IFN-I sulla superficie degli epatociti, non abbiamo più visto questi cambiamenti metabolici", dice Alexander Lercher, primo autore dello studio e dottorando nel laboratorio del CeMM Principal Investigator Andreas Bergthaler. È stato scoperto che i cambiamenti sistemici dell'arginina e dell'ornitina inibiscono le risposte antivirali delle cellule T CD8 e riducono il danno epatico.
Una delle rivelazioni più importanti di questo studio è stata l'identificazione della segnalazione dell'IFN-I come regolatore principale per la repressione dei processi metabolici negli epatociti dopo l'infezione. "Siamo rimasti davvero sorpresi dal fatto che una molecola antivirale influisca su processi biologici vitali come il ciclo dell'urea durante l'infezione", dice Michael Trauner, coautore dello studio e capo del Dipartimento di Gastroenterologia ed Epatologia dell'Università di Medicina di Vienna. Insieme, questi risultati gettano nuova luce su come il sistema immunitario del corpo si è evoluto per regolare il metabolismo epatico che modula le risposte delle cellule T CD8 e riduce il danno tissutale collaterale durante l'infezione. Andreas Bergthaler:"Consideriamo questo studio un importante contributo al campo dell'immunometabolismo sistemico. Evidenzia anche il ruolo centrale del fegato per il nostro sistema immunitario e come gli organi del corpo comunicano attraverso i metaboliti". Nel futuro, tali risultati possono essere sfruttati per intervenire terapeuticamente con la regolazione dei processi metabolici per modulare le risposte delle cellule T CD8 in diverse malattie come infezioni, cancro e autoimmunità.
 I probiotici possono aiutare a frenare la malnutrizione nei prossimi due decenni,
I probiotici possono aiutare a frenare la malnutrizione nei prossimi due decenni,
 Come fai a sapere se hai un'infezione renale?
Come fai a sapere se hai un'infezione renale?
 Hai cacca perfetta?
Hai cacca perfetta?
 Colite ulcerosa e un microbo mancante nell'intestino
Colite ulcerosa e un microbo mancante nell'intestino
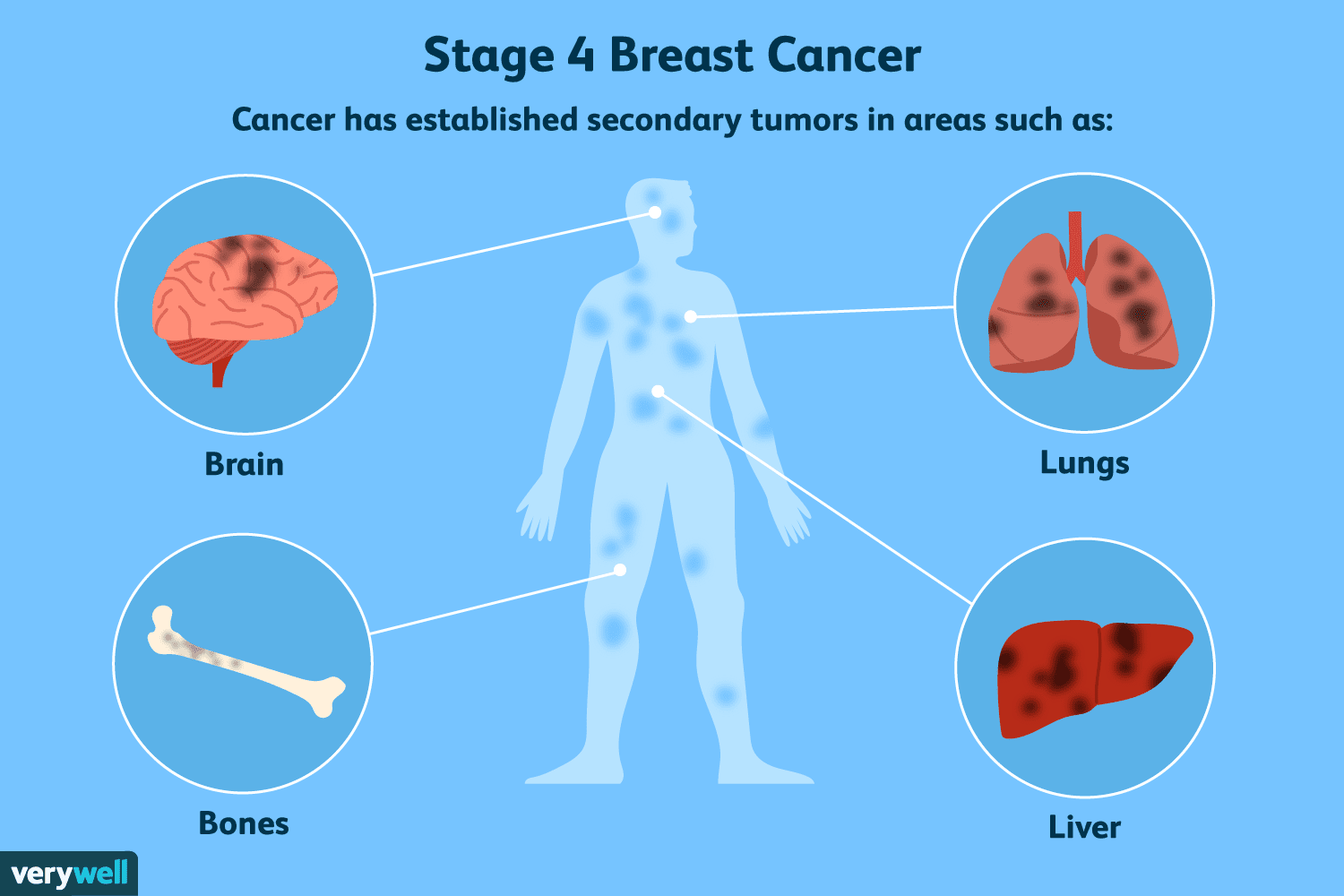 Dove può diffondersi il cancro al seno
Dove può diffondersi il cancro al seno
 I test della vita sono progettati per rivelare le convinzioni
I test della vita sono progettati per rivelare le convinzioni
 Che cos'è la terapia con fasci di protoni per il cancro?
La terapia con fasci di protoni per il cancro è simile alla radioterapia ma utilizza protoni ad alta energia invece di fotoni o raggi X per danneggiare i tumori. Di solito è usato per i tumori allo st
Che cos'è la terapia con fasci di protoni per il cancro?
La terapia con fasci di protoni per il cancro è simile alla radioterapia ma utilizza protoni ad alta energia invece di fotoni o raggi X per danneggiare i tumori. Di solito è usato per i tumori allo st
 Cancro al pancreas
Il cancro al pancreas è una crescita anormale e incontrollata delle cellule del pancreas. Cancro al pancreas è un termine ampio per qualsiasi tipo di cancro che inizia allinterno del pancreas. Ci son
Cancro al pancreas
Il cancro al pancreas è una crescita anormale e incontrollata delle cellule del pancreas. Cancro al pancreas è un termine ampio per qualsiasi tipo di cancro che inizia allinterno del pancreas. Ci son
 Malattia diverticolare
Malattia diverticolare e diverticolosi sono termini intercambiabili che indicano la presenza di diverticoli nellintestino crasso (colon). I diverticoli sono piccole sacche del rivestimento del colon c
Malattia diverticolare
Malattia diverticolare e diverticolosi sono termini intercambiabili che indicano la presenza di diverticoli nellintestino crasso (colon). I diverticoli sono piccole sacche del rivestimento del colon c