Een dergelijke solide tumor die zich goed aanpast aan hypoxie is PDAC, een agressieve vorm van alvleesklierkanker. Het is een van de meest voorkomende oorzaken van sterfgevallen door kanker, met een extreem lage overlevingskans. Aangezien specifieke genexpressieprofielen verschillende eigenschappen verlenen die tumorgroei bevorderen, het begrijpen van intratumorale variaties zal licht werpen op de complexe moleculaire mechanismen die ten grondslag liggen aan de pathogenese van PDAC. Terwijl traditionele sequentiestudies op tumorweefsel inzicht geven in de genexpressiepatronen van de tumor, ze werpen geen licht op ruimtelijke verschillen tussen verschillende regio's van de tumor, ook bekend als "intratumorale heterogeniteit." Bovendien, het effect van hypoxie op dergelijke variatie blijft slecht begrepen.
Nutsvoorzieningen, onderzoekers van het Tianjin Medical University Cancer Institute and Hospital (China) zijn een stap verder gegaan in het begrijpen van door hypoxie geïnduceerde variaties in genexpressie in PDAC, met behulp van "ruimtelijke transcriptomics" (ST). Met deze techniek kan de sequentie van individuele regio's van de tumor worden bepaald. Uitleg over de motivatie achter hun werk gepubliceerd in Kankerbiologie en geneeskunde , Professor Jihui Hao en Baoun Sun, de corresponderende auteurs, zeggen, "Veel patiënten met PDAC sterven uiteindelijk aan de ziekte door een gebrek aan effectieve behandelingen. Door behandeling geïnduceerde hypoxie kan schadelijke veranderingen in kankercellen veroorzaken; echter, de ruimtelijke verdeling van deze veranderingen is tot nu toe niet onderzocht."
De onderzoekers begonnen met het ontwikkelen van een "xenograft"-muismodel door menselijke PDAC te enten in de ischemische achterpoten (die bestaan uit een gebrek aan bloedtoevoer, resulterend in een hypoxische toestand) van de dieren. De tumoren werden geoogst en in verschillende secties gesneden, overeenkomend met verschillende regio's van de tumor. Deze secties werden vervolgens verwerkt en gehecht aan "vanggebieden" die nucleotideprobes bevatten die specifiek zijn voor verschillende genen en complementaire transcripten. Deze objectglaasjes werden verder geïncubeerd in reactiekamers voor amplificatie en voorbereiding van een sequencingbibliotheek. Volgende, een techniek genaamd "RNA-sequencing" werd uitgevoerd om differentiële genexpressiepatronen te identificeren in tumoren geïsoleerd uit hypoxische omstandigheden versus controles. De verkregen gegevens werden gescheiden in specifieke clusters in de hypoxische en controlegroep, gebaseerd op genfunctie uit eerdere literatuur.
interessant, genen die betrokken zijn bij de celcyclus, proliferatie, migratie, en metastase waren opgereguleerd in de controlesubgroepen, vergeleken met de hypoxische subgroepen. Eén dominante hypoxische subgroep geïsoleerd van het invasieve front van de tumor was geassocieerd met deze kenmerken, naast genen die geassocieerd zijn met stressrespons, metabolisme, en normale pancreasfuncties. Opmerkelijk, de expressie van hypoxie-gerelateerde genen was variabel in de subgroepen, het benadrukken van hun associatie met specifieke kankergerelateerde eigenschappen. Dit suggereert dat onder hypoxische omstandigheden, bepaalde subpopulaties van de kankercellen blijven overleven en worden veerkrachtig tegen hypoxische stress.
De onderzoekers valideerden de klinische relevantie van hun bevindingen verder door expressiepatronen te correleren met de prognose van de patiënt. Een hypoxisch genexpressiepatroon was inderdaad, geassocieerd met een slechtere prognose. Hun bevindingen suggereerden ook de betrokkenheid van de "PI3K" -signaleringsroute in de meest agressieve hypoxische subgroep. Tumoren met gensignaturen van deze subgroep kunnen, dus, reageren op behandeling met PI3K-remmers.
Algemeen, de studie benadrukt dat hypoxie een belangrijke rol speelt bij intratumorale heterogeniteit in PDAC en verheldert ruimtelijke moleculaire variaties in PDAC. Het begrijpen van de moleculaire kaart van PDAC's kan het ontwerp van gerichte behandelingen in de toekomst vergemakkelijken.
De klinische implicaties van hun bevindingen beschrijven, Professor Jihui Hao en Baocun Sun concluderen:" Onze resultaten combineren histologische en transcriptomische variaties in PDAC, het onthullen van enkele mechanismen van resistentie tegen geneesmiddelen en potentiële therapeutische doelen voor de behandeling van alvleesklierkanker t."
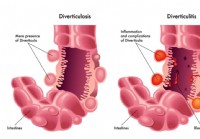 Divertikelziekte
Diverticulosis wordt gedefinieerd als de uitstulping van de mucosa en submucosa door de muscularis propria (vals diverticulum aangezien er slechts 2 lagen bij betrokken zijn). Dit is een veel voorkome
Divertikelziekte
Diverticulosis wordt gedefinieerd als de uitstulping van de mucosa en submucosa door de muscularis propria (vals diverticulum aangezien er slechts 2 lagen bij betrokken zijn). Dit is een veel voorkome
 Wat helpt constipatie snel?
Wat is constipatie? Constipatie houdt in dat u minder dan drie keer per week stoelgang maakt of dat u moeite heeft met ontlasting. Help constipatie snel door water te drinken, meer vezels te eten e
Wat helpt constipatie snel?
Wat is constipatie? Constipatie houdt in dat u minder dan drie keer per week stoelgang maakt of dat u moeite heeft met ontlasting. Help constipatie snel door water te drinken, meer vezels te eten e
 Spijsverteringsstoornissen:23 constipatiemythen en feiten
Zijn dagelijkse stoelgang normaal? Het is een mythe dat iedereen een dagelijkse stoelgang zou moeten hebben. De resultaten van onderzoeken tonen aan dat sommige mensen wel 3 keer per dag bewegen, te
Spijsverteringsstoornissen:23 constipatiemythen en feiten
Zijn dagelijkse stoelgang normaal? Het is een mythe dat iedereen een dagelijkse stoelgang zou moeten hebben. De resultaten van onderzoeken tonen aan dat sommige mensen wel 3 keer per dag bewegen, te