Een verhoging van de integrine-gekoppeld kinase niet-canoniek verleent NF-KB-gemedieerde groei voordelen aan maagkanker cellen door het activeren van ERK1 /2
Abstracte achtergrond
toegenomen activiteit of expressie van integrine-gekoppeld kinase (ILK) , die celhechting, migratie en proliferatie reguleert, tot oncogenese. We identificeerden de moleculaire basis voor de regulering van ILK en als alternatief rol bij het verlenen van ERK1 /2 /NF-KB gemedieerde groeivoordelen maagkanker cellen.
Resultaten
remmende ILK korte haarspeld RNA of T315, een vermeend ILK remmer afgeschaft NF-KB gemedieerde groei van het menselijke maagkanker cellen AGS, SNU-1, MKN45 en GES-1. ILK gestimuleerde Ras activiteit de c-Raf activeren /MEK1 /2 /ERK1 /2 /ribosomale S6 kinase /remmer van κBα /NF-kB- signalering door het vergemakkelijken van de vorming van de IQ-motief bevattende GTPase activerend eiwit 1 (IQGAP1) - Ras complex. Gedwongen enzymatische ILK expressie bevorderd celgroei door het vergemakkelijken van ERK1 /2 /NF-kB signalering. PI3K activatie of verlaagde PTEN expressie langdurige ERK1 /2 activatie door ILK beschermen tegen proteasoom-gemedieerde degradatie. C-terminus van heat shock verwante 70 interagerende proteïne, een HSP90-geassocieerde ubiquitine E3 ligase gemedieerd ILK ubiquitinering te PI3K- en HSP90-gereguleerde ILK stabilisatie en signalering controleren. Naast celgroei, de geïdentificeerde traject bevorderd celmigratie verkleinde gevoeligheid van maagkanker cellen aan de oncolytica 5-fluoruracil en cisplatine. Daarnaast exogene toediening van EGF evenals overexpressie van EGFR geactiveerd ILK- en IQGAP1 gereguleerde ERK1 /2 /NF-KB activering, celgroei, en migratie.
Conclusie
Een toename van ILK niet-kerkelijk bevordert ERK1 /2 /NF-KB-activering en leidt tot de groei van maagkanker cellen.
Sleutelwoorden
ILK Celgroei IQGAP1 ERK1 /2 NK-KB Achtergrond
integrine-gekoppeld kinase (ILK), een 59-kDa serine /threonine kinase, direct met het cytoplasmatische domein van β1 integrine [1]. ILK bestaat uit drie domeinen: N-terminale ankyrine (ANK) herhalingen, een centrale pleckstrin homologie (PH) -achtig domein en een C-terminaal kinase domein [2], [3]. Integrine gemedieerde cel-extracellulaire matrix (ECM) adhesie of groeifactoren geactiveerd fosfatidylinositol 3-kinase (PI3K) om membraangebonden PI 4,5-bisfosfaat (PIP2) fosforyleren en genereren PI 3,4,5-trifosfaat (PIP 3), dat bindt aan het PH-achtige domein van ILK en activeert ILK [4], [5]. Na ILK activatie kan het C-terminale kinasedomein van ILK binden aan verschillende eiwitten, waaronder AKT, affixin, β-Parvin, glycogeen synthase kinase (GSK) -3β, calponine-homologie met ILK-bindend eiwit, het 20-kDa regulerende lichte ketens van myosine (LC20), de-myosine targeting subunit van myosine lichte keten fosfatase (MYPT1), paxillin, α-NAC, en het eiwit fosfatase remmers PHI-1, KEPI en CPI-17 [2], [3] , [6], [7]. De N-terminale repeats ANK mediëren de interactie van ILK met ILKAP, een eiwit fosfatase 2C familielid en PINCH een LIM domein alleen adapter eiwit. ILK kan worden beschouwd als een PIP3 interagerende proteïne stroomafwaarts van PI3K; de effecten ervan worden geblokkeerd door fosfatase en tensin homoloog geschrapt op chromosoom 10 (PTEN) [8], [9]. PTEN onderdrukt tumoren door defosforyleren PIP3 [10], [11]
ILK speelt een vitale rol in het reguleren van verschillende cellulaire processen, waaronder proliferatie, overleving, migratie, celcyclus progressie en angiogenese.; verhoogde activiteit of expressie van ILK leidt tot oncogenese [2], [3]. Naast het moduleren van haar partner eiwitten voor cellulaire processen, is ILK verondersteld betrokken te zijn bij een intracellulaire signaaltransductie netwerk. Mechanistisch ILK direct fosforyleert AKT op Ser473 en GSK-3β on Ser9 [4], [9] te bemiddelen β-catenine translocatie en reguleren AP-1 expressie voor tumor celproliferatie [12]. NF-KB activering essentieel is voor ILK gemedieerde oncogene processen, zoals anti-apoptotische activiteit [13], overleving bevorderen [14], epitheliale-mesenchymale overgang [15], cellulaire uitbreiding en resistentie tegen apoptose [16], angiogenese [17 ] en migratie, invasie en metastase [18] - [20]. Daarnaast is NF-KB-activering vereist is voor de canonieke regulering van IKKα en IKKß de ILK /AKT pad. Celmigratie activeren, kan ILK de kleine GTPases RAC CDC42 [21] en activeren. Bovendien regelt ILK ERK1 /2 activatie in myogene differentiatie [22]. Verhoogde expressie van microRNA-143 en microRNA-145, die ILK targeten remt AKT en ERK1 /2 routes [23]. De onderliggende moleculaire mechanisme ILK-gemedieerde ERK1 /2 activatie blijft onbekend. Ondernemingen De stimulering van cellen door groeifactoren en cytokinen en cellulaire interactie met ECM toename ILK activiteit [24]. Naast de moleculaire regeling van PI3K /PTEN door ILK, Aoyagi et al. ILK geïdentificeerd als nieuwe hitteschokeiwit (HSP) 90 client eiwit en vonden dat farmacologisch remmen van HSP90 resulteerde in ILK afbraak in een proteasoom-afhankelijke wijze [25]. Bovendien is de HSP90-geassocieerde ubiquitine E3 ligase C-terminus van heat shock verwante 70 interagerende proteïne (CHIP) veroorzaakt ILK degradatie [26]. Hashiramoto et al. aangetoond dat HSP90 gestabiliseerd ILK en aanhoudende AKT en ERK1 /2 activatie [16]. Derhalve speculeren we een relatie tussen ILK stabiliteit en de activering van de stroomafwaartse kinasen. Ras /MAPK route signalering essentieel is voor het ontstaan van tumoren [27]. ILK verhoogde expressie gerelateerd is aan hoogwaardige maagkanker [28], prostaatkanker [29] en niet-kleincellig longcarcinoom [30], alhoewel cellen van deze kankers gewoonlijk herbergen Ras mutaties [31] - [33]. Targeting ILK met siRNA vermindert maagkanker invasie, proliferatie en groei door een onbekend mechanisme [34]. Over de mogelijkheid dat ILK fungeert stroomopwaarts van NF-KB door het regelen IKKα [13], die is betrokken bij maag- tumorigenese [35], wordt gespeculeerd ILK celgroei activeren via een NF-KB-gereguleerde route. Gebruik maagkanker cellen (AGS, MKN45 en SNU-1), onderzochten we de moleculaire regulatie van ILK en heeft een niet-canonieke route van ILK gereguleerde ERK1 /2 activatie van NF-KB gemedieerde groei van maagkanker cellen, migratie, en overleving bevorderen.
Resultaten
ILK activiteit en expressie essentieel zijn voor NF-KB gemedieerde celgroei
toegenomen activiteit of expressie van ILK tumorigenese bevordert door het bevorderen van celgroei [6]. RNAi-gebaseerde ILK silencing verzwakt gastrische kanker celgroei [34], terwijl ILK overexpressie komt voor bij maag- tumorigenese [28]. In humane maag tumoren en AGS-afgeleide knobbeltjes in BALB /c muizen, Ki-67-positieve prolifererende cellen samen tot expressie ILK getuige de fluorescentie gebaseerde immunokleuring (figuur 1A) en AEC-gebaseerde immunokleuring (aanvullende bestandsinformatie 1 brief materialen en methoden; Extra file 2: Figuur S1) experimenten. Om de mogelijke mechanismen onderzocht die ten grondslag liggen ILK-gemedieerde groei van maagkanker cellen, werden verschillende maagepitheel cellijnen worden gekenmerkt door hun verschillende celgroeisnelheden, die de AGS en SNU-1 cellen en lager voor de MKN45 en GES-1-cellen waren hoger en die in deze studie (aanvullende bestandsinformatie 3: Figuur S2A). Vergeleken met de MKN45 cellen, de AGS en SNU-1-cellen had ook ILK expressie verhoogd (Extra file 3: Figuur S2B en S2C). Een lentiviraal-gebaseerde shRNA werd gebruikt om ILK zwijgen
genetisch in de AGS, SNU-1, MKN45 en GES-1 maagepitheelcellen (Figuur 1B, bovenste paneel) en in A549 en H1975 menselijke long adenocarcinoom cellen, HK-2 humane renale proximale tubulaire epitheelcellen, en THP-1 menselijke monocytische cellen (Extra file 3: Figuur S2D). In deze cellen, ILK significant zwijgen (P Restaurant < 0,05) daalde celgroei (Figuur 1B; Extra file 3: Figuur S2E). Bovendien behandelen cellen met de ILK inhibitor T315 [36] significant (P
< 0,05) en dosisafhankelijke vertraagde celgroei (Figuur 1C) zonder cytotoxiciteit (gegevens niet getoond). Daarnaast verminderde vorming kolonie werd waargenomen in-ILK zwijgen opgelegd AGS cellen (Extra file 3: Figuur S2F). Zo gene silencing (Extra file 3: Figuur S2G) en farmacologische methoden (Extra file 3: Figuur S2H) naar ILK activiteit of overexpressie leidde tot de celcyclus bij de G
1-fase te onderdrukken. Deze resultaten tonen een groeibevorderende rol van ILK. Figuur 1 ILK expressie noodzakelijk is voor celgroei en NF-KB activering. (A) Representatieve fluorescentie gebaseerde immunohistochemische kleuring toont de co-expressie van ILK (Groen
) en Ki-67 (rode en) in humane maag tumoren en AGS-afgeleide knobbeltjes in BALB /c muizen. DAPI (blauw en) werd gebruikt voor nucleaire tegenkleuring. ILK + Ki-67 + cellen in het immunofluorescently lood weefselcoupes worden gepresenteerd als dot-plots van een FACS-achtige analyse met behulp van TissueQuest software. De cellen werden berekend als het percentage en het aantal cellen van de totale cellen (DAPI + cellen) per veld. (B) Western blot van ILK expressie in cellen die met shRNAs targeting ILK (shILK
) of een controle-luciferase (shLuc
). β-actine werd gebruikt als een interne controle. WST-8-gebaseerde test toont de remming van celgroei in ILK zwijgen cellen. (C) De dosis-afhankelijk effect van de remmer ILK T315 op de remming van celgroei AGS. (D) Vertegenwoordiger fluorescentie gebaseerde immunohistochemische kleuring toont de co-expressie van ILK (groen
) en gefosforyleerd NF-KB Ser536 (rode en) in de menselijke maag tumoren en AGS-afgeleide knobbeltjes in muizen. DAPI (blauw en) werd gebruikt voor nucleaire tegenkleuring. De dot-plots tonen de co-expressie van ILK en NF-KB Ser536. (E) logistische regressie-analyse toonde een correlatie tussen ILK, gefosforyleerde NF-KB Ser536 en Ki-67 93 in maagkanker monsters getest. R-kwadraat (R 2
) en P
waarden worden getoond. (F) tonen EMSA NF-KB activering. (G) Luciferase reporter assay toont de activering verhouding van NF-KB te Renilla luciferase in cellen behandeld met de NF-KB-remmer CAPE (25 ug /ml) regelen. (H) Groei van 25 ug /ml KAAPSE AGS behandelde cellen. (I) NF-KB-activering in shLuc- of shILK-getransfecteerde cellen. (J) NF-KB-activering na 6 h T315 behandeling AGS cellen. Voor celgroei, kolonievorming en luciferaseactiviteit, gegevens zijn gemiddelden ± SD van drie onafhankelijke experimenten. * P Restaurant < 0,05, ** P Restaurant < 0,01 en *** P Restaurant < 0,001 ten opzichte van de Dag 0 of relatieve controle. #P Restaurant < 0,05, ## P Restaurant < 0,01 en ### P
. ≪ 0,001 ten opzichte van shLuc
Om de eigenschappen van ILK gereguleerde celgroei te karakteriseren, NF- KB-signalering onderzocht vanwege ILK stroomopwaarts van NF-KB kan optreden door het regelen IKKα [13]. Door immunokleuring, de co-expressie van ILK en gefosforyleerde NF-KB (Ser536) waargenomen bij mens en muis gastrische weefsels (figuur 1D), en de co-expressie significant (P
< 0,01) en positief gecorreleerd met het aantal prolifererende cellen Dit wordt aangegeven door 55 triple-positieve gevallen van de totale 93 maagkanker monsters (Figuur 1E, aanvullende bestandsinformatie 4: Figuur S3). Immunokleuring voor NF-kB nucleaire translokatie (aanvullende bestandsinformatie 3: Figuur S2I), EMSA (figuur 1F) en promotor assays (figuur 1G) bevestigde de constitutieve activering van NF-KB in de AGS cellen maar niet in de cellen MKN45. Behandelen cellen met de NF-KB-remmer CAPE significant (P
< 0,001) verminderde NF-KB activering (figuur 1G) en celgroei (Figuur 1H). Ofwel ILK silencing (figuur 1I; Extra file 3: Figuur S2J) of T315 behandeling (figuur 1J) significant (P Restaurant < 0,05) gestopt met NF-KB-activiteit. Deze resultaten toonden dat ILK onontbeerlijk voor celgroei in de geteste omdat het vergemakkelijkt NF-KB-activering in maagkanker cellijnen.
ILK reguleert Ras activiteit door het vergemakkelijken van het complex van IQGAP1-Ras aan controle-MAPK geactiveerd NF-KB
Omdat AGS cellen herbergen PIK3CA Kopen en KRAS
mutaties [37], onderzochten we mogelijke regulerende effecten van ILK op het bijsturen van de NF-KB-activiteit door deze 2 kinasen [38]. Met een menselijk fosfo-MAPK Array Kit identificeerden we 10 kinasen die hoger werden uitgedrukt in de AGS cellen dan in de MKN45 cellen. Deze kinasen meestal gehandeld stroomafwaarts van de PI3K en MAPK signaalwegen (Extra file 5: Figuur S4A). Door Western blotting bevestigd we een verhoogde fosforylatie van AKT, ERK1 /2 en IKBa vergezeld van IKBa afbraak in de AGS cellen (Figuur 2A). De farmacologische remming van c-Raf, MEK1 /2 en PI3K significant (P
< 0,05) verlaagd celgroei (Figuur 2B), fosforylering IKBa (Ser32) en afbraak (figuur 2C) en NF-KB-activiteit ( figuur 2D), wat aangeeft dat zowel PI3K- en Ras-activering signaalroutes vergemakkelijkt NF-KB activering. De effecten van ILK zijn uitgebreid bestudeerd vanwege zijn interacties met cel groei en NF-KB-geassocieerde AKT [4], [9]. Verrassend genoeg heeft ILK silencing geen invloed AKT en GSK-3β fosforylering in de AGS en SNU-1-cellen, maar duidelijk verminderd c-Raf en ERK1 /2 activatie in alle geteste cellen (Figuur 2E; Extra file 5: Figuur S4B). AKT zonder deactivering evalueerden we een alternatieve route voor het activeren van NF-KB via een mechanisme met MAPK /p90RSK /IKBa signalering [38]. De knock-down van ILK
verminderde de meervoudige fosforylering van RSK (Thr573, Thr359 /Ser363 en Ser380) en IKBa fosforylering (Ser32) en verhoogde IKBa accumulatie (figuur 2E). Remmende MEK1 /2 veroorzaakt vergelijkbare effecten (Extra file 5: Figuur S4C) en een van de celcyclus bij de G 1-fase (Extra file 5: Figuur S4D). Een Ras pull-down test onthulde dat remming ILK veroorzaakt Ras deactivering zonder dat de stabiliteit van het Ras-eiwit (figuur 2F). Deze bevindingen toonden mogelijke niet-canonieke route voor ILK NF-KB moduleren door het reguleren Ras /c-Raf /MEK1 /2 /ERK1 /2 /IKBa signalering. Figuur 2 ILK-IQGAP1-Ras complex onderhoudt Ras activiteit c-Raf /MEK1 /2 /ERK1 /2 /STR /IKBa /NF-kB- signalering activeren. (A) Western blot van de aangegeven eiwitten in AGS en MKN45 cellen. β-actine werd gebruikt als een interne controle. AGS cellen behandeld met c-Raf remmer GW5074, MEK1 /2 remmers U0126 of PD98059 of PI3K remmer LY294002 gedurende 48 uur werden geëvalueerd voor hun groei (B), fosforylering van IKBa op Ser32 (pIκBα
) en totale proteïne (C ) en NF-KB activering (D). (E) In shLuc- of shILK-getransfecteerde cellen, Western blots tonen de expressie van het vermelde eiwit. β-actine werd gebruikt als een interne controle. (F) Ras activering assay tonen Ras-activiteit en eiwitexpressie in shLuc- en-shILK getransfecteerde AGS cellen. (G) Representatieve fluorescentie gebaseerde immunohistochemische kleuring toont de co-expressie van ILK (Groen
) en gefosforyleerd ERK1 /2 Tyr202 /Thr204 (rode en) in humane maag tumoren en AGS-afgeleide knobbeltjes in BALB /c muizen. DAPI (blauw en) werd gebruikt voor nucleaire tegenkleuring. De dot-plots tonen de co-expressie van de vermelde eiwitten. Controle en IQGAP1 siRNA getransfecteerde AGS cellen op 48 uur, de expressie van de vermelde eiwitten (H), NF-KB activering en celgroei (I) getoond. Eiwit lysaten geëxtraheerd uit onbehandelde AGS-cellen (J) of met shLuc en shILK transfectie (L, M) werden immunogeprecipiteerd (IP
) met controle IgG (K. IgG
) of met antilichamen tegen ILK, IQGAP1 en Ras . Immunoblots (IB
) tonen de expressie van ILK, IQGAP1 en Ras. (K) Vertegenwoordiger fluorescentie gebaseerde immunohistochemische kleuring die de co-expressie van ILK (groen
), IQGAP1 (rood
) en Ras (rode en) in AGS-cellen. DAPI (blauw en) werd gebruikt voor nucleaire tegenkleuring. Proliferatie en luciferaseactiviteit, gegevens zijn gemiddelden ± SD van drie onafhankelijke experimenten. ** P Restaurant < 0,01 en *** P Restaurant < 0,001 vergeleken met de controlegroep. Rechtop driehoek, verhoogde expressie; omgekeerde driehoek, verminderde expressie
ILK kan ERK1 /2 activatie te passen in het kader van celgroei en differentiatie [22].; Echter, de moleculaire regelgeving met betrekking tot Ras signalering niet gedocumenteerd [2], [3]. De co-expressie van ILK en gefosforyleerd ERK1 /2 (Tyr202 /Thr204) is aangetoond in humane maag tumoren en AGS-afgeleide knobbeltjes in BALB /c-muizen (figuur 2G). ILK interageert met IQGAP1 [7], een Ras GTPase-activerende-achtige eiwit dat onvergelijkbaar is met GAP, die Ras transformeert naar zijn inactieve toestand. Omdat IQGAP1 regelt Ras /MAPK signalering is oncogene [39], [40]. De expressie van IQGAP familie eiwitten was onveranderd in de AGS en MKN45 cellen, zelfs na ILK silencing (Extra file 5: Figuur S4E). Echter, zwijgen oncogene IQGAP1, maar niet IQGAP3, (Extra file 5: Figuur S4F-S4H) c-Raf /MEK1 /2 /ERK1 /2 /RSK signalering (figuur 2H), NF-KB-activiteit en groei doeltreffend geremd cel ( Figuur 2I). Door het uitvoeren van een co-immunoprecipitatie assay, hebben we aangetoond een potentiële complex herbergen ILK, IQGAP1 en Ras (figuur 2J). Immunokleuring bevestigde dat ILK werd tezamen tot expressie gebracht op een niveau vergelijkbaar met die van IQGAP1 en Ras (figuur 2K; Extra file 6: Figuur S5). Met name silencing ILK verstoorde de IQGAP1-Ras complex (Figuur 2L en 2M). Deze resultaten toonden dat ILK vergemakkelijkt de vorming van de IQGAP1-Ras complex Ras activiteit behouden.
Enzymatische ILK moduleert de vorming van het complex IQGAP1-Ras en ERK1 /2-gemedieerde celgroei Home Onze resultaten toonden dat farmacologische remming ILK verminderde celgroei, met vermelding van de essentiële rol van de enzymatische activiteit van ILK. Verder remmen ILK door de genetische aanpak verstoord IQGAP1-gemedieerde Ras signalering. ILK remmende activiteit met farmacologisch T315 (figuur 3A) of genetisch door transfecteren van de enzymatische mutant ILK A262V [41] (figuur 3B) ook maakte de vorming van de IQGAP1-Ras complex in de AGS cellen. Drie afgeknotte gebieden van ILK (figuur 3C) werden tot overexpressie gebracht in de cellen MKN45 het domein essentieel voor het behoud van de IQGAP1-Ras complex identificeren. Co-immunoprecipitatie assays aangetoond dat overexpressie ILK constructen herbergen PH en katalytisch kinasedomein gebieden immunogeprecipiteerd met IQGAP1 en Ras (Figuur 3D). Dus enkel kinasedomein bevattende ILK geactiveerde ERK1 /2 (figuur 3E). Vergeleken met de volledige lengte ILK (ILK 1-452) transfecteren van de dood kinase mutant ILK A262V niet geactiveerd ERK1 /2 (Figuur 3F). Aanvullende experimenten toonden dat alleen kinase-domein bevattende ILK verhoogd MEK1 /2-gereguleerde NF-KB activering (Figuur 3G), gevolgd door MEK1 /2 en NF-KB-gereguleerde celgroei (Figuur 3H) MKN45 in de cellen. Deze resultaten toonden aan dat enzymatische ILK gemedieerde vorming van de IQGAP1-Ras complex ERK1 /2 en NF-kB gemedieerde celgroei veroorzaken. Figuur 3 Gedwongen ILK expressie faciliteert celgroei door het induceren van ERK1 /2 /NF-KB activering. Eiwit geëxtraheerd uit lysaten AGS cellen behandeld met T315 (A) of getransfecteerd met Myc-gemerkte mutant DDK ILKA262V (B) werden immunogeprecipiteerd (IP
) met antilichamen tegen ILK. Immunoblots (IB
) tonen de expressie van ILK, IQGAP1 en Ras. Plasmiden op basis van pcDNA3.1-Flag-ILK bevatten full-length ILK (ILK 1
-452
), fragment 171-452 (ILK
171
-452
) , fragment 1-170 (ILK 1
-170
) (C) of Myc-gemerkte mutant DDK ILKA262V werden getransfecteerd in cellen MKN45. (D), co-immunoprecipitatie van de Vlag met de aangegeven eiwitten wordt weergegeven met behulp van western blotting. Vergeleken met pcDNA3.1-Flag (Vlag
) alleen, western blots tonen de expressie van gefosforyleerd ERK1 /2 bij Tyr202 /Thr204 (ERK1 Twitter /2
) (E, F). β-actine werd gebruikt als een interne controle. NF-KB activering (G) en celgroei (H) werden ook gedetecteerd in de afwezigheid of aanwezigheid van PD98059 en cape. Gegevens zijn gemiddelde ± SD van drie onafhankelijke experimenten. ** P Restaurant < 0,01 vergeleken met de controlegroep. ## P Restaurant < 0,01, vergeleken met ILK1-452. Rechtopstaande driehoek, verhoogde expressie.
PI3K activatie en verminderde PTEN expressie te vergemakkelijken ERK1 /2 /NF-KB-activering door het stabiliseren ILK
Omdat ILK afhankelijk van PI3K-gemedieerde PIP3 generatie van de activering [4], groeifactor- en integrine gemedieerde activering PI3K PI3K of een mutatie in de AGS cellen [37] kan bijdragen tot expressie en activatie soortgenoten. In vergelijking met de groei van de MKN45 cellen, de groei van de AGS cellen werd niet beïnvloed door verhoogde IL-6 niveaus [42], en de expressie van β1 en β3 integrinen niet toegenomen (aanvullende bestandsinformatie 7: Figuur S6). We verder bevestigd dat PIP3 generatie hoger in de PI3K-gemuteerde AGS cellen (Figuur 4A). De relaties tussen de PI3K, ILK en Ras signaalwegen onderzoeken werden de AGS cellen behandeld met MEK1 /2, PI3K, ILK of Ras remmer voor verschillende tijdsduren. Om 6 uur na de behandeling, T315 enigszins geremd MEK1 /2 en ERK1 /2 fosforylering (Extra file 8: Figuur S7). Op 24 uur na behandeling, remming PI3K verstoord ILK expressie, gevolgd door MEK1 /2 /ERK1 /2 deactivering 24 uur na de behandeling (Figuur 4B). Echter, Ras remming niet AKT of ILK in de AGS cellen uit te schakelen, hoewel Ras PI3K activering [27] kan bemiddelen. Net als bij de ILK tot zwijgen AGS cellen, zowel MKN45 en LY294002 gestimuleerde AGS cellen vertoonden verminderde Ras-activiteit (Figuur 4C). De vertaling remmer cycloheximide gefaciliteerd-LY294002 geïnduceerde ILK downregulatie (figuur 4D) en de proteasoomremmer MG132 teruggedraaid de hiervoor genoemde effect en ERK1 /2 inactivatie (Figuur 4E). De tumor suppressor fosfatase PTEN regelt negatief PI3K /PDK1 /AKT signalering [10], [11] en ILK activiteit [8], [9], en de AGS cellen vertoonden een lage expressie van PTEN (Figuur 2A) [43]. De geforceerde expressie van PTEN in de AGS cellen niet alleen verzwakt de constitutieve fosforylering van PDK1, AKT en PAK1 maar ook geremd ILK expressie, ERK1 /2 fosforylering (figuur 4F) en NF-KB-activering (figuur 4G). Deze resultaten gaven aan dat PI3K activatie en verminderde PTEN expressie stabiliseren ILK aan ERK1 /2 /NF-KB-activering reguleren. Figuur 4 PI3K activatie en verminderde PTEN expressie te vergemakkelijken ERK1 /2 /NF-KB activering door de ILK stabilisatie. (A) Een PIP3 Massa ELISA kit werd gebruikt om PI3K-activiteit bepaald door meting van de hoeveelheid PIP3 onttrokken onbehandelde AGS en MKN45 cellen en van AGS cellen behandeld met LY294002 gedurende 24 uur. (B) AGS cellen werden behandeld met PD98059, LY294002, T315 of Ras remmer FTI-277 gedurende de aangegeven tijden. Western blots tonen de expressie van het vermelde eiwit. β-actine werd gebruikt als een interne controle. (C) Ras-activiteit werd gedetecteerd in AGS, MKN45, en LY294002 AGS behandelde cellen na 24 uur. Western blots tonen de expressie van de vermelde eiwitten in AGS cellen voorbehandeld met de vertaling remmer cycloheximide (CHX
) (D) of proteasoom inhibitor MG132 (E) gedurende 0,5 uur en vervolgens behandeld met LY294002 gedurende 24 uur. PTEN werd in AGS cellen overexpressie door het gebruik van pcDNA3.1-GFP-PTEN (PTEN
). Western blots tonen de expressie van de aangegeven eiwitten vergeleken met pcDNA3.1-GFP (Vector
) transfectie (F) en NF-KB activering (G) werd ook bepaald. Voor kinase en luciferaseactiviteit, gegevens zijn gemiddelden ± SD van drie onafhankelijke experimenten. * P Restaurant < 0,05, ** P Restaurant < 0,01 en *** P Restaurant < 0,001 vergeleken met de controlegroep. Rechtop driehoek, verhoogde expressie; omgekeerde driehoek, verminderde expressie.
-HSP90 geassocieerde E3 ligase CHIP negatieve controles ILK stabilisatie, ERK1 /2 /NF-KB-activering, en de celgroei
Door verdere controle van de onderliggende mechanisme ILK destabilisatie, onze resultaten toonden aan dat AKT remming had geen invloed op ILK stabiliteit, terwijl PI3K remming beïnvloed ILK stabiliteit (Extra file 9: Figuur S8). HSP90 werd vervolgens onderzocht omdat ILK degradatie [25] kunnen veroorzaken. Vergelijkbaar met de resultaten van PI3K remming, shRNA-gebaseerde (figuur 5A) of farmacologische remming van HSP90 (aanvullende bestandsinformatie 10 Figuur S9A) vertraagd niet alleen PDK1 /AKT fosforylering maar ook c-Raf /MEK1 /2 /ERK1 /2 activatie na ILK afbraak. Bovendien, genetisch of farmacologisch remmen HSP90 door behandeling met 17-AAG of de HDAC-inhibitor SAHA, die HSP90 opsluit in een geacetyleerde, enzymatisch inactieve toestand, verzwakte NF-KB-activiteit (Figuur 5B; Extra file 10: Figuur S9B) en de celgroei ( figuur 5C). Gelijktijdige behandeling met MG132 redde de effecten van 17-AAG (figuur 5D) en SAHA op ILK afbraak en ERK1 /2 inactivatie (Extra file 10: Figuur S9C). In de MKN45 cellen behandeld met MG132 verhoogde expressie ILK, MEK1 /2 en ERK1 /2 fosforylering (aanvullende bestandsinformatie 11 Figuur S10) en NF-KB activering (gegevens niet getoond). Co-immunoprecipitatie toonde de vorming van het HSP90-complex ILK (gegevens niet getoond). Met behulp van een lentivirale shRNA gebaseerde benadering (Figuur 5E), HSP90-geassocieerde E3 ligasen, inclusief CHIP, Cullin 4A en 4B Cullin [26], [44], [45], werden onderzocht voor hun rol bij ILK afbraak. De resultaten toonden aan dat slechts silencing CHIP gered ILK afbraak en ERK1 /2 inactivatie (Figuur 5F), NF-KB deactivering (figuur 5G) en celgroei inhibitie (figuur 5H) na de farmacologische inhibitie van PI3K en HSP90. CHIP nodig was voor ILK ubiquitinatie in-LY294002 AGS behandelde cellen (figuur 5I). Deze resultaten toonden dat HSP90 /CHIP signalering regelt PI3K-gemedieerde ILK stabilisatie en ILK-gereguleerde ERK1 //NF-KB activering 2 en vergemakkelijkt daardoor celgroei. Figuur 5 CHIP bepaalt ILK destabilisatie, ERK1 /2 /NF-kB- inactivering van celgroeiremming na PI3K /HSP90 inactivatie. AGS-cellen werden getransfecteerd met shLuc of shHSP90 of voorbehandeld met de HSP90-remmer 17 AAG (0,1 uM) gedurende 48 uur. Western blots tonen de expressie van de vermelde eiwitten (A) en NF-KB activering (B) en celgroei (C) werden bepaald. (D) MG132 voorbehandeling (0,5 uur) omgekeerd ILK expressie en gefosforyleerd ERK1 /2 bij Tyr202 /Thr204 (ERK1 Twitter /2
) in 17-AAG-behandelde AGS cellen. (E) CHIP, Cullin 4A en 4B Cullin werden het zwijgen opgelegd in AGS cellen door shRNAs. shRNA-getransfecteerde cellen werden behandeld met LY294002 of 17-AAG gedurende 24 uur. Western blotting toonde de expressie van ILK en gefosforyleerd ERK1 /2 in Tyr202 /Thr204 (ERK1
/2
) (F) en NF-KB activering (G) en celgroei (H) werden ook bepaald. (I) In shLuc- en shCHIP AGS-getransfecteerde cellen behandeld met LY294002, ILK werd immunologisch neergeslagen en de ubiquitinering werd gesondeerd. Voor western blot analyse werd β-actine gebruikt als een interne controle. Voor luciferaseactiviteit en celgroei, gegevens zijn gemiddelden ± SD van drie onafhankelijke experimenten. ** P Restaurant < 0,01 en *** P Restaurant < 0,001 vergeleken met de controlegroep. ## P Restaurant < 0,01 en ### P Restaurant < 0,001 ten opzichte van shLuc of DMSO. NS: niet significant. Rechtop driehoek, verhoogde expressie; omgekeerde driehoek, verminderde expressie.
PI3K /HSP90 /CHIP /ILK /IQGAP1 /ERK1 /2 /NF-kB signalering bijdraagt aan de migratie en de gevoeligheid cel tot 5-FU en cisplatine
Verhoogde ILK activiteit of expressie kan regelen oncogene processen, waaronder celproliferatie, migratie en overleving [3], [6]. We bestudeerden de mogelijke betrokkenheid van de geïdentificeerde PI3K /HSP90 /CHIP /ILK /IQGAP1 /ERK1 /2 /NF-kB signaalweg in de celgroei voordelen. Vergeleken met de MKN45 cellen, toonde de AGS cellen verhoogde trekkende activiteit; echter ILK of IQGAP1 zwijgen significant (P Restaurant < 0,001) afgeschaft celmigratie (Extra file 12: Figuur S11A). Farmacologisch blokkeren PI3K /HSP90 /ILK /MEK1 /2 /NF-kB signalering in de AGS cellen ook aanzienlijk (P Restaurant < 0,001) verzwakt het vermogen tot migratie (Extra file 12: Figuur S11B) en CHIP knockdown aanzienlijk teruggedraaid de remmende effecten van de remming van PI3K en HSP90 (figuur 6A; aanvullende bestandsinformatie 12 Figuur S11C). De antikankermiddelen 5-FU en cisplatine worden gewoonlijk gebruikt bij de behandeling van maagkanker [46]. Behandelen van de AGS cellen met 5-FU en cisplatine, met name na ILK of IQGAP1 silencing veroorzaakt verhoogde gevoeligheid voor apoptose (figuur 6B). T315 verhoogde de gevoeligheid van de AGS cellen 5-FU en cisplatine (aanvullende bestandsinformatie 12 Figuur S11D). Farmacologisch remmende PI3K /HSP90 /ILK /MEK1 /2 /NF-kB signalering ook gevoelig de AGS cellen om 5-FU-geïnduceerde apoptose (figuur 6C), terwijl CHIP silencing vertraagd de synergetische effecten van LY294002 en 17-AAG op 5-FU geïnduceerde apoptose (figuur 6D). Daarentegen zijn de overexpressie van ILK bevattende een katalytisch kinasedomein, waaronder ILK 1-452 en ILK 171-452, verbeterde MEK1 /2 /NF-KB gereguleerde celmigratie (Figuur 6E) en celoverleving na behandeling met 5-FU (figuur 6F). Deze resultaten gaven een gemeenschappelijke effecten van ILK en IQGAP1 op ERK1 /2 /NF-KB-activering voor celmigratie en overleving. Figuur 6 PI3K /HSP90 /CHIP /ILK /ERK1 /2 /NF-kB signalering bepaalt celmigratie en regelt gevoeligheid voor de anti-kankermiddelen 5-FU en cisplatine. (A) migratie activiteit werd getest in shLuc- of shCHIP AGS-getransfecteerde cellen behandeld met LY294002 (25 uM) en 17-AAG (0,2 uM) gedurende 12 h. shLuc, controle siRNA of DMSO werden als negatieve controles. Het aantal gemigreerde cellen op de waargenomen velden worden getoond. PI kleuring gevolgd door flow cytometry analyse toonde aan 5-FU en cisplatine geïnduceerde apoptose gedurende 2 dagen in shILK- of siIQGAP1 AGS-getransfecteerde cellen (B), AGS cellen voorbehandeld met de aangegeven remmers 0,5 uur (C) en shLuc- of shCHIP AGS-getransfecteerde cellen behandeld met LY294002 of 17-AAG (D). shLuc, controle siRNA of DMSO werden als negatieve controles. Plasmiden op basis van pcDNA3.1-Flag-ILK bevatten full-length ILK (ILK 1
-452
), fragment 171-452 (ILK
171
-452
) of fragment 1-170 (ILK 1
-170
) werden getransfecteerd in MKN45 cellen. Vergeleken met pcDNA3.1-vlag (vlag
) in, celmigratie (E) en apoptose geïnduceerd door 5-FU (5 uM) (F) zijn in de afwezigheid of aanwezigheid van PD98059 en cape. Gegevens zijn gemiddelde ± SD van drie onafhankelijke experimenten. * P Restaurant < 0,05, ** P Restaurant < 0,01 en *** P Restaurant < 0,001 vergeleken met de controlegroep. #P Restaurant < 0,05, ## P Restaurant < 0,01 en ### P Restaurant < 0,001 vergeleken met de controlegroep. NS:. Niet significant
EGFR signalering regelt ILK /IQGAP1 tot ERK1 /2, NF-KB en celmigratie en proliferatie activeren Belgique Om de rol van ILK /IQGAP1-gemedieerde ERK1 /2 en NF-KB-activering te verifiëren onderzochten we EGF /EGFR signalering zoals eerder beschreven [47], [48]. β-actine werd gebruikt als een interne controle. β-actine werd gebruikt als een interne controle. β-actine werd gebruikt als een interne controle. β-actine werd gebruikt als een interne controle. β-actine werd gebruikt als een interne controle. β-actine werd gebruikt als een interne controle. β-actine werd gebruikt als een interne controle. * P Restaurant < β-actine werd gebruikt als een interne controle. * P Restaurant < β-actine werd gebruikt als een interne controle. β-actine werd gebruikt als een interne controle. ** P Restaurant < * P Restaurant <
 Rotavirus speelt rol bij ontwikkeling van type 1 diabetes
Rotavirus speelt rol bij ontwikkeling van type 1 diabetes
 Drug vermindert complicaties bij chirurgische abortussen:onderzoek
Drug vermindert complicaties bij chirurgische abortussen:onderzoek
 Spijsverteringsstoornissen:de slechtste voedingsmiddelen voor de spijsvertering
Spijsverteringsstoornissen:de slechtste voedingsmiddelen voor de spijsvertering
 Bloedonderzoek voor microbieel DNA kan waarschuwen voor kanker
Bloedonderzoek voor microbieel DNA kan waarschuwen voor kanker
 Hoe lang mag je een galstent laten zitten?
Hoe lang mag je een galstent laten zitten?
 Hoe maak je SCD legale citroenkip die je van je sokken stoot!
Hoe maak je SCD legale citroenkip die je van je sokken stoot!
 Is capsule-endoscopie veilig?
Wat is capsule-endoscopie? Een capsule-endoscoop bevat een camera en lampjes in een doorzichtige behuizing. Een patiënt slikt de capsule in en de camera maakt vergrote fotos en videos voor de diagn
Is capsule-endoscopie veilig?
Wat is capsule-endoscopie? Een capsule-endoscoop bevat een camera en lampjes in een doorzichtige behuizing. Een patiënt slikt de capsule in en de camera maakt vergrote fotos en videos voor de diagn
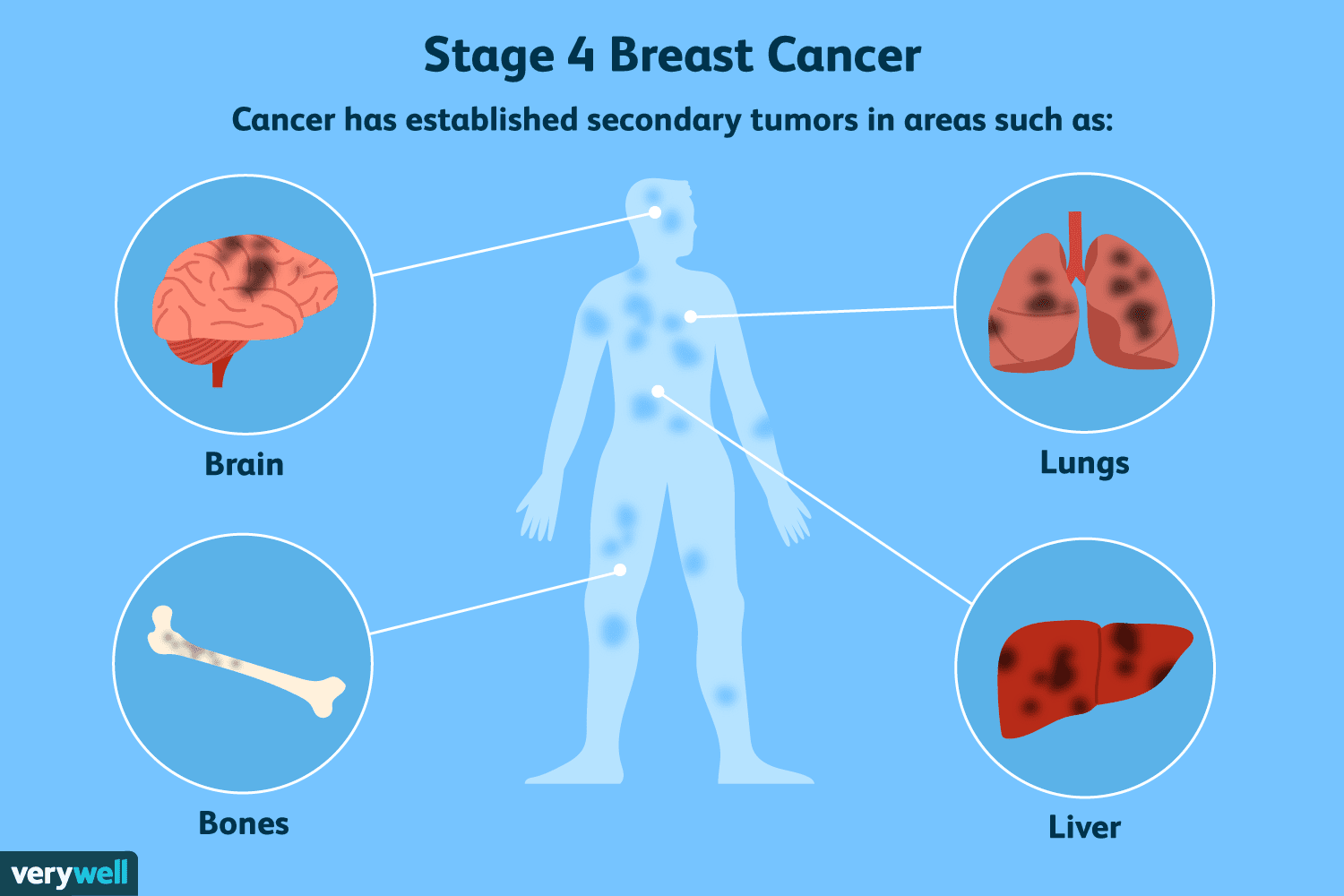 Een overzicht van fase 4 borstkanker
Fase 4 is de meest geavanceerde vorm van borstkanker. Het wordt ook wel uitgezaaide borstkanker genoemd omdat de maligniteit zich vanuit de borst heeft verspreid (uitgezaaid) naar andere delen van het
Een overzicht van fase 4 borstkanker
Fase 4 is de meest geavanceerde vorm van borstkanker. Het wordt ook wel uitgezaaide borstkanker genoemd omdat de maligniteit zich vanuit de borst heeft verspreid (uitgezaaid) naar andere delen van het
 Constipatie
Chronische, langdurige of terugkerende constipatie is een grotere uitdaging om te behandelen dan gewone eenvoudige constipatie. Mensen met constipatie kunnen een of meer van… verminderde ontlastings
Constipatie
Chronische, langdurige of terugkerende constipatie is een grotere uitdaging om te behandelen dan gewone eenvoudige constipatie. Mensen met constipatie kunnen een of meer van… verminderde ontlastings