Downregulatie van bindweefselgroeifactor remt de groei en invasie van maagkanker cellen en vermindert peritoneale verspreiding
Abstract achtergrond
Bindweefsel groeifactor (CTGF) is aangetoond dat het een rol bij tumorontwikkeling en progressie. De rol van CTGF bij maagkanker grotendeels onbekend.
Resultaten
In deze studie hebben we aangetoond dat CTGF was sterk tot expressie gebracht in maagkanker weefsels vergeleken met matchende normale gastrische weefsels. De CTGF-expressie in tumorweefsel werd geassocieerd met histologische graad, lymfeklier en peritoneale verspreiding (P < 0,05). Patiënten met een positieve CTGF meningsuiting hadden beduidend lagere cumulatieve postoperatieve 5 jaars overleving dan die met negatieve CTGF expressie (22,9% versus 48,1%, P < 0,001). We hebben aangetoond dat knockdown van CTGF-expressie significant remde celgroei van maagkanker cellen en verminderde cycline D
1 expressie. Bovendien knockdown van CTGF-expressie ook duidelijk verminderd de migratie en invasie van maagkanker cellen en verminderde de expressie van matrix metalloproteïnase (MMP) -2 en MMP-9. In dierproeven zijn dat naakt muizen geïnjecteerd met de CTGF knockdown stabiele cellijnen bevatte een kleiner aantal peritoneale zaaien knobbeltjes dan de controle cellijnen.
Conclusies
Deze gegevens suggereren dat CTGF speelt een belangrijke rol bij de celgroei en invasie in menselijke maagkanker en het lijkt om een potentiële prognostische marker voor patiënten met maagkanker zijn.
Sleutelwoorden
Bindweefsel groeifactor maag gezwellen Cell proliferatie Invasiviteit peritoneale verspreiding Inleiding
Ondanks de aanzienlijke vooruitgang in het onderzoek naar kanker, blijft kanker een wereldwijd gezondheidsprobleem en sterfte als gevolg van kanker blijft hoog [1]. Maagkanker is de tweede leidende oorzaak van kanker-gerelateerde sterfte in de wereld, terwijl lijkt er een dalende trend in voorkomen, met name in westerse landen; is het nog steeds vaak gemeld in China en Japan [2, 3]. Hoewel de prognose van patiënten met gevorderde maagkanker lijkt te zijn verbeterd tengevolge van de standaardisering van chirurgische technieken en recente vooruitgang in de chemotherapie, het 5-jaar postoperatieve overleving blijft laag [4, 5]. Peritoneale metastase is de meest voorkomende en belangrijke oorzaak van sterfte na operatie van maagkanker [6, 7]. De mechanismen van peritoneale metastasen niet duidelijk gedefinieerd.
Bindweefsel groeifactor (CTGF), ook bekend als CCN2, is een lid van de familie CCN, waaronder cysteïnerijke eiwitten 61 (Cyr61), ook bekend als CCN1 en nefroblastoom-overexpressie gebracht gen (november), ook bekend als CCN3, alsmede WISP-1 /elm1 (CCN4), WISP-2 /rcop1 (CCN5) en WISP-3 (CCN6) [8, 9]. CTGF wordt beschouwd als een multifunctionele modulator signalering betrokken bij een groot aantal biologische of pathologische processen, zoals angiogenese, osteogenese, fibrose van de nieren en de huid, en tumorontwikkeling [10-12] zijn. Hoewel de rol van CCN2 normale weefselfibrose goed bestudeerd is [13], de functie van CCN2 bij kanker is niet goed begrepen. Interessant is CCN2 geïdentificeerd als een oncogen in diverse soorten kanker, maar wordt beschouwd als een tumor-suppressor gen in andere vormen van kanker [14]. Overexpressie van CTGF wordt gevonden bij prostaatkanker [15], gliomen [16], borstkanker [17], en volwassen acute lymfoblastische leukemie [18]. Verhoogde CTGF-expressie is geassocieerd met de progressie van cervicale tumoren [19] en oesofageale plaveiselcelcarcinoom [20]. Omgekeerd zal longadenocarcinomen [21] en darmkanker [22], overexpressie van CTGF remt invasie en metastase van kankercellen zowel in vitro als in vivo.
Klinische studies hebben aangetoond dat overexpressie van CTGF was significant gecorreleerd met lymfeknoop metastase en slechte prognose bij patiënten met maagkanker [23, 24]. De precieze rol van CTGF bij maagkanker is nog onbekend. In deze studie hebben we aangetoond CTGF-expressie in weefsels maagkanker. We vonden dat CTGF werd overexpressie in maagkanker, en de expressie werd geassocieerd met agressief gedrag van maagkanker. Vervolgens gebruikt siRNA technologie endogene CTGF-expressie bij maagkanker cellen knockdown. We hebben aangetoond dat neerwaartse regulatie van CTGF remde de groei en invasie van maagkanker in vitro en verzwakt peritoneale verspreiding in vivo. Onze studie benadrukt sterk het belang van CTGF in de groei en de invasie van maagkanker, en kan een therapeutisch doel te voorzien in maagkanker.
Materialen en methoden
reagentia
Dimethylsulfoxide (DMSO) en trypsine werden gekocht bij Sigma (St. Louis, MO, USA). DMEM, streptomycine en andere celcultuur voorraden waren afkomstig GIBCOBRL (Grand Island, NY, USA). Foetaal runderserum was bij Hyclone (Logan, UT, USA). MTT [3- (4, 5-dimethylthiazol-2-yl) -2, 5-diphenyltrazolium bromide] werd verkregen van Fluka (Ronkonkoma, NY, USA). CTGF, cycline D1, matrix metalloproteïnase (MMP) -2, MMP-3, MMP-9 en GAPDH primair antilichaam, en tweede antilichaam Rhodamine (TRITC) geconjugeerd AffiniPure geit anti-muis IgG werden verkregen van Santa Cruz Biotechnology (Santa Cruz, CA, USA). CTGF ELISA kit werd gekocht bij R &D (Minneapolis, MN, USA). Trizol en Lipofectamine 2000 werden verkregen van Invitrogen (Carlsbad, CA, USA). SYBR @ Primescript ™ RT-PCR kit was uit Takara Biotechnology, Japan.
Weefselmonsters en immunohistochemische kleuring
Tumor monsters werden verkregen van 110 patiënten met maagkanker die een operatie onderging aan het Department of Surgical Oncology, First Affiliated Hospital van de China Medical University in de periode 2003-2005. Alle patiënten ondergingen gastrctomy, en hun klinische en pathologische gegevens beschikbaar waren. Normale maag weefsels werden uit de afgedekte distale weggesneden marge van maagkanker monsters. Alle chirurgische monsters werden onderzocht door ervaren pathologen en de distale weggesneden marge was tumorvrij. De verse weefsels werden gesneden in kleine stukjes, snel bevroren in vloeibare stikstof onmiddellijk en bewaard bij -80 ° C tot eiwitextractie. Het studieprotocol werd beoordeeld en goedgekeurd door de ethische commissie van de China Medical University goedgekeurd.
Voor immunohistochemische kleuring, 4 micrometer histologische secties werden van paraffine ontdaan met xyleen en gehydrateerd door middel van een gesorteerde reeks van alcohol. De plakjes werden vervolgens gekookt gedurende 10 minuten in 0,01 M citraatbuffer en endogene peroxidase werd geblokkeerd door incubatie in 0,3% H 2 O 2 in methanol gedurende 30 min. Niet-specifieke binding werd geblokkeerd door incuberen dia normale geit serum gedurende 30 minuten bij kamertemperatuur. De secties werden overnacht geïncubeerd bij 4 ° C met een 1:50 verdunning van primair antilichaam CTGF. De secties werden blootgesteld aan met biotine gemerkt secundair antilichaam gedurende 1 uur, een streptavidine-peroxidase reactiesysteem, en vervolgens ontwikkeld met DAB- H 2 O 2. Kleuring werd gescoord op de volgende schaal: 0, geen vlekken; 1+, minimale kleuring; 2+, matig tot sterke kleuring in ten minste 20% van de cellen; 3+, sterke kleuring in ten minste 50% van de cellen. Gevallen met 0 of 1+ kleuring werden geclassificeerd als negatief, en gevallen met 2+ of 3+ kleuring werden geclassificeerd als positief.
Cell Culture
menselijke maagkanker cellijnen, MKN-45, MKN-1, AGS, SGC7901, BGC823 en MGC803 werden verkregen van de afdeling Celbiologie, China Medical University, China. Ze werden gekweekt in DMEM dat 10% foetaal bovien serum, 100 U /ml penicilline, 100 ug /ml streptomycine bij 37 ° C in een bevochtigde atmosfeer van 5% CO 2. De cellen werden losgemaakt met behulp van 0,25% trypsine en 0,02 mol /L EDTA in PBS voor subcultuur.
Bouw van CTGF knockdown stabiele cellijnen
Twee kleine interfererende RNA (siRNA) oligonucleotiden werden gesynthetiseerd om twee verschillende regio's te richten in de CTGF cDNA: GTGCATCCGTACTCCCAAA (PSC1) en GCTAAATTCTGTGGAGTAT (PSC2). Ze werden gekloneerd in de expressievector siRNA pGCsilencer ™ U6.Neo.GFP. De niet-specifieke siRNA werd gebruikt als een negatieve controle (PSNC). De siRNA expressieplasmiden werden getransfecteerd in cellen met behulp van Lipofectamine SGC7901 2000. De cellen werden gescreend met G418 (800 ug /ml), en de kolonies werden opgepikt na 3 weken, bepaald met RT-QPCR en Western blot. Cellen die met PSC1, PSC2 of PSNC werden aangeduid PSC1 cellen, PSC2 cellen of PSNC cellen, respectievelijk.
Real-time kwantitatieve Polymerase Chain Reaction (RT-QPCR)
Totaal RNA werd geïsoleerd uit celpellets met behulp Trizol reagens. Totaal RNA (1 ug) werd omgezet in cDNA met behulp van een RT (reverse transcriptase) reactie kit. Real-time PCR werd uitgevoerd met behulp Mx3000P real-time PCR volgens de instructies van de fabrikant en SYBR ® Premix ExTaq als DNA specifieke fluorescente kleurstof. PCR werd gedurende 40 cycli van 95 ° C gedurende 5 s en 60 ° C gedurende 40 s uitgevoerd. Primersequenties worden getoond in tabel 1. De drempelcyclus (Ct) werd verkregen en de relatieve hoeveelheden werden bepaald voor elk monster genormaliseerd naar GAPDH. Uitingen van mRNA werden berekend met behulp van de ΔΔCt methode [25] .table 1 PCR Primer Sequences
Gene
Primer sequenties (5'-3 ') Vooruit en achteruit rijden
Home Product (bp)
CTGF
CTTGCGAAGCTGACCTGGAA
AAAGCTCAAACTTGATAGGCTTGGA
90
MMP-2
ATGACATCAAGGGCATTCAGGAG
TCTGAGCGATGCCATCAAATACA
135
MMP-3
GGGTGAGGACACCAGCATGA
CAGAGTGTCGGAGTCCAGCTTC
178
MMP-9
TCCCAGACCTGGGCAGATTC
GCAAAGGCGTCGTCAATCAC
124
Cyclin D1
GATGCCAACCTCCTCAACGAC
CTCCTCGCACTTCTGTTCCTC
171
GAPDH
GCACCGTCAAGGCTGAGAAC
TGGTGAAGACGCCAGTGGA
138
Western blotanalyse
Weefsels of cellen werden gelyseerd in RIPA buffer gesupplementeerd met protease-inhibitor mengsel gedurende 30 minuten bij 4 ° C. De cellysaten werden vervolgens gesonificeerd kort gecentrifugeerd (14.000 g bij 4 ° C) gedurende 15 minuten om onoplosbare materialen te verwijderen. Gelijke hoeveelheden eiwitten werden gescheiden door SDS-PAGE en overgebracht naar een PVDF membraan. Membranen werden geblokkeerd met 5% magere melkpoeder en vervolgens geïncubeerd met eerste antilichaam, gevolgd door mierikswortelperoxidase-geconjugeerd secundair antilichaam. Eiwitbanden werden gevisualiseerd door ECL chemoluminescentiemethode.
Immunofluorescentie en confocale beeldvorming
cellen op Lab-Tek weefselkweek kamer plaatjes werden gefixeerd in koude 100% methanol gedurende 10 min, en vervolgens geblokkeerd met normaal geitenserum gedurende 30 minuten . De cellen werden geïncubeerd met het primaire antilichaam overnacht bij 4 ° C, gewassen 3 keer in PBT (PBS met 1 ‰ Triton X-100), en vervolgens geïncubeerd met tweede antilichaam geconjugeerd met Rhodamine. Het DNA kleurstof DAPI werd gebruikt om het DNA te kleuren. Cellen werden afgebeeld op een Leica confocale microscoop SP2AOBS.
Geconditioneerd medium (CM) verzamelen en enzymgekoppelde immunoassay (ELISA)
3 x 10 5 cellen werden gezaaid in 100 mm weefselkweekplaat met DMEM bevattende 10 % foetaal runderserum gedurende 2 dagen. Vervolgens werden de cellen tweemaal met PBS gewassen en geïncubeerd met 5 ml serumvrij DMEM. 48 uur later, werd het geconditioneerde medium verzameld en gecentrifugeerd bij 2000 g gedurende 5 minuten, geleid door filters (poriegrootte 0,45 um) en bewaard bij -80 ° C tot gebruik. Ondernemingen De niveaus van CTGF in het geconditioneerde medium van maagkanker cellijnen werden gemeten met menselijke Quantikine ELISA kit volgens de instructies van de fabrikant.
MTT proliferatieassay
het vermogen van cellulaire proliferatie werd gemeten met MTT [3- (4, 5-dimethylthiazol-2-yl) -2 , 5-diphenyltrazolium bromide] assay. Ongeveer 5 x 10 3-cellen werden uitgezaaid in 96-putjes en gekweekt in serumvrij DMEM gedurende 24, 48, 72 en 96 uur, respectievelijk. Daarna werden cellen geïncubeerd met 20 ul MTT (10 mg /ml) gedurende 4 uur bij 37 ° Cen 200 ul DMSO werd gepipetteerd op het formazanproduct te solubiliseren gedurende 20 minuten bij kamertemperatuur. De optische dichtheid (OD) werd bepaald met een spectrofotometer (Bio-Rad) bij een golflengte van 570 nm.
Kolonievorming assay
5 × 10 2 cellen gesuspendeerd in 2 ml 0,3% agarose DMEM medium bevattende 10% foetaal runderserum werden uitgeplaat in 6-well platen bovenop bestaande bodem 0,6% agarose met hetzelfde medium. De platen werden geïncubeerd bij 37 ° C in een 5% CO 2 incubator. Na drie weken cel kolonies > 0,1 mm in diameter werden geteld onder een microscopische veld.
Invasie assay
De invasie werd bepaald door een invasie kamer assay. Cellen (2 x 10 4) werden gezaaid in de bovenste kamer van een 24-well-Matrigel beklede microporie membraanfilter met 8 urn poriën en de onderste kamer werd gevuld met 0,5 ml DMEM met 10% foetaal runderserum als chemoattractant. Na incubatie gedurende 24 uur werden de niet-binnendringende cellen (bovenste kamer) voorzichtig verwijderen met een wattenstaafje en binnendringende cellen (tweede kamer) werden bevestigd met methanol en gekleurd met trypan blauw. Het invasieve vermogen werd bepaald door het aantal indringende cellen onder een microscoop bij 200 x vergroting voor 10 willekeurige velden in elk putje.
Chamber migratieanalyse
Werkwijze in vitro migratie bepaling werd een niet-Matrigel-beklede 24-putjes Boyden-kamer (8 um, Millipore). Cellen (2 x 10 4) werden gezaaid op de inzetstukken gesuspendeerd in 0,2 ml serumvrij DMEM medium. Niet-migrerende cellen werden verwijderd uit de bovenste kamer van het filter na incubatie gedurende 24 uur. Gemigreerd cellen werden gekleurd en gekwantificeerd op basis van de procedure zoals eerder beschreven. Drievoud werden uitgevoerd voor elke groep cellen in invasie en migratie assays, en de resultaten worden uitgedrukt als gemiddelden ± SD.
Gelatine zymografie
MMP-2 en MMP-9-activiteit werd bepaald met gelatine zymografie zoals eerder beschreven [ ,,,0],26]. Kortom, na centrifugeren van de supernatant werd afgescheiden en eiwitconcentratie bepaald; gelijke hoeveelheden eiwit, toegevoegd door monsterbuffer (Tris-HCl 1 M, pH 6,8, natrium dodecyl sulfaat (SDS) 2%, glycerol 10%) werden op 7,5% SDS-polyacrylamidegel die 1 mg /ml gelatine. Na elektroforese werd SDS uit de gel verwijderd door tweemaal wassen met 2,5% Triton X-100 gedurende 1 uur. Na een korte spoeling, werd de gel geïncubeerd bij 37 ° C gedurende 18 uur in buffer, pH 7,6, bevattende 100 mM Tris-HCl, 10 mM CaCl 2, 20 mM NaCl. De gel werd gekleurd with1% Coomassie Brilliant Blue R250 gedurende 2 uur en vervolgens met ontkleuroplossing (40% methanol, 10% azijnzuur, 50% gedestilleerd water). Proteolytische activiteit werd gedetecteerd als duidelijke banden tegen de achtergrond smet van onverteerd substraat in de gel.
Animal studie van peritoneale implantatie
Dit experiment werd uitgevoerd in overeenstemming met de richtlijnen uitgegeven door de Staat Food and Drug Administration (SFDA van China ). De dieren werden gehuisvest en verzorgd in overeenstemming met de door de National Science Raad van de Republiek China.
Vrouwelijke BALB /c naakt muizen, 35-40 dagen oud en met een gewicht van 20-22 g richtlijnen, werden geleverd door Shanghai SLAC Laboratory Animal Limited Company. De muizen werden onder steriele omstandigheden gehouden en gevoed met een gesteriliseerde muis voeding en water. De dieren werden verdoofd via inhalatie van isofluraan. PSC1, PSC2, PSNC en SGC7901 cellen (1 x 10 7 cellen) werden gesuspendeerd in 0,5 ml DMEM en geïnoculeerd in de buikholte van proefmuizen. De muizen werden zes weken later geofferd en eventuele knobbeltjes verspreid aanwezig op het mesenterium en membraan werden geëvalueerd.
Statistische analyse Leer Alle waarden in de tekst en figuren worden weergegeven als gemiddelde ± SD. Overall survival tarieven werden bepaald met behulp van Kaplan-Meier schatter, een gebeurtenis wordt gedefinieerd als de dood voor kanker gecorreleerd oorzaak. De log-rank test werd gebruikt om de verschillen tussen het voortbestaan rondingen van groepen verschillende patiënten te identificeren. In univariate analyse, 2 staart χ 2 tests voor categorische variabelen en 2-tailed t-test voor continue variabelen werden gebruikt voor statistische vergelijkingen. Waarden van p
< 0,05 werden naar een significant verschil tussen gemiddelden tonen.
Resultaten
CTGF tot overexpressie wordt gebracht in maagkanker en gecorreleerd met klinische en pathologische kenmerken van patiënten met maagkanker
We bepaalden de CTGF-expressie in weefsels maagkanker en gekoppeld distale normale weefsels . Figuur 1A geïllustreerd CTGF meningsuiting in vijf willekeurig gekozen patiënten. Verhoogde CTGF eiwit gevonden in menselijke maagkanker weefsels in vergelijking met het andere normale weefsels van de patiënt. Dit werd bevestigd door immunohistochemische kleuring (Figuur 1B). Bovendien, om verder de correlatie tussen expressie van CTGF en clinicopathologische functies werden 110 monsters voor onderzoek met immunohistochemische kleuring. Statistische analyse toonde positieve CTGF-expressie was significant geassocieerd met histologische graad, lymfeklier en peritoneale verspreiding vergelijking met patiënten met een negatieve CTGF-expressie (Tabel 2). Positieve CTGF-expressie werd vaker waargenomen in gevallen van lymfeknopen metastasen (P = 0,012). Niveaus van CTGF-expressie significant in ongedifferentieerde maagkanker verhoogd vergeleken met gedifferentieerde maagkanker (P = 0,039). En de expressie van CTGF eiwit was significant gecorreleerd met de ontwikkeling van peritoneale verspreiding van maagkanker (P = 0,011). Berekening van de overlevingsduur van de 110 betrokken patiënten door de Kaplan-Meier-methode bleek dat de patiënten die CTGF-positieve tumoren wordt gekenmerkt toonde een kortere overleving in vergelijking met patiënten die van CTGF-negatieve tumoren (figuur 1C, P <geleden; 0,001 ). Figuur 1 Overexpressie van CTGF bij maagkanker met een slechtere prognose. A. Western blot analyse toonde de CTGF-expressie bij maagkanker weefsels en gekoppeld distale normale weefsels van vijf willekeurig geselecteerde maagkankerpatiënten. B. Immunohistochemie resultaten van CTGF-expressie in gepaarde maagkanker weefselmonsters. C. Kaplen-Meir survival curves voor 110 patiënten met maagkanker, gegroepeerd op basis van CTGF meningsuiting.
Tabel 2 Verband tussen CTGF expressie en clinicopathologic kenmerken van patiënten met maagkanker (n = 110)
CTGF uitdrukking
|
|
Negatief
Positieve
P-waarde
Gender
Man
33
34
0,779
Vrouw
20
23
Leeftijd (jaar)
≤ 65
35
40
0,642
> 65
18
17
Tumor grootte (cm) Restaurant < 5
26
25
|  Overdracht van SARS-CoV-2 van moeder op baby tijdens de zwangerschap mogelijk, maar zeldzaam
Overdracht van SARS-CoV-2 van moeder op baby tijdens de zwangerschap mogelijk, maar zeldzaam
 Twisting van cysten van eierstokken - Diagnose van acute buik
Twisting van cysten van eierstokken - Diagnose van acute buik
 Is de ziekte van Crohn besmettelijk?
Is de ziekte van Crohn besmettelijk?
 Loopt u vast in de epidemie van spijsverteringsziekten?
Loopt u vast in de epidemie van spijsverteringsziekten?
 Voordelen en bijwerkingen van antrachinonen
Voordelen en bijwerkingen van antrachinonen
 Heb ik een colonoscopie nodig?
Heb ik een colonoscopie nodig?
 Choledocale cyste
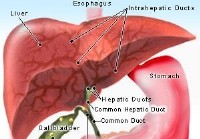
Wat is een choledochale cyste? Afbeelding van de lever, galblaas en maag Gal die in de lever wordt geproduceerd, stroomt door steeds grotere kanalen (kanalen) in de lever en uiteindelijk in nog gr
Choledocale cyste
Wat is een choledochale cyste? Afbeelding van de lever, galblaas en maag Gal die in de lever wordt geproduceerd, stroomt door steeds grotere kanalen (kanalen) in de lever en uiteindelijk in nog gr
 Verspilt u geld aan de verkeerde medische tests?
De laatste tijd krijgen we veel vragen van mensen over medische tests, zoals deze van onze vriend Richard: “In je Facebook-bericht vermeld je het krijgen van specifieke test(s). Waar kan ik informat
Verspilt u geld aan de verkeerde medische tests?
De laatste tijd krijgen we veel vragen van mensen over medische tests, zoals deze van onze vriend Richard: “In je Facebook-bericht vermeld je het krijgen van specifieke test(s). Waar kan ik informat
 Helpt het verminderen van zwavel in de voeding bij de behandeling van colitis ulcerosa?
Colitis ulcerosa (UC) is een type inflammatoire darmaandoening waarbij ontstekingen structurele schade optreedt in de binnenste laag van de dikke darm. Momenteel is er onvoldoende bewijs om te suggere
Helpt het verminderen van zwavel in de voeding bij de behandeling van colitis ulcerosa?
Colitis ulcerosa (UC) is een type inflammatoire darmaandoening waarbij ontstekingen structurele schade optreedt in de binnenste laag van de dikke darm. Momenteel is er onvoldoende bewijs om te suggere