Betrokkenheid van tumornecrosefactor-α in de opwaartse regulatie van expressie CXCR4 bij maagkanker veroorzaakt door Helicobacter pylori
Abstract achtergrond
H. pylori, waarvan bij toenemende tumor invasiviteit en metastase, algemeen aangeduid als de sterkste risico voor de ontwikkeling van maagkanker. Het blijkt toeval dat er ook een overexpressie van CXCR4 en een duidelijke betrokkenheid bij maagkanker metastase te zijn. Het doel van deze studie probeert te onderzoeken en verder een verband te leggen tussen hen. Met H. pylori die een krachtige inductor van TNF-α, of TNF-α, tumorpromotor, is betrokken bij de inductie van CXCR4 expressie door H. pylori werd ook onder onderzoek in deze studie.
Methods
Expression van CXCR4, TNF-α, IL-6 en IL-1β mRNA werd bepaald door real-time PCR. CXCR4 eiwitexpressie werd gedetecteerd met Western blotting. Concentraties van TNF-α, IL-6 en IL-1β in celcultuur supernatanten werden gemeten met de Elisa Quantikine kit. TNF-α expressie trekt in HGC27 cellen, TNF-a- RNAi plasmide werd gebruikt om ze te transfecteren.
Resultaten
Niveaus van CXCR4 en TNF-α mRNA significant hoger bij H. pylori-positieve maagkanker (n = 19) vergeleken met H. pylori-negatieve (n = 15). Een later Spearman rangcorrelatietoets toonde aan dat er een positieve correlatie tussen het niveau van CXCR4-mRNA en die van TNF-α in 34 primaire maagkanker. Andere resultaten volgt: Expressie van CXCR4 en TNF-α is bij maagkanker cel MKN45 en HGC27 opgereguleerd na infectie met H. pylori 26695 (cag PAI
+) of Tx30a (cag PAI -); De inductie van CXCR4 expressie door H. pylori werd significant geremd door een neutraliserende TNF-α antilichaam, infliximab; CXCR4 expressie is opgereguleerd in MKN45 cellen na behandeling met exogeen TNF-α of co-kweek met macrofagen, en is downgereguleerd in HGC27 cellen na transfectie met TNFa RNAi plasmide. Er was een significante toename van de migratie van MKN45 cellen behandeld met H. pylori 26.695 en een sterke remming bij AMD 3100, een CXCR4 antagonist of infliximab, werd toegevoegd.
Conclusies Home Onze bevindingen laten zien dat H. pylori upreguleert CXCR4 expressie bij maagkanker door middel van TNF-α. achtergrond
het is algemeen aanvaard dat Helicobacter pylori (H. pylori) is een sterke risicofactor voor de ontwikkeling van verschillende maagaandoeningen, namelijk chronische gastritis, maagzweren, gastrische mucosa-geassocieerde lymfeweefsel lymfoom en maagkanker en wordt erkend dat de interactie tussen H. pylori en epitheelcellen bijdraagt aan deze ontwikkeling. In feite, H. pylori-infectie induceert ontsteking in micro-omgeving van de maag geassocieerd met inductie van pro-inflammatoire cytokinen, zoals tumornecrosefactor-α (TNF-α), interleukine-1β (IL-1β) en IL-6 [1-3 ], die de maag carcinogenese bevorderlijk maakt.
H. pylori-infectie verhoogt ook tumor invasiviteit en metastase [4-6], maar het mechanisme is nog steeds niet goed begrepen. Het proces van kanker metastase is niet willekeurig, en verschillende vormen van kanker hebben hun voorkeur homing sites. Net als leukocyten mensenhandel, wordt de tumorcel migratie kritisch gereguleerd door chemokine /chemokine receptor-systeem. Andere meeste aandacht wordt geworpen op CXCR4, de meest voorkomende chemokine receptor tot overexpressie in een aantal kankers (maagkanker inbegrepen) veruit [7, 8]. Studies hebben aangegeven CXCL12 /CXCR4 as is betrokken bij maagkanker metastase [9]. Daarom wekt grote belangen om een verband tussen H. pylori infectie en CXCR4 overexpressie bij maagkanker te vinden.
Een van de belangrijkste chemische mediatoren betrokken bij-ontsteking geassocieerd kankers is TNF-α, en er is nu substantieel bewijs in haar betrokkenheid in promotie en progressie van experimentele en menselijke kankers [10, 11]. Trouw aan haar naam, kan een hoge doses van de regionale TNF-α leiden tot hemorrhagische necrose via selectieve vernietiging van de tumor bloedvaten. Het kan echter onverwacht optreden als een endogene promoter tumor indien zij in de tumor micro-omgeving. Onze interesse is dus aangetrokken door de betrokkenheid bij de inductie van CXCR4 expressie door H. pylori, een krachtige inductor van TNF-α, waarvan bekend is dat een reeks cytokinen, chemokinen, adhesiemoleculen en groeifactoren kankers upregulate.
methoden
maagkanker cellijnen en weefselmonsters Ondernemingen De menselijke maagkanker cel MKN45 en HGC27 werden verkregen van Keygen Biotech. Co (Nanjing, China), en werden gekweekt in RPMI 1640 aangevuld met 10% foetaal runderserum bij 37 ° C in een vochtige incubator met 5% CO 2. 34 primaire maagkanker monsters werden verkregen van patiënten onder gebruik met hun geïnformeerde toestemming op Shengjing ziekenhuis, Chinese Medical University, en werden bevroren in vloeibare stikstof onmiddellijk na chirurgische verwijdering. Haematoxylin- en eosine-kleuring secties werden voorbereid voor de beoordeling van het percentage van tumorcellen, en alleen exemplaren met > 70% tumorcellen werden geselecteerd voor analyse. Dit onderzoek werd uitgevoerd met de goedkeuring van de ethische commissie van de China Medical University uitgevoerd. Alle experimenten werden ten minste driemaal uitgevoerd.
Macrofaag cellijn RAW264.7 Ondernemingen De macrofaag RAW 264.7 cellen werd geleverd door de American Type Culture Collection (Rockville, MD, USA), en werd in Dulbecco's gemodificeerd Eagle's medium gehandhaafd aangevuld met 10% foetaal runderserum bij 37 ° C in een vochtige incubator met 5% CO 2.
H. pylori stammen
H. pylori-stam 26695 (ATCC 700.392, cag PAI +) en Tx30a (ATCC 51.932, cag PAI -) kregen bij ATCC (Rockville, MD, USA). Ze werden gekweekt op schapenbloedagar agarplaten bij 37 ° C onder microaërofiele omstandigheden. Bacteriën werden overgebracht na 48 hr in Brucella-bouillon bevattende 5% foetaal runderserum gedurende 24 uur. Een veelvoud van infectie van 100 werd in alle studies.
Real-time reverse transcriptie PCR
Totaal RNA werd uit weefsels en cellijnen geïsoleerd door Trizol (Takara, Dalian, China) volgens de door de geleverde protocol fabrikanten. cDNA werd gesynthetiseerd onder toepassing van Takara RNA PCR Kit 3,0 (Takara, Dalian, China) in een totaal volume van 10 ul, met AMV reverse transcriptase, 0,5 pl; 9 willekeurige primer, 0,5 pl; 25 mM MgClz 2, 2 pi; 10 × RT Buffer, 1 ui; dNTP mengsel (10 mM elk), 1 pi; RNase-remmer, 0,25 pl; RNA 1 pl; dH 2O, 3,75 pl. Voorwaarden voor RT waren: 30 ° C gedurende 10 minuten, 42 ° C gedurende 25 minuten, 99 ° C gedurende 5 minuten en 5 ° C gedurende 5 minuten. Real-time PCR werd uitgevoerd met behulp van het LightCycler systeem tezamen met de LightCycler DNA Master SYBR Green I Kit (Roche Diagnostics). Het totale volume is 20 pl, bevattende 25 mM MgClz 2, 3 pl; 10 x buffer, 5 pl; 10 pM forward Primer, 1 ui; 10 uM reverse Primer, 1 ui; LightCycler DNA Master SYBR Green I, 2 pl; cDNA, 2 pi; dH 2O, 6 pl. Omstandigheden voor PCR waren: 50 ° C gedurende 2 minuten, 95 ° C gedurende 10 minuten en daarna 40 cycli van 5 seconden bij 95 ° C en 20 seconden bij 60 ° C. Het huishoudingsgen glyceraldehyde-3-fosfaatdehydrogenase (GAPDH
) werd gebruikt als een interne controle. Genexpressie werd gekwantificeerd door de vergelijkende CT methode normaliseren CT waarden GAPDH Kopen en berekenen van relatieve expressie waarden. Primersequenties werden door Takala (Dalian, China) als volgt: CXCR4
voorwaarts, 5'- GAGGAAATGGGCTCAGGG-3 ', reverse, 5'-AGTCAGCAGGAGGGCAGGGA-3'; TNF-α
forward, 5'- AGTGACAAGCCTGTAGCCC-3 ', reverse, 5'-GCAATGATCCCAAAGTAGACC-3'; IL-1β
forward, 5'- CCACCACTACAGCAAGGG-3 ', reverse, 5'-GAACTGGGCAGACTCAAA-3'; IL-6
forward, 5'- CCTTCGGTCCAGTTGCCTTCT-3 ', reverse, 5'-GCATTTGTGGTTGGGTCA-3'; GAPDH
voorwaarts, 5'- GGGAAACTGTGGCGTGAT-3 ', reverse, 5'-AAAGGTGGAGGAGTGGGT-3'.
Western blotting
cellysaten werden bereid met monsterbuffer [50 mmol /L Tris-HCl (pH 6,8 ), 100 mmol /L DTT, 2% SDS, 0,1% broomfenol blauw en 10% glycerol] en werden onderworpen aan een 12% natriumdodecylsulfaat (SDS) /acrylamide gel. De eiwitten op acrylamide gel werden overgebracht op een nylon membraan dat overnacht werd geblokkeerd (4 ° C in PBS met 0,1% Tween en 10% melkpoeder). Polyklonale antilichamen voor CXCR4 (Santa Cruz, Californië, Amerika), en de bijbehorende secundaire antilichamen (Santa Cruz, Californië, Amerika) werden toegepast voor immunoblotting. Het menselijke gen β-actine
(Santa Cruz, CA, Amerika) werd gebruikt als een interne controle. Blots werden zichtbaar gemaakt met FX Pro Plus systeem (Bio-Rad) en gekwantificeerd met behulp van Scion Image 4.03 software.
RNA interferentie
-TNFa RNAi plasmide en nonsilencing control RNAi plasmide werden gekocht bij Takala (Dalian, China). Cellen werden gezaaid in een 24-wells plaat met een dichtheid van 2 x 10 5. De volgende dag werden de cellen getransfecteerd met TNF-a siRNA of controle siRNA gebruik van Lipofectamine 2000 (Invitrogen, Verenigd Koninkrijk) volgens de instructies van de fabrikant.
Elisa cytokines in celcultuur supernatanten
Concentraties van TNF-α, IL-1β en IL-6 in celcultuur supernatanten werden gemeten met de Quantikine Elisa-kit (Boster, Wuhan, China) volgens de instructies van de fabrikant. De gevoeligheid van de assay werd 2 pg /ml voor TNF-α, 4 pg /ml voor IL-1β en 4 pg /ml voor IL-6.
Migratie assays
de migratie van gekweekte cellen werd getest met behulp Matrigel invasie kamer (24-well formaat, 8 micrometer porie; BD Pharmingen). Cellen (5 x 10 5) werden aan de bovenste kamer en medium aangevuld met CXCL12 (100 ng /ml, Sigma) werd aan de onderste kamer toegevoegd. Migratie assays werden gedurende 18 uur bij 37 ° C en 5% CO 2. Gemigreerde cellen op het onderoppervlak werden gekleurd met 1% toluidine blauw na fixatie met 100% methanol. Voor elke Transwell het aantal gemigreerde cellen in 10 medium krachtvelden (x 20) werd geteld.
Statistische analyse
Mann-Whitney U-test
werd gebruikt om mRNA-expressie te vergelijken tussen H. pylori-positieve en H. pylori-negatieve tumoren. Correlatie tussen CXCR4 expressie en TNF-α expressie in maagkanker monsters werd geanalyseerd met behulp van Spearman rangcorrelatietoets. Expressie van mRNA in de maag cellijnen werd vergeleken met behulp van Student's t
-test of een ANOVA. Statistische analyse werd uitgevoerd met behulp van SPSS versie 11.0 (SPSS, Chicago, IL, USA). Verschil werd beschouwd als significant bij P
-waarde was < 0,05.
Resultaten
expressie van CXCR4 en TNF-α mRNA in primaire maagkanker
CXCR4-mRNA werd bepaald door real-time reverse transcriptie PCR 34 maagkanker, en de expressie ervan in elk monster werd gestandaardiseerd GAPDH
expressie. De resultaten lieten een niveau dat aanzienlijk hoger bij H. pylori-positieve maagkanker (n = 19) vergeleken met H. pylori-negatieve (n = 15) (7,2 voudig, P
< 0,01, figuur 1A). Van dezelfde groep van tumoren, werd TNF-α mRNA expressie gedetecteerd door real-time reverse-transcriptie PCR, en werd sterker in H. pylori-positieve maagkanker gevonden vergeleken met H. pylori-negatieve (4,3 voudig, P Restaurant < 0,01, Figuur 1B). Spearman rangcorrelatietoets een positieve correlatie van CXCR4 meningsuiting verder geverifieerd met TNF-α in deze 34 maagkanker (P Restaurant < 0,01, figuur 1C). Figuur 1 Expressie van CXCR4 en TNF-α mRNA in primaire maagkanker door real-time PCR. (A) en (B) H. pylori-positieve maagkanker (grijze kolommen, n = 19), uitgedrukt hoger CXCR4 (A) en TNF-α (B) mRNA vergeleken met H. pylori-negatieve maagkanker (zwarte kolommen , n = 15), * P Restaurant < 0,01. Horizontale lijnen: middel van mRNA-niveau. (C) Aantal CXCR4-mRNA positief gecorreleerd aan die van TNF-α mRNA in 34 maagkanker, P
< 0,01. Black ruit: H. pylori-negatieve maagkanker; grijze ruit. H. pylori-positieve maagkanker
Inductie van CXCR4 en TNF-α expressie door H. pylori in de maag kankercellen
Real time-PCR en Western blotting werd gebruikt om CXCR4 expressie te detecteren en MKN45 HGC27 cellen (Figuur 2A, B); en openbaren in hen na infectie aanzienlijk opgereguleerd met H. pylori 26695 voor 24 uur (P Restaurant < 0,01, respectievelijk figuur 2A, B). Vervolgens werden ze met een CAG PAI-negatieve H. pylori, Tx30a anderzijds aan de opwaartse regulatie bepalen, en wordt ook gevonden CXCR4 expressie in MKN45 en HGC27 cellen (P
<induceren, 0,01 respectievelijk figuur 2A , B). Figuur 2 Expressie van CXCR4 en TNF-α in MKN45 en HGC27 cellen na infectie met H. pylori. (A) en (B) CXCR4 expressie werd opgereguleerd in MKN45 en HGC27 cellen na infectie met H. pylori 26695 (* P
< 0,01 respectievelijk vs.
H. pylori) of Tx30a (* P
< 0,01, respectievelijk, versus
H. pylori). (C) en (D) TNF-α-expressie was verhoogd in MKN45 en HGC27 cellen na infectie met H. pylori 26695 (* P
< 0,01 respectievelijk vs.
H. pylori) of Tx30a (* P Restaurant < 0,01, respectievelijk, versus
H. pylori). Gegevens worden uitgedrukt als gemiddelde ± SD, n = 3.
Het effect van H. pylori-infectie op TNF-α-expressie werd verder onderzocht met behulp van real-time PCR en ELISA, en de detectie aangetoond dat infectie met 26.695 of Tx30a voor 12 uur kan hebben geleid tot zowel meer expressie van TNF-α mRNA (P
< 0,01, respectievelijk) en uitscheiding van TNF-α eiwit in het kweeksupernatant (P
<, respectievelijk 0,01,) en in MKN45 HGC27 cellen (Figuur 2C, D).
Effect van Infliximab, een neutraliserend antilichaam tegen TNF-α, op de inductie van expressie van CXCR4 H. Pylori Ondernemingen de vaststelling van opwaartse regulatie van TNF-α expressie in dit geval bracht ons onderzoek verder op haar betrokkenheid bij de inductie van CXCR4 expressie door H. pylori. Een neutraliserende TNF-α antilichaam, infliximab (4 ug /ml, Sigma) werd vervolgens gebruikt om MKN45 en HGC27 cellen na behandeling van een infectie van 26.695 en de inductie van CXCR4 significant (P
<geremd, 0,01, respectievelijk figuur 3A, B). Soortgelijke resultaten werden waargenomen wanneer deze cellen werden behandeld met infliximab na een infectie door Tx30a (P
< 0,01 respectievelijk Figure3C, D). Figuur 3 Effect van infliximab op de inductie van CXCR4 expressie door H. pylori. (A) en (B) CXCR4 opregulatie geïnduceerd door H. pylori 26695 werd in MKN45 en HGC27 cellen geremd na behandeling met infliximab, * P Restaurant < 0,01, respectievelijk, versus
26.695 + inf. (C) en (D) CXCR4 opregulatie geïnduceerd door H. pylori Tx30a werd geremd en MKN45 HGC27 cellen na behandeling met infliximab, * P
< 0,01, respectievelijk, versus
Tx30a + inf. Gegevens worden uitgedrukt als gemiddelde ± SD, n = 3. inf. Infliximab
opregulatie van expressie CXCR4 bij maagkanker cellen door TNF-α
MKN45 cellen, die geheim lagere TNF-α eiwit, behandeld met 1, 10, of 50 ng /ml TNF-α (Sigma) gedurende 6 uur in een poging om de rol van TNF-α in de opwaartse regulatie van CXCR4 expressie verder te onderzoeken, en real-time-PCR en Western blotting detectie geopenbaard significant opgereguleerd in een dosis-afhankelijke wijze (P
< 0,01, Figuur 4A, B), en zelfs 15,8 plooien met 50 ng /ml TNF-α behandeling. Figuur 4 opregulatie van expressie CXCR4 bij maagkanker cellen door TNF-α. (A) en (B) CXCR4 expressie werd opgereguleerd in MKN45 cellen door exogeen TNF-α in een dosis-afhankelijke wijze, * P
< 0,01. (C) en (D) Het gemengde cultuursysteem van MKN45 en RAW264.7 cellen tot expressie meer CXCR4, * P
< 0.001, versus
M; ** P Restaurant < 0.001, versus
R. De opregulatie van CXCR4 expressie werd geremd na behandeling met infliximab, *** P Restaurant < 0.001, versus
M + R + inf. M: MKN45; R: RAW264.7; inf: infliximab. (E) Expressie van TNF-α afwezig in HGC27 cellen na transfectie met TNFa RNAi plasmide. (F) CXCR4-mRNA expressie werd gedownreguleerd in HGC27 cellen na transfectie met-TNFa RNAi plamid, * P Restaurant < 0.001, versus verhuur No RNAi; ** P Restaurant < 0.001, versus de kwaliteitscontrole RNAi. Gegevens worden uitgedrukt als gemiddelde ± SD, n = 3.
Vervolgens werd de CXCR4 expressie in een co-kweeksysteem werd onderzocht, aangezien tumor-geassocieerde macrofagen ook als bron van TNF-α in maagkanker micro dienen. Een co-kweek van cellen met MKN45 RAW264.7 cellen gedurende 24 uur aangetoond dat aanzienlijk expressie CXCR4-mRNA en eiwit (P
< 0,001, figuur 4C, D); Deze toename werd echter significant geremd door infliximab (P
< 0,001, figuur 4C, D)
Tenslotte endogene TNF-α is gericht op de regulering op CXCR4 expressie in HGC27 cellen die geheimen hogere evalueren. niveau van TNF-α eiwit. TNF-a- RNAi plasmide werd gebruikt om cellen te transfecteren HGC27 en dienovereenkomstig nonsilencing RNAi plasmide werd in de tegenhanger als controle. Waargenomen werd dat expressie van TNF-α afwezig in HGC27 cellen na transfectie met TNFa-RNAi-plasmide (Figuur 4E). Vervolgens expressie van CXCR4 gedetecteerd door real-time PCR, en aangegeven bij het detecteren dat na transfectie met TNFa RNAi plasmide werd CXCR4-mRNA-expressie significant neerwaarts gereguleerd in HGC27 cellen vergeleken met cellen met control RNAi of cellen zonder RNAi (P Restaurant < 0,001, respectievelijk figuur 4F).
Inductie van cytokinen in macrofagen door H. pylori
Real-time PCR en Elisa werden gebruikt om het effect van H. pylori te evalueren 26695 op cytokine-expressie in RAW264.7 cellen, aangezien het algemeen aanvaard dat cytokinen betrokken zijn bij chronische ontstekingsprocessen door H. pylori. De real-time PCR detectie toonde expressie van TNF-α, IL-1β en IL-6 mRNA werd opgereguleerd in 26.695-behandelde cellen in vergelijking met 26.695 onbehandelde cellen (TNF-α, P
< 0,001, IL-1β , P Restaurant < 0,001 en IL-6, P Restaurant < 0,001, figuur 5A). En ELISA resultaten gaven meer eiwitten van TNF-α, IL-1β en IL-6 werden afgescheiden in kweeksupernatant in 26.695-behandelde cellen in vergelijking met 26.695 onbehandelde cellen (TNF-α, P
< 0,001, IL-1β , P Restaurant < 0,001 en IL-6, P Restaurant < 0,001, Figuur 5B). Figuur 5 Inductie van cytokinen in macrofagen door H. pylori. (A) en (B) Expressie van TNF-α, IL-1β en IL-6 werd opgereguleerd in 26.695 behandelde RAW264.7 cellen, * P
< 0.001, versus
onbehandelde cellen. (C) en (D) Noch IL-1β of IL-6 kan CXCR4 expressie opreguleren in MKN45 cellen. Gegevens worden uitgedrukt als gemiddelde ± SD, n = 3.
Tenslotte MKN45 cellen werden behandeld met exogeen IL-1β (50 ng /ml) en IL-6 (50 ng /ml) respectievelijk uitsluiten dat IL -1β en IL-6 kan CXCR4 uitdrukking als TNF-α upregulate. Noch IL-1β of IL-6 bleek CXCR4 expressie significant (figuur 5C, D).
Migratie analyse
migratie analyse werd uitgevoerd met het Matrigel invasie kamer in een poging om te onderzoeken of de CXCR4 opgereguleerd was functioneel opwaarts reguleren . In de beginfase van het experiment met 100 ng /ml CXCL12 in de onderste kamer, was er een significante toename (tot 4,5 vouwen) in de migratie van MKN45 cellen met 26.695 in de hogere kamer, vergeleken met controlecellen zonder 26.695 behandeling (P Restaurant < 0,001, figuur 6A). Later, maar de stijging was opvallend geremd wanneer AMD 3100 (1 ug /ml, Sigma), een CXCR4 antagonist of infliximab, werd toegevoegd (P
< 0,01 respectievelijk figuur 6A). Figuur 6 Migratie studie. (A) MKN45 cellen vertoonden een significante toename van de migratie na behandeling met 26.695, * P
< 0.001, versus de kwaliteitscontrole. De toename van de migratie van MKN45 cellen geïnduceerd door 26.695 geremd werd toen AMD 3100 (** P Restaurant < 0,01, versus
26.695 + AMD), of infliximab (*** P Restaurant < 0,01, versus
26.695 + inf) werd toegevoegd. AMD: AMD3100; inf: infliximab. (B) TNF-α verhoogd MKN45 cel migratie, * P Restaurant < 0.001, versus de kwaliteitscontrole. Noch IL-1β of IL-6 kan een aanzienlijke verhoging MKN45 celmigratie. Gegevens worden uitgedrukt als gemiddelde ± SD, n = 3.
Bovendien, het effect van cytokines op MKN45 celmigratie werd ook onderzocht, en TNF-α (50 ng /ml) bleek aanzienlijk te verhogen MKN45 celmigratie (P Restaurant < 0,001, figuur 6B). Noch IL-1β (50 ng /ml) of IL-6 (50 ng /ml) werd bewezen MKN45 celmigratie aanzienlijk (figuur 6B) te promoten.
Discussie
H. pylori wordt geweten aan ongeveer 50% van de wereldbevolking infecteren definitieve maag carcinogeen voor de mens [12]. Pathogenese van de infectie vaak ook ontsteking, mucosale schade of maag-atrofie, en vereist een nauwe interactie tussen de bacteriën en de maag epitheelcellen, het activeren van signaalwegen, wijzigen gastheer cellulaire functies, en leidt tot chronische epitheliale reacties [13.14]. Er zijn nu veel bewijzen koppelen chronische ontsteking menselijke kankers [15-17], en in het bijzonder H. pylori geïnduceerde chronische ontsteking en cytokines in maag lokale micro-omgeving dienen als de meest voorkomende medewerkers [18-20]. Deze studie wijst zodat mucosale niveau van TNF-α mRNA was significant hoger bij H. pylori-positieve patiënten dan bij negatieve patiënten met behulp van kwantitatieve real-time PCR, en twee maagkanker cellen ook uitgescheiden TNF-α eiwit in vitro. Voorts wijst naar de veronderstelling dat TNF-α wellicht bij H. pylori-positieve maagkanker als onmisbaar en sterke linker tussen ontsteking en kanker [21].
Hoewel het mechanisme van inductie van TNF-α door H. pylori blijft relatief onduidelijk is een eiwitfamilie beschreven in het laatste decennium, zoals Helicobacter pylori-membraaneiwit-1 (HP-MP1) en TNF-α inducerend eiwit (Tipα) [22-24]. Tipα gen, die van H. pylori-stam 26695, homoloog HP-MP1 gen met 94,3% homologie, en beiden vertonen sterk vermogen om TNF-α genexpressie induceren. In de studie, H. pylori 26695 bleek TNF-α expressie opreguleren aanzienlijk MKN45 en HGC27 cellen en cag PAI negatieve stam Tx30a werd gespot op het natuurlijk induceren, eventueel in deel te wijten aan het feit dat HP-MP1 /Tipα familie is niet in cag PAI regio. Er werd ook opgemerkt dat het effect van Tx30a op TNF-α inductie was zwakker dan 26.695 (2,3 vouwen versus
3,1 vouwen in MKN45 cellen), die H. pylori produkten cag PAI ook betrokken kan zijn bij gesuggereerd de inductie. In feite had hij gemeld dat cagA van H. pylori TNF-α bij maagkanker biopten [25] zou kunnen veroorzaken. Bovendien gezuiverde H. pylori-urease bleek ook MKN45 cellen induceren TNF-α expressie [26].
TNF-α, een sleutel cytokine in vele chronische ontstekingsziekten, oorspronkelijk aangeduid als een serum factor voor de inductie van hemorragische necrose van getransplanteerde solide tumoren in muizen. Echter, op dit moment is het algemeen aangeduid als een tumor promotor lokale tumor micro-omgeving, en derhalve de verwijdering of remming daarvan zou de incidentie van experimentele kankers. TNF-α /TNF-R1 knock down muizen resistent zijn tegen chemisch-geïnduceerde carcinogenese [27, 28]. Het wordt vaak gedetecteerd in biopten van verschillende menselijke kankers, die hetzij door epitheliale tumorcellen en stromale cellen. Bovendien wordt ook gevonden, hoewel in geringe hoeveelheid, in de uitscheiding van vele kanker lijnen in vitro zonder inflammatoire stimuli, maar het mechanisme is nog niet helemaal duidelijk.
TNF-α bleek niet alleen betrokken bij celtransformatie en proliferatie maar ook bij tumormetastase. Een dergelijke vaststelling Aanvankelijk werd een diermodel met colonkanker, waarbij injectie van LPS versterkte de ontwikkeling van longmetastasen afhankelijk van TNF-α productie door gastheercellen [29]. De volgende resultaten tonen de verhoogde tumormetastase geremd door het neutraliseren van TNF-α antilichaam [30]. Dit leidde tot onze speculatie dat een van de onderliggende mechanismen van TNF-α in tumormetastase kan worden gerelateerd aan de opwaartse regulatie van chemokinen /chemokinereceptoren. Eerst was er een aanzienlijke opwaartse regulatie van CXCR4 bij maagkanker cellen nadat ze werden behandeld met exogeen TNF-α. Er was een duidelijke opregulatie van CXCR4 expressie in kankercellen nadat ze werden samen gekweekt met macrofaag, een alternatieve bron van TNF-α in maagkanker micromilieu. Zoals werd verwacht, kan dit opregulatie worden geremd door TNF-α neutraliserend antilichaam infliximab. Er was dus een opmerkelijke verlaging van de expressie van CXCR4 in HGC27 cellen na RNAi werd gebruikt om het TNF-α expressie trekt in deze cellen, die endogeen TNF-α aangegeven kan opreguleren CXCR4 expressie. De algemene bevindingen leidden tot onze conclusie dat TNF-α, met zichzelf betrokken bij de metastase van maagkanker, upreguleert CXCR4 expressie.
Overexpressie van CXCR4, waarvan betrokkenheid bij verschillende menselijke tumoren is bekend, werd vaak waargenomen bij maagkanker weefsels maagkanker metastase verhogen. Sommige menselijke maag-carcinoom cellen ook uiten CXCR4-mRNA en eiwit op hoog niveau [7, 8]. Onze studie toonde aan H. pylori-infectie verhoogde MKN45 cel migratie door de opwaartse regulatie van CXCR4 expressie. Het behandelen met CXCR4 antagonist AMD3100 resulteerde in een significante onderdrukking van MKN45 celmigratie in vitro. Een andere studie toonde AMD3100 onderdrukt significant de ontwikkeling van peritoneale metastasen in een muismodel van maagkanker, die bleek uit het verminderen van tumorgroei en ascitesvocht vorming [9]. De voorgaande onderzoeken tot onze conclusie dat CXCR4 overexpressie biopt primaire maagkanker als preoperatieve beoordeling van risico's voor het voorkomen van peritoneale carcinomatosis dienen. Betrokkenheid
Macrofagen in de carcinogenese en tumor invasie en metastase [31, 32 ] algemeen toegeschreven motiveren TAM (tumor-geassocieerde macrofagen), een belangrijke bron van TNF-α in de tumor micro-omgeving van verschillende groeifactoren, cytokinen en ontstekingsmediatoren vrijgeven. De studie bleek er een significante expressie van TNF-α geïnduceerd door H. pylori en tegelijkertijd opregulatie van IL-1 beta en IL-6 in RAW264.7 cellen, echter deze variatie niet CXCR4 expressie induceren in cellen MKN45.
Studies hebben uiteindelijk toegeschreven de abnormale activatie van NF-KB in kankercellen om overmatige afscheiding van TNF-α, wiens rol CXCR4 opregulatie wordt vervolgens aangenomen dat met betrekking tot trajecten gemedieerd door NF-KB. Andere bevindingen hebben uitgewezen TNF-α-antagonisten kan de opwaartse regulatie van CXCR4 expressie door H. pylori te remmen, en zij en CXCR4 antagonisten kunnen de toegenomen migratie van maagkanker cellen te onderdrukken in vitro. Deze resultaten suggereren dat deze antagonisten alleen of in combinatie met andere behandelingen, kunnen als doeltreffende therapieën voor maagkanker patiënten te helpen.
Conclusies
TNF-α is betrokken bij de opwaartse regulatie van expressie CXCR4 bij maagkanker geïnduceerd door H. pylori.
verklaringen
Dankwoord
Dit werk werd ondersteund door een subsidie van divisie van Onderwijs, de provincie Liaoning, China (2009A751). origineel ingediende dossiers
Authors 'voor beelden
Hieronder staan de links de oorspronkelijke ingediende dossiers van de auteurs voor afbeeldingen. 'Originele bestand voor figuur 1 12885_2009_2218_MOESM2_ESM.tiff Authors' 12885_2009_2218_MOESM1_ESM.tiff Auteurs originele bestand voor 'originele bestand voor figuur 3 12885_2009_2218_MOESM4_ESM.tiff Authors' figuur 2 12885_2009_2218_MOESM3_ESM.tiff Auteurs originele bestand voor figuur 4 originele bestand 12885_2009_2218_MOESM5_ESM.tiff Authors 'voor figuur 5 oorspronkelijke bestand 12885_2009_2218_MOESM6_ESM.tiff Authors 'voor figuur 6 concurrerende belangen Ondernemingen De auteurs verklaren dat ze geen concurrerende belangen.
 review van sibo thuisbezorging:dagen 7 en laatste gedachten
review van sibo thuisbezorging:dagen 7 en laatste gedachten
 Is het het prikkelbaredarmsyndroom?
Is het het prikkelbaredarmsyndroom?
 Lagere kans op darmobstructie met minder invasieve chirurgie:onderzoek
Lagere kans op darmobstructie met minder invasieve chirurgie:onderzoek
 Gut Microbiota Conference – Probiotica
Gut Microbiota Conference – Probiotica
 We veranderen samen de wereld (één darm tegelijk)
We veranderen samen de wereld (één darm tegelijk)
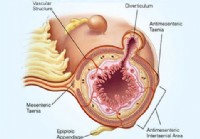 Diverticulitis (Diverticulosis) Symptomen, dieet, behandeling
Diverticulitis (Diverticulosis) Symptomen, dieet, behandeling
 De glazen wandfout die iedereen lijkt te maken (en hoe deze te vermijden)
Elke week is er een thema in onze adviespraktijk. Afgelopen week was het thema luid en duidelijk en ik hoop dat jullie er wat van kunnen leren. Dit is hoe bijna al mijn consulten begonnen. Ik: Hoe
De glazen wandfout die iedereen lijkt te maken (en hoe deze te vermijden)
Elke week is er een thema in onze adviespraktijk. Afgelopen week was het thema luid en duidelijk en ik hoop dat jullie er wat van kunnen leren. Dit is hoe bijna al mijn consulten begonnen. Ik: Hoe
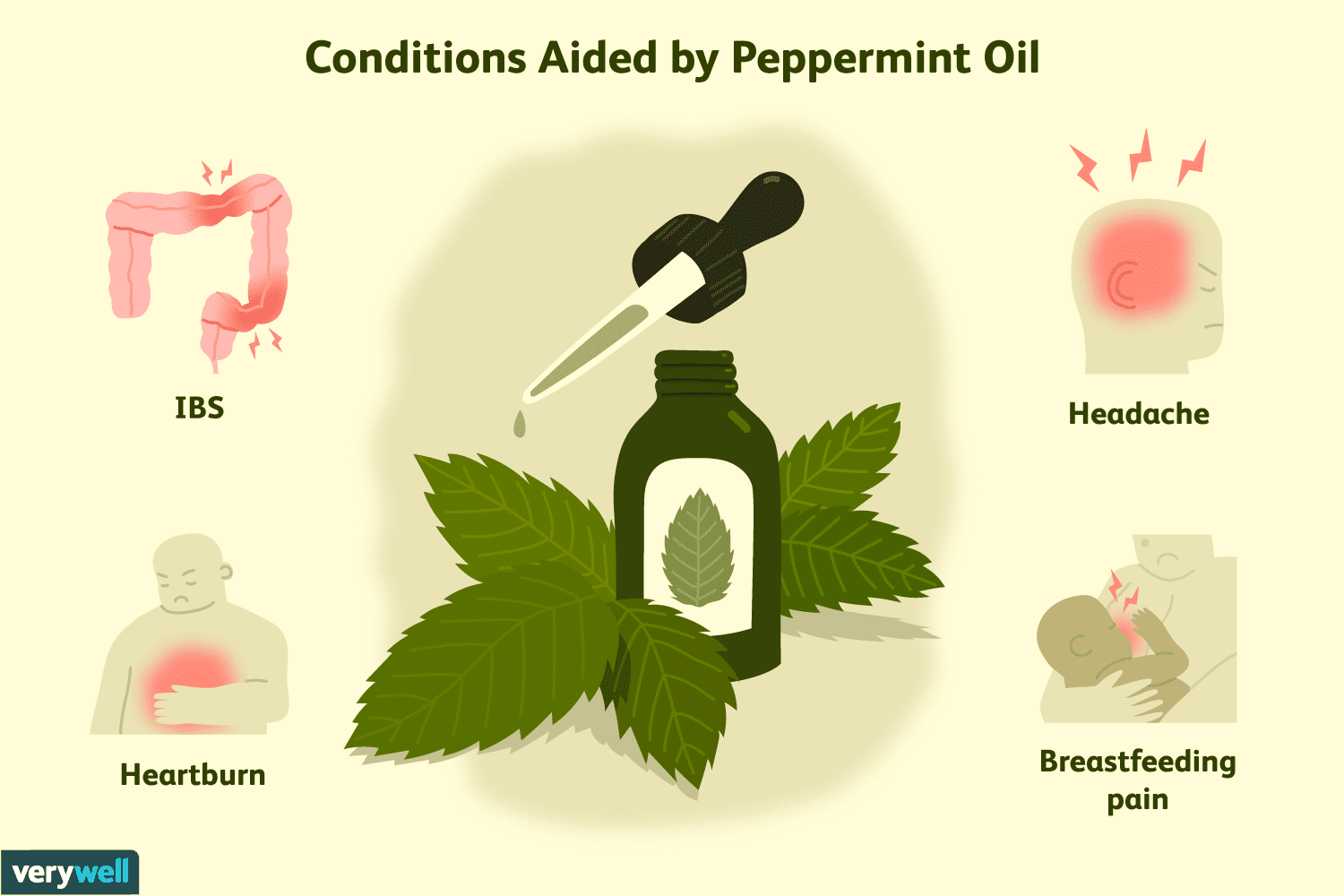 De gezondheidsvoordelen van pepermuntolie
Pepermunt (Mentha piperita ) wordt vaak gebruikt om voedsel op smaak te brengen, vooral zoete lekkernijen. Pepermuntolie en bladeren zijn ook gebruikt om verschillende aandoeningen te behandelen, van
De gezondheidsvoordelen van pepermuntolie
Pepermunt (Mentha piperita ) wordt vaak gebruikt om voedsel op smaak te brengen, vooral zoete lekkernijen. Pepermuntolie en bladeren zijn ook gebruikt om verschillende aandoeningen te behandelen, van
 Lifestyle, het microbioom en PCOS
Polycysteus ovariumsyndroom (PCOS) is een van de meest voorkomende endocriene stofwisselingsstoornissen bij vrouwen. PCOS treedt op wanneer de hormonale profielen van een vrouw worden gewijzigd; er is
Lifestyle, het microbioom en PCOS
Polycysteus ovariumsyndroom (PCOS) is een van de meest voorkomende endocriene stofwisselingsstoornissen bij vrouwen. PCOS treedt op wanneer de hormonale profielen van een vrouw worden gewijzigd; er is