chitinasen hydrolyseren de β-1-4 glycosidebindingen van chitine, een belangrijke structurele component van schimmels, schaaldieren en insecten. Hoewel zoogdieren niet chitine of haar synthase te produceren, ze uiten twee actieve chitinasen, chitotriosidase (Chit1) en zure zoogdieren chitinase (AMCase). Deze zoogdieren chitinasen aanzienlijke aandacht getrokken vanwege hun verhoogde expressie bij mensen met een aantal pathologische aandoeningen, waaronder de ziekte van Gaucher, ziekte van Alzheimer en astma. Toch blijft de bijdrage van deze enzymen om de pathofysiologie van deze ziekten te bepalen. De kwantificering van de Chit1 en AMCase mRNA niveaus en de vergelijking van deze niveaus met de niveaus van bekende referentie genen nuttige en biomedisch relevante informatie te genereren. In het begin, hebben we een kwantitatieve real-time PCR systeem standaard DNA door ligeren van de cDNA-fragmenten van de doelgenen gebruikt. Dit systeem konden we kwantificeren en vergelijk de expressieniveaus van de chitinasen en de verwijzing genen op dezelfde schaal. We vonden dat AMCase mRNA gesynthetiseerd op uitzonderlijk hoge niveaus in de maag van de muis. De hoogte van dit mRNA in de maag van de muis was 7- tot 10-maal hoger dan de niveaus van de housekeeping genen en was vergelijkbaar met het niveau van het mRNA voor pepsinogeen C (progastricsin), een belangrijke component van het maagslijmvlies. Aldus AMCase mRNA transcript in een grote maag muizen, wat suggereert dat AMCase functioneert als een digestief enzym dat polymeer chitine en als onderdeel van de afweermechanismen tegen chitine bevattende ziekteverwekkers in de maaginhoud. Onze methodiek is toepasbaar op de kwantificering van mRNA's voor meerdere genen over meerdere exemplaren met behulp van dezelfde schaal
Visum:. Ohno M, Tsuda K, Sakaguchi M, Sugahara Y, Oyama F (2012) Chitinase mRNA Niveaus door Quantitative PCR met behulp van de Single Standard DNA: Zuur Mammalian Chitinase Is een Major Transcript in de muis maag. PLoS One 7 (11): e50381. doi: 10.1371 /journal.pone.0050381
Editor: Dominik Hartl, Universiteit van Tübingen, Duitsland
Ontvangen: 6 augustus 2012; Aanvaard: 19 oktober 2012; Gepubliceerd: 21 november 2012
Copyright: © 2012 Ohno et al. Dit is een open-access artikel gedistribueerd onder de voorwaarden van de Creative Commons Attribution License, die onbeperkt gebruik, distributie en reproductie maakt in elk medium, op voorwaarde dat de oorspronkelijke auteur en de bron worden gecrediteerd
Financiering:. Dit werk werd gesteund door de Project Research Grant van het Research Institute of Science and Technology, Kogakuin University. De financiers hadden geen rol in de studie design, het verzamelen van gegevens en analyse, besluit te publiceren, of de voorbereiding van het manuscript
Competing belangen:.. De auteurs hebben verklaard dat er geen tegenstrijdige belangen bestaan
Introductie
Chitine, een lineair polymeer van β-1-4-gekoppelde N De Chit1 niveau wordt aanzienlijk verhoogd in het plasma patiënten met de ziekte van Gaucher, een autosomaal recessieve lysosomale stapelingsziekte [4]. Chit1 was de eerste zoogdieren chitinase worden gezuiverd en gekloneerd [5], [6]. Een recessief erfelijke tekort aan Chit1 activiteit wordt vaak waargenomen bij blanken [7]. AMCase ontdekt vanwege zijn compenserend effect en is genoemd naar zijn zure pH-optimum [8]. Deze zoogdierlijke chitinasen worden beschouwd als onderdeel van de ontvangende afweermechanisme tegen chitine bevattende ziekteverwekkers en parasieten [3], [9]. Zowel Chit1 en AMCase uitgescheiden eiwitten met molecuulgewichten van ongeveer 50 kDa. Beide eiwitten bevatten een N-terminaal katalytisch domein, een scharnier regio en een C-terminale chitine-bindend domein [6], [8]. Muis AMCase toont sequentiehomologie Chit1 met een identiteit van 52% en gelijkenis van 60% [10]. Ondanks deze structurele overeenkomsten, deze enzymen significant verschillen met betrekking tot hun enzymatische gedrag bij zure pH. AMCase geven een groot pH-optimum bij pH 2 en een minder duidelijk optimum bij pH 4-7 [8], terwijl Chit1 toont alleen een breed pH-optimum bij ongeveer pH 5 [5], [11]. Mammalian chitinasen hebben aanzienlijke aandacht gekregen vanwege hun verhoogde expressie in individuen met verschillende pathologische aandoeningen. Chit1 is verhoogd bij mensen met de ziekte van Gaucher [4], chronische obstructieve longziekte (COPD) [12], en de ziekte van Alzheimer [13] en bij rokers [14]. AMCase expressie en activiteit worden ook opgereguleerd tijdens allergische reacties van de luchtwegen in muismodellen van astma [15]. Bovendien, polymere chitine induceert AMCase meningsuiting en de rekrutering van immuuncellen in verband met allergie en astma [16]. Deze resultaten suggereren sterk dat chitinolytische enzymen spelen een belangrijke rol in vele pathofysiologische omstandigheden. Toch blijft de bijdrage van deze enzymen om de pathofysiologie van deze ziekten te bepalen. De kwantificering van de Chit1 en AMCase mRNA niveaus en de vergelijking van deze niveaus met de niveaus van bekende referentie genen van belang stappen in het verkrijgen van inzicht in de in vivo In dit onderzoek hebben we een kwantitatieve real-time RT-PCR systeem standaard DNA door ligeren van het gebruik cDNA-fragmenten van de doelgenen. Dit systeem konden we kwantificeren en vergelijk de expressieniveaus van de chitinasen en de verwijzing genen op dezelfde schaal. Onze resultaten geven aan dat AMCase een belangrijk transcript in de maag van de muis, wat erop wijst dat het overeenkomstige eiwit functioneert als een digestief enzym dat chitine bevattende voedingsmiddelen en als onderdeel van de afweermechanismen tegen chitine bevattende ziekteverwekkers in de maaginhoud. Materialen en Werkwijzen RNA, RNA isolatie en cDNA bereiding de muis Totaal RNA Master Panel (Clontech Laboratories) werd gebruikt om de weefselverdeling van transcripten onderzocht. Analyseerden we vier verschillende embryonale stadia en acht volwassen weefsels. Daarnaast werd RNA geïsoleerd uit de longen en magen van 3 maanden oude mannelijke muizen. C57BL /6J muizen (CLEAR Japan) werden gefokt op het RIKEN Brain Science Institute Animal Facility. Alle dierlijke experimenten werden uitgevoerd in overeenstemming met de institutionele richtlijnen. Het protocol werd goedgekeurd door het Comité voor de ethiek van dierproeven van de RIKEN Brain Science Institute (Goedkeuring nr H19-2B013). Alle operatie werd uitgevoerd door het gebruik van diethyl ether als verdovingsmiddel, en alle inspanningen werden gedaan om het lijden te minimaliseren. Deze weefsels voor mRNA voorbereiding werden verstrekt door Drs. Miyazaki en Nukina bij RIKEN Brain Science Institute. Totaal RNA werd bereid uit longen en maag via TRIzol Reagent (Invitrogen) volgens de instructies van de fabrikant. Om sporen van verontreinigend genomisch DNA te verwijderen, werd het totale RNA monsters behandeld met RQ1 RNase-vrij DNase (Promega) volgens de aanbevolen protocol van de fabrikant. De concentratie van de nucleïnezuren werden bepaald door meting van de absorptie bij 260 nm onder toepassing van een BioPhotometer Plus (Eppendorf). Elk van de totale RNA-monsters (3 ug) werd onderworpen aan omgekeerde transcriptie met willekeurige hexameren als primers. Het reactiemengsel (15 pi) bevatte het enzym buffer [50 mM Tris-HCl (pH 8,3), 75 mM KCl, en 3 mM MgCl 2], 100 ng willekeurige hexameren, 10 mM dithiothreïtol en 0,5 mM deoxynucleotide trifosfaten (dNTPs). Na gedurende 5 min verwarmen van de oplossing tot 60 ° C en gedurende 5 min incuberen van het mengsel bij 37 ° C, 200 U van recombinant murine leukemie virus reverse transcriptase (Invitrogen) werd toegevoegd en het mengsel werd gedurende 45 min geïncubeerd bij 37 ° C . De reverse transcriptie werd beëindigd door verwarming tot 95 ° C gedurende 5 min. Primers voor real-time RT-PCR werden ontworpen op basis van Primer Express Software (Applied Biosystems) en werden commercieel gesynthetiseerd (Sigma-Genosys, Sigma-Aldrich). De PCR reacties werden uitgevoerd in een eindvolume van 13 pl bevattende 2 x SYBR Green Master Mix (Brilliant II SYBR Green QPCR Master Mix, Agilent), 2,7 ng cDNA muis of geschikte verdunningen van de externe standaarden (zie hieronder), en de geschikte concentraties van de primers voor de chitinasen, pepsinogeen C, glyceraldehyde-3-fosfaatdehydrogenase (GAPDH) of β-actine. Standaard real-time PCR-omstandigheden voor het systeem (Mx3005P, Agilent) gebruikt: een initiële denaturatie en polymerase activeringsstap gedurende 10 min bij 95 ° C, gevolgd door 40 cycli van denaturatie bij 95 ° C gedurende 1 min, 55 ° C gedurende 30 sec en 72 ° C gedurende 1 min. Smeltcurven werden gegenereerd na amplificatie. De PCR producten werden geëlektroforeerd op een 10% polyacrylamidegel en geanalyseerd met de luminescerende Image Analyzer (ImageQuant LAS 4000, GE Healthcare). De PCR werd behandeld met ExoSAP-IT (USB Products) volgens de instructies van de fabrikant om de niet ingebouwde dNTPs en primers te elimineren, en de producten werden gesequenced met behulp van de ABI PRISM Big-Dye Terminator v3.1 Cycle Sequencing Kit en 3130 Genetic Analyzer ( Applied Biosystems). De nucleotide sequenties van de voor de real-time PCR primers worden getoond in Tabel S1. De standaard template cDNA (913 basen) voor de kwantificering van transcriptniveaus door real-time PCR werd als volgt geconstrueerd. De cDNA-fragmenten die het PCR-doelgebied plus basen 9-120 van de flankerende gebieden van AMCase, Chit1, pepsinogeen C, GAPDH en β-actine werd geamplificeerd uit maag muizen-cDNA door PCR met behulp Plus KOD DNA polymerase (Toyobo) en oligonucleotiden primer met de restrictie sites van de Bgl Om onze absolute real-time PCR-methode te valideren, we bereid zijn volledige coderende cDNA door PCR met de primer sets van Tabel S3 genoemd. Vijf cDNA's die het gehele coderende gebieden van twee chitinasen (Chit1 en AMCase) en de referentie-genen (GAPDH, β-actine en pepsinogeen C) werden geamplificeerd met PCR uit maag muizen-cDNA gebruikt KOD Plus DNA polymerase en werden gesubkloneerd in de pGEM-T Easy-vector door middel van TA-klonering zoals hierboven beschreven. De sequenties van de cDNA's werden geverifieerd door sequentiebepaling, zoals beschreven in figuur S1. De fragmenten werden gesubkloneerd opnieuw geamplificeerd van het plasmide DNA met dezelfde primers en werden vervolgens gebruikt als het gehele coderende gebied cDNAs. De molaire concentratie van de multigen-bevattende DNA standaard werd berekend gebaseerd op de concentratie en het molecuulgewicht. Seriële verdunningen werden bereid uitgaande van de standaard templateconcentratie, die een Ct van ongeveer 13 (Ct = fractiewaarde drempelcyclus waarde) opleverde. De standaard DNA werd onderworpen aan 10-voudige seriële verdunningen variërend van 10 0-10 7 moleculen, en de porties werden ingevroren bewaard bij -20 ° C tot gebruik. elk monster werd geamplificeerd in drievoud, en elk experiment werd ten minste tweemaal herhaald. Met de standaardkromme werden de aantallen Chit1, AMCase, GAPDH, β-actine en pepsinogeen C mRNA-moleculen automatisch geëxtrapoleerd met de MxPro QPCR softwareversie 4.10 (Agilent). Alle waarden werden uitgedrukt als moleculen per 10 ng totaal RNA. In sommige gevallen werden de waarden genormaliseerd tegen de niveaus van GAPDH of β-actine mRNA. gaan onze huidige methodologie we ook gebruikt de ΔΔ Ct methode [21], waarbij de meting van de cyclus drempel vereist (Ct) van doelgenen. Ct-waarden werden berekend door de MxPro QPCR Software met behulp van GAPDH of β-actine als een normalizer. Oprichting van de Real-time PCR-test De oprichting van een betrouwbare methode voor het meten van de expressie van chitinase transcripten is een belangrijke stap in het onderzoeken van de betekenis van muis chitinasen. Real-time RT-PCR is op dit moment de meest gevoelige kwantitatieve werkwijze voor de detectie van zowel lage abundantie en overvloedige mRNA transcripten. We vergeleken de eerste genexpressie niveaus van de Chit1 en AMCase genen (zie figuur 1). Het chitinase niveaus evalueren, gebruikten we twee housekeeping genen, GAPDH en β-actine als referentie genen omdat zij constitutief op hoge niveaus tot expressie worden gebracht in de meeste weefsels en cellen [22]. Daarnaast hebben we kozen pepsinogeen C (ook bekend als progastricsin) als een referentie-gen in de maag. Pepsinogeen C is een asparaginezuurprotease dat functioneert als een digestief enzym en wordt geproduceerd in de maag. Dit enzym vormt een belangrijk onderdeel van het maagslijmvlies [23]. Met deze drie referentie genen, onderzochten we de genexpressie van Chit1 en AMCase in muizenweefsels (figuur 1). We eerst verschillende sets primers ontworpen voor kwantitatieve PCR en evalueerden hun geschiktheid afhankelijk van of ze gaven enkelstuks , zoals blijkt uit een smelttemperatuur (Tm) en een enkele band op een 10% polyacrylamidegel. De nucleotidesequenties van de producten werden ook onderzocht. Om de specificiteit van de primers wijze, elk van de PCR producten werd onder real-time PCR omstandigheden geamplificeerd met een muis cDNA tissue mengsel bestaande uit weefsels van embryonale stadia vier en acht volwassen weefsels en werd getest in combinatie met verschillende methoden. Zoals getoond in Figuur 2A-E bleek één piek in de dissociatie curven voor Chit1 (Tm = 79,7 ° C), AMCase (Tm = 79,1 ° C), GAPDH (Tm = 81,4 ° C), β-actine (Tm = 82,0 ° C) en pepsinogeen C (Tm = 81,4 ° C). Aan het einde van de PCR, analyseerden we de producten op een 10% polyacrylamidegel. Gel elektroforese toonde duidelijk enkele bands bij de verwachte maten Chit1 (69 bp), AMCase (81 bp), GAPDH (77 bp), β-actine (71 bp) en pepsinogeen C (82 bp) (figuur 2F). De nucleotide sequenties van de PCR-producten werden direct bepaald zoals beschreven in de paragraaf Materialen en Werkwijzen. We bevestigd dat de PCR-producten werden geamplificeerd uit het doel cDNA (zie figuur 3B). Deze resultaten geven aan dat de PCR-producten specifiek amplicons van het doel cDNA en dat mispriming verwaarloosbaar onder onze experimentele omstandigheden. We wilden de expressieniveaus vergelijkt van twee chitinasen en drie referentie genen op dezelfde schaal (figuur 1). Hiervoor hebben we een kwantitatieve real-time PCR systeem waarvoor een standaardmodel noodzakelijk voor nauwkeurige kwantificering (Figuur 3A) was. Construeerden wij een standaard template DNA voor real-time PCR door het ligeren van de vijf doelwit fragmenten in een één-op-één verhouding, en dan deze geligeerde DNA-fragment werd gekloneerd in de plasmidevector zoals beschreven in de Materialen en Werkwijzen sectie (figuur 3A) . De 913-nucleotide-lange template-DNA bevatte vijf cDNA-fragmenten die de PCR-doelgebied plus 9-120 bases van de flankerende gebieden en bevatte de restrictie sites van de Bgl Validatie van de Standard Curve en de kwantitatieve real-time PCR-systeem de kwantificering van zowel de chitinasen en de verwijzing mRNA gebaseerd op standaard curves. Seriële verdunningen van de standaard template DNA werden gebruikt om een standaardcurve te vergelijken en de real-time RT-PCR kwantificeren strategieën die werden toegepast om de vijf mRNA analyse construeren. Elke standaardkromme werd gegenereerd met behulp van 10-voudige seriële verdunningen van de standaard DNA en de vijf verschillende primerparen (Figuur 4A-E, links). Exponentiële amplificatie werd gedurende een groot aantal cycli, hetgeen een dynamisch bereik van zeven orden van grootte (figuur 4A-E, links). Door het standaard template DNA dat de vijf cDNA-fragmenten, kunnen gelijke hoeveelheden worden toegewezen aan de vijf genen in elke verdunning gebruikt de standaard curves (figuur 4A-E, rechts) construeren. De absolute gelijkheid testen van de bochten, een bekende concentratie van de volledige coderende cDNA werd geamplificeerd en vervolgens geanalyseerd als een onbekend monster. Deze test werd uitgevoerd om te controleren of elke geteste verdunning resulteerde in de verwachte hoeveelheid. Zoals getoond in Figuur 4A-E, exact gelijke hoeveelheden werden waargenomen voor elke geteste verdunning gebruikt om de standaardkromme te construeren (zie figuur S2). De kwantificering van de lage-overvloed transcripten en overvloedige transcripten stelt ons in staat om de gevoeligheid en betrouwbaarheid van real-time PCR te bevestigen, wat aangeeft dat onze real-time PCR-methode biedt een groot dynamisch bereik van de kwantificatie, hoge nauwkeurigheid en hoge gevoeligheid (figuur 4A- E, rechts). Zo, onze real-time PCR-methode zorgt voor een betrouwbare waarden voor twee chitinase genen en voor referentie genen op dezelfde schaal. Om de studie van de We vergeleken de verhoudingen van AMCase naar Chit1. Het aantal kopieën van elk mRNA werd bepaald met behulp van dezelfde standaard verdunningen. We vonden dat de maag en de onderkaak klier voornamelijk tot expressie AMCase mRNA (Figuur 5C, bovenste paneel). De andere weefsels onderzocht in deze studie produceerde meer dan AMCase Chit1 en Chit1 heerste alleen in de ogen (figuur 5C, onderste paneel). We vervolgens onderzocht de relatieve kwantificatie van de oorspronkelijke gegevens in figuur 5, die werd uitgedrukt als moleculen per 10 ng totaal RNA, gebruiken housekeeping genen zoals beschreven in Materialen en werkwijzen. De resultaten werden getoond als Ondersteunende informatie in figuur S3 (gegevens werden genormaliseerd door GAPDH) en Figuur S4 (genormaliseerd door β-actine). Vervolgens analyseerden we uit figuur 5 de ΔΔ Ct methode [21] en getoond als aanvullende informatie in figuur S5 (genormaliseerd op GAPDH) en Figuur S6 (genormaliseerd door β-actine). Bij vergelijking van de relatieve expressie gedetecteerd door de huidige absolute en relatieve kwantificatie werkwijzen, was er geen significant verschil tussen de gegevens behalve Chit1 mRNA, die het meest overvloedig tot expressie werd gebracht in de ogen wanneer genormaliseerd door β-actine (zie figuur 5, Figuur S3 en Figuur S4). Soortgelijke resultaten werden ook verkregen door de relatieve kwantificatie met behulp van de ΔΔ Ct methode [21] (zie Figuur 5, Figuur S5 en S6 figuur). Echter, we konden niet direct wederzijdse expressie van Chit1 en AMCase beoordelen als geanalyseerd door de ΔΔ Ct methode. Veel studies zijn uitgevoerd op de pathofysiologie van zoogdieren chitinasen in longweefsel uitgevoerd. In deze studie hebben we aangetoond dat AMCase mRNA sterk tot expressie komt in de maag muisweefsels (Figuur 5). We vergeleken ook de expressieniveaus van de chitinasen en referentie-genen met behulp van de cDNA's bereid van de long en maag weefsels van 3 maanden oude muizen (n = 5). De kwantitatieve gegevens worden getoond in figuur 6. Wanneer de Chit1 niveaus werden ingesteld op 1,0, de relatieve expressieniveaus van cDNA waren AMCase, 14; GAPDH, 196; en β-actine, 681 bij de muis longweefsel (figuur 6A). Dit resultaat geeft aan dat longweefsel expressie meer dan AMCase Chit1, hoewel de AMCase expressieniveau lager dan die van de twee housekeeping genen was. In maag weefsels, wanneer het Chit1 werd vastgesteld op 1,0, de relatieve expressieniveaus waren AMCase, 721; pepsinogeen C, 2261; GAPDH, 61; en β-actine, 127 (figuur 6B). Zowel GAPDH en β-actine-genen zijn bekend housekeeping genen worden constitutief tot expressie op hoog niveau in de meeste weefsels en cellen. Pepsinogeen C (progastricsin) een asparaginezuurprotease dat functioneert als een digestief enzym en wordt geproduceerd in de maag. Dit enzym is een belangrijk onderdeel van het maagslijmvlies [23]. Het expressieniveau van AMCase was veel hoger dan die van GAPDH en β-actine en was vergelijkbaar met het niveau van pepsinogeen C Deze resultaten geven aan dat de maag AMCase een belangrijk transcript in het maagslijmvlies en suggereren dat dit enzym waarschijnlijk aanzienlijk spelen fysiologische rollen in de maag. ook herzien relatieve expressie van Chit1, AMCase pepsinogeen C en figuur 6 gebruikt huishoudgenen door de huidige werkwijze zoals hierboven beschreven. De resultaten werden getoond als Ondersteunende informatie in figuur S7 (genormaliseerd op GAPDH) en Figuur S8 (genormaliseerd door β-actine). Er was geen significant verschil tussen de figuur 6, Figuur S7 en S8 figuur. Zowel Chit1 en AMCase worden verondersteld om te helpen bij de afweer tegen chitine bevattende ziekteverwekkers [3], [ ,,,0],9]. Bovendien AMCase een effectormolecuul in allergische ontsteking. Deze chitinolytische enzymen spelen een belangrijke rol in de pathofysiologie van allergische reacties luchtwegen in muismodellen van astma. Relatief weinig bekend, maar over de In vivo Kwantitatieve real-time RT-PCR is een belangrijke vooruitgang bij het kwantificeren mRNA en maakt de detectie van de expressie van een bepaald gen van belang op moleculair niveau . Er zijn vele rapporten over de detectie van extreem lage niveaus van mRNA met behulp van deze technologie. Echter, real-time RT-PCR is een veel gebruikt omdat het nog beperkingen te kwantificeren meerdere mRNA's met dezelfde schaal. We construeerden een standaard template DNA dat vijf cDNA-fragmenten (iedere -200 basen lang). Deze fragmenten opgenomen fragmenten twee chitinasen, een marker en twee housekeeping genen en werden in één-op-één verhouding (Figuur 3A). GAPDH en β-actine, de meest gebruikte housekeeping genen werden als interne controles en referenties voor PCR amplificatie. Daarnaast gebruikten we pepsinogeen C als een merkergen omdat het geproduceerd wordt op hoog niveau in de maag [23]. Deze methode kon de absolute kwantificering van het aantal Chit1 AMCase en mRNA-moleculen, evenals het aantal referentie mRNA moleculen per 10 ng totaal RNA (mol /10 ng) (Figuur 5 en Figuur 6). Verder konden we relatieve kwantificering van de Chit1 en AMCase mRNA-niveaus met behulp van twee housekeeping genen, GAPDH en β-actine (Ondersteunende informatie Figuur S3 en Figuur S4) te onderzoeken. De relatieve kwantificatie is makkelijker uit te voeren dan de absolute kwantificering omdat een kalibratiekromme is niet noodzakelijk. In relatieve kwantificatie, worden mRNA-niveaus van het gen van belang ten opzichte van die van de housekeeping genen [21]. Echter, deze kwantificatie methode niet het niveau van de verschillende gentranscripten vergelijken op dezelfde schaal. Hoewel onze werkwijze meerdere stappen in verband met de bouw van het standaard-DNA en de validatie processen vereist, kan deze werkwijze genexpressie gegevens direct vergelijkbaar tussen genen (Figuur 5 en Figuur 6) zijn voorzien. Onze real-time PCR leverde een groot dynamisch bereik van de kwantificatie en een hoge gevoeligheid, en de kwantificering van lage-overvloed transcripten liet ons toe om de gevoeligheid en de betrouwbaarheid van onze methode (figuur 4) te valideren. Deze techniek is zeer geschikt voor de kwantificering en vergelijking van mRNA niveaus in meerdere genen met dezelfde schaal. Onze huidige methode is toepasbaar voor biomedische engineering, alsmede klinische en praktische toepassingen. In het onderhavige onderzoek, vonden we dat AMCase mRNA wordt gesynthetiseerd op buitengewoon hoog niveau in de maag muis ten opzichte van de niveaus van housekeeping genen (Figuur 5 en Figuur 6). Het niveau van mRNA AMCase is vergelijkbaar met die van pepsinogeen C (progastricsin) mRNA, een belangrijke component van het maagslijmvlies in de maag (figuur 6B). Naast de maag werden de onderkaak klieren ook gevonden dat grote hoeveelheden AMCase (figuur 5) te drukken. Zoals voor het synthetiseren van zoogdieren chitinase mRNA's, zowel maag en onderkaak klieren worden beschouwd als significante weefsels voor het produceren enorme AMCase in muizen. Zoutzuur wordt uitgescheiden in de maag, waardoor zure omstandigheden voor de vertering van eiwitten door pepsine bij ongeveer pH 2 [23], [24]. Mouse AMCase toont diepe zuur stabiliteit en het meest actief is bij een pH van 2,0, die het zich onderscheidt van andere muis enzymen [8]. De ongewone pH-stabiliteit en de afhankelijkheid van de muis AMCase op zure omstandigheden kan de efficiënte vertering van chitinous materialen onder zure omstandigheden. De observatie dat AMCase voornamelijk in de maag punten wordt uitgedrukt op een eventuele functie in de voedingsmiddelenindustrie. Wild muizen eet-chitine bevattende voedingsmiddelen zoals insecten, terwijl muizen in het laboratorium gehouden eet kunstmatige voeding met gedroogde brouwers gist, waarin ook chitine in de celwand. Zo kan AMCase functioneren als een digestief enzym dat afbreekt polymere chitine in de maaginhoud. Het hoogste niveau van Chit1 werd ook tot uitdrukking in de maag van de muis. De Chit1 expressieniveau in de maag was 1/721 dat de AMCase expressieniveau en lager dan de expressieniveaus van twee housekeeping genen, GAPDH en β-actine (Figuur 6A). Bovendien heeft Chit1 geen chitinolytische activiteit bezitten bij de pH van maagsappen, die ongeveer pH 2 [5], [11]. Er is aangetoond dat Chit1 geproduceerd op plaatsen van bijna neutrale pH, zoals niet-glandulaire gedeelte van de maag en de dunne darm [25]. Aldus heeft Chit1 niet bij aan chitinase activiteit in de maag van de muis. Hoewel AMCase overwegend tot expressie gebracht in de maag en onderkaak klieren, alle andere weefsels onderzocht in deze studie uitgedrukt lage, maar detecteerbare niveaus van Chit1 en AMCase . De expressieniveaus van Chit1 en AMCase waren lager dan die van de housekeeping genen in deze weefsels. Chit1 toont een breed pH-optimum bij ongeveer pH 5 [5], dat de primaire optimale pH van AMCase pH 2 en de secundaire pH optimum bij pH 4-7, met behoud AMCase minder dan 30% van zijn activiteit bij pH 2 in deze pH bereik [8]. Zowel Chit1 en AMCase verteren natuurlijke chitine en chitosan via endo-chitinase activiteit en produceren chitobiose [8], [26]. Hoewel AMCase dominant is over Chit1 vele muizenweefsels, kan er geen significante verschillen in de chitinolytische activiteit in muisweefsels. Meer AMCase mRNA dan Chit1 mRNA werd waargenomen in de meeste muizen weefsels, behalve de ogen. Onze resultaten suggereren ook dat genexpressie van Chit1 ontwikkelingsgebied worden opgesteld, suggereert dat het een rol speelt ontogenie. Het bestuderen van de regulering van de expressie van het zoogdierlijke chitinasen kan inzicht in de fysiologische rol van deze enzymen geven. Een gedetailleerde karakterisering van de promotor regio van Chit1 en AMCase genen, alsmede de identificatie van de cis Hoewel zoogdieren produceren geen chitine of chitinesynthase, ze voortdurend blootgesteld aan dit polymeer door blootstelling aan chitine bevattende parasieten en pathogenen. Het substraat voor zoogdierlijke chitinasen vermoedelijk milieu chitine, zoals die in schimmels en nematoden. In de longen kunnen beide enzymen fungeren als onderdeel van de ontvangende afweermechanisme tegen chitine bevattende ziekteverwekkers, zoals milieu- schimmels en mijten, die luchtwegen veroorzaken allergie.
acetyl-D-glucosamine, is de tweede meest voorkomende polysaccharide in de natuur. Het functioneert als een belangrijke structurele component van schimmels, schaaldieren en insecten maar wordt niet gevonden bij zoogdieren [1]. Chitinasen hydrolyseren de β-1-4 glycosidische bindingen van de chitine polymeer. Hoewel zoogdieren niet chitine of haar synthase te produceren, ze uiten twee actieve chitinasen, chitotriosidase (Chit1) en zure zoogdieren chitinase (AMCase) [2], [3].
regulering van zoogdier chitinasen. Onlangs is real-time RT-PCR gebruikt om mRNA te kwantificeren in vele genexpressiestudies [17] - [20], omdat deze werkwijze voldoende gevoelig om mRNA te detecteren van zelfs een enkele cel. Real-time PCR impliceert gewoonlijk de normalisatie van de expressieniveaus van het gen van belang met die van housekeeping genen waarvan wordt gedacht dat consistent uitgedrukt in alle monsters. Echter, deze kwantificatie methode niet het niveau van de verschillende gentranscripten te vergelijken op dezelfde schaal.
Real-time PCR
Constructie van de standaard DNA
II, Xho
I, Pst
I, of Niet
I (bij 5'- en 3 ' - ends) volgens het protocol van de fabrikant. De voorwaartse en omgekeerde primers zijn opgesomd in Tabel S2. De PCR-producten werden gezuiverd met behulp van de Wizard SV Gel en PCR Clean-Up System (Promega) en vervolgens geknipt met de overeenkomstige restrictie-enzymen. De DNA-fragmenten werden gezuiverd met behulp van agarosegelelektroforese en het Clean-Up Systeem en vervolgens geligeerd met T4 DNA ligase (Toyobo). De geligeerde fragmenten werden geamplificeerd met de voorwaartse primer 5'-GTGGATTCTGTGCCGACAAAGCAGATGGCC-3 'en de reverse primer 5'-TGGGTACATGGTGGTACCACCAGACAGCAC-3' met Plus KOD DNA polymerase. 3'-dA werd toegevoegd aan het geamplificeerde DNA met gebruikmaking van Takara HS Taq (Takara Bio), en het product werd gezuiverd door gelelektroforese zoals hierboven beschreven. Het resulterende DNA werd gekloneerd in de pGEM-T Easy-vector (Promega) met TA klonering volgens de instructies van de fabrikant. De nucleotidesequentie van het resulterende plasmide werd bevestigd door sequentiebepaling. De gelineariseerde multigen-bevattende DNA-fragment werd bereid door heramplificatie van het plasmide DNA met dezelfde primers door PCR met behulp Plus KOD DNA polymerase. De fragmenten werden gezuiverd en gekwantificeerd zoals hierboven beschreven en gebruikt als de standaard DNA.
Voorbereiding van de vijf cDNA's die het gehele coderende gebied
Standaard krommen
Kwantificering van mRNA door real-time PCR met behulp van de standaard curven of ΔΔ Ct Method
Resultaten
Constructie van de Standard Template DNA voor de kwantificering en vergelijking van genexpressie over vijf genen
II, Xho
I Pst
I en Niet
I (details in figuur 3B te zien).
Expressie van Chit1 en AMCase in Muis weefsels
in vivo regulatie van Chit1 en AMCase genexpressie totale RNA-monsters geëxtraheerd uit vier embryonale stadia en uit verschillende volwassen weefsels werden geanalyseerd met kwantitatieve real-time PCR met de interne standaard DNA (Figuur 3). De resultaten werden uitgedrukt als moleculen per 10 ng totaal RNA (Figuur 5 en Figuur 6). Zowel de Chit1 en AMCase mRNA's werden op grote schaal tot expressie gebracht in de muis weefsels (figuur 5A en 5B). Duidelijke specificiteiten weefsel werden waargenomen in de expressiepatronen van beide chitinase mRNA. Hoge niveaus van Chit1 mRNA werden gedetecteerd in de maag van de muis (Figuur 5A, bovenste paneel), gevolgd door de ogen en de longen. Chit1 mRNA werd gedetecteerd bij laag, maar gemakkelijk waarneembaar, de concentraties in andere weefsels (figuur 5A, onderste paneel). AMCase mRNA werd voornamelijk gedetecteerd in de maag, gevolgd door de onderkaak klier (Figuur 5B, bovenste paneel), maar is ook aanwezig in andere weefsels (Figuur 5B, onderste paneel).
Analyse van Chit1, AMCase, Pepsinogen C, GAPDH, en β-actine in de longen en maag weefsels
Discussie
wederzijdse expressie van Chit1 en AMCase. De kwantificering van mRNA kan nuttig en biomedisch relevante informatie te genereren. In deze studie hebben we een kwantitatieve real-time PCR systeem geschikt zijn om de mRNA niveaus van twee zoogdieren chitinasen en vergelijken van deze niveaus met die referentie genen met dezelfde schaal. Onze resultaten geven aan dat AMCase overwegend tot expressie gebracht in de maag van de muis.
- en trans
-werkende factoren nodig zal zijn om de selectieve expressie van deze enzymen te begrijpen <. br>
 Wat veroorzaakt scherpe pijn in de maag?
Wat veroorzaakt scherpe pijn in de maag?
 Waarom ben ik zo gasachtig en opgeblazen? Opluchting en oorzaken
Waarom ben ik zo gasachtig en opgeblazen? Opluchting en oorzaken
 Portiegroottes &het FODMAP-dieet
Portiegroottes &het FODMAP-dieet
 Overgebleven ontbijtsoep
Overgebleven ontbijtsoep
 Antibioticum X-206 effectief tegen SARS-CoV-2 in vitro
Antibioticum X-206 effectief tegen SARS-CoV-2 in vitro
 Schoonmaakproducten kunnen het risico op astma bij kinderen verhogen, blijkt uit onderzoek
Schoonmaakproducten kunnen het risico op astma bij kinderen verhogen, blijkt uit onderzoek
 Wat u moet weten over telezorg voor maagkanker
Telegezondheid - een manier om zorg op afstand te ontvangen via verschillende communicatietechnologieën - maakt het mogelijk om zorg te verlenen zonder persoonlijke interacties. Er zijn vaak bezoeken
Wat u moet weten over telezorg voor maagkanker
Telegezondheid - een manier om zorg op afstand te ontvangen via verschillende communicatietechnologieën - maakt het mogelijk om zorg te verlenen zonder persoonlijke interacties. Er zijn vaak bezoeken
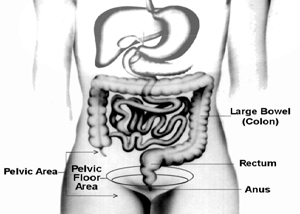 Dyssynerge ontlasting:over een veelvoorkomende oorzaak van chronische constipatie
Inleiding Er is geen eenduidige definitie van constipatie. Een persoon kan een of meer problemen ervaren, zoals onregelmatige stoelgang, harde en moeilijk te passeren ontlasting, onvolledige stoelgan
Dyssynerge ontlasting:over een veelvoorkomende oorzaak van chronische constipatie
Inleiding Er is geen eenduidige definitie van constipatie. Een persoon kan een of meer problemen ervaren, zoals onregelmatige stoelgang, harde en moeilijk te passeren ontlasting, onvolledige stoelgan
 Na de heropening van de COVID-19-kliniek
Terwijl we ons voorbereiden om u weer in de kliniek te verwelkomen, is onze belangrijkste prioriteit de gezondheid en het welzijn van al onze patiënten. Om u hoogwaardige, persoonlijke zorg te kunnen
Na de heropening van de COVID-19-kliniek
Terwijl we ons voorbereiden om u weer in de kliniek te verwelkomen, is onze belangrijkste prioriteit de gezondheid en het welzijn van al onze patiënten. Om u hoogwaardige, persoonlijke zorg te kunnen