A GSDMB
Enhancer-drevet HSV tymidinkinase-uttrykke vektor for styring av okkult peritoneal formidling av magekreftceller
Abstract
bakgrunn
Magekreft kreft~~POS=HEADCOMP (GC) er en av de store ondartede sykdommer over hele verden, spesielt i Asia og Japan og Korea har den høyeste forekomsten i verden. Fordi de fleste av de sakene som ikke responderer på behandling dør på grunn av peritoneal formidling (PD) av kreftceller, kontrollere PD er viktig for pasientens overlevelse. GSDMB
er medlem av gasdermin genet familien. Fordi GSDMB
er uttrykt i mange typer kreft, inkludert GC, er det sannsynlig at genet inneholder et regulatorisk område som benyttes for behandling av okkult PD gjennom kreftcellespesifikk ekspresjon av cytotoksiske gener.
Methods
Vi utførte reporter analyser for å identifisere den regulatoriske regionen for kreftcellen spesifikke uttrykk. Vi har også konstruert en lentiviral terapeutisk vektor som uttrykker herpes simplex virus tymidin kinase (HSVtk) i en GC celle-spesifikk måte, og testet det i en musemodell for Parkinsons sykdom.
Resultater
Vi identifiserte det regulatoriske område ved 496 til 989 fra GSDMB
transkripsjon start stedet og betegnet det som en GSDMB
forsterker. Den lentiviral terapeutiske vektoren trykkes spredning av en GC-cellelinje, 60As6, in vitro
i nærvær av ganciclovir, og intraperitoneal administrering av vektoren forlenget overlevelsen varigheten av mus som ble intraperitonealt inokulert med 60As6 en uke før administrering.
Konklusjoner
GSDMB
-driven HSVtk ekspresjonsvektor hadde en terapeutisk effekt på de okkulte PD modell mus. Denne strategien kan potensielt brukes til å behandle GC pasienter med PD.
Nøkkelord
Mage svulster bukhulen Genetisk terapi HSV tymidin kinase Bakgrunn
Magekreft (GC) er en av de store ondartede sykdommer, spesielt i Asia, og den nest største årsaken til kreft-assosiert dødsfall på verdensbasis [1]. Det er vanligvis klassifisert i to typer (Lauren klassifikasjon) [2], intestinal og diffuse, som antas å gjenspeile sin patogenesen [3]. Den diffuse-type GC (DGC) er sub-klassifisert som dårlig differensiert GC (ikke-fast type) eller udifferensiert GC i den japanske Gastric Cancer Association klassifiseringssystemet [4]. DGC er infiltrerende og ofte aggressiv viser invasjon til den gastriske vegg, noe som resulterer i metastaser og spredning av GC celler i bukhulen (peritoneal spredning, PD).
Den spres GC celler i bukhulen gi opphav til peritoneal karsinomatose ( PC) [5]. PC forårsaker gastrointestinale symptomer som magesmerter, kvalme og oppkast, samt systemiske symptomer som vekttap og ascites. PC ikke bare sterkt forringer livskvaliteten til GC pasienter, men det er også den ledende dødsårsaken i GC [6]. Med støttebehandling alene, var median overlevelse av pasienter med PC er 3-6 måneder [7]. Hvis det behandles med systemisk kjemoterapi, på samme måte som for andre metastatiske lesjoner, viser PC-en dårligere respons på behandlingen enn andre typer av metastase i GC, hovedsakelig på grunn av dårlig fordeling av det kjemoterapeutiske middel i bukhulen. Derfor har siste innsats fokusert på innovative PC therapeutics, slik kombinasjon av cytoreduserende kirurgi, termisk behandling, og intraperitoneal kjemoterapi. Disse kombinerte tilnærminger har noe forbedret prognose av PC, selv om den midlere overlevelsestiden er fortsatt mindre enn 12 måneder, slik at det er klart at det er en praktisk grense for den effekt av kirurgiske cytoreduksjon [8, 9]. Nylige studier tyder på at det er viktig å identifisere GC pasienter med okkult PD ved å utføre et cytologisk undersøkelse av peritoneal vaskevæske, fordi slike tilfeller viste forbedret prognose hvis de oppnådde omdannelse til negativ cytologi ved omfattende intraoperativ peritoneale lavage etterfulgt av intraperitoneal kjemoterapi [10].
begrepet "selvmord gen" kreftbehandling, ved hjelp av herpes simplex virus tymidinkinase (HSVtk), dukket opp på 1980-tallet [11]. HSVtk katalyserer fosforyleringen av guanosin analog ganciclovir (GCV) inn i et monofosfat form som deretter blir fosforylert av cellulære nukleotid-kinaser i meget giftig ganciclovir-trifosfat [12]. Ganciclovir trifosfat blokker DNA-replikasjon, noe som fører til cellesyklus-stans og celledød [13]. Terapi som involverer HSVtk overføring til kreftceller, etterfulgt av GCV administrasjon, er kjent som selvmord genterapi, og denne teknikken ble nylig brukt i en fase III klinisk studie på glioblastoma multi [12].
I denne studien har vi utviklet en terapeutisk vektor som uttrykker HSVtk i kreftceller, utnytte et regulatorisk område av gasdermin B genet (GSDMB
). GSDMB
er medlem av gasdermin (GSDM
) familie som består av fire gener, GSDMA
, GSDMB
, GSDMC Kjøpe og GSDMD product: [14, 15], og er uttrykt i prolifererende celler i normal epitel og også i mange typer kreft, inkludert øsofageal, gastrisk, lever, tykktarm, livmorhalsen og brystkreft [14, 16-18]. GSDMB
ekspresjon drives av to promotorer, den cellulære promoter og LTR-avledet promoter [19-21]. LTR-avledet promoter (LTR promoter) er aktivt i de fleste normale vev, bortsett fra magen, og i mange cancercellelinjer, mens den cellulære-promoteren er aktiv i normalt vev magen og i noen cancercellelinjer [20]. I denne studien, identifiserte vi en region i nedstrøms av det LTR-promoteren, som viste sterk transkripsjonen aktivitet i GC-cellelinjer. Vi brukte denne regionen for å konstruere en HSVtk-uttrykk viral vektor for å kontrollere okkult PD.
Metoder
menneskelig vev
Magekreft (GC) vev ble levert av National Cancer Center Hospital etter å ha innhentet skriftlig informert samtykke fra hver pasient, som ble godkjent av National Cancer Center Institutional Review Board (ID: No.17-030). Vevsprøver ble umiddelbart frosset med flytende nitrogen etter kirurgisk ekstraksjon, og lagret ved -80 ° C inntil bruk.
Microarray analyse
Totalt RNA ble isolert ved å suspendere cellene i ISOGEN lysis buffer (Nippon Gene, Toyama, Japan) etterfulgt av utfelling med isopropanol. Vi utførte uttrykk analyser ved hjelp av menneskelig uttrykk Array U95A versjon 2 (Affymetrix, Santa Clara, CA) i henhold til leverandørenes protokoller. Uttrykket verdi (gjennomsnittlig forskjell: AD) av hvert gen ble beregnet ved bruk av Genechip Analysis Suite versjon 4.0-programvaren (Affymetrix). Hierarkisk clustering av microarray data ble utført ved hjelp GeneSpring (Agilent Technologies Ltd., Palo Alto, CA), Microsoft Excel, og Cluster & Treeview [22, 23]. Alle microarray data har blitt deponert i en MIAME kompatibel database, GEO (tiltredelse nummer, GSE47007). Ved Wilcoxon u
-test (p
< 0,05) og ved å vise en to-ganger endring, gener uttrykkes spesifikt i diffuse-type GC ble valgt [22] Hotell Cellelinjer og hovedkultur mus. mesothelial celler
Tre gastrisk kreft-cellelinjer, HSC-57, avledet fra intestinal-type GC, og HSC-59 og HSC-60, som begge er avledet fra diffus-type GC, ble etablert og karakterisert ved en av forfatterne [24 ]. SNU16, avledet fra diffus-type GC, ble levert fra American Type Culture Collection (ATCC), to andre cellelinjer med effektivitet i å produsere PD-mus, 60As6 og 60As6GFP (60As6 uttrykker grønn fluorescens-protein), ble etablert av forfatterne fra diffuse-type GC utledet HSC-60 cellelinjen etter flere passasjer av intraperitoneal transplantasjon til mus [25]. CC-2511, en fibroblast cellelinje, ble kjøpt fra Lonza, Japan (Tokyo, Japan). Alle cellelinjer ble opprettholdt i Dulbeccos modifiserte Eagle-medium. Muse mesothelial Cellene ble høstet ved injeksjon av 10 ml oppvarmet 0,25% Trypsin /EDTA-oppløsning inn i bukhulen [26]. Cellene ble inkubert i 3 dager i RPMI-1640 supplert med L-glutamin, fenolrødt og HEPES (WAKO, Tokyo, Japan). Met-5A, en human mesothelial cellelinje, ble levert fra ATCC, og opprettholdt i Medium 199 (Life Technologies, Tokyo, Japan) supplert med 3,3 nM EGF (Life Technologies), 400 nM hydrocortison (Sigma-Aldrich, St. Louis, MO USA), 870 nM insulin (Life Technologies) og 10% FBS.
RT-PCR
Total RNA fra humane normale organer ble kjøpt fra BioChain, Hayward, CA. Total RNA ble ekstrahert ved bruk av en RNeasy Mini Kit (Qiagen, Tokyo, Japan). Når du har generert første-cDNA fra total RNA ved hjelp ThermoScript RT-PCR System (Life Technologies, Tokyo Japan), ble PCR utført med AccuPrime ™ pfx
DNA Polymerase (Life Technologies) under følgende sykkelforhold enten 35 (LTR transkripsjoner ) eller 25 sykluser (andre): 95 ° C i 1 min; 56 ° C (β-aktin) eller 58 ° C (andre) i 1 min; og 72 ° C i 1 min. De følgende primersett ble anvendt: for cellulær promoter-transkript, 5'-CTTCCTGAGATTCAGAGGCC-3 'og 5'-CCAGAATTTGAAACTCAGCC-3'; for LTR promotor-avledet transkripter, 5'-TTCAGTTGCTTCAGGCCATC-3 'og 5'-CCAGAATTTGAAACTCAGCC-3'; for 3'-siden av GSDMB
, 5'-ATTCTGGACTTCCTGGATGC-3 'og 5'-ATGTATGAAATCCAGGCTGG-3'; for MYH11
, 5'CAGTGACGATGAGAAGTTCC-3 'og 5'CGCAGAAGAGGCCAGAGTAC; og for β-aktin
, 5'-TCATCACCATTGGCAATGAG-3 'og 5'-CACTGTGTTGGCGTACAGGT-3' reporter analysen.
En genomisk fragment, -1080 til 1053 av GSDMB Hotell og inneholder LTR-promoteren, ble amplifisert ved PCR ved anvendelse av LA Taq Hot start-DNA-polymerase (Takara) i 35 sykluser av 96 ° C i 30 s og 68 ° C i 2 min, ved hjelp av primersett: 5'-CTTCCTGAGATTCAGAGGCC-3 'og 5'- -CTCGAGTTCACTGTGTTAGCCAGG-3 ', og satt inn i en pGL3 grunnleggende vektor (Promega, Madison, WI). Det ble avkortet ved hjelp av restriksjonssetene: Nhe
jeg og Eco
R jeg å generere -1035 til 1053 fragment; KPN
jeg og Eco
R jeg for -426 til 1053; Nhe
jeg og Afl
II for -61 til 1053; Nhe
jeg og Eco
81 jeg for 129-1053; og Nhe
jeg og Stu
jeg for 496-1053. Den 496-1053 reporter konstruere ble ytterligere avkortet med restriksjonsenzymer: Nhe
jeg og Swa
jeg for 757-1053; Nhe
jeg og Pvu
II for 860-1053; Nhe
jeg og Bst
X jeg for 989-1053; Xho
jeg og Bst
X jeg for 496-989; Xho
jeg og Pvu
II for 496-860; og Xho
jeg og Swa
jeg for 496-757. For ytterligere trunkering av 496-989 fragment, ble PCR utført med fragment som et templat ved hjelp av Ex Taq DNA-polymerase (Takara) i 35 sykluser på 95 ° C i 1 minutt, 58 ° C i 1 min, og 72 ° C i 1 minutt, ved bruk av følgende primersett: for 562-989, 5'-GCTAGCTGTGGGATTTGTACACATCC-3 'og 5'- AGATCTCGACTGGGATTACAGG-3'; og for 649-989, 5'-GCTAGCTTTATTTCCACTGGAAACCG-3 'og 5'-AGATCTCGACTGGGATTACAGG-3'. Etter forsterkning, ble fragmenter satt inn pGL4.12 [luc2CP
] vektor (Promega). De -1 kb oppstrøms regioner av CXCR4
og CXCR7
ble fremstilt ved PCR ved anvendelse av genomisk MightyAmp DNA-polymerase (Takara) i 35 sykluser av 98 ° C i 10 s, 62 ° C i 15 s, og 68 ° C i 2 minutter, ved hjelp av følgende primer sett: for CXCR4
, 5'-GCTAGCGCGCCCACTGCAAACCTCAG-3 'og 5'-CTTAAGTCACTTTGCTACCTGCTGC-3'; og for CXCR7
, 5'-GCTAGCCGGAGGCCCCCGGAGAGCAG-3 'og 5'-CTTAAGTTTGCAACAACTGTGAGC-3'. Disse fragmentene ble satt inn i pGL4.12 [luc2CP
] vektor. En mikrogram hver konstruksjon og Renilla luciferase kontroll reporter vektor (PRL-SV40 vektor, Promega) ble ko-transfektert inn 1 × 10
5 celler ved hjelp Superfect Transfeksjon Reagens (QIAGEN). Luciferase-assay ble utført 24 timer etter reporteren innledning, ved hjelp av en dobbel-luciferase reporter Assay System (Promega). Analysen ble utført i tre eksemplarer.
GSDMB
Enhancer-HSVtk lentivirus vektor, En pMFG-HSVtk vektor ble gitt av Riken BRC gjennom National Bio-Resource prosjekt MEXT, Japan, av høflighet av Dr . Hirofumi Hamada, og en HSVtk cDNA ble skåret ut fra det som et Nco I-Bam
HI fragment. Å konstruere GSDMB
Enhancer-HSVtk lentivirus vektor, først 496-989 fragment (GSDMB
Enhancer) ble satt inn i pcDNA3.1 (+) (Life Technologies) mellom Nhe
I og Hind
III områder, og deretter HSVtk-cDNA ble satt inn i vektoren ved et Bam HI-sete
i fremover (for ekspresjon sans-tråden) eller bakover (for antisense-tråd uttrykk) retning. Deretter ble GSDMB
enhancer-HSVtk forstand og GSDMB
enhancer-HSVtk antisense-fragmentene spaltet ut fra plasmid-vektorer som Nhe I-
ikke
I-fragmenter og innføres i pLVSIN-CMV-neo vektorer mellom Xba
jeg og ikke anbefale jeg sider. Til slutt ble en CMV-promoter fjernet fra lentivirale konstruksjoner. For å generere viruspartikler som inneholder vektorene ble konstruerer introdusert i Lenti-X ™ 293 T-celler (Takara) ved hjelp Lenti-X ™ HTX Aging System (Takara). Etter 72 H'-inkubasjon ble mediet samlet og viral titer (cfu /ml) ble bestemt ved transduksjon inn i HT-1080-celler i nærvær av polybrene (5 mikrogram /ml i kulturmedium, Sigma-Aldrich). Partiklene ble påført på Met-5A og 60As6 (1 x 10 5 celler pr tallerken, i triplikat) in vitro
i nærvær av polybrene (5 ug /ml), og cellene ble inkubert i medium innehold Gancicrovir (GCV, 5 ug /ml, WAKO) i 5 dager for cellevekstmålinger. Analysene ble utført in triplo og P
-verdi av Student t-test
mellom de dyrkede celler med (+) og uten (-) GCV ble beregnet
Behandling av PD-musemodell med GSDMB enhancer-HSVtk vektorer
Vi har tidligere rapportert en mus PD-modell (PD mus) som var fremstilt ved intraperitoneal injeksjon av 60As6 celler [25]. 60As6GFP-celler (1 x 10 6 celler per mus) ble injisert i bukhulen til 18 mus (6 uker gamle mus av CB17 /ICR-Prkdc < scid > /CrlCrlj Genotype: scid /scid, Charles River, Yokohama Japan) ved dag 1. musene ble delt i to grupper; en gruppe ble injisert med antisens ekspresjonsvektor, og den andre gruppen ble injisert med den forstand vektoren; begge gruppene ble deretter injisert intraperitonealt med 2 ml PBS-løsning inneholdende virale partikler (5 x 10 5 cfu) og Ganciclovir (2 mg) ved 8, 10 og 12 dag. Det betyr overlevelsestid for hver gruppe og P
-verdi av Student t
-test mellom de to gruppene ble beregnet. Studien ble godkjent av National Cancer Center komité for dyreforsøk.
Resultater
Identifikasjon av en forsterker region i GSDMB
, som driver genuttrykk i GC celler
å identifisere promoter /enhancer regioner som vil være effektiv i å utvikle et terapeutisk vektor for peritoneal spredning (PD), ser vi først søkte etter gener oftere uttrykt i diffust-type GC enn i intestinal-type GC ved hjelp av sammenlignende genekspresjonsanalyser mellom 12 primær diffuse-typer og 18 intestinal -types, fordi PD blir oftere sett i diffuse-type GC enn i tarm-type [22]. Vi la merke til at fire av ti Affymetrix Genechip probe sett viser den høyeste fold-endring for genuttrykk i diffuse-type GC forhold til intestinal-type var probe sett for MYH11 plakater (myosin, tung kjede 11, glatt muskulatur genet, tilleggsfiler 1: Tabell S1). Etter å ha bekreftet at genet ikke er uttrykt i udødeliggjort human mesothelial cellelinje MET-5A (data ikke vist), valgte vi MYH11
som en sterk kandidat til gen hvis arrangøren gjør diffus-type GC spesifikke uttrykk for HSVtk. Imidlertid er genet ikke uttrykt i 60As6-celler som ble brukt for fremstilling av PD-modell mus (Tilleggs fil 2: Figur S1). Det er sannsynlig at MYH11
er uttrykt i kreft-assosiert fibroblaster som er spesielt rik på diffuse-type GC vev. Deretter går ut av microarray dataanalyse, flyttet vi vår oppmerksomhet til oppstrøms regioner av CXCR4 plakater (chemokine (CXC motiv) receptor 4 gen) og CXCR7 plakater (chemokine (CXC motiv) reseptor 7-genet), som begge er uttrykt i mange typer kreft og har en viktig rolle i metastase [27]. Men ved å bruke reporter analyser, fant vi at oppstrøms områder av disse genene var transkripsjonelt aktiv i både Met-5A og 60As6 celler (Tilleggs fil 2: Figur S2), noe som tyder på at regionene drive uttrykk for HSVtk i humane mesothelial celler in vivo
. Til slutt, vi fokusert på GSDMB
genet, som vår tidligere studie indikerte at det er sterkt uttrykt i GC vev og cellelinjer [14].
GSDMB
er transkribert av to arrangører, cellulære og LTR arrangører ( fig. 1a), og den sistnevnte blir hovedsakelig brukt i normalt vev og i kreftcellelinjer [19-21]. Vi har bekreftet disse resultatene ved å utføre RT-PCR analyser av RNA fra flere typer av normalt vev (Fig. 1b). RT-PCR på GC kirurgiske prøver viste at LTR-promoteren ble benyttet i 14 av 15 intestinal-type GCer og i 11 av 15 diffus-type GCer (Fig. 1c). Fig. 1 GSDMB
genet transkribert av Cellular og LTR arrangører. (A) En skjematisk illustrasjon av de to promotere. (B) Ekspresjon av to transkripter, en av cellulær promoter og den andre av LTR, i humane normale vev (RT-PCR). Fire varianter av menneskelig GSDMB transkripsjon er registrert i GenBank; variant 1 (NM_001042471), variant 2 (NM_018530), variant 3 (NM_001165958) og variant 4 (NM_001165959). Transkripsjon av variantene 1, 3 og 4 drives av den cellulære promoteren og det av variant 2 er ved den LTR promoter. 3 'side av GSDMB
transkripsjoner er felles for alle. (C) Ekspresjon av LTR-transkripter i magekreft vev, 15 intestinal-type og 15 diffus lignende prøver (RT-PCR på kirurgiske prøver)
For å identifisere en region kritisk for transkripsjonen aktivitet i GC-celler, et DNA-fragment som strekker seg -1080 til 1053 bp, posisjonen fra en transkripsjon start stedet for LTR promoter, ble isolert (fig. 2a). Rapportørmålinger på avkortede DNA-fragmenter ved hjelp av to GC cellelinjer, HSC-57 og HSC-59, indikerte at en 496-989-regionen hadde sterk transkripsjonen aktivitet, enda sterkere enn den opprinnelige -1080 til 1053 fragment, og at videre trunkering av 496-989 fragmentet resulterte i signifikant reduksjon av den transkripsjonelle aktivitet (fig. 2b). Området som tilsvarer dette fragment med sterk transkripsjonen aktivitet het GSDMB
enhancer. Fig. 2 Identifisering av GSDMB
forsterker. (A) En skjematisk illustrasjon som viser rapportør konstruksjoner som brukes i luciferase-analyser. Lang terminal gjenta (LTR) element av menneskelig endogene retrovirus er vist med en tohodet pil. Stillingen er fra transkripsjon start stedet for transkripsjon av LTR promoter. (B) luciferase analyser ved hjelp av to magekreft cellelinjer, HSC-57 og HSC-59, avslørte en region med sterk transkripsjonen aktivitet, som spenner 496-989, som ble utpekt som GSDMB
forsterker. Vector, tom reporter vektor, Bar, standardavvik
Bygging av en GSDMB
Enhancer-drevet HSVtk lentivirus vektor
Vi har tidligere rapportert om en mus PD-modell (PD mus) som ble produsert ved intraperitoneal injeksjon av 60As6 celler [ ,,,0],25]; i denne studien, har vi utviklet en viral vektor terapeutisk for behandling av PD mus. For å undersøke styrken av den transkripsjonelle aktivitet av GSDMB
enhancer i 60As6, ble reporter-analyser utført ved hjelp av reporter konstruksjon for oppstrøms regioner av CXCR4
og CXCR7
for sammenligning. Den GSDMB
Enhancer viste sterkere transkripsjonen aktivitet i 60As6 celler enn CXCR4
eller CXCR7
oppstrøms regioner, og, viktigst, GSDMB
Enhancer hadde svært svak transkripsjonen aktivitet i mus peritoneal mesothelial celler og i Met-5A, en human mesothelial cellelinje (fig. 3). Dette resultatet tyder på at GSDMB
Enhancer gjør HSVtk uttrykk nesten utelukkende i 60As6 men ikke i mesothelial celler i bukhulen av PD mus, og sannsynligvis ikke i menneskelig peritoneal mesothelium. Fig. 3 GSDMB
Enhancer har sterk transkripsjonen aktivitet i en 60As6 cellelinje. Luciferase-forsøk med tre typer av dyrkede celler: 60As6 celler som ble brukt for fremstilling av peritoneal spredning (PD) modell mus i denne studien, primær kultur celler fra mus peritoneale mesothelial celler og etablert human cellelinje mesotherial Met-5A. Bar, standardavvik
Deretter undersøkte vi effekten av HSVtk /GCV behandling med GSDMB
Enhancer-drevet HSVtk lentivirus vektor på 60As6 in vitro plakater (Fig. 4a). Antallet 60As6 celler transdusert med lentivirus-vektoren ble signifikant redusert når inkubert i medium supplert med GCV; på den annen side, det samme HSVtk /GCV behandling hadde ingen effekt på celletall på Met-5A (fig. 4b). Fig. 4 HSVtk /GCV behandling med GSDMB
Enhancer-drevet lentivirus vektor bedret overlevelse av PD mus. (A) En lentiviral terapeutisk vektor for GSDMB
forsterker (Enh) -driven ekspresjon av herpes simplex virus tymidin kinase (HSVtk). (B) Celle proliferasjonsanalyser på 60As6 og Met-5A transdusert med den terapeutiske vektor, foretatt ved inkubering i mediet med (+) /uten (-) ganciclovir (GCV). (C) En diett av HSVtk /GCV terapi for PD mus. Bar, standardavvik P
, P
-verdi av Student t
-test mellom de dyrkede celler med (+) og uten (-) GCV. (D) Mikroskopisk observasjon viste en liten populasjon av 60As6GFP celler (grønn fluorescens) implantert i mus bukhinne ved dag 10. (e) Antall mus overlevde etter HSVtk /GCV behandling med den forstand-tråden uttrykkende vektor (rød) og med et antisense -Strand uttrykke vektor som referanse (blå). Mener overlevelsestid på hver gruppe er vist på høyre side med P
- verdien av Student t
-test mellom de to gruppene
HSVtk /GCV behandling av okkulte PD mus
Vi søkte HSVtk /GCV terapi til PD mus. I denne terapeutiske analysen, fremstilt vi to typer av GSDMB
enhancer-drevet lentivirus vektoren: en vektor uttrykt følelse-tråd av HSVtk cDNA og ble anvendt for behandling av PD-mus, mens den andre vektoren uttrykte antisense-tråd og ble anvendt som kontroll. Behandlingen ble startet sju dager etter intraperitoneal inokulering av 60As6 celler som uttrykker grønn fluorescens protein (60As6GFP). Dette regimet ble utformet for behandling av okkult PD-modell hvori 60As6GFP celler ble diffust podet inn i bukhulen (fig. 4c, d). Etter tre doser av behandling, på dag 36, hadde ingen av de ni musene behandlet med HSVtk sans-ekspresjonsvektor døde, mens to av de ni referanse mus hadde allerede dødd. Ingen av de ni referanse mus var i live på dag 57, dvs. åtte uker etter injeksjon av 60As6GFP celler; imidlertid fire av ni terapeutiske vektor-behandlede musene var fremdeles i live (fig. 4e). Dette resultatet tyder på at behandlingen kan bedre prognosen for okkulte PD mus.
Diskusjon
GSDMB
forsterker driver genuttrykk i GC celler
Tidligere har vi rapportert at GSDMB
er uttrykt i alle GC vev og cellelinjer undersøkt [14], og i denne studien viste at LTR-promoteren driver GSDMB
ekspresjon i 25 av 30 GC prøver (fig. 1c). Den transkripsjonelle aktivitet av LTR regionen (Fig. 2a) ble tidligere demonstrert ved rapportør assays i ikke-GC-cellelinjer [20, 21]. Men vi fant en tydelig region med sterk transkripsjonen aktivitet i nedstrøms LTR regionen, og betegnet det som GSDMB
forsterker. I tillegg til de to GC cellelinjer, HSC-57 og HSC-59, ble den transkripsjonelle aktivitet av denne regionen detekteres av rapportør analyser i andre GC-cellelinjer, blant annet MKN74 (relativ luciferaseaktivitet var ca. 1,9), HSC-60 (29.4 ), HSC-42 (2,5) og HSC-44 (4,6), men ikke i HSC-58 eller MKN28 (data ikke vist) [14]. Dermed gjør GSDMB
Enhancer ikke kjøre genuttrykk i noen GC-celler.
Trunkering av en region som spenner 496-562 betydelig redusert transkripsjonen aktivitet av GSDMB
forsterker (fig. 2b, 562 til 989). I 496-562 regionen, fant vi konsensus-bindende områder av flere transkripsjonsfaktorer, inkludert GATA2, GATA3, GATA4, YY1, SOX5, SOX9, SOX10 og NFY-A, og base substitusjon i noen av disse konsensussekvenser gjorde ikke påvirke transkripsjonen aktivitet av forøker (data ikke vist). Transkripsjonsfaktor som samhandler med forsterker og bidrar til det transkripsjonen aktivitet ennå ikke er identifisert.
Bruk av terapeutiske lentivirus vektor til behandling av humant okkult PD
Kurativ behandling har ikke blitt etablert for PD. GC pasienter med makroskopisk PD har dårlige prognoser, med en samlet median overlevelse på 3-6 måneder. De med bare mikroskopisk PD har også en dårlig prognose; sin 5-års overlevelse er 0-18% [28]. Derfor er det viktig å påvise okkult PD ved cytologisk undersøkelse av peritoneal vaskevæske og fullstendig utrydde kreftceller i bukhulen. Meta-analyser av Cabalag et al
. indikerte at utstrakt intraperitoneal kylling (EIPL, fysiologisk saltvann ett kull /dose, 10 ganger) og intraoperativ intraperitoneal kjemoterapi (IIPC) med cisplatin betydelig forbedret 5-års overlevelse for mer enn 40% [28]. Resultatene fra vår studie tyder på at HSVtk /GCV behandling med lentivirus vektor forbedrer prognosen for pasienter uavhengig av hverandre, og vi antar det vil bli brukt som en konsolideringsbehandling. Solide svulster med diffuse vekst er sammensatt av mange myofibroblasts og få fartøyer (f.eks diffus-type GCer, bukspyttkjertel kreft og scirrhous type brystkreft). Avhengig av forholdene i mikromiljøet, som for eksempel næringsmangel, disse svulstene viser en høy forekomst av sjelden-proliferative tumorceller. Således kan diffus-type GC-celler formidlet i bukhulen består av en populasjon som kan motstå den cytotoksiske effekt av cisplatin. Lentivirus terapeutiske Vektoren kan innføre HSVtk inn i både prolifererende og ikke-prolifererende celler. Dessuten muliggjør den GSDMB
enhancer GC celle-spesifikke HSVtk ekspresjon. Denne begrensede ekspresjon minimerer mesothelial celleskade, hvilket betyr at genterapi kan utføres ved bruk av doser som er høye nok til å fullstendig utrydde GC-celler, dette gjelder også motstandsdyktig mot cisplatin, i okkult PD. Det er sannsynlig at kombinasjonsbehandling, EIPL og IIPC, etterfulgt av HSVtk /GCV behandling med lentivirus vektor, vil bedre prognosen av okkult PD mer betydelig enn EIPL og IIPC kombinasjonsbehandling alene. Vi tror at dette regimet er verdig til å bli plassert på kliniske studier. Selv om det ser ut til at GSDMB
Enhancer ikke fungerer i noen GC-celler, videre studier som tar sikte på å identifisere ytterligere GC-spesifikke enhancers vil løse dette problemet.
Konklusjoner
GSDMB
-driven HSVtk uttrykk vektor hadde en terapeutisk effekt på okkult PD-modell mus. Denne strategien kan potensielt brukes til å hindre at GC pasienter fra kontraktør PD og også brukes til å behandle GC pasienter med PD.
Erklæringer
Erkjennelse
Denne studien ble støttet av en Grants-i-Aid for Scientific Research (C .) av Japan Society for Promotion of Science (JSP KAKENHI Grant Number 23501322)
Tilleggsfiler filer~~POS=HEADCOMP
tilleggsfiler 1: Tabell S1. Topp ti probe sett viser uttrykk bestemt å spre-type magekreft. Tilleggs fil 2: Figur S1. MYH11
er ikke uttrykt i mage kreft cellelinjer. En promoter-regionen i både CXCR4 Hotell og CXCR7
gener viser en transcriptional aktivitet både 60As6 og Met-5A celler. Konkurrerende interesser
Forfatterne erklærer de har ingen konkurrerende interesser. Bidrag
Forfatternes NS og HS designet og ledet denne studien. NS utført biologiske analyser og dyreforsøk med støtte av RK, FC og KY. Alle forfattere lese og godkjent den endelige manuskriptet.
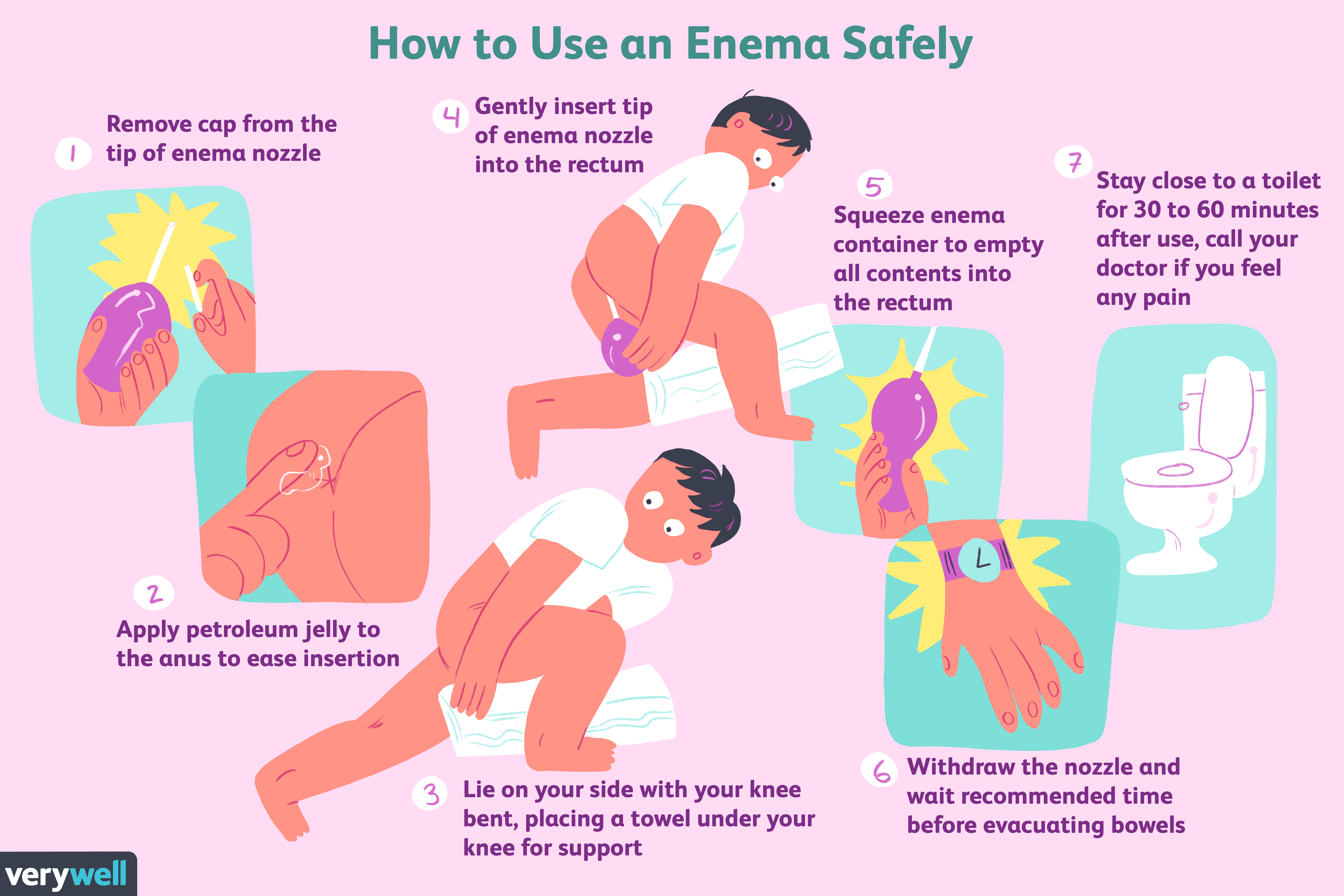 Slik bruker du en klyster på en sikker måte
Slik bruker du en klyster på en sikker måte
 Administrer livet ditt med irritabel tarmsyndrom
Administrer livet ditt med irritabel tarmsyndrom
 Forskere identifiserer en bakterie med anti-SARS-CoV-2-aktivitet in vitro:Dolosigranulum pigrum
Forskere identifiserer en bakterie med anti-SARS-CoV-2-aktivitet in vitro:Dolosigranulum pigrum
 En oversikt over Rotavirus
En oversikt over Rotavirus
 Det du spiser kan endre måten antibiotika påvirker tarmen på
Det du spiser kan endre måten antibiotika påvirker tarmen på
 Risikoene for tykktarmskreft og de beskyttende tiltakene du kan ta
Risikoene for tykktarmskreft og de beskyttende tiltakene du kan ta
 SCD kyllingfylte Portobellosopp
Dere vet, jeg er ikke en profesjonell kokk. Men i løpet av de siste 10 årene har jeg lært noen ting om hva som får mat til å smake godt. Og en av tingene som gjør hva som helst smaker bedre er umam
SCD kyllingfylte Portobellosopp
Dere vet, jeg er ikke en profesjonell kokk. Men i løpet av de siste 10 årene har jeg lært noen ting om hva som får mat til å smake godt. Og en av tingene som gjør hva som helst smaker bedre er umam
 Hva 'Gas Pains From Hell' lærte meg om helse og kroppen min
Det føles som 100 kniver som stikker meg i magen. Om og om igjen. Time etter time. Jeg kaller det Dødens magesmerter (og jeg HATER det). I tilfelle du lurer, før i tiden krøp jeg vanligvis opp på
Hva 'Gas Pains From Hell' lærte meg om helse og kroppen min
Det føles som 100 kniver som stikker meg i magen. Om og om igjen. Time etter time. Jeg kaller det Dødens magesmerter (og jeg HATER det). I tilfelle du lurer, før i tiden krøp jeg vanligvis opp på
 Dr. David Yamini gjestestjerner på KCAAs Fusion of Science and Beauty
Nylig spilte Dr. David Yamini hovedrollen i KCAAs radioprogram, Fusion of Science and Beauty. Lytt til Dr. Yamini diskutere hvordan du kan håndtere, behandle og nærme deg oppblåst mage. Hvis du oppl
Dr. David Yamini gjestestjerner på KCAAs Fusion of Science and Beauty
Nylig spilte Dr. David Yamini hovedrollen i KCAAs radioprogram, Fusion of Science and Beauty. Lytt til Dr. Yamini diskutere hvordan du kan håndtere, behandle og nærme deg oppblåst mage. Hvis du oppl