Abstract
mage-tarmkanalen av dyr er tilpasset deres primære kilde til mat for å optimalisere ressursbruk og energiinntak. Tempererte flaggermusarter hovedsakelig lever av leddyr. Disse inneholder den energirike karbohydrater kitin, som er ufordøyelig for de endogene enzymene i en typisk magetarmkanalen hos pattedyr. Imidlertid bør mage-tarmkanalen av flaggermus arter tilpasses sin diett og være i stand til å fordøye kitin. Vi antok at (i) europeiske vespertilionid flaggermusarter har fordøyelseskanal enzym kitinase og at (ii) kitinolytiske aktivitet ligger i tarmen, som har blitt funnet for nordamerikanske flaggermusarter. Gastrointestinale områder med syv flaggermusarter ( Pipistrellus Pipistrellus Citation. Strobel S, Roswag A, Becker NI, Trenczek TE, Encarnação JA (2013) insectivorous Bats Digest Chitin i magen Bruke surt pattedyr Chitinase. PLoS ONE 8 (9): e72770. doi: 10,1371 /journal.pone.0072770 Redaktør: François Blachier, Nasjonalt institutt for Agronomic Research, Frankrike mottatt: 26 mars 2013; Godkjent: 12 juli 2013; Publisert: 3. september 2013 Copyright: © 2013 Strobel et al. Dette er en åpen-tilgang artikkelen distribueres under betingelsene i Creative Commons Attribution License, som tillater ubegrenset bruk, distribusjon og reproduksjon i ethvert medium, forutsatt den opprinnelige forfatteren og kilden krediteres Finansiering:. Forfatterne har ingen støtte eller finansiering for å rapportere konkurrerende interesser:.. forfatterne har erklært at ingen konkurrerende interesser eksisterer Innledning Dyr har å innta og fordøye mat for å sikre kontinuerlig funksjon av deres interne metabolisme ved å dekke, for eksempel, sin energi, protein og vitamin krav [1]. Den flertrinns prosess og fordøyelse omfatter mekaniske, kjemiske og enzymatiske trinn for omdannelse av næringsstoffer [2]. Bat arter har en høy masse-spesifikk energibehovet på grunn av sin lille størrelse og evnen til å fly aktivt [3], [4]. I flygende dyr, mat må behandles raskt for å redusere energibehovet som følge av økt flight masse [2]. Europeiske flaggermusarter har en diett bestående hovedsakelig av leddyr [5]. De har korte oppholdstider [6] men en høy fordøyelses effektivitet [7]. Dette tyder på at deres gastrointestinal (GI) tarmkanalen er sterkt tilpasset deres diett siden det fordøyer leddyr raskt og grundig. Derfor kan det hevdes at europeiske flaggermusarter er avhengige av leddyr spesifikke fordøyelsesenzymer. Siden leddyr består av opp til 75% kitin (energiinnhold 21,2 kJ /g, [8]), er det svært sannsynlig at bat-arter er i stand til å fordøye chitinous materiale, som har blitt vist i andre virveldyr, for eksempel det europeiske grønn øgle ( Lacerta viridis Chitin kan brytes ned av kitinaser (EC 3.2.1.14) og noen lysozym (EC 3.2.1.17) [11], [12]. I pattedyr er bare to kitinaser blitt identifisert: chitotriosidase og sure pattedyr chitinase (AMCase) [13], som begge er klassifisert som endochitinases [14]. Chitotriosidase er hovedsakelig skilles ut av fagocytter og virker mot kitin-holdige patogener [15]. AMCase har så langt bare blitt identifisert i mus (Mus musculus), makaker (Macaca fascicularis) og mennesker [16], [17]. Det er sterkt uttrykt i mage og lunge, noe som indikerer en dobbel fordøyelsesenzymer og immunologisk funksjon [16], [17]. Kitinolytiske aktivitet kan også stamme fra endogene enzymer, inntatt mat til stede i mage-tarmkanalen, eller enzymer som produseres av mikroorganismer [18], [19]. kitinolytiske aktivitet i mage-tarmkanalen er blitt funnet i flere insectivorous bat arter [8], [9]. Det er imidlertid ingen kunnskap om den tilsvarende enzymet. Jeuniaux [9] verifisert kitinolytiske aktiviteten i mage-tarmkanalen av Rhinolophus ferrumequinum Vi hypotese at (i) europeiske insektetflaggermusarter av familien Vespertilionidae besitter kitinolytiske aktiviteten i mage-tarmkanalen, som har vist seg for nordamerikanske insektetflaggermusarter [8] og ett europeiske flaggermusarter av familien Rhinolophidae [9] og (ii) kitinolytiske aktivitet ligger i tarmen, som har vært vist i nordamerikanske arter [8]. I denne studien har vi plassert kitinolytiske aktivitet og identifisert den tilsvarende enzym som AMCase ved hjelp av et enzym assay, immunoblotting og immunhistokjemi. Etikk uttalelse Alle individer brukes i denne studien døde i frivillige rehabiliteringssentre for flaggermus. De ble levert av frivillige uten noen form for refusjon. Ifølge barnevernloven tysk Animal (TSchG §4 (3)) og til naturvernloven Federal (BNatSchG § 45 (4)) uten tillatelse er nødvendig for å arbeide på kadaver. Musen magen var en rest av en studie ved Institutt for anatomi og cellebiologi ved Justus-Liebig-universitetet i Giessen som ble godkjent av Regionrådet (No. V54-19C20 /15C Giessen 20/23 400AZ). Ingen dyr ble drept i forbindelse med denne studien. Slakt ble lagret umiddelbart etter døden ved -20 ° C. Flaggermus ble levert på is dvs. frosset til University of Giessen. Skrottene ble lagret i inntil seks måneder ved -80 ° C inntil vev preparat. Makro- og mikroskopiske observasjoner bekreftet veldig god konservering av organer og celler som gjorde enzymatiske og histologiske undersøkelser av vev mulig. Slakt av sju insektetflaggermusarter uten noen tegn på forråtnelse ( Pipistrellus Pipistrellus product: ( n Utarbeidelse av løselige proteinfraksjoner GI veis segmenter av ikke-faste, friske eksemplarer av P. Pipistrellus product: ( n Fastsettelse av kitinolytiske aktivitet For å måle kitinolytiske aktivitet, ble agarosegel plater fremstilt som beskrevet av Zou, Nonogaki &.; Welbaum [24] med noen modifikasjoner. Fosforsyre-svellet kitin ble fremstilt ved å blande 10 g kitin fra krabbeskall (Roth, Tyskland) med 100 ml 85% fosforsyre og inkubert i 48 timer ved 4 ° C. Deretter 2 liter kaldt vann fra springen ble tilsatt, og den resulterende kaken ble vasket inntil pH 6,5 ble nådd [25], [26]. Agarose (1,6%) ble oppløst i inkubasjonsbuffer (pH 5.0) [24] i en mikrobølgeovn og avkjølt til 50-60 ° C. Deretter ble fosforsyre-svellet kitin (0,5%) tilsatt, og 10 ml av denne suspensjonen ble pipettert inn i 85-mm petriskåler. Etter polymeriseringen, ble 4-mm-diameter brønner stemplet inn agarose og gelbitene ble fjernet ved hjelp av en vannstrålepumpe lyofilisert pulver av standard chitinase fra Serratia marcescens For å analysere enzymatisk aktivitet ved forskjellige pH-verdier, ble gel plater fremstilt som før, men med forskjellige pH-verdier (pH 4,0, pH 5,0, pH 6,0, pH 7,0 og pH 8,0). Supernatanter i magen, tolvfingertarmen, jejunum /ileum, ileum /tykktarm og tykktarm /endetarm av en person av P. Pipistrellus Uttrykk av kitinase i mage-tarmkanalen Western blot analyse. Western blotting ble utført for å identifisere og biokjemisk finne kitinase i mage-tarmkanalen europeiske flaggermusarter og for å utelukke kitinolytiske aktivitet forårsaket av lysozym. Supernatanter av vevsprøver fra seks flaggermusarter (mage-tarmkanalen seksjon prøver (mage, tolvfingertarmen, jejunum /ileum, ileum /tykktarm og tykktarm /endetarm). P Pipistrellus product: ( n supernatanter av hver 750 ug vev ble blandet 1:01 i 2 x SDS-gel-ladningsbuffer og oppvarmet til 95 ° C i 3 minutter. Av hver prøve, ble 15 ul underkastet en 12% oppløsende gel og 5% stabling gel. Elektroforese ble utført under reduserende betingelser ved en spenning på 100 V. De separerte proteiner ble elektroblottet i en time ved en konstant strømstyrke på 0,8 mA /cm 2 på PVDF-membraner. Blottene ble blokkert med 5% ikke-fett tørrmelk i tris-bufret saltoppløsning (TBS, pH 7,5) inneholdende 0,1% Tween 20 (Roth) i 1 time før inkubering med et kanin polyklonalt antistoff rettet mot den N-terminale surt chitinase ( AVIVA Systems Biology, CA, USA; utvannet 1:1000 i TBS som inneholder 1% BSA) ved 4 ° C over natten. Etter vasking med TBS som inneholdt 0,05% Tween 20 og 0,1% BSA, ble membranene inkubert i 1 time med alkalisk fosfatase-konjugert geit polyklonalt antistoff mot kanin-IgG (H &Co. L) (Roth, anti kanin-AP 4751; fortynnet 1:7500 i TBS inneholdende 1% BSA). Blottene ble vasket fire ganger, og antistoff-binding ble visualisert ved hjelp av inkubering med bromochloroindoyl fosfat (Bethesda Research Laboratories, MD, USA) og nitro tetrazolium substrat (Biotech Trade &Co. Service GmbH, Tyskland) i henhold til Harlow og Lane [30] Immunohistochemistry. for å lokalisere AMCase på cellenivå, ble utført immunhistokjemisk analyse på mage-tarmkanalen segmenter av P. Pipistrellus product: ( n kitinolytiske aktivitet Vi var i stand til å oppdage kitinolytiske aktivitet i mage prøver av alle personer (for eksempel fig. 1) og i tykktarm /endetarm prøve av en, M. Myotis, M. nattereri Hotell og N. leisleri uttrykk av kitinase i mage-tarmkanalen Western blot analyse av M. musculus mage Vi antok at europeiske insektetflaggermusarter av familien Vespertilionidae har fordøyelseskanal enzym kitinase. Denne hypotese ble bekreftet ved nærværet av kitinolytiske aktivitet i magen på de studerte arter. Videre er en sann kitinase, mer spesielt AMCase, kunne biokjemisk identifisert i alle mage prøver. Aktive kitinaser er vanlige og konservert blant pattedyr [14]. Imidlertid plasseringen og funksjon av AMCase variere mellom artene, og er ikke fullstendig løst [31]. Vi ytterligere en hypotese om at det kitinolytiske aktivitet er lokalisert i tarmen, spesielt i tynntarmen, som det er stedet der hoved enzymatisk fordøyelse og absorpsjon skjer [32]. Våre resultater bekrefter ikke denne hypotesen som kitinolytiske aktivitet ble lokalisert hovedsakelig i magen og for tre personer på lavt aktivitetsnivå i tykktarm /endetarm. Den høye variabilitet kitinolytiske aktivitet i de studerte individer kan skyldes varierende fordøyelses aktivitet av individer ved tidspunktet for død. Dette støttes av ulike mengder mat funnet i GI traktater. Den kitinolytiske aktivitet i mage prøvene, men ikke i tykktarm /endetarm prøvene kan føres tilbake til aktiviteten av AMCase og ikke til en lysozym ved western-blotting. Aktiviteten av flaggermus AMCase var optimalt mellom pH 5,0 og pH 6,0. Disse pH-verdier er sammenlignbare med den sure miljøet i magen på insektetflaggermusarter som måles i denne studien og rapportert av Naumova og Zharova [33]. Dette er en første indikasjon for den biologiske relevans AMCase under fordøyelsen i denne delen av GI-systemet. Imidlertid bør videre eksperimenter som fordøyelseseffektivitet studier bli utført for å teste om aktiviteten av AMCase utgjør en biologisk betydning for kitin fordøyelse. AMCase har en dobbelt funksjon i immunforsvaret og fordøyelsen av chitin-inneholdende organismer, [34], [35]. For eksempel er human AMCase ikke tilpasset til det sure miljøet i magen, i motsetning til AMCase funnet hos mus [31]. Magen AMCase av M. musculus immunhistokjemiske Resultatene fra denne studien støtte lokalisering av AMCase i magen av flaggermus arter, særlig i de gastriske kjertler i slimhinnene . Videre fant vi at enzymet var plassert i eller rundt politimesteren celler lokalisert ved foten av mage kjertler, som tidligere ble vist for magen AMCase av M. musculus product: [27], [31], [34]. Chief cellene skiller fordøyelsesenzymer [36] som befinner seg i de mange cytoplasmiske granuler [37]. En vanlig enzym som produseres av denne gastrisk celletype er pepsinogen, en forløper av det proteolytiske enzym pepsin [38]. Goto et al. [27] viste at produksjonsstedet av magen AMCase av M. musculus Vi takker E. Mühlbach, R. Keil , N. Dittrich og S. Wiegand for dyret prøver og Y. Kühnel, C. von Bredow, A. Diebel og pattedyr Ecology Group for deres hjelp.
, Plecotus auritus
, Myotis bechsteinii
, Myotis nattereri
, Myotis daubentonii
, Myotis Myotis, Hotell og Nyctalus leisleri
) ble testet for kitinolytiske aktivitet ved diffusjon analysen. Gastrointestinale områder med P. Pipistrellus
, P. auritus
, M. nattereri
, M. Myotis, Hotell og N. leisleri
ble undersøkt for surt pattedyr kitinase av western blot analyse. Vevssnitt av mage-tarmkanalen av P. Pipistrellus
ble immunohistochemically analysert for å finne den sure pattedyr kitinase. Kitinolytiske aktivitet ble påvist i magen på alle flaggermusarter. Western blot-analyse bekreftet den sure pattedyr chitinase i mage prøver. Immunhistokjemi av P. Pipistrellus
mage-tarmkanalen indikerte at sure pattedyr chitinase og ligger på magen viktigste cellene på undersiden av de gastriske kjertler. I konklusjonen, europeiske vespertilionid flaggermusarter har syrlig pattedyr kitinase som er produsert i mage kjertler i magen. Derfor gastrointestinale traktater av insektetflaggermusarter utviklet seg en enzymatisk tilpasning til kostholdet
), den svarttrost ( Turdus merula
) og rødrev ( vulpes vulpes
) [9], [10].
, en europeisk flaggermusarter av familien Rhinolophidae. Whitaker et al. [8] viste kitinolytiske aktiviteten i mage-tarmkanalen av nordamerikanske vespertilionid flaggermusarter av slektene Myotis
, Eptesicus
, Nycticeius
, Lasiurus
Pipistrellus Hotell og Lasionycteris
. De isolerte kitinase-produserende bakteriestammer fra tarmen som en kilde for den kitinolytiske aktivitet. I motsetning til dette, Jeuniaux [9] funnet bevis for kitinolytiske aktivitet i den gastriske slimhinne i mage av Rhinolophus ferrumequinum
mens tarmen viste ingen kitinolytiske aktivitet. Men Buchholz, Wells & Conaway [20] finner ikke noen kitinase i insektetflaggermusarter Pipistrellus subflavus Hotell og Myotis grisescens
. Dess kitinaser, noen lysozymer er i stand til å oppløse chitin [11], [12]. For eksempel, Phillips, Weiss & Tandler [21] oppdaget lysozym i spyttkjertlene insektetflaggermusarter og spekulert i at det kan fungere som en kitinolytiske enzym i spyttet. Men lysozymer er hovedsakelig anti-bakteriell og er en viktig del av immunsystemet [22] eller for fordøyelsen av bakterier hos drøvtyggere [12].
Materialer og metoder
Tissue lagrings
Tissue forberedelse
= 14), Plecotus auritus product: ( n
= 3), Myotis bechsteinii product: ( n
= 1), Myotis nattereri product: ( n
= 3), Myotis daubentonii product: ( n
= 2) Myotis Myotis
( n
= 1) og Nyctalus leisleri product: ( n
= 1)) ble brukt i denne studien (tabell 1) . Etter åpning av bukveggen, ble GI-systemet fjernet, vasket med 0,9% NaCl, og tørket på filterpapir. GI-trakten ble delt inn i spiserøret, magen, tolvfingertarmen, jejunum /ileum, ileum /tykktarm og tykktarm /endetarm etter Ishikawa et al. [23] og veid på en digital skala (EW2200-2NM, nøyaktighet: 0,01 g; Kern & Sohn GmbH, Balingen, Tyskland). I tillegg magen av en Mus musculus
(stamme C57BL /6, Black 6; n
= 1). Ble anvendt som en positiv kontroll for AMCase deteksjon ved western blotting
= 11), P. auritus product: ( n
= 3), M. bechsteinii product: ( n
= 1), M. nattereri product: ( n
= 3), M. daubentonii product: ( n
= 2), M. Myotis
( n
= 1) og N. leisleri product: ( n
= 1) og magen av M. musculus
ble individuelt malt opp i en morter og pistill med ekstra ren sea sand (Merck, Tyskland) og 0,9% NaCl (mengde standardisert vev: 1 ml pr 100 mg vev). Homogenatene ble inkubert over natten ved 4 ° C, [10], og deretter sentrifugert (20 min, 3500 g, 4 ° C). Supernatantene ble holdt ved -20 ° C inntil videre analyse
(5 U.; Sigma-Aldrich, Tyskland) ble oppløst i 1 ml inkubasjonsbuffer som standardstamløsning. En kjent konsentrasjon av standard chitinase ble tilsatt til hver plate som referanse og inkuberingsbuffer ble anvendt som den negative kontroll. Først, ble 6 ul prøver av hver oppløsning ble pipettert per brønn, hvoretter platene ble inkubert i 20 minutter ved romtemperatur for å tillate prøvene å diffundere inn i agaren. Deretter en ytterligere L prøve ble tilsatt til hver brønn og platene ble inkubert ved romtemperatur i 20 minutter etterfulgt av inkubering ved 37 ° C i 20 timer. Agaroseplater ble deretter beiset med 0,1% calcofluor (Calcofluor Brightener M2R, Sigma, MO, USA) i 10 minutter og vasket med destillert vann i 2 timer. Lytisk sonene ble visualisert ved hjelp av UV transillumination og deretter fotografert. Diameter på lytiske sonene ble målt ved hjelp av GIMP (versjon 2.6.11, www.gimp.org). Ved hjelp av en referanse fortynningsrekke av kitinase stamløsning med inkubasjon bufferenzymaktivitet ble beregnet etter areal diameter versus logaritme av konsentrasjon og variasjon mellom platene ble justert til interne kitinase standarder som brukes på hver petriskål.
ble brukt. Den lytiske soner ble visualisert ved hjelp av UV-gjennomlysnings og analysert som før. I tillegg har pH-verdier av GI-systemet deler av fem individer av P. Pipistrellus
ble målt ved hjelp av flerfarget kodede pH-papir (pH 0,0 til 6,0: Acilit, nøyaktighet 0,5; pH 6,5 til 10,0: Spesial Indikator, nøyaktighet 0,3; Merck).
= 2 ), P. auritus product: ( n
= 2), M. nattereri product: ( n
= 1), M. Myotis product: ( n
= 1) og N leisleri product: ( n
= 1); ekstra mageprøver.. P Pipistrellus product: ( n
= 9), M. nattereri product: ( n
= 1), M. daubentonii product: ( n
= 2)) og magen av en M. musculus
anvendt som en positiv kontroll [27] ble underkastet natriumdodecylsulfat-polyakrylamidgel-elektroforese (SDS-PAGE) (Laemmli [28] modifiseres etter Sambrook, Fritsch & Maniatis [29]).
= 3). GI-systemet deler ble fiksert i 4% paraformaldehyd i fosfat-bufret saltløsning (pH 7,0) i 24 timer før de ble vasket 4 x 1 time med TBS. Deretter vevet blokkene ble dehydrert i en gradert etanolserie (30%, 50%, 70%, 90%, 100%) og til slutt innstøpt i parafin. De parafinblokker ble kuttet i seksjoner av 4-9 mikrometer tykkelse ved hjelp av en slede mikrotom (Leitz, Tyskland) og ble tørket over natten. For å få adgang antigenbindingsstillingene, ble vevssnitt predigested med pepsin (Sigma) etter Goto et al. [27]. Snittene ble vasket med 0,01% Tween 20 i TBS. Uspesifikke seter ble blokkert med 5% geiteserum (Merck) i 3% BSA (AppliChem, Tyskland). Seksjonene ble utsatt for kanin polyklonale antistoff rettet mot den N-terminale surt chitinase (AVIVA Systems Biology, fortynnet 1:200 i TBS inneholdende 1% BSA) i et fuktig kammer. Ubundet antistoff ble fjernet ved vasking med TBS, før det sekundære antistoff (ChromeoTM 546, Abcam, Storbritannia, fortynnet 1:2500 i 0,5% BSA i TBS) ble påført. For atomkontra snittene ble inkubert med 0,05% 4 ', 6-diamidino-2-fenylindol (DAPI) (AppliChem). Etter en avsluttende skylling med TBS, ble de seksjoner montert med 1,4-diazabicyklo [2.2.2] oktan-løsning (DABCO) (Sigma). For styring av autofluorescens og bindende spesifisitet av antistoffene ble seksjonene som er behandlet med fluorescein-isotiocyanat (FITC) merket sekundært antistoff, men uten primært antistoff. Seksjonene ble evaluert ved hjelp av en fluorescens mikroskop (Olympus BX60 F-3, Olympus Optical Co LTP, Tyskland).
Resultater
hver (tabell 2). Ingen kitinolytiske aktivitet kan måles i tolvfingertarmen, jejunum /ileum eller ileum /tykktarm prøver. Den kitinolytiske aktivitet i mage prøvene var høyest mellom pH 5,0 og pH 6,0 (Fig. 2). Støtte til våre tidligere resultater, ble det ikke kitinolytiske aktivitet påvist i de andre områder av mage-tarmkanalen, uavhengig av pH-verdi. Den midlere pH-verdien i mage-tarmkanalen av P. Pipistrellus product: ( n
= 5) var 5,6 ± 0,2 i magen, 7,0 ± 0,3 i tolvfingertarmen, 7,1 ± 0,2 i jejunum /ileum, 7,0 ± 0,2 i ileum /tykktarm og 7,0 ± 0,5 i tykktarm /endetarm.
viste et karakteristisk bånd ved en relativ molekylvekt på 46 k, noe som indikerer tilstedeværelse av AMCase. Videre er det i alle mageprøver av P. Pipistrellus, P. auritus, M. nattereri
, M. Myotis
, og N. leisleri
en klar protein band på 46 k ble identifisert (for representative vestlige blot bilder, se Fig. 3 for Pipistrellus Hotell og Fig. 4 for Plecotus, Myotis Hotell og Nyctalus
). Dette proteinet bandet ble ikke påvist i spiserør, tolvfingertarmen, jejunum /ileum, ileum /tykktarm eller tykktarm /endetarm prøver av flaggermusarter (Fig. 3). Alle immunhistokjemiske resultater ble kontrollert for autofluorescens og uspesifikk binding av det sekundære FITC-koblet antistoff. Mage seksjoner var positive for anti-AMCase antistoff merking, mens i spiserør, tolvfingertarmen, jejunum /ileum, ileum /tykktarm og tykktarm /endetarm seksjoner ingen binding ble oppdaget. I mage seksjoner, ble anti-AMCase merking begrenset til bunnen av gastriske kjertler langs den gastriske slimhinne rundt DAPI-farget cellekjerner (fig. 5).
diskusjon
inneholder aminosyre-substitusjoner som er nødvendig for tilpasning til det sure miljø i magesekken [31]. Videre Boot et al. [17] viste at AMCase mRNA av M. musculus
er bare funnet i magen. Hvis disse aminosyresubstitusjoner er til stede i AMCase av flaggermus arter gjenstår å bli vist.
er i disse sekresjonsgranuler. Derfor er det mest sannsynlig at AMCase er også utskilt av mage sjef celler i flaggermusarter. Dette er i motsetning til resultatene av Whitaker et al. [8], som har uttalt at chitinase i bat-arter blir produsert av kitinase-produserende bakteriestammer (for det meste av familien Enterobacteriaceae) i tarmen. Det er kjent at tarmbakterier produsere kitinase å tilfredsstille sine egne ernæringsmessige behov [39]. Imidlertid kan kitinase-produserende enterobakterier også bli funnet i GI områder av pattedyr som ikke lever av chitinous materialet [19]. Dette tyder på at det ikke er nær sammenheng mellom kitin fordøyelse og kitinolytiske bakterier. I denne studien ble lav kitinolytiske aktivitet målt i tarmen hos noen få individer, og ingen AMCase kunne påvises ved å skille tarmen fra magesekken. Denne annen kitinolytiske aktivitet kan forklares ved transport av AMCase produsert i magesekken og inn i tarmen med mat, som diskutert av Suzuki et al. [34] og Boot et al. [17]. I tillegg kan den lave kitinolytiske aktivitet i tarmen være forårsaket av kitinase-produserende enterobakterier [8]. Imidlertid vil kvantifisering av disse bakteriene være nødvendig for å bekrefte deltakelse i kitin fordøyelsen av disse symbionter. Derfor er det sannsynlig at kitin i insektetflaggermusarter er fordøyd av en kombinasjon av endogen magen AMCase og kitinase utskilles av tarmbakterier, som ble foreslått for M. musculus product: [17]. Denne studien viser tydelig at europeiske insektet flaggermus av familien Vespertilionidae har fordøyelseskanal enzym AMCase. Vi viste at dette enzymet er aktiv og ligger i magen, spesielt i og rundt de viktigste cellene i bunnen av mage kjertler.
Takk
 Når bør du gå til legen for hemoroider?
Når bør du gå til legen for hemoroider?
 Usunn tarmmikrobiom reduserer synaptisk beskjæring av hjernen,
Usunn tarmmikrobiom reduserer synaptisk beskjæring av hjernen,
 Forskere utvikler en tilnærming for å vaksinere mot tarmbetennelse
Forskere utvikler en tilnærming for å vaksinere mot tarmbetennelse
 Er det mer sannsynlig at kvinner utvikler lang COVID?
Er det mer sannsynlig at kvinner utvikler lang COVID?
 Hvorfor alle med cøliaki desperat trenger vitamin D
Hvorfor alle med cøliaki desperat trenger vitamin D
 5 tips for en sunn tykktarm
5 tips for en sunn tykktarm
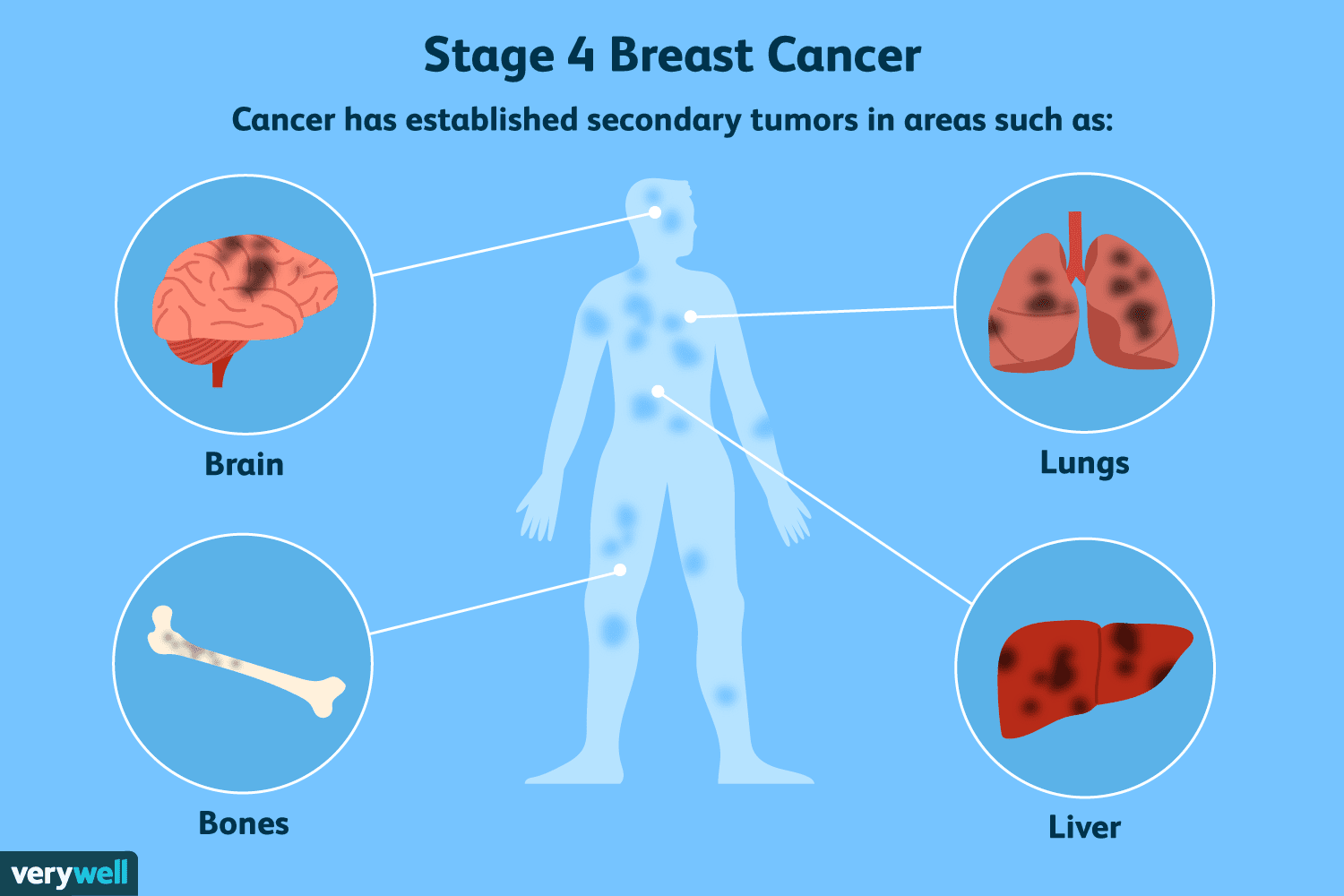 En oversikt over trinn 4 brystkreft
stadium 4 er den mest avanserte formen for brystkreft. Det blir også referert til som metastatisk brystkreft fordi maligniteten vil ha spredt seg (metastasert) fra brystet til andre deler av kroppen,
En oversikt over trinn 4 brystkreft
stadium 4 er den mest avanserte formen for brystkreft. Det blir også referert til som metastatisk brystkreft fordi maligniteten vil ha spredt seg (metastasert) fra brystet til andre deler av kroppen,
 Matvarer som utløser diaré (men smaker så godt)
«Hei bro, du der?» sa jeg med en sliten og svak stemme. Klokken var 01.00 og den 8.th gang de siste 4 timene hadde jeg eksplosiv diaré. Jeg tok opp telefonen og ringte Jordan. Jeg trengte litt støtt
Matvarer som utløser diaré (men smaker så godt)
«Hei bro, du der?» sa jeg med en sliten og svak stemme. Klokken var 01.00 og den 8.th gang de siste 4 timene hadde jeg eksplosiv diaré. Jeg tok opp telefonen og ringte Jordan. Jeg trengte litt støtt
 Bør du testes for lekk tarm?
Vi har fått mange spørsmål om lekk tarm, siden over 45 000 mennesker har tatt quizen vår om lekk tarm... Spørsmål som ... “Bør jeg bli testet for Leaky Gut?” “Gjør Candida at tarmen min lekker?”
Bør du testes for lekk tarm?
Vi har fått mange spørsmål om lekk tarm, siden over 45 000 mennesker har tatt quizen vår om lekk tarm... Spørsmål som ... “Bør jeg bli testet for Leaky Gut?” “Gjør Candida at tarmen min lekker?”