Ett-karbon metabolismen (folat metabolisme) anses som viktig i kreftutvikling på grunn av sitt engasjement i DNA-syntese og biologiske metylering reaksjoner. Vi undersøkte sammenslutninger av enkeltnukleotidpolymorfi (SNPs) i folat metabolismeveien og risikoen for tre GI kreft i en populasjonsbasert case-control studie i Taixing City, Kina, med 218 esophageal krefttilfeller, 206 magekrefttilfeller, 204 lever krefttilfeller og 415 friske befolkningskontroll. Deltakerne i studien ble intervjuet med et standardisert spørreskjema, og blodprøver ble samlet etter intervjuene. Vi genotypede SNPs av MTHFR Citation. Chang SC, Chang PY, Butler B, Goldstein BY, Mu L, Cai L, et al. (2014) enkeltnukleotidpolymorfi av One-Carbon Metabolisme og Kreft i spiserør, magesekk, og lever i en kinesisk befolkning. PLoS ONE 9 (10): e109235. doi: 10,1371 /journal.pone.0109235 Redaktør: Nathan A. Ellis, University of Arizona, USA mottatt: 05.02.2014; Godkjent: 09.09.2014; Publisert: 22 oktober 2014 Copyright: © 2014 Chang et al. Dette er en åpen-tilgang artikkelen distribueres under betingelsene i Creative Commons Attribution License, som tillater ubegrenset bruk, distribusjon og reproduksjon i ethvert medium, forutsatt den opprinnelige forfatteren og kilden krediteres Finansiering:. Dette arbeidet støttes delvis av International Union Against Cancer (UICC) Technology Transfer fellesskap (ICRETT) tildelt Dr. Li-Na Mu og ved Stiftelsen for forfatteren av National Excellent doktoravhandling av PR China, nr 200 157, tildeles Dr . Lin Cai. Studien ble også delvis støttet av NIH National Institute of Environmental Health Sciences, National Cancer Institute, Department of Health and Human Services, gir ES06718, ES 011 667, CA09142, samt Alper Research Program for Environmental Genomics av UCLA Jonsson Comprehensive Cancer Center og UCLA Clinical Nutrition Research Unit. Finansiører hadde ingen rolle i studiedesign, datainnsamling og analyse, beslutning om å publisere, eller utarbeidelse av manuskriptet Konkurrerende interesser:.. Forfatterne har erklært at ingen konkurrerende interesser eksisterer Innledning Øvre gastrointestinal (GI) kreft er viktige årsaker til sykelighet og dødelighet over hele verden. Basert på GLOBOCAN 2012 estimater, mage, lever, og esophageal kreft er den femte, sjette og åttende mest vanlige kreftformer, henholdsvis med en global forekomst på cirka 2.189.829 nye krefttilfeller (15,5% av totalt), og 1,868,700 dødsfall (22,8 % av det totale) [1]. De fleste av disse krefttilfellene (1,694,874 tilfeller, 77,4%) forekommer i mindre utviklede land. Kina alene står for nesten halvparten av alle hendelsen GI kreft (1,023,072 tilfeller, 46,7%) [1]. Fortsatt forskning om involvering av enkeltnukleotidpolymorfi (SNPs) i etiologien av disse tre øverste GI kreft har vært fruktbart. Av spesiell interesse er de SNP'er ligger innenfor gener involvert i folatmetabolismen [2] - [4]. Folat opprettholder DNA stabilitet ved å regulere DNA biosyntese, DNA-reparasjon og DNA metylering [5]. Neoplasmer kan utvikle seg når denne veien er feilregulert ved uttømming av mikronæringsstoffer eller ved inkorporering av polymorfismer [5]. Flere enzymer er involvert i en karbon-metabolisme, inkludert metylentetrahydrofolat-reduktase (MTHFR), metionin syntase (MTR), metionin syntase-reduktase (MTRR), DNA metyltransferaser (DNMTs), og mitokondriell aldehyddehydrogenase 2 (ALDH2). MTHFR, MTR, og MTRR er involvert i DNA-syntese, og genereringen av S-adenosylmethionin (SAM) -a universal methyl-donor for metylering reaksjoner. DNMTs kata DNA metylering og replikere metylering mønstre. ALDH2 er ansvarlig for metabolizing acetaldehyd generert under alkohol metabolisme. Alkohol og acetaldehyd kan hemme folat absorpsjon og forringe DNA metylering [6]. Rollen til folat og en karbonomsetningen i øvre GI kreft er ikke fullt ut forstått. Dyrestudier gitt noe bevis for en effekt av lavt folatnivå i oksidativt stress, DNA metylering, og hepatocarcinogenesis [7], [8]; mens høy folat inntak kan øke global DNA metylering og redusere magekreftrisiko [9], [10]. Epidemiologiske studier har antydet at genetisk polymorfisme av gener i ett-karbon metabolismen kan modulere faren og magekreft [4]. Men publiserte resultater er mangelfulle og begrenset i form av antall gener /polymorfismer blir undersøkt. Mulig endring av nærstående mikronæringsstoffer og kjente risikofaktorer har sjelden vært utforsket. Derfor vurderer viktigheten av en-karbonomsetningen i øvre GI kreftutvikling, undersøkte vi assosiasjoner mellom åtte SNPs i gener i ett-karbon metabolismen og kreft i spiserør, magesekk, og lever i en kinesisk befolkning. Vi evaluerte også heterogenitet av foreningene på tvers av ulike lag av plasmamikronæringsstoffer (inkludert folat, vitamin B12, og total homocystein) og kjente risikofaktorer for disse kreftformene. Etikk uttalelse Denne studien ble fritatt av Institutional Review board of University of California i Los Angeles (Sertifisert Unntatt 02-248). studie~~POS=TRUNC og Befolkning En detaljert beskrivelse av studiedesign har vært publisert tidligere [11], [12]. Kort fortalt, dette var en populasjonsbasert case-control studie utført i Taixing City, Jiangsu-provinsen i Kina. Kvalifiserte saker ble nylig diagnostisert pasienter med patologisk eller klinisk bekreftet spiserørskreft (mellom 1. juni og 30. desember, 2000), magekreft (mellom 1. juni og 30. desember, 2000), og leverkreft (mellom 1 januar og 30. juni, 2000) rapportert til Taixing CDC Tumor registeret. Andre inklusjonskriterier, inkludert å være 20 år eller eldre, i stabil medisinsk tilstand som bestemmes av en lege, bosted i Taixing i 10 år eller mer, og vilje til å delta. Totalt 218 esophageal krefttilfeller, 206 magekrefttilfeller og 204 leverkreft tilfeller deltok, som representerer 67, 65 og 57%, henholdsvis av alle nydiagnostiserte kreftpasienter. Controls ble tilfeldig utvalgt blant friske innbyggere av Taixing med en 02:03 frekvenstilpasning forholdet til den kombinerte saken gruppe på 5-års aldersgrupper (20-24 til 80-84), kjønn og bosted (landsby i landlige township eller i en urban boligblokken i sentrum Taixing By). Det er 23 townships (rurale områder) og en sentral by (byområde) i Taixing City. Hver landlig township består av 10-12 landsbyer, og det sentrale byområde består av 10-12 boligblokker. Andre inklusjonskriteriene var de samme som i tilfellene. Totalt 464 potensielle kontroller ble kontaktet, og 415 (89,4%) samtykket til å delta. Alle de rekrutterte saker og kontroller gjennomført et standard spørreskjema administrert av trente intervjuere. Intervjuer fant sted enten på deltakernes hjem, i sykehusene (for tilfeller), eller i fylket legekontoret (for kontroller). Krefttilfeller ble vanligvis intervjuet innen 6 måneder etter diagnoser. Spørreskjemaet samlet detaljert informasjon om demografiske faktorer, nåværende høyde og vekt, kosttilskudd historie, tobakksrøyking historie, alkohol drikking historie, te drikkevaner, yrkes historie, familiehistorie med kreft, og fysiske aktiviteter. Hver studie deltaker gitt en 5-ml perifer blodprøve etter sine intervjuer. DNA ble isolert fra blodpropper, ved hjelp av fenol-kloroform-metoden. Hepatitt B-virus overflateantigen (HBsAg), IgG antistoffer for hepatitt C virus (HCV), og IgG antistoffer for CagA- Helicobacter pylori plakater (H. pylori Vi valgte åtte SNPs fra MTHFR Vi brukte Pearsons khikvadrattest for Hardy-Weinberg likevekt (HWE) for fordelinger av genotypefrekvensene av de åtte SNPs i bare kontrollene. Testing for HWE blant kontrollene brukes ofte som et foreløpig kvalitetskontrollmetode genetiske assosiasjonsstudier for å identifisere systematiske feil i genotype i ubeslektede individer. Vi analyserte hver SNP-kreft foreningen etter co-dominant, log-lineære, dominant og recessive genetiske modeller, ved hjelp ubetinget logistikk regresjonsmodeller å beregne odds ratio (ORS) og 95% konfidensintervall (CIS). Modeller inkludert alders matchet kategorier, sex, bosted (by /land), utdanning (analfabetisme /barneskole /høyere enn ungdomsskole), body mass index (BMI, kontinuerlig), røyking paknings år (sammenhengende), alkoholforbruk frekvens ( aldri /tidvis /ofte /hver dag), H. pylori Vi videre gjennomført stratifisert analysene for å sjekke heterogenitet på tvers av lag av mikronæringsstoffer eller modifiserbare risikofaktorer, inkludert plasma mikronæringsstoffer (folat, vitamin B12, og tHcy), røykestatus, alkoholforbruk, H. pylori For å redusere risikoen for multippel-sammenligning gjenstander og sparsom-data bias, vi brukte en semi-Bayes (SB) krymping ( straffet-sannsynlighet) metode for å anslå genotype koeffisienter [20]; odds-ratio estimater vi rapporterer er antilogs av disse koeffisientene. Krymping estimering har blitt anbefalt i stor utstrekning som et alternativ overlegen Bonferroni i den statistiske litteraturen for å eliminere multippel-test gjenstander i sammenlignende studier [21] - [24]. I krymping estimering, i stedet for å endre alfanivå, regress vi ( 'krympe') anslag mot null i en viss grad proporsjonal med deres estimerte variansen og omvendt proporsjonal med de tidligere variansene v. Den tidligere variansen spiller en rolle er analog med den justerte α -nivå, ved at mindre verdier tilsvarer mer stringent avvisning /deteksjon av kriteriene, med α = 0 og v = 0 er den nedre grense for regulerings ved hvilke avvisningen av null blir umulig. På den andre ytterligheten, oppstår ingen justering når du bruker den opprinnelige verdien av α eller en stor (effektivt uendelig) verdi for v. I vår studie vi tildelt en tidligere avvik på 0,50, og en tidligere median OR = 1 (ingen forbindelse) som resulterer i en 95% før sannsynlighet for å falle innenfor intervallet 0,25, 4. Dette trekker de observerte assosiasjoner mot null i den grad som ville følge hvis det hadde vært et tidligere eksperiment null observere 4 /v = 8 tilfeller totalt og det hadde blitt slått sammen med aktuelle data [20], [25]. Når forskjellige stratum-spesifikk SNP effekter ble tillatt, for eksempel i stratifisert analyser, ble den kjente variansen redusert til 0,25, noe som tilsvarer et avvik på 0,50 for koeffisienten av stratum-SNP produkt (interaksjon). For hver SB bakre anslag, gir vi videre retnings (ensidige) SB P-verdier, som tilsvare den bakre sannsynligheten for at punktestimatet er på feil side av null under utstyrt modell og krymping priors [26], [27]. for å oppsummere sammenslutninger av de 8 SNPs for hver av de tre øverste GI kreft, bygget vi en polygenetisk risiko score (PRS) [28]. PRS ble beregnet som den veide sum av risikoen genotype (under enten dominante eller recessive modell som i de stratifiserte analyser) teller, hvor vekten for hvert SNP ble bestemt ved den semi-Bayes logg eller fra sin tilknytning til hver kreft i fullt justert modell. PRS var bare beregnet blant de med fullstendige genotype data om alle de 8 SNPs, som inkluderer 126 esophageal krefttilfeller, 125 magekrefttilfeller, 142 leverkreft, og 287 kontroller. Rekkevidden (maks minus minimum) av PRS for hver kreft ble delt inn i tre likt adskilte kategorier; disse områdene var 0,11 til 2,05 for esophageal kreft, 0 til 1,91 for magekreft, og 0 til 1,40 for leverkreft. Dataanalyser ble utført ved hjelp av SAS 9.1.3 (SAS Institute, Cary, NC). I forhold til befolkningskontroll, krefttilfeller tendens til å være røykere, hadde lavere BMI og lavere utdanning nivåer (tabell 1). Esophageal og magekrefttilfeller var eldre enn kontrollene, mens leveren krefttilfeller var den yngste. Leveren kreftpasienter hadde høyest hann-til-kvinne-forhold på 3,53, og var mest sannsynlig å konsumere alkohol; esophageal kreftpasienter drakk oftere enn de andre krefttilfellene og kontroller i denne studien. For risikofaktorer som er spesifikke for hver kreft området, kan vi ikke observere ulik frekvens på H. pylori Tabell 2 viser SB odds-ratio estimater (sbor) for hver SNP-kreft sammenslutning av de åtte SNPs.; Tabell S1, S2, S3, S4, S5, S6 viser stratifiserte assosiasjoner og figur 1 oppsummerer utvalgte resultater. Genotypen fordelinger mellom kontroller først er kompatibel med Hardy-Weinberg likevekt, bortsett fra muligens etter DNMT1 Vi har tidligere rapportert positive assosiasjoner av T allelet av MTHFR Mens det var ingen klar overordnet sammenheng mellom SNPs i MTR Hotell og MTRR Hotell og eventuelle kreft i hoved effekt analyser (tabell 2), heterogenitet av foreningen ble foreslått i lagdelt analyser på alkoholforbruk, herunder sammenslutninger av MTR For DNMT1 med unntak for analyse på enkelt SNP-modeller, vi også gjorde felles SNPs analyse ved å inkludere alle de 8 SNPs i en modell. (Tabell 3). Resultatene fra felles SNPs analyse foreslått tilsvarende foreninger som i enkelt SNP-modeller, men 95% bakre intervaller var bredere. Analysen på PRS foreslo omtrent en dobling av oddsen for esophageal og leverkreft blant personer i høyeste PRS kategori i forhold til de i den laveste kategorien (sbor: 2,06; 95% bakre grenser: 1,13, 3,77 for esophageal kreft og sbor: 2,09, 95% bakre grenser~~POS=HEADCOMP: 1.05, 4.17 for leverkreft), med noe mindre konsistens på tvers av kategorier for magekreft. I den kontinuerlige PRS-analyse, og resultatene antydet en dobling av sjanser for disse tre øvre gastrointestinale cancere med en enhet (i log OR) økning av PRS (tabell 4). Vi advarer imidlertid at PRS analyser tar ikke hensyn til den stillingen bygging fra dataene, og dermed kan overvurdere effekten og undervurderer variasjon i de resulterende estimatene. Vi undersøkte assosiasjoner mellom åtte SNPs i gener som er involvert i en-karbon metabolismen og mottakelighet for esophageal, mage og lever kreft i en kinesisk befolkning. Etter bruk SB svinn metoder og kontrollerende for potensielle confounders, observerte vi at noen T genotype av MTHFR I ett-karbon metabolismen, MTHFR irreversibelt katalyserer omdannelsen av 5,10-metylentetrahydrofolat (5, 10-methyleneTHF) til 5-metyltetrahydrofolat (5-methylTHF). 5,10-methyleneTHF er viktig i purin og thymidilate syntese, og 5-methylTHF er et ko-substrat for remetylering av homocystein til metionin, som videre omdannes til SAM for metylering reaksjoner [5]. MTHFR lav MTHFR aktivitet er forbundet med økt risiko for kreft på grunn av lav blod 5-methylTHF og nedsatt DNA metylering. Omvendt, kan det redusere risikoen for kreft ved å øke tilgjengeligheten av 5,10-methyleneTHF for normal DNA-syntese og hindre uracil misincorporation og kromosombrudd [5]. Selv om bevis som støtter disse hypotesene er svak og inkonsekvent [5], en in vitro i dagens analyse ved hjelp av SB svinn, fikk vi bekreftet våre tidligere funn av positive assosiasjoner mellom T-allelet av MTHFR MTR og MTRR er to andre viktige enzymer involvert i en karbon metabolismen. MTR katalyserer metylering av homocystein til metionin. MTR Vår studie observert odds-ratio variant av assosiasjoner mellom disse MTR Twitter / MTRR ALDH2 er involvert i alkohol metabolisme av oksiderende acetaldehyd, en gruppe 2B karsinogen for mennesker, til eddiksyre. ALDH2
, MTR
, MTRR
, DNMT1
og ALDH2
gener, ved hjelp av PCR RFLP, SNPlex eller TaqMan analyser. Å gjøre rede for multiple sammenligninger og redusere sjansene for falske rapporter, ansatt vi semi-Bayes (SB) krymping analyse. Etter krymping og justering for potensielle konfunderende faktorer, fant vi positive assosiasjoner mellom MTHFR
rs1801133 og magekreft (noen T versus C /C, SB odds-ratio [sbor]: 1,79, 95% bakre grenser: 1.18, 2.71) og leverkreft (sbor: 1,51, 95% bakre grenser: 0,98, 2,32). Det var en invers sammenheng mellom DNMT1
rs2228612 og spiserørskreft (noen G versus A /A, sbor: 0,60, 95% posteriore grenser: 0,39, 0,94). I tillegg, vi har oppdaget potensialet heterogenitet på tvers av alkohol drikking status for ORS om MTRR
rs1801394 til esophageal (posterior homogenitet P
= 0.005) og magekreft (posterior homogenitet P
= 0,004), og ORS knyttet MTR
rs1805087 til leverkreft (posterior homogenitet P
= 0,021). Blant ikke-alkoholholdige drikker, ble varianten allel (allelet G) av disse to SNPs omvendt assosiert med risiko for disse kreftformene; mens en positiv sammenheng ble observert blant stadig drikker alkohol. Våre resultater tyder på at genetisk polymorfisme forbundet med en karbon-metabolisme kan være assosiert med kreft i spiserør, magesekk, og lever. Heterogenitet over alkoholforbruk status for sammenhengen mellom MTR Twitter / MTRR
polymorfismer og disse kreftformene indikerer potensielle interaksjoner mellom alkohol drikking og en karbon metabolismen
Materialer og metoder
Epidemiologiske data innsamling
laboratorieanalyser
) ble målt ved hjelp av enzymbundet immunosorbant assay (ELISA) med kits fra Reagens Company i Shanghai sykehus for smittsomme sykdommer (Shanghai, Kina), Shanghai Huamei biologiske Company (Shanghai, Kina), og Reagens Company of Shanghai Bioteknologi Industry Park (Pudong, Shanghai, Kina), respektivt. Plasma aflatoksin B1 (AFB1) -albumin addukt-nivåer ble bestemt ved hjelp av ELISA-analyse, slik som tidligere beskrevet [13] under anvendelse av fri aflatoksin (Supelco) for de aflatoksin-standarder. En sammenligning mellom frie og bundne aflatoksin standarder avslørte en log-lineært forhold, tillater oss å beregne de absolutte verdier av prøvene. Plasma folat og vitamin B12-nivåer ble målt ved anvendelse av en konkurrerende radioassay med jod 125-merkede folat og kobolt 57-merket vitamin B12 som tracere (Quantaphase II B12 /folat radiobinding kit, Bio-Rad, CA). Plasma total homocystein (tHcy) ble målt ved hjelp av et kommersielt tilgjengelig kjemiluminescerende immunoanalysesystemet (IMMULITE 1000 Automated Analyzer, DPC, Los Angeles, California).
, MTR
, MTRR
, DNMT1
, og ALDH2
gener, basert på følgende kriterier: 1) SNPs som er funksjonelle eller potensielt funksjonell (SNPs lokalisert i den kodende, 3', og 5'-ikke-translaterte områder); 2) SNPs tidligere rapportert å være assosiert med øvre GI kreft; og 3) SNPs med mindre allel frekvens på minst 5% i National Center for Biotechnology Information SNP database. Genotyping ble utført ved bruk av TaqMan ( MTR
rs1805087, MTRR
rs1532268 /rs1801394, og ALDH2
rs886205) eller SNPlex ( DNMT1
rs2228612 og ALDH2
rs2238151) assay, som tidligere beskrevet (Applied Biosystems av Life Technologies, Foster City, California) [14], eller PCR-RFLP-analyse ( MTHFR
rs1801133 og ALDH2
rs671) endret fra tidligere publiserte metoder [15], [16]. Genotyping ringeprisene var over 97% for TaqMan og PCR-RFLP metoder, og over 80% for SNPlex analysen. Reproduserbarhet var 98% for de SNPlex analyse (3% tilfeldig duplikatprøvene) [17], og 100% for de TaqMan analysen (10% tilfeldig duplikate prøver).
Statistisk analyse
infeksjon (magekreft, negativ /positiv), HBsAg status (leverkreft, negative /positive) og plasma AFB1-albumin adduktpartiklene nivåer i kvintilene (leverkreft, anslått kvintilen: < 222,7, 222,7 til 344,2, 344.2- 442,6, 442,6 til 588,5, og > 588,5 fmol /mg). For å justere for rest konfunderende effekter fra alder, har vi også tatt med avviket av hver persons alder fra gjennomsnittsalderen i hver alderskategori [18]. Vi advarer at en rekke justeringsvariabler kan påvirkes av genetiske variasjoner, som disse variablene opptrer etterpå. I beste fall våre anslag er for direkte genotype effekter, og ellers kan være over-justert eller forvirret av ukontrollerte faktorer som påvirker både justeringsvariabler og resultatene [19]. Derfor sjekket vi estimatene for direkte genotype effekter mot estimatene justeres bare for alder og kjønn.
infeksjon (magekreft), HBsAg status (leverkreft), og plasma AFB1 nivåer (leverkreft). Vi brukte estimerte median nivåer i kontroller for å dichotomize plasmanivåer av folat (12,76 nmol /l), vitamin B12 (228,88 pmol /l), tHcy (9,5 mikromol /l), og AFB1 (388,95 fmol /mg). Vi brukte dominant genetisk modell som forutsettes at virkningen av varianten allelet er dominerende dersom forholdet mellom ORS sammenligne variant allel homozygote for heterozygoter var mindre enn det som sammenligner heterozygoter på vanlige allel homozygote; ellers vi brukte recessive genetiske modell. Vi vurderte heterogenitet på tvers av lagene bruker likelihood ratio tester ved å sammenligne modeller med og uten produkt vilkår.
Resultater
smitte mellom magekreftpasienter og kontroller. Sammenlignet med kontroller, leverkreftpasienter viste en høyere prosentandel av HBsAg positive (65 vs. 25%), anti-HCV positive (9 vs. 3%), og hadde høyere plasma AFB1-albumin adduktpartiklene nivåer (30 vs. 20% i den 5 th kvintil)
rs2228612, som hadde P
= 0,010, under den tradisjonelle alfa-nivå på 0,05, men større enn den Bonferroni- justerte alfa nivå på 0,05 /8 = 0,006 (teste alle åtte SNPs). Men ser vi at matching mai skjevhet styrer unna likevekt hvis samsvarende faktorer er assosiert med både SNPs og kreft.
rs1801133 med mage og leverkreft [11], [12]. I den foreliggende analysen, forble disse assosiasjonene tydelig etter confounder justering og SB krymping (noen T versus C /C, fullt justert sbor: 1,79, 95% posteriore grenser: 1,18, 2,71 for magekreft, sbor: 1,51, 95% posteriore grenser: 0,98, 2,32 for leverkreft). I stratifisert SB analyser, sammenhengen mellom MTHFR
rs1801133 og magekreft dukket sterkere blant personer som hadde lavere plasma folatnivå, høyere plasma vitamin B12 eller tHcy nivåer, og blant røykere (figur 1). Det var ingen klar sammenheng av MTHFR
rs1801133 med spiserørskreft (tabell 2 og tabell S1, S2, S3, S4, S5).
rs1805087 med leverkreft (homogenitet P
= 0,021), og MTRR
rs1801394 med både esophageal (homogenitet P
= 0.005) og magekreft (homogenitet P
= 0.004). Mens G allel bærere av MTR
rs1805087 ble omvendt assosiert med leverkreft blant ikke-drikkere (sbor: 0,57, 95% posteriore grenser: 0,31, 1,04), de var positivt assosiert med leverkreft blant drinkers (sbor: 1,48, 95% bakre grenser: 0,85, 2,57) (figur 1). Tilsvarende G allel bærere av MTRR
rs1801394 ble omvendt assosiert med esophageal og magekreft blant ikke-drikkere (sbor: 0,59, 95% posteriore grenser: 0,37, 0,94 for esophageal kreft, sbor: 0,49, 95% posterior grenser~~POS=HEADCOMP: 0,30, 0,79 for magekreft), men positivt assosiert med kreft blant drinkers (sbor: 1,56, 95% bakre grenser~~POS=HEADCOMP: 0,95, 2,56 for spiserørskreft, sbor: 1,39, 95% bakre grenser~~POS=HEADCOMP: 0,83, 2,32 for magekreft) ( . Figur 1)
polymorfisme, rs2228612 ble omvendt assosiert med esophageal kreft i dominant genetisk modell (noen G versus A /A, sbor: 0,60, 95% bakre grenser: 0,39 , 0,94) (tabell 2). Blant tre ALDH2
SNPs, rs671 var assosiert med esophageal kreft i recessive genetiske modellen (A /A verus G, sbor: 1.76, 95% posteriore Grenser: 0.96, 3.24). I stratifisert justerte analyser, ALDH2
rs671 dukket opp i forbindelse med spiserørskreft blant personer med lavere plasmafolatnivåer (A /A verus G, sbor: 2.12, 95% posteriore grenser: 1,01, 4,44) (figur 1) . ALDH2
rs2238151 dukket omvendt assosiert med leverkreft når man sammenligner T allel bærere til de med C /C genotype (alder og kjønn justert sbor: 0,47, 95% posteriore grenser: 0,24, 0,92). Selv om vi ikke finne assosiasjoner mellom ALDH2
rs886205 og kreft mottakelighet viktigste effekten analyser, stratum spesifikke sbor antydet at ALDH2
rs886205 var positivt assosiert med magekreft blant deltakere med høyere plasma vitamin B12 nivåer (sbor: 1,87, 95% posteriore grenser: 1,09, 3,20) (figur 1)
Diskusjoner
rs1801133 var positivt assosiert med både mage og leverkreft. Vi har også funnet en invers sammenheng mellom variant G allelet av DNMT1
rs2228612 og spiserørskreft. I tillegg vår studie antydet potensielle OR variasjoner mellom lag av alkoholbruk, herunder sammenslutninger av MTRR
rs1801394 med esophageal og magekreft, og MTR
rs1805087 med leverkreft. Oddsen for øvre GI kreft ble omtrent fordoblet for kinesiske deltakere med en enhet (i loggen OR) økning på PRS.
C677T (rs1801133) polymorfisme, noe som resulterer i en valin til alanin-substitusjon, fører til redusert MTHFR enzymaktivitet [29], redusert 5-methylTHF og en opphopning av 5,10-methyleneTHF i røde blodlegemer [30].
studien antydet at effekten av MTHFR
rs1801133 på DNA stabilitet og metylering er stedsspesifikke og kan avhenge på folat tilgjengelighet [31]. Når folat forsyningen er tilstrekkelig eller høy, T-allelet av MTHFR
er assosiert med økt genomisk DNA metylering i tykktarm kreft celler, men redusert DNA metylering i brystkreftceller. Når folat tilførsel er begrenset, er denne varianten assosiert med redusert og uendret DNA-metylering i tykktarm og brystkreftceller, henholdsvis [31]. Uracil misincorporation er redusert i tykktarm kreft celler uttrykker MTHFR
T-allelet, og vokste i brystkreftceller uttrykker den samme varianten [31]. Denne stedsspesifikke forskjellen kan delvis forklare forskjellen i kreftrisiko forbundet med MTHFR
rs1801133 polymorphism [4]. I epidemiologiske studier, synes T-allelet for å redusere risikoen for kolorektal og brystkreft [32], [33], men øker risikoen for kreft i spiserøret, magen, leveren, blæren, cervix uteri, og lunge [2] - [4], [34] - [36]
rs1801133 og kreft. magesekken og leveren i denne Taixing populasjonen [11], [12], noe som tyder på at forstyrrelse av DNA-metylering som følge av denne varianten spiller en viktig rolle i magesekken og leveren karsinogenese. Nyere meta-analyser rapportert lignende foreninger (T /T versus C /C, OR: 1,40, 95% KI: 1,19 til 1,66 for magekreft, OR: 1,21, 95% KI: 0,95 til 1,56 for leverkreft) [3], [4]. I tillegg Zacho et al. [4] rapporterte en større sammenheng mellom MTHFR
rs1801133 og magekreft blant studiepopulasjoner uten folsyre festningsverk (OR: 1,60, 95% KI: 1,36 til 1,88), sammenlignet med de med befestning (OR: 1,15 , 95% KI: 0,81 til 1,63), som er lik vår funn av en sterkere assosiasjon blant personer med lavere plasmafolatnivåer. For spiserørskreft, våre data foreslått en økt risiko blant MTHFR
rs1801133 T allel bærere (noen T vs C /C, sbor: 1,25, 95% bakre Grenser: 0,85, 1,84), som er konsistent med funn fra en meta-analyse av 19 studier (C /T versus C /C, OR: 1,47, 95% KI: 1,32 til 1,63; T /T versus C /C, OR: 1,69, 95% KI: 1,49 til 1,91) [ ,,,0],2].
A2756G (rs1805087), en felles SNP som fører til substitusjon av asparaginsyre med glysin, er i stor grad undersøkt. Imidlertid har ingen åpenbare assosiasjoner blitt observert med kreft på følgende steder: lunge, prostata, hode og nakke, blære, spiserør, magesekk, bryst eller tykktarm og endetarm [37] - [46]. MTRR regenererer en funksjonell MTR via reduktiv metylering. To vanlige polymorfismer, MTRR
A66G (rs1801394, konverterer isoleucin til metionin) og C524T (rs1532268, endres serin til leucin), har blitt antydet for å regenerere MTR mindre effektivt [47]. G allel bærere av MTRR
rs1801394 har vært forbundet med økt risiko for leverkreft (HCC) [48]. Motsatt, foreninger er i strid med andre kreftformer, inkludert esophageal plateepitelkarsinom (ESCC), magekreft, og endetarmskreft [37], [44], [49] - [53]. De fleste studier som har undersøkt MTRR
rs1532268 rapporterte ingen assosiasjoner med kolorektal, mage, bryst og lungekreft [44], [51], [53] - [56]. Man bør huske imidlertid at misforståelser og rapporter om ingen sammenheng kan bare reflektere forventet variasjon i P
-verdier ( "statistisk signifikans") i stedet for noen reelle konflikter.
polymorfismer og øvre GI kreft over alkoholforbruket, selv etter at konservative SB krymping. Alkoholforbruket syntes å ha endret odds-forholdstall knyttet MTR
rs1805087 til leverkreft, og MTRR
rs1801394 til esophageal og magekreft. G allel bærere av disse to SNPs ble positivt assosiert med kreft blant dem som drikker, og omvendt assosiert med kreft blant ikke-drikkere. . Matsuo et al, observert en lignende OR variasjon [57]: G /G genotype bærere av MTR
rs1805087 viste høyere kolorektal kreftrisiko blant drikker alkohol og lavere risiko blant ikke-drikkere. Selv om den funksjonelle effekten av MTR /MTRR
polymorfismer er ikke klarlagt, våre resultater er biologisk plausibel som alkohol kan forstyrre en-karbon metabolismen ved å hemme folat absorpsjon, undertrykke SAM syntese, og svekke DNA metylering [6]. Alkohol kan også føre til hemming av metionin-syntaseaktivitet [6]. Derfor er det mulig at den varianten allelet av disse to MTR /MTRR
polymorfismer er beskyttende for de øvre GI kreft under miljø uten alkohol eksponeringer. Men det blir skadelig når en karbon metabolismen blir forstyrret av alkohol og dets metabolitter.
rs671 polymorfisme-en velkjent variant som oppstår utelukkende i asiatiske populasjoner-fører til en lavere katalytisk virkningsgrad ALDH2, og dermed gjengir lavere evne til å eliminere acetaldehyd [58]. ALDH2
rs671 Et allel (langsom type) har vært assosiert med økt risiko for hode og nakke kreft, samt kreftfaren [59], [60]. I samsvar med tidligere funn, observerte vi en positiv sammenheng mellom A /A genotype og spiserørskreft i denne studien, og videre rapportert en sterkere assosiasjon blant personer med lavere plasmafolatnivåer. Acetaldehyd også griper inn i folatmetabolismen [6].
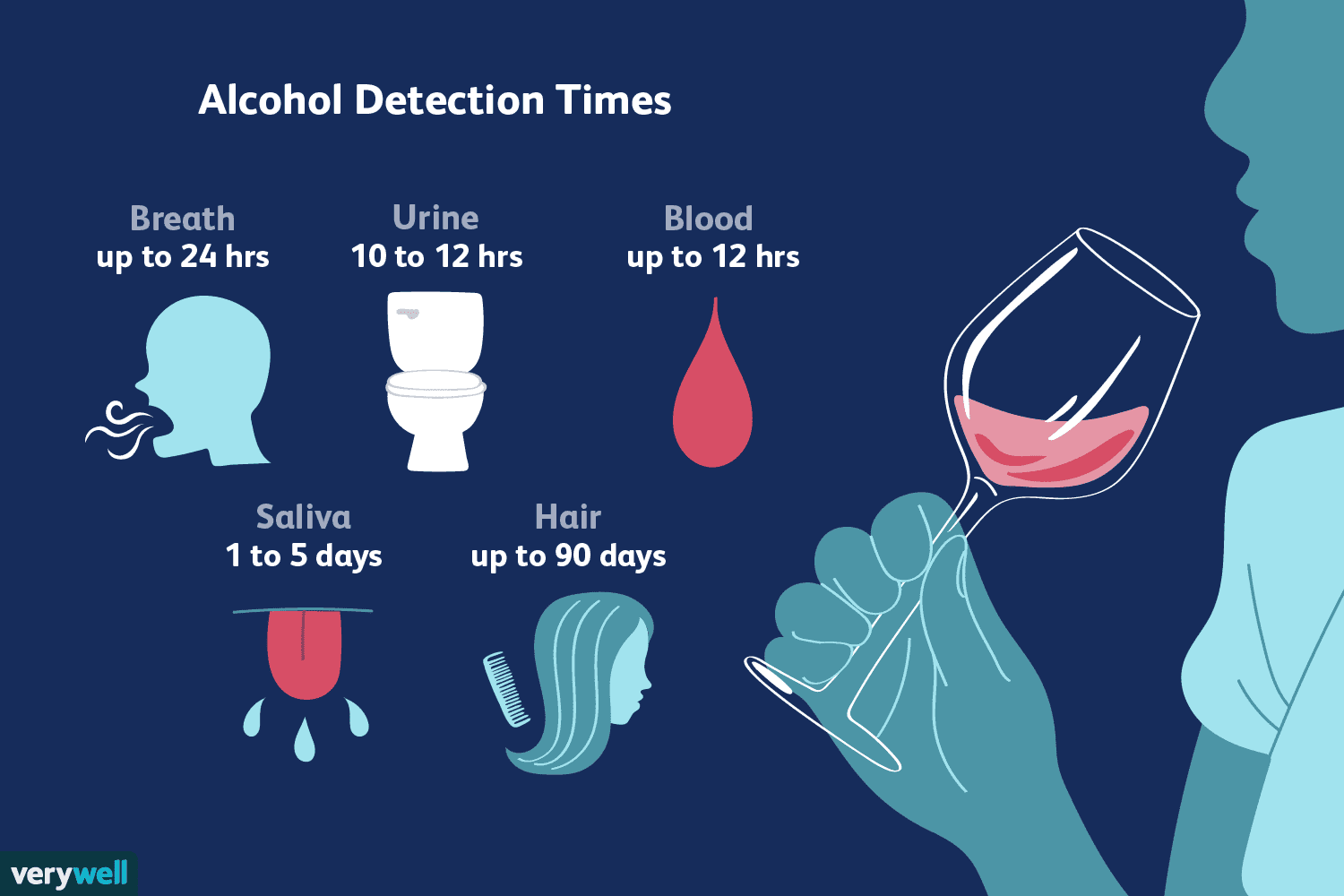 Hvor lenge blir alkohol i systemet ditt?
Å vite hvor lenge alkohol (etanol) forblir i systemet ditt er viktig for å unngå farlige interaksjoner med medisiner så vel som svekkelser i din fysiske og mentale ytelse. Selv om alkohol ikke anses s
Hvor lenge blir alkohol i systemet ditt?
Å vite hvor lenge alkohol (etanol) forblir i systemet ditt er viktig for å unngå farlige interaksjoner med medisiner så vel som svekkelser i din fysiske og mentale ytelse. Selv om alkohol ikke anses s
 22 hjemmemedisiner for fordøyelsen
Varm myntete (sitron og ingefær) hjelper på fordøyelsesbesværet. Enhver spesiell anledning innebærer mye moro og god mat. Noen ganger er nytelsen hemmet på grunn av problemer knyttet til fordøyelse
22 hjemmemedisiner for fordøyelsen
Varm myntete (sitron og ingefær) hjelper på fordøyelsesbesværet. Enhver spesiell anledning innebærer mye moro og god mat. Noen ganger er nytelsen hemmet på grunn av problemer knyttet til fordøyelse
 Ernæringsbehandling av inflammatorisk tarmsykdom
Hos Ignite Nutrition spesialiserer vi oss ikke bare på Irritable Bowel Syndrome (IBS), men vi jobber også med klienter med inflammatorisk tarmsykdom (IBD) og andre tarmsykdommer. Hvis du lurer på hva
Ernæringsbehandling av inflammatorisk tarmsykdom
Hos Ignite Nutrition spesialiserer vi oss ikke bare på Irritable Bowel Syndrome (IBS), men vi jobber også med klienter med inflammatorisk tarmsykdom (IBD) og andre tarmsykdommer. Hvis du lurer på hva