Últimas notícias sobre crianças saudáveis
- Problemas de alimentação do bebê ligados a atrasos no desenvolvimento
- O braço dela ficou preso na esteira da família
- Preocupado com o uso de mídia social de seu filho adolescente?
- Eficácia do 'Brinquedo Orientado' para o Aprendizado
- O comportamento das crianças piorou com o aprendizado remoto
- Quer mais notícias? Inscreva-se para receber os boletins da MedicineNet!

TERÇA-FEIRA, 11 de junho de 2019 (HealthDay News) -- O IB-Stim recebeu aprovação de marketing da Food and Drug Administration dos EUA como o primeiro dispositivo médico usado para ajudar a aliviar a dor abdominal funcional em pacientes de 11 a 18 anos com síndrome do intestino irritável (SII), anunciou a agência na sexta-feira.
O dispositivo de prescrição é composto por um pequeno estimulador de nervo elétrico de uso único colocado atrás da orelha do paciente. Um chip alimentado por bateria no estimulador emite pulsos elétricos de baixa frequência para estimular continuamente certos ramos do nervo craniano. O estimulador é substituído após cinco dias e os pacientes podem usar o dispositivo por até três semanas consecutivas em combinação com outras terapias para SII.
A aprovação de comercialização foi baseada em dados de um estudo clínico publicado de 50 pacientes com idades entre 11 e 18 anos com SII. Vinte e sete pacientes foram tratados com o dispositivo e os 23 pacientes restantes receberam um dispositivo placebo. Os pacientes de ambos os grupos relataram pior dor semelhante no início do estudo, e todos os pacientes continuaram com doses estáveis de medicação para tratar a dor abdominal crônica. Cinquenta e dois por cento dos pacientes do grupo de tratamento experimentaram uma redução de pelo menos 30 por cento na dor habitual em três semanas em comparação com 30 por cento dos pacientes que receberam o dispositivo placebo. Cinquenta e nove por cento dos pacientes tratados relataram uma redução de pelo menos 30 por cento na pior dor versus 26 por cento dos pacientes que receberam placebo. Os pacientes do grupo de tratamento também tiveram uma mudança maior nos escores compostos de duração da gravidade da frequência da dor desde a linha de base até a semana 3.
Desconforto leve no ouvido foi relatado por seis pacientes tratados, e três pacientes relataram alergia ao adesivo no local da aplicação. A FDA observa que o IB-Stim é contraindicado para pacientes com hemofilia, portadores de marca-passo cardíaco e portadores de psoríase vulgar.
A aprovação do IB-Stim foi concedida à Innovative Health Solutions.
Mais Informações

Copyright © 2019 HealthDay. Todos os direitos reservados.


 Novas interações hospedeiro-viral-microbioma durante COVID-19 podem determinar o resultado
Novas interações hospedeiro-viral-microbioma durante COVID-19 podem determinar o resultado
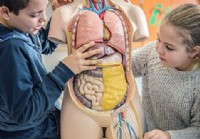 As partes, órgãos e funções do processo de digestão
As partes, órgãos e funções do processo de digestão
 Teste de expulsão de balão para defecação dissinérgica
Teste de expulsão de balão para defecação dissinérgica
 Estar acima do peso dobra suas chances de ter um AVC
Estar acima do peso dobra suas chances de ter um AVC
 Por que vomitamos quando ficamos doentes?
Por que vomitamos quando ficamos doentes?
 Como você sabe se tem uma infecção renal?
Como você sabe se tem uma infecção renal?
 Os pontos cegos da sua saúde estão deixando você doente
Ela foi embora novamente. Sentei-me devastada no meu sofá tentando entender o que fiz de errado. A terceira mulher consecutiva de repente terminou comigo e fugiu da minha vida. Não fazia sentido par
Os pontos cegos da sua saúde estão deixando você doente
Ela foi embora novamente. Sentei-me devastada no meu sofá tentando entender o que fiz de errado. A terceira mulher consecutiva de repente terminou comigo e fugiu da minha vida. Não fazia sentido par
 oh minha banha
Banha está fazendo um retorno. Usado há séculos na cozinha, ganhou uma má reputação nos últimos anos. No entanto, os rumores nem sempre são verdadeiros, e a banha é uma adição fantástica ao seu amigáv
oh minha banha
Banha está fazendo um retorno. Usado há séculos na cozinha, ganhou uma má reputação nos últimos anos. No entanto, os rumores nem sempre são verdadeiros, e a banha é uma adição fantástica ao seu amigáv
 Doença de Chagas
O que é a doença de Chagas? A doença de Chagas é uma infecção causada pelo T. cruz parasita. Os sintomas da doença de Chagas incluem erupção cutânea, linfonodos inchados, febre, fadiga, náuseas, vô
Doença de Chagas
O que é a doença de Chagas? A doença de Chagas é uma infecção causada pelo T. cruz parasita. Os sintomas da doença de Chagas incluem erupção cutânea, linfonodos inchados, febre, fadiga, náuseas, vô