Dificuldades em avaliar perfuração gástrica associada a citomegalovírus em um paciente infectado pelo HIV da arte abstracta
Fundo
Infecção ativa citomegalovírus (CMV) é uma complicação comum em infecção avançada sintomática Vírus da Imunodeficiência Humana (HIV). perfurações intestinal induzida por CMV são difíceis de diagnosticar e pode ser observada em todo o tracto gastrointestinal. perfuração do estômago isolado é excepcional.
Apresentação do caso
Um homem de 47 anos foi internado em nossa unidade de cuidados intensivos com falência de múltiplos órgãos. exame endoscópico gastrointestinal mostrou gastrite eritematosa mas duodeno normal e cólon. hemocultura CMV foi positiva. O exame histológico de uma biópsia gástrica mostrou infiltrado inflamatório e imunocoloração corpos de inclusão CMV típica intranucleares. Concomitante tomografia computadorizada abdominal revelou grandes hypodensities peripancreáticos sem pneumoperitônio. O paciente morreu apesar das terapias de apoio e infusão de ganciclovir. exame post-mortem mostrou uma perfuração gástrica de 4 cm aderindo ao cólon transverso e fígado, com um revestimento inflamatória necrótica de espessura em torno do pâncreas. todo o trato GI, excepto o estômago, era normal. Como outras causas, especialmente Helicobacter pylori
infecção pode ser descartada, uma relação causal entre a CMV ea doença gástrica foi assumido.
Conclusão
CMV pode ser responsável por perfurações gástricas, com dificuldades em avaliar o diagnóstico. O diagnóstico precoce baseado em endoscopia cauteloso e exame histopatológico é necessário para fazer um resultado favorável possível.
Fundo
citomegalovírus (CMV) é frequentemente isolados de pacientes imunodeprimidos com infecção pelo HIV, órgãos ou de medula transplantes, doenças malignas ou medicamentos imunossupressores. CMV pode causar doenças disseminadas e é geralmente preditivo, em pacientes infectados pelo HIV, da sobrevivência a longo prazo pobre refletindo a imunossupressão grave [1]. Nestes pacientes, gastrointestinais (GI), incluindo a infecção por CMV, colite, esofagite, gastrite e [2, 3]. Os sinais clínicos são geralmente escassa, tornando o diagnóstico difícil. Embora perfuração intestinal induzida por CMV foi observada em pacientes com imunodeficiência avançada, perfuração gástrica isolada continua a ser um evento raro. Relatamos aqui o caso fatal de um paciente infectado pelo HIV, que apresentou uma perfuração gástrica associada ao CMV.
Apresentação do caso
Um homem de 47 anos foi internado em nossa unidade de terapia intensiva (UTI) para convulsões generalizadas e hipotensão. Três dias antes da admissão, ele sofria de fadiga, febre, vómitos, dor abdominal e menor hemorragia GI. Ele era sem-teto e uma alcoólica crónica. O exame físico mostrou comprometimento do estado geral, com uma temperatura de 36,5 ° C e uma pontuação de Coma de Glasgow de 10. Sem déficit neurológico focal foi anotada. A pressão arterial foi 80/26 mmHg, a sua frequência cardíaca 106 /min e sua frequência respiratória 36 /min. Seu abdômen estava concurso com hepatomegalia. exames de sangue habituais mostrou uma creatinina de 413 mmol /l (N < 120), contagem de células brancas do sangue de 15,1 × 10
6 /l (N: 4 × 10 6-10 × 10 6 ) com 85% de leucócitos polimorf onucleares, hemoglobina de 8,5 g /dl (N: 13-18) e nas plaquetas 178 x 10 6 /L (N: 150-400). Ele apresentou com acidose láctica grave (pH arterial 7,21 (N: 7,34-7,45), PaCO 2 3,7 kPa (N: 4,3-6,0), bicarbonato de sangue 11 mmol /l (N: 20-26), e plasma lactato 22 mmol /L (N: 1-2)). O seu tempo de protrombina foi de 9% (N > 75%), fibrinogénio 3,72 g /l (N: 2-4), factor V de 25% (N > 75%), e factores II + VII 5% (N > 75 %). Outros testes mostraram um AST de 4.480 UI /l (N < 50), uma ALT de 2.340 UI /l (N < 50), bilirrubina 67 mmol /l (N < 17), LDH 24.500 UI /l (N < 275) , lipase 11.820 UI /l (N < 200), e creatina fosfoquinase 3.330 UI /l (N < 170). ultra-sonografia abdominal mostrou um aumento do fígado, sem ascite. A radiografia de tórax, eletrocardiograma, tomografia computadorizada cerebral foram normais. O paciente foi entubado. Ele recebeu infusões IV de norepinefrina (6 mg /h), dobutamina (15 ug /kg /min), omeprazol (80 mg /dia), a N-acetilcisteína (300 mg /kg ao longo de 20 h), cefotaxima (3 g /dia ) e o metronidazol (1,5 g /dia). hemodiafiltração contínua foi iniciado. Culturas de sangue, urina, fezes e aspiração traqueal foram negativos. testes de rastreio toxicológico, incluindo acetaminofeno, etanol, etileno glicol, e metanol foram negativos. HIV-1 ELISA sorologia foi positiva, linfócitos CD4 + contagem de 160 × 10 6 /l (N > 700) e HIV-1 RNA nível foi de 5,8 × 10 5 cópias /ml. lavado bronco-alveolar (BAL) mostrou 2,5 × 10 8 células /l com linfócitos 58%. Um diagnóstico de Mycobacterium tuberculosis
infecção foi rapidamente avaliado por um ensaio de amplificação (Amplified Mycobacterium Tuberculosis teste direto, Gen Probe, Califórnia) e confirmado retrospectivamente pela LBA. Isoniazida, rifampicina, etambutol e pirazinamida foram iniciadas no dia 3. O exame endoscópico mostrou II varizes esofágicas grau, esofagite moderada péptica, gastrite eritematosa com ulcerações superficiais cardiais sem sangramento ativo, e do duodeno normal e cólon. cultura CMV usando células MRC5 inoculação foi positivo em sangue, mas não em BAL. ensaio de amplificação CMV foi negativa no fluido cerebrospinal. A análise histopatológica da biópsia gástrica mostrou edema, infiltrado inflamatório e corpos de inclusão citomegálicas intranucleares típicas nas células endoteliais em mucosa. A imuno-histoquímica com um anticorpo anti-CMV específico (E13, Argene, França) confirmou a infecção por CMV activa do estômago (Fig. 1). coloração e cultura específica foram negativos para Helicobacter pylori
. Logo que estes resultados eram conhecidas (no dia 10), o ganciclovir foi iniciado. Concomitante tomografia computadorizada abdominal revelou grandes e heterogêneos hypodensities peripancreáticos, levemente reforçada após a infusão de contraste (Fig. 2). No entanto, sua etiologia exata permaneceu indeterminada. O paciente desenvolveu Pseudomonas aeruginosa
pneumonia hospitalar e seu estado de saúde piorou. Ele morreu 30 dias após a admissão. exame post-mortem mostrou uma perfuração gástrica grande, bem circunscrita, com um diâmetro de 4 cm. O estômago foi solidamente aderiu ao cólon transverso e para a face inferior do fígado. Houve um revestimento necrótico inflamatório e hemorrágico de espessura em torno do pâncreas, que, em contraste, apareceu macroscopicamente normal. todo o trato GI, excepto o estômago, era normal. Figura 1 espécime de biópsia da mucosa epiteliais glandulares gástricos que mostram a presença de corpos de inclusão intranucleares citomegálicas (1A, seta), juntamente com edema e infiltrado inflamatório. A infecção por CMV foi confirmada utilizando imuno-histoquímica, com um anticorpo específico anti-CMV (DAB-peroxidase) (1B).
Figura 2 Abdominal TC mostrando a presença de hypodensities grandes e heterogêneos (seta aberta), em torno do pâncreas (seta cheia ) e ligeiramente aumentada a seguir à infusão do contraste. O baço (seta cinza) foi parciais, demonstrando as zonas de isquemia.
Infecção por CMV do trato gastrointestinal pode causar graves danos. envolvimento isolado do estômago é possível, embora raro [3, 4]. Os sintomas não são específicos, incluindo febre inexplicável, disfagia, dor epigástrica aguda ou postural, vómitos, diarreia e sangramento gastrointestinal. Característicos achados endoscópicos superiores são edema, congestão, ulcerações das mucosas, úlceras gástricas soco-out múltiplas, erosões e hemorragia GI superior [5]. No entanto, os resultados podem ser leves mostrando congestão e espessamento ou ser atípica, com gastrite necrótica hemorragia ou pseudo-tumores [6]. Múltiplas biópsias mucosas são necessários para a detecção de CMV [7]. Em pacientes infectados pelo HIV, CMV é significativamente associada à gastrite crónica activa ou úlceras gastroduodenais [7-9], em contraste com os adultos saudáveis, nos quais a infecção gástrica CMV sintomática é excepcional [10]. Assim, o reconhecimento precoce da infecção pelo CMV GI, incluindo culturas de sangue e avaliação GI endoscópico cauteloso, pode permitir uma terapia adequada, prevenindo complicações, como sangramento ou perfuração [3, 11] com risco de vida.
Infecção por CMV ativa as células endoteliais e leucócitos, alterando GI microcirculação e induzindo extensa vasculite, oclusão vascular trombótica, necrose, e perfuração isquémica [12]. Os locais mais comuns relatadas de perfuração intestinal são o cólon (53%) [13-15], o íleo distai (40%) [16, 17], e o apêndice (7%) [18]. perfuração associada ao CMV do estômago é uma apresentação rara [19]. Para nosso conhecimento, perfuração gástrica induzida por CMV isolado foi apenas relatado em receptores de transplante de órgão não-HIV [20]. Em nosso paciente, CMV-associado perfuração gástrica, como uma manifestação inicial da infecção pelo HIV, foi responsável por falência de múltiplos órgãos. O diagnóstico era difícil, na ausência de abdômen agudo e pneumoperitônio. Consistentemente, exame endoscópico inicial perdeu a perfuração gástrica, uma vez que o furo no estômago foi provavelmente preenchido por peritoneu. Além disso, é possível que uma avaliação endoscópica sub-óptima do tracto GI superior era devido a um estado instável inicial do paciente e o desempenho do gastroscopia em tal situação crítica. Em contraste, concomitante tomografia computadorizada abdominal mostrou imagens grandes hipodensas em torno do pâncreas, atribuídas após exame post-mortem, ao hemorrágica e materiais inflamatórios necróticas que preencheu a perfuração gástrica.
Causas alternativas de úlcera gástrica, incluindo a infecção por Helicobacter pylori
, deve ser discutido. Com efeito, CMV é um vírus oportunista e pode, assim, aparecer em tecidos previamente danificadas. No entanto, um estudo recente sugere que CMV, ao invés de Helicobacter pylori
, pode ser a principal patógeno causador de úlceras pépticas em pacientes infectados pelo HIV, em comparação com os não infectados pelo HIV [9]. No nosso caso, as conclusões e as culturas histopatológicos foram negativos para Helicobacter pylori
. Além disso, corpos de inclusão CMV, que foram observados nos achados patológicos iniciais, indicou claramente a existência de uma doença CMV na admissão do paciente.
Normalmente, a resolução dos sintomas e achados endoscópicos é obtida com ganciclovir IV ou foscarnet. terapias anti-retrovirais combinados podem também ser eficazes, mesmo sem tratamento específico de CMV [21]. No entanto, no caso de perfuração, apesar da ressecção cirúrgica imediata e terapia antiviral, a taxa de mortalidade permanece elevada (> 80%), devido à mortalidade operatória elevada e aumento complicações pós-operatórias [17, 18]. No nosso caso, a terapia ganciclovir conseguiu reduzir a carga viral CMV antes da ocorrência da morte, que resultou da perfuração gástrica diagnosticada.
Conclusão
Esta apresentação dramática demonstra que a perfuração pode complicar a infecção gástrica CMV em pacientes infectados pelo HIV. Os médicos devem estar cientes de que o diagnóstico precoce, com base em endoscopia digestiva cauteloso e exame histopatológico da biópsia GI é necessário para fazer um resultado favorável possível.
Declarações
Agradecimentos
consentimento escrito foi obtido a partir da relação paciente para publicação de estudo.
Autores 'arquivos enviados originais para imagens
Abaixo estão os links para os autores' arquivos enviados originais de imagens. 'arquivo original para a figura 1 12879_2005_176_MOESM2_ESM.ppt Autores' 12879_2005_176_MOESM1_ESM.ppt Autores arquivo original para a figura 2 Conflito de interesses
O autor (s) declaram que não têm interesse competindo.
 8 Causas, sintomas, dieta e tratamento da síndrome do intestino irritável (SII)
Fatos sobre a síndrome do intestino irritável (SII) Sintomas da SII A síndrome do intestino irritável, ou IBS, ou cólon espástico, é um tipo de distúrbio gastrointestinal. Os sintomas e sinais da S
8 Causas, sintomas, dieta e tratamento da síndrome do intestino irritável (SII)
Fatos sobre a síndrome do intestino irritável (SII) Sintomas da SII A síndrome do intestino irritável, ou IBS, ou cólon espástico, é um tipo de distúrbio gastrointestinal. Os sintomas e sinais da S
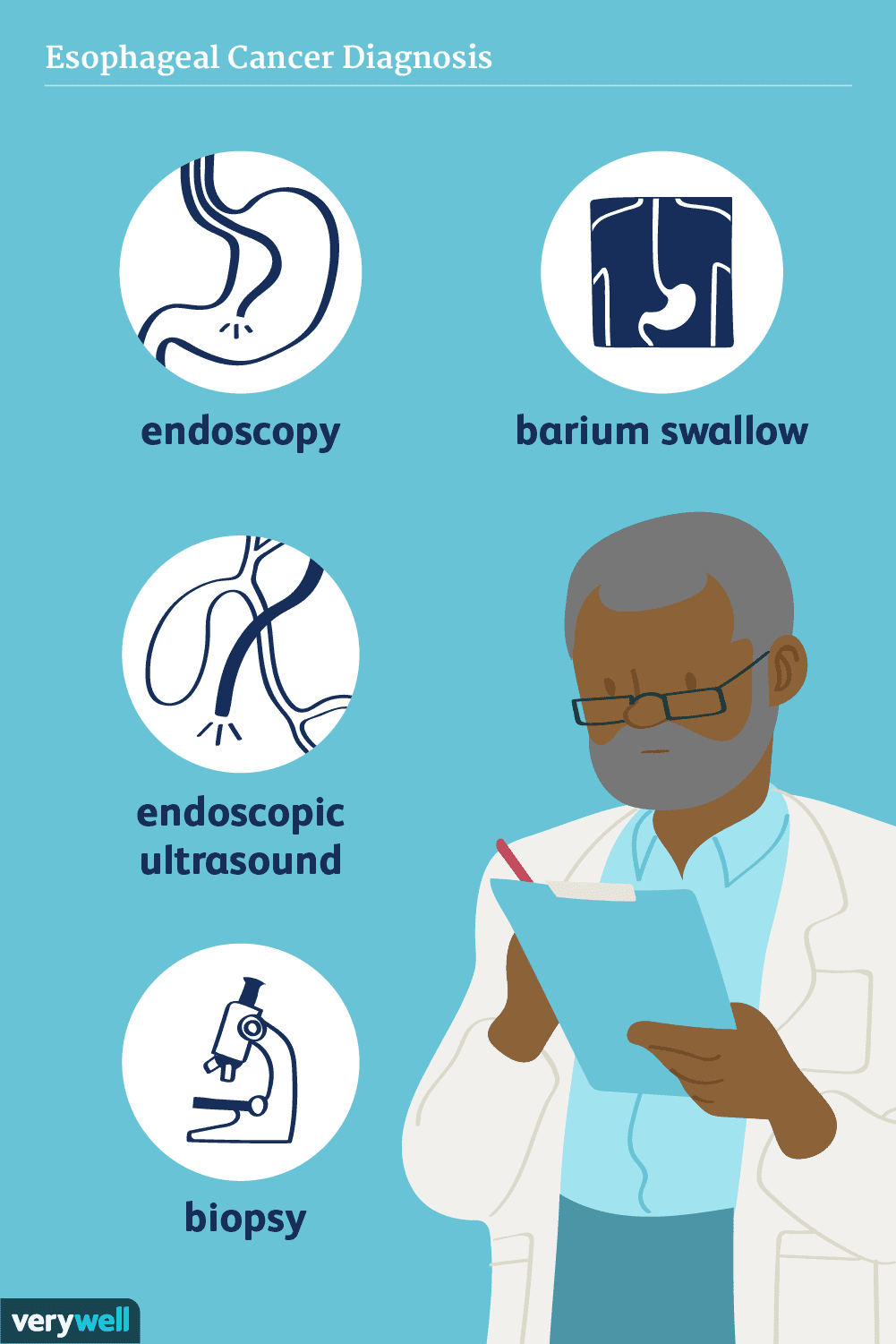 Como o câncer de esôfago é diagnosticado
O diagnóstico de câncer de esôfago pode incluir exames como deglutição de bário, endoscopia e ultrassonografia endoscópica. Você pode precisar de uma avaliação para um possível câncer de esôfago se ti
Como o câncer de esôfago é diagnosticado
O diagnóstico de câncer de esôfago pode incluir exames como deglutição de bário, endoscopia e ultrassonografia endoscópica. Você pode precisar de uma avaliação para um possível câncer de esôfago se ti
 Refeição de Dia dos Namorados amigável para SIBO
Tudo que você precisa é amor, assim disseram os Beatles e no Dia dos Namorados, mais do que em qualquer outro dia do ano, muitos de nós queremos fazer uma refeição para mostrar aos entes queridos que
Refeição de Dia dos Namorados amigável para SIBO
Tudo que você precisa é amor, assim disseram os Beatles e no Dia dos Namorados, mais do que em qualquer outro dia do ano, muitos de nós queremos fazer uma refeição para mostrar aos entes queridos que