infra-regulação da expressão de SPARC diminui câncer gástrico invasão celular e na sobrevivência da arte abstracta
Fundo
proteína secretada ácido e rico em cisteína (SPARC) desempenha um papel fundamental no desenvolvimento de muitos tecidos e tipos de órgãos. SPARC expressão aberrante foi encontrada numa grande variedade de cancros humanos, contribui para o desenvolvimento do tumor. Porque SPARC foi encontrado para ser sobre-expressa em tecido de cancro gástrico humano, que, por conseguinte, para explorar a expressão da SPARC em linhas de cancro gástrico e os mecanismos carcinogénicos.
Métodos
expressão SPARC foi avaliada num painel de linhas celulares de cancro gástrico humano . linhas celulares de cancro gástrico MGC803 e HGC 27 expressam alto nível de SPARC foram transitoriamente transfectadas com pequenos RNAs de interferência específica do SPARC e posteriormente avaliados para efeitos sobre a invasão e proliferação.
Resultados
pequeno interferir knockdown mediada por RNA de SPARC em MGC803 e HGC 27 células cancerosas gástricas diminuiu drasticamente sua invasão. Knockdown da SPARC foi igualmente observado para aumentar significativamente a apoptose de 27 células de cancro gástrico MGC803 HGC e comparado com o grupo controlo transfectado.
Conclusões Os nossos dados mostraram que a regulação negativa da SPARC inibe a invasão e crescimento de células de cancro gástrico humano. Assim, o alvo da SPARC poderia ser uma abordagem terapêutica eficaz contra o câncer gástrico.
Introdução
O câncer gástrico é a segunda principal causa de mortes relacionadas ao câncer em todo o mundo e é um dos tumores mais agressivos e é frequentemente associado com linfonodo metástase, disseminação peritoneal, e metástase hematogênica [1]. No conjunto, 65-70% dos novos casos e mortes por câncer gástrico ocorrer em países menos desenvolvidos [2]. Em 2005, as taxas de incidência de câncer gástrico (0,3 milhões de mortes e 0,4 milhões de novos casos) ficou em terceiro lugar entre os cânceres mais comuns na China [3]. As terapias atuais para a fase avançada ou câncer gástrico metastático têm pouco efeito, a remoção cirúrgica com ressecção dos linfonodos adjacentes oferece a única chance de cura, que é menos de 33% dos pacientes com câncer gástrico. A taxa de sobrevida em 5 anos é apenas 30-40%, com um pior prognóstico para os tumores avançados. A compreensão dos mecanismos moleculares subjacentes a progressão do cancro gástrico podem proporcionar perspectivas sobre novos alvos terapêuticos
proteína secretada ácida e rica em cisteína (SPARC; também conhecido como osteonectina ou BM-40). Pertence à família de proteínas segregadas matricellular [4 ]. SPARC é um componente não-estrutural de matrizes extracelulares que modula interacções célula-matriz, em particular durante o desenvolvimento do tecido, a remodelação e reparação de [5]. Muitos tipos de cancros são caracterizados pela expressão regulada positivamente da SPARC [6]. A sobre-expressão da SPARC tem sido documentada em diversos tipos de tumores sólidos, tais como cancro da mama [7], próstata [8], o melanoma [9] e glioblastomas [10]. Em contraste, os níveis mais baixos de expressão SPARC foram encontrados em outros tipos de cancros, tais como do ovário [11], colorrectal [12], pancreático [13, 14] e leucemia mielóide aguda [15]. Estas observações sugerem que efeito carcinogênico de SPARC é tipo específico de célula e pode ser dependente da célula tumoral ambiente circundante.
O conhecimento sobre as funções SPARC em células de câncer gástrico ainda é escassa. A sobre-expressão do gene da SPARC foi observada no cancro gástrico humano em cinco outros relatórios [16-20]. No entanto, todos os estudos acima mencionados teve nenhum detalhe em linhas celulares de cancro gástrico e mecanismo carcinogénico. SPARC tem sido associada com as fases de cancro gástrico agressivos e correlaciona-se com prognóstico pobre [16], o que sugere que a redução da expressão SPARC pode ter benefício terapêutico. Com efeito, a expressão de oligonucleótidos anti-sentido contra SPARC em células de melanoma bloqueou a formação de tumor [21]. Os mecanismos biológicos e moleculares precisos por meio do qual uma redução na expressão SPARC pode contribuir para a terapia do tumor melhorada continuam a ser investigado. Portanto, o objetivo do presente estudo foi caracterizar funções SPARC em células cancerosas gástricas e explorar o seu mecanismo possivelmente carcinogênico.
Materiais e métodos
celular cultura
Humanos linhas celulares de cancro gástrico NCI-N87, SGC7901, MGC803 , BGC823, HGC27 foram obtidos do Instituto do Câncer da Academia chinesa de Ciências Médicas. Todas as células foram cultivadas em RPMI 1640 (GIBCO ™) meio suplementado com 10% de soro fetal bovino, penicilina G (100 unidades /ml) e estreptomicina (100 ug /ml) denominado meio completo. As células foram mantidas em cultura em monocamada a 37 ° C em ar humidificado com 5% de CO
2.
De produtos químicos e reagentes
EDTA-2 de sódio, laranja de acridina, brometo de etidio (EB) e 3- [4, 5-dimetiltiazol-2-il] -2,5-difenil tetrazoliumbromide (MTT) foram adquiridos a Sigma (St. Louis, MO, EUA). anticorpo monoclonal de ratinho específico para a p-actina foi de Sigma. anticorpo policlonal de coelho específico para a proteína Bcl-2 (SC-492), caspase-3 (sc-7148) e PARP (sc-7150) foram adquiridas a partir de Santa Cruz Biotechnology (Santa Cruz, CA, EUA). Os anticorpos monoclonais de ratinho específicos para SPARC (SC-74295) e Bax (sc-7480) foram obtidos da Santa Cruz Biotechnology. De cabra anti-coelho (w3960) e anti-rato (w3950) os anticorpos secundários foram adquiridos à Promega (Madison, WI, EUA).
RNAi e transfecção
humano SPARC siRNA e ARNsi de controlo eram de Dharmacon Bioscience Corp (Chicago , IL, EUA). Quantidades equimolares de ARNsi foram usadas de acordo com as instruções do fabricante com controlo não segmentação de siRNA (CTRL). 150 000 células foram plaqueadas por seis poços em DMEM com 10% de FBS e foram deixadas a ligar durante a noite. Quantidades equimolares de ARNsi foram incubadas com Transit-TKO Transfection Reagent de Mirus (Madison, WI, EUA) de acordo com as instruções do fabricante. As células foram mantidas durante 48 h antes de experiências, a não ser que de outro modo descrito
análise de Western blot
Vinte microgramas de proteínas totais foram separadas por SDS-PAGE e transferidas para uma membrana de PVDF. A membrana foi então incubada com anticorpos específicos para SPARC (Santa Cruz; 1: 500), ou anti-β-actina (Sigma; 1: 1000) durante a noite a 4 ° C. Os anticorpos ligados foram visualizados utilizando quimioluminescência aumentada. Para confirmar carga igual, as membranas foram retirados durante 30 minutos a 50 ° C em tampão contendo SDS a 2%, Tris 62,5 mM (pH 6,7), e mM de 2-mercaptoetanol 100 e sondado com um anticorpo anti-β actina para demonstrar o carregamento igual . A densidade das bandas foi quantificada por análise densitométrica utilizando o sistema ImageTool (versão 3.0).
RT-PCR O ARN total
(1-2? G) foi transcrito de forma inversa utilizando um estojo de pré-amplif icação SuperScript (Invitrogen, Carlsbad , CA). Iniciadores foram baseados em sequências relatadas em Genebank (NM 003118). sequência com sentido foi 5'-SPARC GTGGGCAAAGGGAAGTAACA-3 'e SPARC sequência anti-sentido 5'-GGGAGGGTGAAGAAAAGGAG-3'. O tamanho esperado do produto de ADNc foi SPARC 512bp. ß-actina de sequência com sentido foi 5'-GGCATCCTCACCCTGAAGTA-3 'e ß-actina sequência anti-sentido 5'-GTCAGG CAGCTCGTAGCTCT-3'. O tamanho esperado do produto de ADNc de beta-actina foi 514bp. A amplificação por PCR foi realizada em volumes de reacção de 25 uL contendo 0,2 ^ M de dNTPs, 20 pmol de cada iniciador oligonucleotídico, e 0.2U polimerase Taq em tampão de PCR. O ADNc foi amplificado num controlador térmico de PCR com uma desnaturação inicial a 95 ° C durante 5 min, seguido de ciclos de 95 ° C durante 1 min, 65 ° C durante 1 min, e 72 ° C durante 1 min, 27 ciclos, e um passo de extensão final de 72 ° C durante 10 min. A quantidade de a partir de ADNc foi ajustado usando intensidade β-actina.
Ensaio de migração celular
A capacidade das células para migrar através de filtros foi medida usando uma câmara de invasão de Matrigel BioCoat (BD Biosciences, San Jose, CA). A cultura de células com uma membrana insere PET de tamanho de poro de 8 um foram usadas de acordo com o protocolo do fabricante. A câmara inferior incluídos médio (0,75 ml) contendo FCS a 10%, ao passo que SPARC siARN transfectadas ou células de controlo transfectadas (1,0 × 10 5 suspensos em 0,5 ml de meio contendo 1% de FCS) foram semeadas para dentro da câmara superior e incubaram-se durante a noite a 37 ° C numa atmosfera humidificada contendo 5% de CO 2. Remaning células na superfície superior foi removido mecanicamente. As membranas foram então lavadas, fixadas e coradas por Diff-Quik (Medion Diagnostics). O número de células que migraram para a superfície inferior dos filtros foi determinado por contagem de células coradas sob um microscópio de luz em três campos independentes (0,25 mm 2 bem /).
Ensaio de crescimento celular e viabilidade in the efeito da SPARC SiRNA sobre a viabilidade das células foi determinado pelo ensaio de MTT. Resumidamente, MGC803 e HGC 27 células foram plaqueadas a 1 x 10 4 células por poço em placas de microtitulação de noventa e seis poços. Após incubação durante 72 h, foi determinada a viabilidade das células. Em seguida, 20 ul de MTT (10 mg /ml em PBS estoque, diluiu-se a concentração de 1 mg /ml com meio de trabalho) foi adicionado a cada poço e incubou-se durante 4 h. Após remoção cuidadosa do meio, 200 ul de sulfóxido de dimetilo foi adicionado a cada poço e agitou-se cuidadosamente. A absorvância foi gravado no leitor de microplacas (ELX 800; Bio-Tek Instruments, Inc. Winooski, VT, EUA) a um comprimento de onda de 570 nm. O efeito da SPARC siRNA na inibição do crescimento celular foi avaliada como percentagem da viabilidade celular em células tratados com veículo foram tomados como 100% viáveis.
Análise do ciclo celular e anexina V coloração
Para a análise do ciclo celular por citometria de fluxo, as células tratadas com siRNA foram coletadas, lavadas com PBS, fixadas em etanol frio a 70%, e armazenado a -20 ° C até à coloração. Após a fixação, as células foram lavadas com PBS e incubadas com 50 ug /mL com ARNase A (Sigma) durante 30 min a 37 ° C, antes da coloração com iodeto de propídio a 50 ug /mL (Sigma). As células apoptóticas em fases precoces e tardias foram detectados utilizando um V FITC Apoptosis Detection Kit de anexina BioVision (Mountain View, CA, EUA). Em resumo, as células foram transfectadas com ARNsi. Em 96 horas após a transfecção, o meio de cultura e as células foram recolhidas e centrifugadas. Após lavagem, as células foram ressuspensas em 490 ul de tampão de ligação da anexina V, seguindo-se a adição de 5 mL de iodeto de propidio de anexina V-FITC e 5 uL. As amostras foram incubadas no escuro durante 5 min à temperatura ambiente e analisadas por citometria de fluxo. Estatísticas
Os resultados foram expressos como a média dos níveis de expressão de (± DP). t de Student
-teste ou soma rank foram utilizados para análise estatística. Um valor de p < 0,05 foi tomado como nível de significância (frente e verso).
Resultados Expressão de SPARC em células cancerosas gástricas cultivadas
Nós primeiro avaliamos a expressão endógena de SPARC em várias linhas celulares de cancro gástrico humano. Descobrimos que a proteína SPARC e ARNm foram predominantes em células MGC803 e HGC27, foram produzidos em níveis baixos pela linha de células SGC7901 foram undectable em linhas celulares BGC823 (Figura 1) e NCI-N87. Figura 1 Expressão da SPARC em linhas celulares de cancro gástrico. A, A análise de imunotransferência utilizando um anticorpo policlonal de coelho SPARC (1: 500). B, reacção em cadeia de polimerase transcriptase reversa específica (RT-PCR) Análise para SPARC. p-actina foi utilizado como controlo de carga. C, os níveis relativos de expressão de ARNm SPARC. Autorradiografias foram digitalizados e analisados por densitometria seguido de quantificação relativa de p-actina. Os resultados são apresentados como a expressão (em%) em relação a p-actina e são médias (± DP) de 3 experiências.
Inibição da expressão endógena SPARC
Seguindo este rastreio inicial, MGC803 células e células que expressam HGC27 relativamente elevada endógeno SPARC foram estabelecidos knockdown SPARC expressar de forma transiente para determinar a importância da expressão endógena SPARC. Como mostrado na Figura 2A, a expressão SPARC foi inibida com transfectantes SPARC siRNA nos níveis de proteína. Estes resultados sugerem que estes SPARC siRNAs exercer um efeito de silenciamento com êxito para a expressão SPARC. Figura 2 Efeito da SPARC knockdown sobre a migração celular em linhas celulares de cancro gástrico MGC 803 e HGC 27 células. A. expressão SPARC em MGC e 803 HGC 27, controlo e células transfectadas SPARC de ARNip foi detectada por análise de imunotransferência utilizando um anticorpo policlonal de coelho SPARC (1: 500). p-actina foi utilizado como controlo de carga. B. Efeitos da SPARC knockdown sobre a migração celular em linhas celulares de cancro gástrico. expressão SPARC foi derrubado em MGC e 803 HGC 27 células usando SPARC siRNA e submetido a um ensaio de migração usando um aparelho de invasão de duas câmaras, como descrito em Materiais e Métodos, histograma que mostra a percentagem de inibição do MGC 803 e HGC 27 invasão celular. A experiência foi realizada em triplicado, e o valor obtido a partir de células transfectadas siRNA mexidos foi definido como 100%.
Regulação negativa da expressão SPARC inibida gástrica células cancerosas invasão in vitro Para determinar se
SPARC siRNA poderia reduzir os comportamentos associados com celulares protumorigenic expressão SPARC, determinou-se primeiro o efeito da diminuição da expressão SPARC em invasão de células tumorais. ensaio celular invasão foram então realizada usando as câmaras Transwell. Medimos a capacidade de células de cancro gástrico para invadir através de Matrigel, uma matriz extracelular artificial, após transfecção com um siRNA de controlo não segmentação ou SPARC siARN. Redução da expressão SPARC levou à inibição da invasão por 69% e 79% em MGC803 e HGC27, respectivamente (Figura 2B, C). Tomados em conjunto, estes resultados indicam claramente que a supressão da SPARC inibe a capacidade de migração e a invasão de células e MGC803 HGC27 células.
Regulação negativa da expressão SPARC inibe o crescimento de células de cancro gástrico in vitro
Nós investigamos se SPARC siARN pode diminuir o sobrevivência de células de cancro gástrico. MGC 803 e HGC 27 células de cancro gástrico transfectadas com ARNsi SPARC sobreviveram pelo decréscimo das taxas relativas de células combinadas transfectadas com um controlo não segmentação de siRNA (Figura 3A). Regulação negativa da expressão SPARC não induziu a paragem do ciclo celular em células de cancro gástrico. Foram examinados os efeitos da SPARC siRNA na progressão do ciclo celular. Silenciamento de SPARC em MGC803 e HGC27 células não se alterou G1 ou fase S populações às 72 h após transfecção com SPARC siRNA em comparação com o grupo controle negativo (Figura 3B). A Figura 3 Efeitos da SPARC knockdown no crescimento celular em linhas celulares de cancro gástrico. os dados metade esquerda representam dados obtidos a partir MGC 803 células e os corretos representam dados obtidos a partir de células HGC 27. crescimento A. basal foi determinada após 48 horas em meio completo pelo ensaio MTT. Os resultados são apresentados como média de crescimento (em%) da respectiva linha de células MGC 803 e HGC 27 e são meios (± SE) de determinações em quadruplicado de seis experiências separadas. Células de os grupos de controlo e de ARNip foram recolhidas para análise do ciclo celular por citometria. B. silenciamento de SPARC por siRNA transfecção não alterar a distribuição do ciclo celular em MGC 803 e HGC 27 células cancerosas gástricas. MGC 803 e HGC células 27 foram transfectadas com SPARC siRNA ou controle negativo siRNA. Às 72 horas pós-transfecção, o teor de ADN foi medido usando coloração com iodeto de propidio (PI) em citometria de fluxo.
Inibição da expressão SPARC intensifica a apoptose em células de cancro gástrico
Nós investigamos se SPARC siARN pode induzir a morte celular em cancro gástrico linhas de celular. O tratamento de células e MGC803 HGC27 com SPARC siARN aumento precoce células apoptóticas bem como células apoptóticas tardias, em comparação com o controlo negativo tratamento siRNA (Figura 4A) como medido pelo ensaio de Anexina V. Como esperado, a sobrevivência decresceu das células transfectadas com ARNsi SPARC foi associado com o aumento das taxas de apoptose por 91% em MGC803 e 92% em HGC27 células (Figura 4B). Estes achados sugerem que SPARC está envolvido em apoptose para manter a sobrevivência celular em algumas células de cancro gástrico. Figura 4 SPARC resultados knockdown na indução de apoptose em linhas celulares de cancro gástrico. Para a análise de citometria de fluxo, as células foram colhidas 96 h após a transfecção com SPARC siRNA controlo negativo ou ARNsi, depois coradas com anexina V-FITC e iodeto de propídio (PI). os dados metade esquerda representam dados obtidos a partir MGC 803 células e os corretos representam dados obtidos a partir de células HGC 27. As percentagens de anexina V /PI (precoce de apoptose) e anexina V /PI células (apoptose tardia) é mostrado em cada painel. Os valores a negrito indicam diminuição expressão SPARC aumento da apoptose em 65% em MGC803 e 92% em comparação com HGC27 siRNA controlo negativo.
Efeito apoptótico da SPARC siARN tratamento transfectado em células MGC 803 e HGC27
Num esforço para elucidar o foram avaliadas mecanismo da SPARC siARN apoptose induzida em células MGC 803 e HGC27 células, os níveis de expressão de proteínas apoptótica-regulação, tais como Bcl-2, Bax e caspase-3 e PARP. MGC 803 células e as células foram transfectadas com HGC27 SPARC siARN. Como mostrado na Figura 5, não houve diferenças significativas na expressão de Bax e Bcl-2 em células MGC 803 e células HGC27 em comparação com o grupo de controlo negativo (P < 0,05 e P < 0,01). Em resposta a estímulos apoptóticos, pro-caspase-3 é clivada em um fragmento de 20 kDa, e a reacção autocatalítica subsequente conduz à formação do fragmento de 17 kDa activa. Quando a caspase-3 é activado, a PARP é clivada. Assim, a clivagem de PARP é utilizado como um indicador da apoptose. A fim de obter provas directas que mostra a relação da ativação caspase e apoptose, pro-caspase-3 clivada e PARP foram examinados em células MGC 803 e células HGC27 após SPARC siRNA transfectadas. Como mostrado na Figura 5, SPARC SiRNA induziu a clivagem de 32 kDa pro-caspase-3 na sua forma activa de 17 kDa e a clivagem de PARP apareceu em MGC e 803 células HGC27 células. A Figura 5 A expressão de proteínas de apoptose em células MGC 803 e HGC27 após transfecção com controlo ou ARNsi SPARC. Os lisados celulares foram separados em gel de SDS-PAGE 10%, transferidos para membrana de nitrocelulose e sondados com anti-PARP, anti-caspase-3, anti-Bcl-2, e anti-Bax. O teor de proteína foram normalizados por sondagem da mesma membrana com anti-β-actina. . Os dados metade esquerda representam dados obtidos a partir de células MGC 803 e os direita representam os dados obtidos a partir de células HGC 27
Discussão
proteína secretada e rica em cisteína, SPARC (também conhecido como osteonectina; ou porão-membrana-40 , BM-40), é um membro de uma família de proteínas matricellular, cuja função é o de modular as interacções célula-matriz e a função das células sem participar no andaime estrutural da matriz extracelular. A sobre-expressão da SPARC tem sido documentada em diversos tipos de tumores sólidos, tais como cancro da mama [7], próstata [8], o melanoma [9] e glioblastomas [10]. Em contraste, os níveis mais baixos de expressão SPARC foram encontrados em outros tipos de cancros, tais como do ovário [11], colorrectal [12], pancreático [13, 14] e leucemia mielóide aguda [15]. Estas observações sugerem que efeito carcinogênico de SPARC é tipo específico de célula e pode ser dependente da célula tumoral ambiente circundante.
O conhecimento sobre as funções SPARC em células de câncer gástrico ainda é escassa. Alguns estudos de imuno-histoquímica [16-20, 22] coletivamente relatou um aumento da regulação do SPARC no câncer gástrico em comparação com a mucosa não-neoplásica. Wewer et ai. [17] descrita uma expressão diferencial da SPARC nos compartimentos epiteliais e estromais de seis amostras de cancro gástrico. Maeng [18] verificaram que SPARC é altamente expressa no estroma reactivo associada com adenocarcinomas diferenciados invasivos e que pode servir como um marcador de diagnóstico clínico útil para o cancro do estômago. Wang et al. [16] também encontraram uma diferencialmente expressos SPARC em pacientes com câncer gástrico, avaliada pela análise de arranjo de gene, RT-PCR quantitativo e imunocoloração, maior expressão SPARC foi significativamente associada com a progressão do tumor e os estágios avançados de câncer gástrico. Franke et al. [20] demonstraram em uma série maior de pacientes que SPARC é diferencialmente expresso em cancros gástricos e que a sua expressão está correlacionada com a progressão do tumor e propagação nodal utilizando micromatrizes de tecidos (TMA), o nível de expressão da SPARC, determinado por imuno-histoquímica, correlacionados no câncer gástrico do tipo intestinal com o crescimento local do tumor, propagação nodal, e estágio do tumor de acordo com o Internacional cancer Union Against. Zhao ZS et al. [19] descobriu que SPARC foi detectado em 334 de 436 casos de câncer gástrico humano e foi altamente expressa em 239 tumores. Em fases I, II e III, a taxa de sobrevida em 5 anos dos pacientes com uma alta expressão de SPARC foi significativamente menor do que os pacientes com baixa expressão. Além disso análise multivariada sugeriu que a regulação positiva de SPARC, MMP-2 e beta 1 integrina, foram indicadores prognósticos independentes para a doença.
Reunimos 49 tecidos de câncer gástrico e correspondentes tecidos normais através de procedimentos cirúrgicos (Jie Yin, Guowei Chen, Si Liu, Jianxun Zhao, Yucun Liu: Expressão de SPARC no cancro gástrico humano é associado com as características clínico-patológicas, submetido). A distribuição e expressão da SPARC foram observadas por imuno-histoquímica, a técnica Western Blot e RT-PCR, respectivamente. proteína SPARC e ARNm expresso significativamente mais elevado em tecidos de cancro gástrico em comparação com tecidos normais. Os graus de sua expressão foi associada com a diferenciação de tumor, divisão TNM, semeadura peritoneal e invasão vascular notavelmente. Pacientes com alta expressão de SPARC têm pior prognóstico do que aqueles com baixa expressão de SPARC.
Tomados em conjunto, maior expressão SPARC foi significativamente associada com a progressão do tumor e estágios avançados de câncer gástrico. Uma pesquisa recente da Inoue M et al [23], mesmo identificada SPARC como um antigénio alvo candidato para imunoterapia de vários cancros, incluindo o cancro gástrico por cDNA microarray do genoma. É emocionante que a terapia alvo a subunidade SPARC pode ser uma abordagem útil para suprimir o crescimento do câncer gástrico. No entanto, os mecanismos moleculares responsáveis para a oncogénese da SPARC no cancro gástrico não é totalmente compreendido. Através da análise de um painel de linhas celulares de cancro gástrico expressão, que mostrou que SPARC também é sobre-expresso em linhas celulares de cancro gástrico humano SEVEL. Portanto, testou-se que as nossas hipóteses SPARC pode ser uma molécula-chave na invasão de cancro gástrico, e que a segmentação SPARC pode apresentar uma nova estratégia terapêutica para o anti-invasão do cancro gástrico.
Difusão de células cancerosas, quer localmente ou, pelo metastática distante locais, exige que as células malignas adquirir a capacidade para invadir a membrana basal e a aderir a outras matrizes. Tem sido sugerido que SPARC pode desempenhar um papel chave durante os passos iniciais do processo de invasão tumoral e metástase [24]. Além disso, SPARC pode induzir a expressão de metaloproteinases ou enzimas que, subsequentemente, desempenham um papel importante na degradação das membranas basais e componentes da matriz extracelular [25]. SPARC foi associada com a invasão de meningiomas [26, 27] e [28] gliomas. Além disso, a supressão da expressão SPARC utilizando ARN anti-sentido inibiu a motilidade e invasão de células de cancro da mama humano in vitro [21]. Para determinar se
SPARC siARN pode reduzir comportamentos celulares protumorigenic associados com a expressão SPARC, determinou-se primeiro o efeito de diminuição da SPARC expressão na invasão de células tumorais. Medimos a capacidade de células de cancro gástrico para invadir através de Matrigel, uma matriz extracelular artificial, após transfecção com SPARC siRNA ou um controlo não segmentação de siRNA. Redução da expressão SPARC levou à inibição da invasão por 69% e 79% em MGC803 e HGC27, respectivamente. Assim, SPARC siRNA pode diminuir invasão câncer gástrico in vitro.
Um estudo recente descobriu que SPARC protege as células da apoptose induzida pelo stress in vitro através de uma interacção com a integrina heterodímeros b1 que aumentam a ativação de ILK e atividade prosurvival [28]. Estudos iniciais utilizando estratégias de ARN anti-sentido revogada completamente o crescimento de melanoma humano em ratinhos nus [21]. Horie et ai. [29] mostrou que a regulação negativa da expressão SPARC induzida a inibição do crescimento com L 1 prisão em células de melanoma humano. Tem sido relatado que SPARC promove a sobrevivência de células de glioma através da activação de Akt através de sinalização de integrina sob condições isentas de soro [30]. Estes relatórios sugerem fortemente que SPARC desempenha um papel como um factor anti-stress.
Por outro lado, alguns artigos descobriram que SPARC pode promover a apoptose em células cancerosas. Yao e colegas [11] mostrou que o tratamento exógeno de várias linhas de células de cancro do ovário com apoptose induzida SPARC. Said e Motamed [31] descobriram que a exposição SPARC aumentou caspase 3 em células de carcinoma de ovário humano que apoiaram o ex observação. Pancreático [13] e cancro do ovário [30] exibiu um maior crescimento e apoptose reduzida quando implantado em SPARC - /-. Em linhas celulares de cancro colorrectal, a superexpressão da SPARC reduziu a viabilidade das células e reforçada a apoptose em células expostas a diversos agentes quimioterapêuticos [32].
Estas observações aparentemente paradoxais dentro de cada tipo de cancro, e de diferentes tipos de cancro podem ser explicados pelo conhecimento de Tai da SPARC Biology [33]: fragmentos peptídicos mais pequenos da SPARC que representam diferentes domínios da SPARC conferem actividades biológicas que, por vezes, se opõem aos de outros fragmentos ou a proteína nativa SPARC. Uma vez que o perfil da protease do microambiente do tumor pode ser diferente em diferentes tipos de cancros, e como SPARC é conhecido por sofrer proteólise por metaloproteinases da matriz [34], estas diferenças, em combinação com as mudanças na composição local das moléculas da matriz e citocinas, que todos estar a contribuir para o comportamento complexo da SPARC em diferentes tipos de cancro.
para elucidar os efeitos da SPARC siARN sobre o crescimento de células de cancro gástrico, ensaio de proliferação MTT foi realizado para comparar a proliferação entre SPARC ARNsi de controlo transfectadas e transfectadas MGC803 e 27 HGC células. MGC803 e HGC27 células gástricas cancerosas transfectadas com ARNsi SPARC sobreviveram pelo decréscimo das taxas relativas de células combinadas transfectadas com um controlo não segmentação de siRNA (Figura 3). A sobrevivência diminuída das células transfectadas com ARNsi SPARC foi associado com o aumento das taxas de apoptose tal como medido pelo ensaio de Anexina V. Diminuindo expressão SPARC apoptose aumentada por 91% em MGC803 e 92% em HGC27 (Figura 4B).
Caspases activas desempenham um importante papel na indução de apoptose. Quando a caspase-3 foi activada, a PARP é clivada mais tarde. Normalmente, a clivagem de PARP foi utilizada como um indicador da apoptose. No presente estudo, encontramos SPARC siRNA activado caspase-3 para produzir fragmentos caspase-3 (p17) na MGC 803 células e HGC 27 às 48 h. Ao mesmo tempo, foi também detectada a clivagem de PARP. Os resultados indicam que SPARC induzida fragmentação de PARP, bem como o aumento da actividade da caspase-3 em células MGC 803.
A família de proteínas Bcl-2 foram relatados para regular a apoptose, controlando a permeabilidade da membrana mitocondrial. SPARC-se regulou a expressão de Bax e regulada negativamente a expressão de Bcl-2 em células MGC 803 e células HGC 27. Descobrimos que SPARC siARN pode induzir a apoptose de células de cancro gástrico e, simultaneamente, reduzir a proporção de Bcl-2 a Bax. Portanto, a regulação da expressão de Bcl-2 e Bax pode ser um mecanismo fundamental subjacente a indução SPARC de apoptose em células de cancro gástrico.
Assim, os nossos dados indicam que a regulação negativa da SPARC inibiu a proliferação celular de células de cancro gástrico pela iniciação de apoptose, que consciência com melanoma e glioma, mas ao contrário do câncer de ovário e de pâncreas. A indução de apoptose foi parcialmente regulado a via mitocondrial, tais como via de activação de caspase, bem como a clivagem de PARP. o estudo futuro precisa de se concentrar sobre o mecanismo exato.
Em conclusão, nossos dados atuais sugerem que SPARC desempenharam papéis importantes na apoptose e metástase de câncer gástrico. No momento, não há abordagens eficazes para a cura do câncer gástrico fase tardia. Como expressão de SPARC elevada está associada à diminuição câncer de sobrevida do paciente gástrica [16], acreditamos que nossos resultados, demonstrando diminuição da invasão e aumento da morte celular com siRNA dirigido contra SPARC, sugerem que a diminuição da expressão de SPARC pode ter benefício terapêutico para pacientes com câncer gástrico.
Declarações
Agradecimentos
Este trabalho foi apoiado pelo Comité Científico Tecnológico Apoio Fundo Nacional do Projeto [30901417]. Agradecemos ao professor Yang Ke e Xiaojuan Du do Centro de Ciências da Saúde da Universidade de Pequim, Pequim, China, para suporte técnico.
Autores 'original apresentada arquivos para imagens
Abaixo estão os links para os autores' arquivos originais apresentados para imagens. 'arquivo original para a figura 1 13046_2010_306_MOESM2_ESM.jpeg Autores' 13046_2010_306_MOESM1_ESM.jpeg Autores arquivo original para a figura 2 13046_2010_306_MOESM3_ESM.jpeg Autores 'arquivo original para a figura 3 13046_2010_306_MOESM4_ESM.jpeg Autores' arquivo original para o arquivo original figura 4 13046_2010_306_MOESM5_ESM.jpeg dos autores para a figura 5 interesses concorrentes
Os autores declaram que não têm interesses conflitantes.
 Dica de saúde:prevenindo uma hérnia
Dica de saúde:prevenindo uma hérnia
 Específicos amigos da dieta de carboidratos em destaque:Susan “A garota SCD”
Específicos amigos da dieta de carboidratos em destaque:Susan “A garota SCD”
 É seguro alimentar animais de estimação com comida crua,
É seguro alimentar animais de estimação com comida crua,
 6 razões pelas quais as resoluções de ano novo falham
6 razões pelas quais as resoluções de ano novo falham
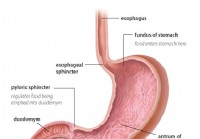 Gastroparesia diabética
Gastroparesia diabética
 7 sinais de que você pode ter supercrescimento bacteriano SIBO no intestino delgado (e o que fazer a respeito)
7 sinais de que você pode ter supercrescimento bacteriano SIBO no intestino delgado (e o que fazer a respeito)
 O que é bom comer e beber quando você tem diarreia?
A diarreia ou fezes aquosas soltas podem ser causadas por gripe estomacal, intoxicação alimentar, radiação, quimioterapia, outros medicamentos e infecções. Pessoas com diarreia devem comer pequenas re
O que é bom comer e beber quando você tem diarreia?
A diarreia ou fezes aquosas soltas podem ser causadas por gripe estomacal, intoxicação alimentar, radiação, quimioterapia, outros medicamentos e infecções. Pessoas com diarreia devem comer pequenas re
 A cesariana é boa para a saúde infantil?
Um estudo recente publicado pelo VATT Institute for Economic Research sugere que um CS não planejado realizado para uma indicação que talvez pudesse ter sido evitada, só tem uma relação de causa-efeit
A cesariana é boa para a saúde infantil?
Um estudo recente publicado pelo VATT Institute for Economic Research sugere que um CS não planejado realizado para uma indicação que talvez pudesse ter sido evitada, só tem uma relação de causa-efeit
 L-Glutamina:7 prós e contras para pessoas com intestino preso e autoimunidade
“Ewwww, isso significa que meu cocô está vazando no meu corpo?” Apenas aqueles que lidam com problemas intestinais crônicos podem apreciar perguntas como essa. Mas, na verdade, é uma pergunta que
L-Glutamina:7 prós e contras para pessoas com intestino preso e autoimunidade
“Ewwww, isso significa que meu cocô está vazando no meu corpo?” Apenas aqueles que lidam com problemas intestinais crônicos podem apreciar perguntas como essa. Mas, na verdade, é uma pergunta que