Хост вторжения клеток и полости рта инфекции, вызванной Trypanosoma Тгурапозота
штаммов генетических групп TCI и TcIV из chagasic больных
Аннотация
Справочная информация
вспышкам острого заболевания Шагаса оральным инфекции было зарегистрировано часто в течение последних десяти лет , с более высоким уровнем в северной части Южной Америки, где Trypanosoma Тгурапозота
родословная TCI преобладает, будучи ответственным за основной причиной возрождающейся болезни человека, и небольшой процент идентифицируется как TcIV. Механизмы оральной инфекции и инвазии клеток хозяина этими паразитами плохо изучены. Для решения этого вопроса, мы проанализировали T. Тгурапозота
штаммов, выделенных из chagasic пациентов в Венесуэле, Гватемале и Бразилии.
Методы
Trypanosoma Тгурапозота
метациклическая trypomastigotes перорально инокулировали в мышей. Желудок мыши собирали спустя четыре дня, а также желудок и сердце собирали через 30 дней после заражения, были обработаны для гистологического анализа. Анализы, чтобы имитировать паразита миграции через желудочную слизистого слоя проводили путем подсчета паразитов, которые пересекали желудка муцина покрытием Transwell фильтры. Для вторжения клеток анализы, человеческие эпителиальные клетки HeLa, инкубировали с метациклических формами и количество усвоенных паразитов подсчитывали.
Результаты
Все TCI и TcIV T. Тгурапозота
штаммов были слабо заразным оральным путем. Паразиты были либо незаметного или были обнаружены в небольшом количестве в желудке мыши четыре дня после перорального введения. Репликация паразиты были обнаружены в желудке и /или в сердце 30 дней после заражения. По сравнению с TCI линии, миграция способность TcIV паразитов через желудочный муцин фильтр с покрытием была выше, но ниже, чем, обнаруживаемым TcVI метациклических форм, которые ранее показали высокую инфекционный оральным путем. Выражение пепсина устойчивостью gp90, молекулы поверхности, которая подавляет инвазию клеток, был выше в TCI, чем в TcIV паразитов и, соответственно, вторжение мощность метациклических форм TcIV была выше. Gp90 молекулы спонтанно обнародованные метациклических формами TCI ингибирует запись паразита в клетки-хозяева. TCI паразиты выставлялись низкую скорость репликации внутриклеточной.
Выводы
Наши данные показывают, что слабый потенциал TCI линии, и в меньшей степени TcIV паразитов, при вторжении желудка эпителий после перорального инфекции мышей могут быть связаны с неэффективностью из метациклических форм, в частности TCI паразитов, мигрировать через желудочную слизистого слоя, вторгнуться в эпителиальные клетки-мишени и реплицировать внутриклеточно.
Ключевые слова
Trypanosoma Тгурапозота
TCI и TcIV родословные Метациклические trypomastigotes Оральный инфекция клетка-хозяин вторжение фона
исход инфекции Trypanosoma Тгурапозота
, агент болезни Шагаса, может сильно варьироваться: 20-30% хронически инфицированных пациентов развивается тяжелая миокардит, изменения желудочно-кишечного тракта (megaesophagus и /или мегаколон) встречаются реже, в то время как большинство остается бессимптомным в течение жизни. Генетический фон и иммунологический статус хозяина, а также гетерогенность популяции паразита может способствовать этому разнообразию [1] и, возможно, пути заражения и инфекционной дозы. Согласно внутривидовой номенклатуре, установленной в 2009 году Т. Тгурапозота
штаммов подразделяются на шесть дискретных единиц, набрав (DTUs), TCI-TcVI [2]. В странах Северной Южной Америки и в регионе Амазонки, где megaesophagus и мегаколон являются редкими и chagasic кардиомиопатия является обычным делом, TCI является преобладающим агентом болезни Шагаса, в отличие от TCII, который изолирован от большинства пациентов в бразильском центральной восточного региона где Т. Тгурапозота
инфекции обычно ассоциируется с мега синдромов [1, 3]. TCI было указано в качестве основной причины возрождающейся болезни человека в северной части Южной Америки, на основе генотипирования для мелкомасштабной разрешения географического распределения, используя большую панель полиморфных микросателлитных маркеров [4]. В последние годы вспышки острых заболеваний Шагаса оральной инфекции были зарегистрированы в Венесуэле [5, 6], Колумбия [7, 8] и в бразильской Амазонии [9, 10], где TCI преобладает и малый процент был идентифицированные как TcIV.
Метациклические trypomastigotes участвуют в указанных выше упомянутых случаев устного Т. Тгурапозота
инфекции. На основании наличия амастигота гнезд в пределах участков слизистой оболочки желудка, но никаких доказательств Т. Тгурапозота
вторжения в ротоглотки или пищеводе животных бросили вызов устно с насекомыми происхождения метациклических форм, вторжение желудочного эпителия слизистой оболочки было предложено, чтобы быть уникальный портал входа для системного T. Тгурапозота
инфекции [11]. Эксперименты с TCII и TcVI штаммов из chagasic пациентов показали, что метациклическая стадиеспецифический поверхностные молекулы gp82 и gp90, которые выступают в качестве промотора и ингибитора инвазии клеток-мишеней, соответственно [12, 13], играют центральную роль в устной инфекции [14, 15]. Gp82, которое селективно связывается с желудочной муцина [16] высоко консервативен между генетически расходящегося Т. Тгурапозота
родословных [17] и устойчив к перевариванию пепсином при кислом рН, тогда как gp90 изоформы с дифференциальной чувствительностью к пептической переваривания может быть выражено в различных штаммов, так что высокая или низкая инфекционность при оральном связано с экспрессией пепсина-восприимчивыми или пепсин устойчивостью gp90 изоформы [14, 15]. Является ли такое разнообразие в gp90 экспрессии и перорального инфекционности также находится в TCI и TcIV DTUs остается предстоит исследовать. Там нет информации об экспериментальном оральном заражении этими паразитами, имеющиеся данные относятся к мышам, которым вводили trypomastigotes крови или метациклических форм внутрибрюшинно [18], который является неестественным путем передачи инфекции. Здесь мы проанализировали метациклические trypomastigotes штаммов TCI и TcIV, выделенных из chagasic пациентов в различных географических регионах, в отношении gp82 и gp90 выражение, способность мигрировать через желудочный муцин слой и вторгнуться слизистой оболочки желудка эпителия при пероральном введении в организм мышей. Для выяснения механизмов паразита вторжения, в пробирке
вторжения клеток анализы проводили, используя эпителиальные клетки человека. Поскольку поверхностные антигены спонтанно пролил из тканевой культуры, полученных trypomastigotes [19] Сообщалось, что играть роль в Т. Тгурапозота
инфекции [20], мы исследовали, могут ли поверхностные молекулы были выпущены метациклических форм и под влиянием вторжения хозяина клетки.
Методы
Паразиты и инвазию клеток хозяина анализ
Trypanosoma Тгурапозота
штаммы из трипаносоматиды коллекции культур (ТСС), факультет паразитологии, Universidade-де-Сан-Паулу, были любезно предоставлены доктором Мартой MG Тейшейра. Они были изолированы от chagasic пациентов в различных географических регионах: TCC: 28 (Amazon, Бразилия), TCC: 515 (Венесуэла), TCC: 588 (Гватемала), TCC: 1522 (Параиба, Бразилия), TCC: 1434 (Амапа, Бразилия ). Штаммы 28, 515, 588 и 1522 были TCI и штамм 1434, изолированный от лица, инфицированного оральным путем, был TcIV. В качестве контроля, CL штамм (TcVI) был использован в нескольких экспериментах. Паразиты поддерживали циклически у мышей и в печени настой триптоза среды. Для стимуляции дифференцировки, паразиты выращивали за один проход в TC100 (Vitrocell, Бразилия) или среда Грейс (Invitrogen) и Метациклические формы очищают путем пропускания через колонку ДЭАЭ-целлюлозы, как описано [21]. HeLa клетки, карцинома полученные эпителиальные клетки человека, выращивали при 37 ° С в минимальной основной среде Дульбекко (DMEM), дополненной 10% телячьей эмбриональной сыворотки (FCS), стрептомицин (100 мкг /мл) и пенициллин (100 ед /мл) в увлажненной 5% CO <югу> 2 атмосферы. Инвазии клеток анализы проводили, как подробно описано в [22], с помощью затравки очищенного метациклические trypomastigotes в каждую лунку 24-луночных планшетах, содержащих 13-мм Диаметр круглых покровные стекла, покрытого 1,4 × 10
5 клеток HeLa, либо в среде DMEM с 10 % FCS (D10) или в PBS ++ (PBS, содержащий на литр: 140 мг CaCl <суб> 2, 400 мг KCl, 100 мг MgCl <суб> 2.6h <суб> 2O, 100 мг MgSO <суб> 4.7H <суб> 2O, 350 мг NaHCO <югу> 3). После 1 ч инкубации с паразитами, дублирующие друг друга покровные фиксировали в растворе Bouin, окрашивали Гимза, и последовательно обезвожены в ацетоне, градуированных серии ацетон: Ксилол (9: 1, 7: 3, 3: 7) и ксилолы. Число внутриклеточных паразитов было подсчитано в общей сложности 250 клеток.
Оральной инфекцией
, были использованы пять-шесть недельных самок BALB /с мышей, выведенных в виварии в Федеральной де Universidade Сан-Паулу. Все процедуры и эксперименты соответствовали с регулированием институциональной Этического комитета для экспериментов на животных, и исследование было одобрено Комитетом (протокол № 0234/12) путем. Мыши были заражены T. Тгурапозота
метациклических формы при пероральном приеме (5 × 10 7 паразитов в 0,1 мл PBS на одно животное), используя 1 мл шприц с иглой зондового, которая была вставлена в рот животного. Для обнаружения паразитов в желудочном эпителии слизистой оболочки, желудок мышей, привитых в устной форме с метациклических формами было собрано 4 дня после инфицирования, фиксировали 10% нейтральным формальдегида в течение 24 ч. После обработки постепенного обезвоживания в серии градуированных раствора этанола с последующим погружением в воду в ксилоле и встраивание в парафин, серийные срезы толщиной 5 мкм тканей разрезают и окрашивают гематоксилином и эозином. В другой серии экспериментов, Метациклические формы давали перорально мышам (1 × 10 6 паразитов в 0,1 мл PBS на одно животное) и, начиная с 10-й день после инокуляции, паразитемия контролировалась два раза в неделю путем анализа 5 мкл пробы крови собранный из хвоста, на фазово-контрастного микроскопа. На 30 день после инфекции, желудок, сердце и печень были собраны и обработаны для гистологических препаратов, как описано выше.
Анализ миграции паразита через желудочный муцин слой
поликарбонатные фильтры Transwell (3 мкм поры, диаметр 6,5 мм , Costar) покрывали 50 мкл препарата, содержащего 10 мг /мл желудочного муцина в воде. Метациклические формы, взвешенные в 600 мкл PBS, добавляли в нижней части 24-луночные планшеты (1 × 10 7 паразитов /лунку), муцина покрытием фильтры Transwell помещали на паразита, содержащие лунки и 100 мкл PBS, были добавлен в камеру фильтра. Через 30 мин и /или 1 ч инкубации при температуре 37 ° С, 10 мкл пробы были собраны из камеры фильтра для подсчета паразитов.
Проточной цитометрии и непрямой иммунофлюоресценции анализы
Прямой эфир метациклические trypomastigotes (1 × 10 7 ) инкубировали на льду в течение 1 ч с моноклональными антителами 3 F6 или 1G7, направленной соответственно к метациклического стадиеспецифический поверхностной молекулы gp82 или gp90. После этого паразиты фиксировали 4% параформальдегида в течение 20 мин. После промывок в PBS, паразиты инкубировали с Alexa Fluor 488-конъюгированных анти-IgG в течение 1 ч при комнатной температуре, а количество флуоресцентных паразитов оценивали с BD AccuriTM C6 проточный цитометр. паразиты управления инкубировали с только вторичным антителом. Для визуализации лизосомы HeLa клеток, покровные с адгезивные клетки инкубировали в течение 1 ч при 37 ° С в D10 или в PBS ++ или инкубировали с паразитами в D10 в течение 1 ч. После фиксации 4% р-формальдегидом в PBS в течение 30 мин, клетки обрабатывали 50 мМ NH <суб> 4Cl в PBS в течение 30 мин и промывали в PBS. Затем клетки инкубировали в течение 1 ч при комнатной температуре с мышиным анти-человеческим LAMP2 разведенной 1: 8 (об /об) в растворе PBS, содержащем 0,15% желатина, 0,1% азида натрия и 1% сапонина (ПГН-сапонин). После промывок в PBS, покровные инкубировали в течение 1 ч с Alexa Fluor 568-конъюгированные антитела против мышиного IgG (Invitrogen), разведенной 1: 300 в ПГН-сапонин, содержащий 500 нг /мл фаллоидином-FITC и 10 мкг /м DAPI (4 ', 6'-1-диамино-2-фенилиндол дигидрохлорид) с последующим промывок в PBS и последующего монтажа покровные в продлевают Gold (Invitrogen). Конфокальные изображения были получены в Leica TCS SP8 лазерного сканирующего микроскопа (Leica, Германия) с использованием масла погружения Plan-Apochromat 63x цели (числовая апертура 1.4). были обработаны и проанализированы серии изображений, полученных из конфокальной Z-стеки с помощью Leica LAS AF (Leica, 2012, Германия) и программное обеспечение (Imaris) битовой плоскости.
Подготовка паразита среды
метациклических форм условной (10 8) инкубировали при 37 ° с в течение 1 ч в 100 мкл полной D10 среда, питательное вещество лишенной PBS, ++ или PBS. После центрифугирования осадок отбрасывали и собирали надосадочную жидкость (кондиционированная среда). Для использования в инвазии клеток анализы кондиционированную среду разводили 1: 100 в PBS, D10 или ++ и Вестерн-блот-10 мкл загружали
Получение и очистка рекомбинантного белка gp82
рекомбинантного белка, содержащего его. полнометражный Т. Тгурапозота
gp82 последовательности (GenBank базы данных TM, инвентарный номер L14824) в рамке с глутатиона S-трансферазы (GST), был произведен в E.coli
DH5-альфа и очищали, как подробно изложены в другом [23].
Статистический анализ
теста Стьюдента т
, как это реализовано в программном обеспечении GraphPad (версия 6.01), была использована.
Результаты Оральный инфекция мышей с Т. Тгурапозота
Метациклические формы
способность TCI паразитов инфицировать мышей при пероральном приеме была исследована в ряде экспериментов. Сорок мышей были разделены на 8 групп по пять животных. В одной серии экспериментов, направленных на проверку вторжения желудочного эпителия метациклических trypomastigotes, были использованы 4 группы и каждая группа из пяти мышей получала различное напряжение паразита (5 × 10 7 паразиты на животное). Через четыре дня после перорального введения, желудок мышей собирали и обрабатывали для гистологических препаратов. Большое число паразитов было использовано в данном случае, поскольку в предыдущих исследованиях с штамма TCI G, от дикого цикла передачи, мы обнаружили, что даже с высокой инокулята очень мало амастигота гнезд, которые соответствуют intracellulary реплицирующиеся amastigotes, были обнаружены на 4 день сообщение оральная инфекция. Несмотря на большое посевного материала, мы не смогли обнаружить амастигота гнёзда с помощью микроскопического анализа гистологических срезах желудка (таблица 1). Другой набор экспериментов проводили, чтобы определить, есть ли разница в ткани тропизм между Т. Тгурапозота
штаммов. Для этой цели были использованы оставшиеся 4 группы, и каждая группа из пяти мышей получили другого штамма паразита (1 × 10 6 паразиты на животное) и течение инфекции проводили в течение 30 дней. Начиная с 10-й день, уровни паразитемии контролировали два раза в неделю, и на 30-й день желудок, сердце и печень были собраны для гистологического анализа. В этом случае, прививочный материал был меньше, так как мы полагали, что, после того, как несколько раундов вторжения клеток и внутриклеточной репликации, амастигота гнездах можно будет обнаружить. Паразитемии не обнаруживалась в течение всего периода наблюдения, но инфекция была подтверждена во всех группах путем обнаружения амастигота гнезд в желудке и /или в сердце мышей (таблица 1), но не в печени. Следует отметить, что в желудке мышей, зараженных штаммом 1522, которая производном от хронического chagasic пациента с терминальной сердечной недостаточностью [24], паразиты были обнаружены в сердце, но не в желудке, тогда как противоположный приложенного к заражению штаммом 28 (таблица 1). Амастигота гнездах присутствовали при большом количестве в желудке некоторых мышей, зараженных штаммом 28 или 588 (таблица 1), по-видимому в результате нескольких раундов вторжения и внутриклеточной репликации в эпителии желудка. Тот факт, что паразиты не были обнаружены в желудке мыши в 4 день после перорального приема, но только в более поздний момент времени, после того, как внутриклеточные циклов репликации, предложил либо неэффективную миграцию метациклических форм через слой слизи, неэффективное инвазии мишеней эпителиальных клеток и /или внутриклеточным паразитом размножения. В дополнение к штаммов TCI, мы исследовали один штамм TcIV, 1434, полученный из устно инфицированного пациента. Амастигота гнездах, в небольших количествах, были обнаружены у 3 мышей на 4-й день после заражения в гистологических срезах желудка, но паразиты не были обнаружены в желудке или в сердце через 30 дней после заражения (таблица 1). Паразитемия был отрицательным на протяжении всего 30-дневного инфекции. Положительная гемокультуры подтвердили инфекцию всеми штаммами. Гистологические препараты также исследовали на наличие воспалительных процессов. Вне зависимости от штамма паразита, воспалительные очаги были едва обнаружим в желудке на 4-й день или 30 после инфицирования, или в сердце в день 30.Table 1 Oral инфекции мышей с метациклических формами Т. Тгурапозота
strainsa <бр> Т. Тгурапозота
штамм
(происхождения)
Mouse
амастигота гнездах (количество срезов ткани)
Желудок (4-й день)
Желудок (День 30)
Сердце (День 30)
28
(Бразилия Amazon)
1 0 (20)
0 (20)
0 (20) страница 2 0 (20) 60
(20)
0 (21) страница 3 0 (20)
285 (20)
0 (20) 4
0 (20)
11 (18)
0 (23) страница 5 0 (20)
Ndb
0 (20) 515
(Венесуэла)
1 0 (21)
0 (24)
0 (20) страница 2 0 (19)
0 (13)
0 (25) страница 3 0 (20)
0 (21)
0 (23) 4
0 (20)
45 (11)
0 (21) страница 5 0 (20)
5 (21)
0 (24) 588
(Гватемала)
1
0 (09)
31 (19) 10
(21) страница 2 0 (12)
17 (18)
0 (20)
3
0 (09)
6 (20)
3 (15) 4
0 (12)
87 (19)
0 (19)
5
0 (16)
990 (20)
0 (16)
1522
(Бразилия северо-восток)
1 0 (16)
0 (17)
0 (20) страница 2 0 (19)
0 (15)
4 (20) страница 3 0 (20) 0
(17)
0 (20) 4
0 (21)
0 (20)
6 (20) страница 5 0 (21) 0
(16)
4 (18) 1434
(Бразилия Amazon)
1
5 (40)
0 (18)
0 (20)
2
3 (40)
0 (24)
0 (20) страница 3 0 (36)
0 (20)
0 (20)
4
0 (35)
0 (20)
0 (21) страница 5 из 5 (40)
0 (20)
0 (21)
aMetacyclic формы указанного паразита штаммов давали перорально мышам. В одном эксперименте мышам вводили 5 × 107 паразитов и через 4 дня желудок была собрана для гистологических препаратов. В другом эксперименте, получали 1 × 106 паразитов и 30 дней спустя, желудок и сердце были собраны для гистологических препаратов
б ND не
определяется
миграции Т. Тгурапозота
метациклических форм через мышей желудочный муцин слой
анализе для имитации транслокацию паразита через слой слизи в желудке проводили с использованием Transwell фильтров, покрытых желудочный муцин, который является основным компонентом макромолекулярная слизи. Предыдущие исследования показали, что TcVI Метациклические формы, которые эффективно вторгаются желудочный эпителий при пероральном введении в организм мышей, пройти через желудочный муцин покрытием Transwell фильтр так эффективно, как пустой фильтр, и это свойство связано с экспрессией пепсина устойчивостью G82 молекулы, которые селективно связывается с желудочной муцина [16, 25]. Желудочный муцинобразующие покрытием Transwell фильтры были помещены поверх лунок, содержащих метациклические формы. После того, как 30 и 60 мин инкубации при 37 ° С, подсчитывали число паразитов, которые достигли верхней камеры. TCI паразиты отображаются в уменьшенном способность мигрировать через желудочный муцин слоя, по сравнению с штаммом CL (TcVI), который служил в качестве контроля (рис. 1а), подтверждая, что желудочный муцин выступал в качестве барьера для миграции. Метациклические формы TcIV штамма 1434 пересекал желудка фильтров муцинобразующие покрытием более эффективно, чем TCI паразитов, но все же при более низких скоростях, чем штамм CL (рис. 1а). Мы исследовали экспрессию gp82 и его устойчивость к пепсина в штаммов TCI и TcIV. Метациклические формы обрабатывали в течение 1 ч при 2 мг /мл пепсина в цитратном растворе при рН 3,5, условие, которое широко деградирует БСА (рис. 1, б), и моющее средство, растворимые экстракты анализировали с помощью Вестерн-блоттинга, наряду с необработанными паразитами, с использованием моноклональных антитело (МАБ) 3 F6 направлены на gp82. Перед реакцией с МАБ 3 F6, равная загрузка образцов паразитов проверяли с помощью Понсо-S окрашивания (дополнительный файл 1: Рисунок S1A). Выражение gp82, который сохранился нетронутым после обработки пепсином, была одинаковой во всех штаммах, по-видимому, при несколько более высоких уровнях напряжения, чем в 1434 штаммов TCI (рис. 1b). Как это может объяснить более высокую миграционную способность штамма 1434, мы сравнили gp82 экспрессию этого штамма к тому из штамма CL, который эффективно пересекали желудка муцина покрытием фильтра (рис. 1а). Gp82 экспрессия была сравнима в 1434 и CL штаммов (дополнительный файл 1: Рисунок S1B верхняя панель). Присутствие gp82 молекул на поверхности паразита была подтверждена с помощью проточной цитометрии (рис. 1в). Для дальнейшего изучения штамма 1434, экспрессировали ли более высокие уровни gp82, чем штаммы TCI, Вестерн-блот анализ был повторен с использованием штамма 515 в качестве представителя TCI линии. MT образцы двух штаммов, полученных в тот же день и электрофорезу в том же самом геле SDS-PAGE, показали аналогичный профиль (дополнительный файл 1: Рисунок S1c). Из всех этих данных и дополнительного анализа FACS двух штаммов, показывая несколько выше gp82 уровней в штамме 1434 (Дополнительный файл 1: Рисунок S1D), не представляется возможным сделать вывод о том, что относительная эффективность штамма 1434 метациклических форм миграции через желудочную муцин слой связан с дифференциальной экспрессии gp82. Как Т. Тгурапозота
известно спонтанно высвобождают молекулы поверхности [19, 20, 26], паразитами пролил молекулы могут быть также ответственны за наблюдаемые эффекты. Мы проверили, была ли пролил в среду gp82 в течение 1 ч инкубации в PBS, состояния, используемого в желудочном муцина анализа миграции. Вестерн-блот-анализ супернатанта после удаления паразита, полученного, как описано в разделе Методы, показали, что штаммы 515 и 1434 пролил значительные количества gp82, в отличие от штамма CL, выпустившей gp82 на едва заметных уровней, в то время как gp90 было пролито на высоких уровнях штаммом 515 и при очень низких уровнях штаммов 1434 и CL (рис. 1d). Если молекулы дифференцированно выпущенные штаммы 515, 1434 и CL на самом деле мешают миграции паразита через желудочную муцина пальто, что бы объяснить высокую и низкую эффективность штаммов CL и 515, соответственно, а также промежуточную способность показаннных штаммом 1434 (рис. 1а). Эксперимент, чтобы продемонстрировать влияние выпущенной gp90 на штамм 515 миграции осуществляли путем размещения желудочного муцина покрытием Transwell фильтры поверх лунок, содержащих метациклические формы в одиночку, или в смеси с анти-gp90 монАТ 5E7, что не признает живых паразитов или смешаны с несвязанными моноклональное антитело 2С2 направлено на Т. Тгурапозота
амастигота молекулы [27]. После того, как 30 и 60 мин инкубации, были взяты образцы из камеры фильтра для подсчета паразита. Паразиты смешивают с анти-gp90 монАТ 5E7, но не те, смешивается с неродственной мАт 2C2, проходится желудочный муцин пальто в большем количестве, чем контроль паразитов (рис. 1д), указывая, что пролил gp90 препятствует миграции паразитов через неизвестный механизм, который не включает связывание, при условии, что gp90 не связывается с желудочной муцина [28]. Вмешательство gp82, которые не могли быть продемонстрирована, так как анти-gp82 мАт 3 F6 связывается жить паразиты, было бы понятно, так как он связывается с желудочной муцина. Мы также исследовали ли gp90 и gp82 были дифференцированно выпущен в нейтральном и кислом рН. Кондиционированную среду получают из метациклических форм штамма 515 в PBS, инкубированной, рН 7,2, или в цитратном буфере, рН 3,5, анализировали с помощью Вестерн-блоттинга. Выпуск gp82 был похож на обоих рН, тогда как gp90 линять была ниже при кислом рН (Дополнительный файл 1: Рисунок S1B нижняя панель). Инжир. 1 Миграция gp82-экспрессирующие Т. Тгурапозота
метациклических формы через желудочный муцин слоя. а фильтры Transwell покрытые желудка муцина помещали на лунки, содержащих указанные штаммы паразита. Образцы собирали из камеры фильтра через 30 мин и 60 мин для подсчета паразита. Значения являются средние значения ± SD трех независимых экспериментов. По сравнению с штаммом CL, в значительно меньшей миграции штаммов TCI (** P &
л; 0,0005) и штамм TcIV 1434 (* P &
л; 0,005) наблюдался в 60 мин. б Метациклические формы, необработанный (-) или обработанные (+) с 2 мг /мл пепсина, при рН 3,5, анализировали с помощью Вестерн-блоттинга с использованием мАт 3 F6, направленный к gp82. В качестве контроля активности пепсина, БСА окрашивали Кумасси синим показана. C Живые паразиты инкубировали на льду в течение 1 ч, в отсутствии или в присутствии мАт 3 F6. После фиксации, паразиты инкубировали с Alexa Fluor 488-конъюгированных анти-IgG и количество флуоресцентных паразитов оценивали. D Паразиты инкубировали в течение 1 ч в PBS. После центрифугирования для удаления паразитов, кондиционированную PBS, анализировали с помощью Вестерн-блоттинга с использованием монАТ 3 F6 и MAB 5E7, направленный на gp82 и gp90 соответственно. е Transwell фильтры, покрытые желудочного муцина помещали на лунки, содержащие метациклические формы штамма 515 в одиночку, либо в присутствии анти-gp90 мАт 5E7, которые не распознают живых паразитов или неродственного мАт 2С2. После того, как 30 и 60 мин инкубации, были взяты образцы из камеры фильтра для подсчета паразита. Значения являются средними ± изменение дублей
вторжения клетки-хозяина, Т. Тгурапозота
метациклических форм
Снижение потенциала метациклических форм при вторжении желудка эпителий при пероральном введении в организм мышей было связано с выражением пепсина устойчивостью gp90 на высоких уровнях, и коррелирует с плохим инфекционность по отношению к культивируемых эпителиальных клеток человека [14, 15]. Мы исследовали способность TCI и TcIV метациклических форм для ввода клеток-хозяев. Паразиты инкубировали с клетками HeLa в течение 1 ч в полной питательной среде DMEM и количество внутриклеточных паразитов подсчитывали. Низкая мощность вторжение было общей чертой всех штаммов, TcIV штамм 1434 штамма, обладающие большей эффективностью, чем штаммы TCI (рис. 2а). Вестерн-блот-анализ с использованием моноклональных антител, направленных на gp90, показало, что все паразиты выражали пепсина устойчивостью gp90 (рис. 2, б). Присутствие gp90 на поверхности паразита была проверена с помощью проточной цитометрии в штаммов 515 и 1434. При повторных анализах с использованием различных образцов паразитов, gp90 был обнаружен на гораздо более низких уровнях напряжения 1434 (рис 2с, дополнительный файл 1:. Рисунок s1e). Мы ожидали более высокую инвазии клеток способность штамма 1434, поскольку наблюдаемый профиль gp90 аналогичен ХЛ штамма метациклических форм (Дополнительный файл 1: Рисунок S1B верхняя панель), которые не распознаются анти-gp90 моноклональных антител (мАт), gp90 быть обнаружены в экстракте моющего средства с помощью Вестерн-блоттинга. Инжир. вторжение ячейки 2 хоста с помощью gp90-экспрессирующих Т. Тгурапозота
метациклических форм. а HeLa клетки инкубировали в течение 1 ч с указанными паразит штаммов в полной питательной среде DMEM. После фиксации и Гимза окрашивания, количество внутриклеточных паразитов подсчитывали в общей сложности 250 клеток. Значения являются средние значения ± SD из четырех независимых анализов, выполненных в двух экземплярах. По сравнению с штаммом CL, в значительно меньшей вторжения штаммов 28, 588 и 1522 (*** P &
л; 0,0005), штамм 515 (** P &
л; 0,001) и штамм 1434 (* P
&л; 0,005) был обнаружен с помощью теста Стьюдента
. б Метациклические формы, необработанный (-) или обработанные (+) с 2 мг /мл пепсина, при рН 3,5, анализировали с помощью Вестерн-блоттинга с использованием анти-gp90 MAB 1G7. В качестве контроля активности пепсина, БСА окрашивали Кумасси синим показана. C Живые паразиты инкубировали на льду в течение 1 ч, в отсутствии или в присутствии мАт 1G7. После фиксации, паразиты инкубировали с Alexa Fluor 488-конъюгированных анти-IgG и количеством флуоресцентных паразитов оценивали
Эффект поверхностных молекул высвобождаемых Т. Тгурапозота
метациклических форм в вторжения клетки-хозяина
Определяли ли было пролито gp82 и gp90 в среде в течение 1 ч инкубации в полной D10, то есть при условии, используемой в анализе проникновению клеток. Вестерн-блот-анализ кондиционированной среды, полученной, как описано в разделе Методы, показали, что gp90 было пролито на самом высоком уровне с помощью штамма 515 и на самых низких уровнях штаммом CL, в то время как gp82 выпуска штаммами 515 и 1434 визуализировалась но было едва обнаружим в CL штамм супернатанта (рис. 3а). Далее, мы проверили возможность того, что инвазивный потенциал метациклических форм был под влиянием gp90, опубликованным в среду. штамм CL Метациклические формы инкубировали в течение 1 ч с клетками HeLa в одиночку или в D10 плюс 1% кондиционированной среды 515 штамма D10 среды, предварительно инкубировали или не с анти-gp90 мАт 1G7 или неродственными мАт 2C2. штамм CL был использован из-за его клеток больше мощности вторжения и отсутствие реакции с мАт 1G7. Как показано на рис. 3b, кондиционированной среды значительно снижается паразит вторжение, его ингибирующая активность в основном нейтрализовали анти-gp90 мАт 1G7, но не неродственного мАт 2C2. Предположительно, gp82 присутствует в кондиционированной среде также способствовало наблюдаемому тормозящего действия, но это было трудно доказать, так как анти-gp82 моноклональное антитело, которое не признает живых паразитов не доступна. В клетках HeLa инкубируют в D10 в течение 30 мин с метациклических формами штамма 515 или 1434, было некоторое распространение лизосом (рис. 3в), которые могут возникнуть в результате взаимодействия с gp82 выпущенном в среду. Рекомбинантный gp82 белок индуцируют лизосому рассеяния на периферии клетки [29], и событие, которое достигает высшей точки в экзоцитоза и вносит свой вклад в формирование паразитофорной вакуолей, необходимого для T. Тгурапозота
вторжения [30-32]. Инжир. 3 Влияние gp90 выпущен Т. Тгурапозота
метациклических форм вторжения клетки-хозяина. Инжир. Как показано на рис. Инжир.
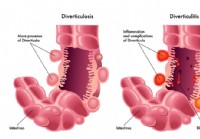 Дивертикулярная болезнь и дивертикулит
Дивертикулярная болезнь — это состояние, при котором в стенке кишечника образуются небольшие карманы или выпячивания, называемые дивертикулами. Дивертикулы могут оставаться безболезненными или они мог
Дивертикулярная болезнь и дивертикулит
Дивертикулярная болезнь — это состояние, при котором в стенке кишечника образуются небольшие карманы или выпячивания, называемые дивертикулами. Дивертикулы могут оставаться безболезненными или они мог
 Заболевание желчного пузыря
Желчный пузырь — один из небольших органов желудочно-кишечного тракта, о котором многие люди не задумываются, пока не возникнет проблема. Однако на самом деле желчный пузырь играет жизненно важную рол
Заболевание желчного пузыря
Желчный пузырь — один из небольших органов желудочно-кишечного тракта, о котором многие люди не задумываются, пока не возникнет проблема. Однако на самом деле желчный пузырь играет жизненно важную рол
 Инфекции мочевыводящих путей (ИМП) у детей
102,2 F или 39 C) и боль в животе. Инфекции мочевыводящих путей являются довольно распространенной проблемой в детском возрасте и могут иметь либо доброкачественное течение, отвечающее на простую а
Инфекции мочевыводящих путей (ИМП) у детей
102,2 F или 39 C) и боль в животе. Инфекции мочевыводящих путей являются довольно распространенной проблемой в детском возрасте и могут иметь либо доброкачественное течение, отвечающее на простую а