рецептора эпидермального фактора роста структурные изменения в раке желудка
Аннотация
фон
EGFR избыточная экспрессия описана во многих человеческих опухолях, включая рак желудка. В пациентов с немелкоклеточным раком легких соматические мутации EGFR, в домене киназы белка, а также амплификацию гена были связаны с хорошим клиническим ответом на ингибиторы EGFR. В опухолях желудка данные о конструктивных изменений EGFR остается спорным. Принимая во внимание его возможное терапевтическое актуальность, мы стремились, чтобы определить частоту и тип конструктивных изменений EGFR
гена в серии первичных желудочных карцином.
Методы
Прямое секвенирование домена киназы в EGFR <бр> ген был проведен в серии из 77 первичных желудочных карцином. Анализ FISH проводили в 30 случаях. исследования ассоциации между EGFR
изменений и клинических патологических особенностей опухолей были выполнены.
Результаты
В 77 первичных карцином желудка мы обнаружили два EGFR
соматические мутации и несколько EGFR
полиморфизмов в экзоне 20. Шесть различных интронного последовательность варианты EGFR
также были найдены. Четыре желудка карцином показали сбалансированный полисомию или EGFR
амплификации гена. Мы проверили, что рак желудка с изменениями EGFR
(соматических мутаций или копировать изменение числа) показали значительное увеличение размера опухоли (р = 0,0094
) по сравнению с диким типом EGFR
карцином.
Заключение
Показано, что EGFR
структурные изменения редки в раке желудка, но всякий раз, когда присутствует, это приводит к росту опухоли. Мы считали, что в поисках EGFR
изменений при раке желудка, вероятно, будет клинически важным для того, чтобы идентифицировать пациентов, предрасположенных реагировать на ингибиторы тирозин-киназы.
Предпосылки
рака желудка остается второй ведущей причиной смерти от рака во всем мире [1] сценарий, который выдвигает на первый план необходимость более конкретных и эффективных методов лечения. Точные механизмы, лежащие в основе канцерогенеза желудка еще до конца не изучен, но данные указывают на ассоциацию с путей, участвующих в процессах развития [2]. Основные молекулы этих путей являются рецепторные тирозинкиназы (RTK), которые найдены будут аберрантно активированы или избыточно экспрессируется в различных опухолей и, следовательно, представляют собой перспективные цели для терапевтическому вмешательству.
Члены РТК подсемейства рецепторов ErbB являются гликопротеинов, которые состоят из внеклеточного домена, в котором связывание лигандов происходит, короткий липофильный трансмембранный домен и внутриклеточный домен, несущий активность тирозинкиназы [3, 4]. Они выражаются в некоторых тканях эпителиального, мезенхимальных и нейронного происхождения, где они играют центральную роль в процессе развития, пролиферации и дифференцировки. Разрегулированной экспрессией молекул ErbB, а именно ERBB2, участвует в развитии многих видов опухолей, в том числе опухолей желудка. В раке желудка было показано, что избыточная экспрессия ERBB2 управляется амплификации гена и связано с карцином с высоким уровнем инвазии [5]. ErbB1, более известный как рецептор эпидермального фактора роста (EGFR), избыточная экспрессия была описана во многих опухолях человека, в том числе легких, толстой кишки, молочной железы, предстательной железы, головного мозга, головы и шеи, щитовидной железы, яичников, мочевого пузыря, почек, а также рака желудка [6 -11] и коррелирует с продвинутой стадии опухоли и плохим клиническим исходом. Совсем недавно, мы показали, что активация EGFR связано с потерей функции E-кадгерина, в пробирке
[12].
Механизмы для онкогенных преобразования EGFR при раке включают усиленный число копий, структурные перестройки рецептора и активирующие мутации [13]. EGFR мутации кластера в домене киназы EGFR (экзоны 18-21), и вызывают лиганд-независимой активации рецептора, представляя возможные цели для терапевтического вмешательства. В связи с этим, соматические мутации EGFR, а также амплификации гена у больных с немелкоклеточным раком легкого (НМРЛ) высоко коррелирует с клиническим ответом на ингибиторы тирозин-киназы [14, 15].
В опухолях желудка, данные, касающиеся структурной изменения EGFR остается спорным. С учетом возможной терапевтической актуальности, в настоящем исследовании мы стремились уточнить актуальность EGFR структурных изменений в желудочном канцерогенезе путем анализа ряда первичных желудочных карцином для количества копий и мутаций в домене тирозинкиназы (экзоны 18-21) в EGFR
гена
.
методов выбора Case и гистологической классификации опухолей
Представительные блоков 77 фиксированных формалином, парафином желудочных первичных опухолей человека были извлечены из отделении патологии больницы Сан-Жуан , после информированного согласия пациентов. Пациенты были проинформированы о том, что опухоль материал будет использоваться исключительно в исследовательских целях. Ни один из пациентов, включенных в данной серии не было семейной истории рака желудка. H &Amp; E- окрашенные срезы были использованы для классификации опухолей по классификации Lauren и Мин. Проникновение стенки желудка, наличия и локализации метастазов в лимфатических регистрировали у всех пациентов с использованием стандартных критериев патологического постановки. Orcein-окрашенные срезы были использованы для обнаружения сосудистой инвазии.
EGFR мутацией Screening
геномную ДНК экстрагировали из секции 10 мкм после микродиссекции опухолевых областей для обеспечения чистоты по крайней мере 70% опухолевых клеток. Выделение ДНК проводили с использованием геномной ДНК набора для очистки (Gentra System) в соответствии с протоколом производителя. Экзон-специфические праймеры и ДНК подвергали ПЦР-амплификации экзонов 18, 19, 20 и 21. Четыре EGFR
экзоны код для домена тирозинкиназы EGFR. Последовательности праймеров приведены в таблице 1.Table 1 праймеры, используемые для ПЦР-амплификации домена EGFR-киназы
Экзон
<й>
праймерПоследовательность
ПЦР размер продукта (пар оснований)
экзон 18
Форвард
TGGGCCATGTCTGGCACTGC
283
Обратный
ACAGCTTGCAAGGACTCTGG
экзона 19
Вперед
TCACTGGGCAGCATGTGGCA
241
Обратный
CAGCTGCCAGACATGAGAAA
экзона 20
Форвард
CCTTCTGGCCACCATGCGAA
295
Обратный
CGCATGTGAGGATCCTGGCT
экзона 21
Вперед
ATTCGGATGCAGAGCTTCTT
265
Обратный
CCTGGTGTCAGGAAAATGCT
продукты ПЦР проводили на агарозном геле 2% и ПЦР-амплификации полосы экстрагировали из геля с очищением Kit гель Band (GE Healthcare). Затем образцы очищали и секвенировали с использованием реакции Kit ABI PRISM дГТФ BigDye Terminator Ready (Perkin Elmer, Foster City, CA), следуя инструкции завода-изготовителя и ABI PRISM 3100 Genetic Analyser (фирма Perkin Elmer, Foster City, CA). Результаты были проанализированы с использованием 3100 сбора данных программного обеспечения. Секвенирование проводили в обеих нитей. В тех случаях, с подозрением на мутации повторяли ПЦР-амплификации и образец повторно секвенировали, чтобы исключить ПЦР артефактами.
EGFR Копировать номер варианта Screening
Парафиновые блоки рассекают на участках 5 мкм и ткани сушили при 60 ° C в течение 30 минут. Срезы deparaffinised и промывают с последующим предварительной обработки и стадию варки с использованием пепсина и окончательно обезвоживается. LSI EGFR Двухцветный Probe-Гибр Set (Vysis
®), оптимизированный для обнаружения область полосы 7p12 в спектре оранжевый и центромеры хромосомы 7 (7p11.1-q11.1, D7Z1 локус) в спектре зеленой, как в интерфазных ядрах и метафазных хромосом, был использован. Пять мкл зонда наносили на каждый слайд. Денатурация проводили при 80 ° С в течение 8 мин с последующей гибридизацией на влажной камере при 37 ° С в течение 16 часов. После гибридизации слайды промывали и инкубировали с 4'-6-диамидино-2-фенилиндола (DAPI) для ядерного окрашивания. Для оценки, от шестидесяти до 100 неповрежденные интерфазных ядрах были проанализированы с помощью двух независимых наблюдателей для того, чтобы набрать сигналы для 7-й хромосомы центромеры и гена EGFR. Окружающие лимфоциты и нормальной слизистой оболочке, использовали в качестве внутреннего контроля качества для анализов. По крайней мере, были выбраны два или три репрезентативных участков опухолевых клеток под полем амплификации 100 × /200 ×, для подсчета ядер сигналов. После краткого обзора при 400 × амплификации в сигналы были затем подсчитывали с использованием иммерсионного масла (1000 ×).
Статистический анализ
исследований ассоциации между EGFR изменениями и клинико-патологическими особенностями случаев были выполнены только в 30 случаях (опухоли анализировали на EGFR мутаций и EGFR копию изменения числа). Статистический анализ оценивали с помощью теста x2 или т
критерия Стьюдента. Значение р Сеть &л;. 0,05 считали статистически значимыми
Результаты
EGFR мутацией скринингу на продажу из 77 желудочных карцином проанализированных, EGFR
мутации в экзоны 18-21 были обнаружены в 2,6% (2/77) случаев (рис. 1А). Одна мутация принадлежала экзона 20 и был миссенс мутацию (2300 C > T), что приводит к замещению аланина 767 для валина. Вторая мутация влияет экзон 21 и был миссенс мутации (2524 > G), ведущий к substituition из аспарагин 842 для аспарагиновой кислоты. Ни одна из мутаций, ранее не были описаны. Нет последовательности изменений не было обнаружено в экзонов 18 и 19. Рисунок 1 Структурные изменения в EGFR. (А) прямое секвенирование, показывающий одну из мутаций, обнаруженных в домене киназы EGFR - миссенс-мутации (2300 C > Т) в экзоне 20, что приводит к замещению аланина 767 для валина. (B) диффузный рак желудка с EGFR увеличением числа копий, вызванного хромосома 7 полисомию. (C) Опухолевые клетки, проявляющие амплификации гена с образованием кластеров с многочисленными сигналами для EGFR.
Несколько полиморфизмов EGFR были обнаружены в экзоне 20 (таблица 2). Полиморфизм 2361G >, A Gln787Gln, ранее описанный Mu и др
[16], присутствовал в 55,8% (43/77) случаев, а в девяти из 43 случаев в гомозиготном состоянии. Мы экранированы 50 нормальных управления и 2361G >, A Gln787Gln присутствовал в 82% в контрольной группе (41/50). Два других EGFR молчащие мутации (The 2301 C > T Ala767Ala и 2415 C > T His805His) были найдены в экзоне 20, никто из них не было описано ранее. Оба изменения были найдены в одном случае и отсутствовали в нормальных controls.Table 2 Sequence изменений, найденных путем прямого секвенирования
<й>
Внесение изменений <бр>
тип
частоте
Ссылки
Экзон 18
2184 + 19 G > A
интронных вариант
2/77
Ensembl
SNP rs17337107 (dbSNP126) [17]
Экзон 19
2185-9 C > G
вариант интронных
1/77
еще не описана
2283 + 11 G > , А
интронных вариант
1/77
еще не описана
2283 + 47 G >, A
интронных вариант
1/77
еще не описана
2283+ 49 C > T
вариант интронных
1/77
еще не описана
экзоне 20
2284-60 C > T
интронных вариант
2/77
Ensembl
SNP rs10241451 (dbSNP126) [17]
2300 C &T Гт
миссенс Ala 767 Val
Результаты 1/77
еще не описана
2301 C > T
Бесшумный Ala 767 Ала
1/77
еще не описана
2361G >, A
Тихая Gln 787 Gln
43/77
[16]
2415 C &GТ; T
Результаты Бесшумный Его 805 Его
1/77
еще не описана
экзоне 21
2524 A &G Гт
миссенс Asn 842 Asp
1/77
пока не описано
Мы нашли шесть различных вариантов последовательностей локализуется в интронных областях EGFR, двое из них ранее описанных в Ensembl [17].
EGFR Copy Number Variation Скрининг
анализ РЭФР
числа копий, по оценке флуоресценции в гибридизация (FISH), было возможно только в 30 из 77 проанализированных случаев для EGFR мутаций. Все EGFR
сигналы по сравнению с сигналами для центромерных зондов для хромосоме 7. Более 2,0 EGFR
копий на клетку (сбалансированный полисомию или амплификации гена) были обнаружены в 13,3% (4/30) случаев. Из четырех случаев, показывающих более 2-х копий EGFR
за 7-й хромосомы, три увеличилось число копий за счет полисомию и у одного амплификации гена, диффузный рак желудка, показывая формирование кластеров с многочисленными сигналами для EGFR
(рис. 1В, с).
EGFR, структурные изменения и клиникопатологическими параметры пациентов и опухолей
в таблице 3 представлены статистические ассоциации между EGFR изменениями и клиникопатологическими характеристик пациентов и опухолей. При сравнении карциномы желудка укрывательство EGFR изменения с карциномой с нормальным статусом EGFR или числом копий, мы наблюдали значимую связь между EGFR структурными изменениями и увеличением размера опухоли. (Р = 0,0094
). Никаких существенных ассоциации не были обнаружены между EGFR изменениями и другими клиникопатологическими параметров пациентов и опухолей, а именно пола и возраста пациентов, локализации опухоли, гистологического типа, пенетрация стенки, наличие метастазов в лимфатических узлах, васкулярной инвазии и стадирования опухоли опухоли .table 3 Ассоциация EGFR генов изменения с клинико-патологическими параметрами
параметры
клинико-патологическими
EGFR статус
<й> <бр> Amplification /мутация (п = 6)
Нормальный (п = 24)
Всего (п = 30)
значение р
Пол (F /M)
1/5
10/14
11/19
0.2557
Возраст (SD)
62,3 ± 14,1 ± 56,3
16.8
57,5 ± 16,2
0,4271
Опухоль локализации
0.8548
проксимальное страница 3 из 11
14
Дистальный страница 3 из 13
16
Размер (SD)
11,6 ± 9,8
5,8 ± 2,0
6,9 ± 5,0 * 0,0094
классификации Лорен
0,1261
Кишечные
1 12
13
Диффузный страница 5 из 9
14
Атипичная
0
3 страница 3 проникновение стена
0,4642
Раннее (T1)
0
2 страница 2 Расширенный (T2-T4)
6
22
28
васкулярной инвазии
0.7125
отсутствующего ( N0) страница 3 из 14
17
настоящее время (N = 1) страница 3 из 10
13
узел метастаз лимфа
0.1921
Absent
1
11
12
Present страница 5 из 13
18
Балетмейстер
0,3845
I
1
7
8
II
0
5 страница 5 III страница 5 из 11
16
IV
0
1
1
Форум
гена EGFR, локализован на хромосоме 7p12 и кодирует рецептор 170 кД, присутствующий в мембране клеток в качестве неактивных мономеров. После связывания лиганда с внеклеточным доменом, рецептор претерпевает конформационные изменения, dimerises и становится аутофосфорилированную в ключевых остатков тирозина в домене внутриклеточный тирозинкиназы (TK). Это приводит к активации нисходящих путей, которые контролируют выживаемость клеток, ингибирование апоптоза и пролиферации [18].
Большое внимание было обращено на онкогенного эффекта EGFR и прежде всего к успеху EGFR целевых методов лечения, которые хорошо создана для немелкоклеточного рака легкого. Роль EGFR при раке желудка является очень спорным. Некоторые авторы сообщили, что EGFR сильно выражено при раке желудка, что говорит о его пригодности в качестве мишени для рецептора тирозин ингибиторов киназы [19, 20]. С другой стороны, Takehana и его коллеги сообщили, что избыточная экспрессия рецептора эпидермального фактора роста является редким событием в желудочном карциномы [21] и происходит преимущественно за счет гена EGFR амплификации, подтверждая результаты предыдущих исследований [22-24]. EGFR мутации в первичной карциномы желудка или желудка клеточных линий рака никогда не сообщалось [25-27]; тем не менее, мы недавно показали, что наследственные диффузные рак желудка, связанный Е-кадгерин зародышевой миссенс мутации приводят к увеличению активности EGFR.
Исходя из этого, мы считали, что поиск EGFR изменений при раке желудка, возможно, было важно определить терапии восприимчивых случаев.
Здесь мы сообщаем о наличии EGFR
увеличения числа копий в 13,3% из 30 случаев, в которых анализ FISH было возможно. Из четырех случаев с увеличением числа копий, только один представленный амплификации гена, в то время как остальные 3 случая показали полисомию хромосомы 7. Эти результаты совпадают предыдущие отчеты Расследуя количество EGFR копий при раке желудка [22-24]. Мутационный анализ киназного домена EGFR показало наличие мутаций в 2,6% на 77-желудочных карцином. Выявленные мутации были типа миссенс и присутствовали в экзонов 20 и 21 гена EGFR. Ни один из идентифицированных мутаций не было описано ранее, и их функциональное значение еще не оценена. Тем не менее, из-за их локализации в домене киназы EGFR, заманчиво предположить, что они влияют на активность рецептора и, следовательно, пациенты, несущие эти мутации EGFR могут получить выгоду от ингибиторов тирозинкиназы, как терапевтический подход.
Помимо этих мутаций, обнаруженных , были идентифицированы другие изменения последовательности, все кластеризация в экзоне 20. EGFR полиморфизма 2361 G > а (ранее описанный в Ensembl) происходит в большом проценте случаев и в нормальных контролей. В отличие от этого, два других еще не описаны молчащие варианты в экзоне 20 (2301 C > T, 2415 C &GТ; T) отсутствовали в нормальных контролей. В дополнение к этим последовательности EGFR вариантов в кодирующих областях, мы также выявили вариации в интронной последовательности фланкирующей экзоны 18, 19 и 20, но их функциональное действие остается неясным.
Корреляции клинических параметров, за исключением случаев, для которых и мутация и FISH анализ был возможен, показали статистически значимую связь между EGFR изменениями и размера опухоли. Интересно, что все случаи с изменениями в EGFR (усиление /мутации) были карцином уже вторгшиеся базальную мембрану и распространяющиеся в стенке желудка (Т2-Т4), предполагая, что изменения этого гена могут придавать инвазивной поведение в опухолевые клетки.
Однако эта гипотеза требует уточнения путем дальнейших исследований, так как мы не проверяли статистически значимую корреляцию между EGFR изменениями и вторжения в стенки желудка (р = 0.4642), как мы только Проанализированы очень небольшое количество ранних желудочных карцином ( п = 2) в нашей серии. Оба результаты согласуются с сообщениями о Хироно и др
., 1995 [23] и ЦУГАВА др
., 1998 [24], предполагая, что EGFR участвует в росте опухоли и активирующие изменения могут быть поздно событие участвует в прогрессии опухоли.
Хотя ни одна другая статистически значимая связь не было найдено, интересно отметить, что EGFR изменения происходят в основном в карцином диффузного типа. Присутствие EGFR изменений в диффузных карцином в отличие от того, что наблюдалось ранее для других членов семейства рецепторов ERBB при раке желудка. В карциномы желудка ERBB2 амплификации был обнаружен преимущественно при кишечных карцином желудка [5].
Заключение
В заключение, в данном исследовании мы показали, что EGFR активирующие изменения не являются частым событием в желудочном канцерогенезе. Переоборудование преимущественно появляются в желудочных карцином диффузного подтипа и связаны с размером опухоли. Несмотря на низкую частоту EGFR изменений, наши результаты также показывают, что существует ограниченная группа отобранных пациентов желудка, которые могут извлечь выгоду из нетрадиционных методов лечения, в том числе фармакологических ингибиторов рецептора EGFR.
Notes
CATIA Моутинью, Ana R Матеуш способствовали в равной степени к этой работе
декларациях
Выражение признательности
Данное исследование было профинансировано за счет субсидий из Fundação п Ciencia еа Tecnologia, Португалия (SFRH /BD /16747/2004 ПЗП /SAU -. OBS /57670 /2004 и PTDC /SAU -. OBD /64319/2006)
авторов оригинальные представленные файлы для изображений изображения Ниже приведены ссылки на авторов оригинальных представленных файлов для изображений. Исходный файл 12885_2007_948_MOESM1_ESM.pdf авторов для фигурного 1 конкурирующими интересами
Автор (ы) заявить, что у них нет конкурирующих интересов.
 Ингибиторы Цокс-2
Слайд-шоу с изображениями ревматоидного артрита Пройдите тест по RA Слайд-шоу Упражнения для суставов для уменьшения боли при ревматоидном артрите Что такое ингибиторы ЦОГ-2? При каких состояниях на
Ингибиторы Цокс-2
Слайд-шоу с изображениями ревматоидного артрита Пройдите тест по RA Слайд-шоу Упражнения для суставов для уменьшения боли при ревматоидном артрите Что такое ингибиторы ЦОГ-2? При каких состояниях на
 Каковы симптомы диспепсии?
Что такое диспепсия? Симптомы диспепсии включают дискомфорт в желудочно-кишечном тракте, чувство переполнения, вздутие живота, тошноту или рвоту, чрезмерную отрыжку и изжога. Диспепсия, также из
Каковы симптомы диспепсии?
Что такое диспепсия? Симптомы диспепсии включают дискомфорт в желудочно-кишечном тракте, чувство переполнения, вздутие живота, тошноту или рвоту, чрезмерную отрыжку и изжога. Диспепсия, также из
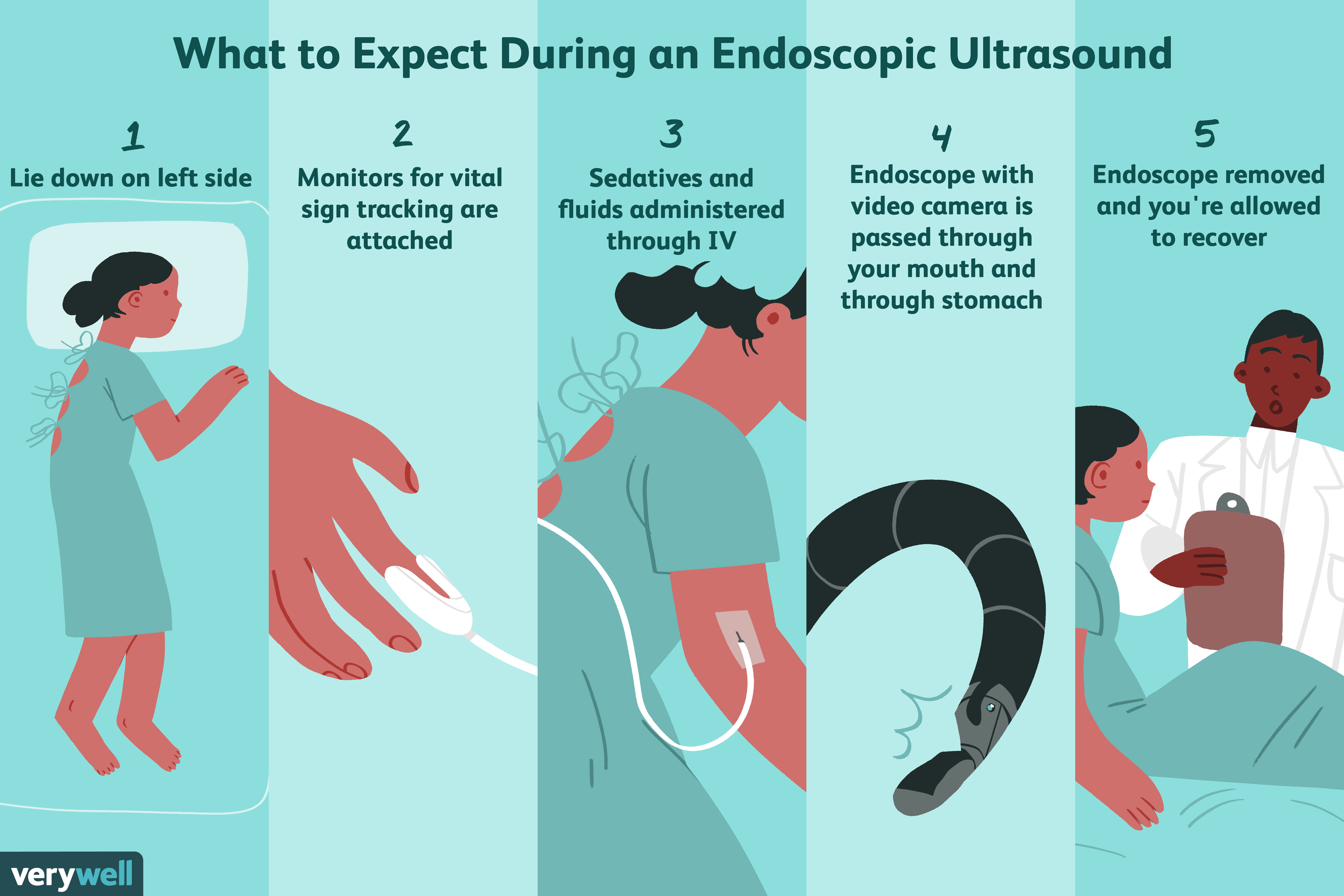 Что такое эндоскопическое ультразвуковое исследование?
Эндоскопическое УЗИ — это тест, который помогает визуализировать части пищеварительного тракта, такие как желудок, поджелудочная железа и желчный пузырь, а также близлежащие органы и ткани, такие как
Что такое эндоскопическое ультразвуковое исследование?
Эндоскопическое УЗИ — это тест, который помогает визуализировать части пищеварительного тракта, такие как желудок, поджелудочная железа и желчный пузырь, а также близлежащие органы и ткани, такие как