Makrofager er immunforsvarsceller, udgør en del af det medfødte immunsystem, der holder øje med infektioner. Imidlertid, deres reaktion på patogener af enhver art kan også udløse kronisk eller overdreven betændelse. Denne form for unormal makrofagaktivering ses ved leddegigt (RA) og andre autoimmune tilstande. Et mål med RA -behandling er at modulere makrofagaktiveringstilstande og reducere makrofaginfiltration i det betændte væv.
I lungerne, også, infektion kan forårsage makrofag-induceret betændelse, hvilket resulterer i ødelæggelse af lungevæv. Det kan også udløse en cytokinstorm, ses ved akut respiratorisk nødsyndrom (ARDS). Makrofagaktivering er afhængig af receptorer, som igen reagerer på en række eksterne signaler. De fleste af disse medieres af cytokiner og antigener til stede på mikrober.
Et af de mest kendte og vigtigste makrofagaktivatormolekyler er interferon-γ (IFN-γ). Makrofager primet ved IFN-γ-eksponering reagerer mere kraftfuldt på efterfølgende stimulering. En anden lignende aktivatorklasse indeholder Toll-like receptor (TLR) agonister, som primer makrofager sådan, at de udskiller molekyler, der danner det inflammatoriske legeme kaldet inflammasomet. Aktivering af inflammasome komponenter får cellen til at dø af pyroptose sammen med frigivelse af interleukin -1β (IL -1β).
Med forskernes ord, “ En vigtig komponent i makrofagresponset på et primært signal er opregulering af en sekundær superaktivatorreceptor, der derefter kan transformere disse primede makrofager til et eksplosiv, potentielt patogen inflammatorisk tilstand . ”
Forskerne undersøgte flere inflammatoriske tilstande som RA, Crohns sygdom og alvorlig COVID-19, at finde en ny sekundær superaktiverende makrofagreceptor kaldet SLAMF7. Det her, de siger, er nøglen til patogenesen af disse tilstande.
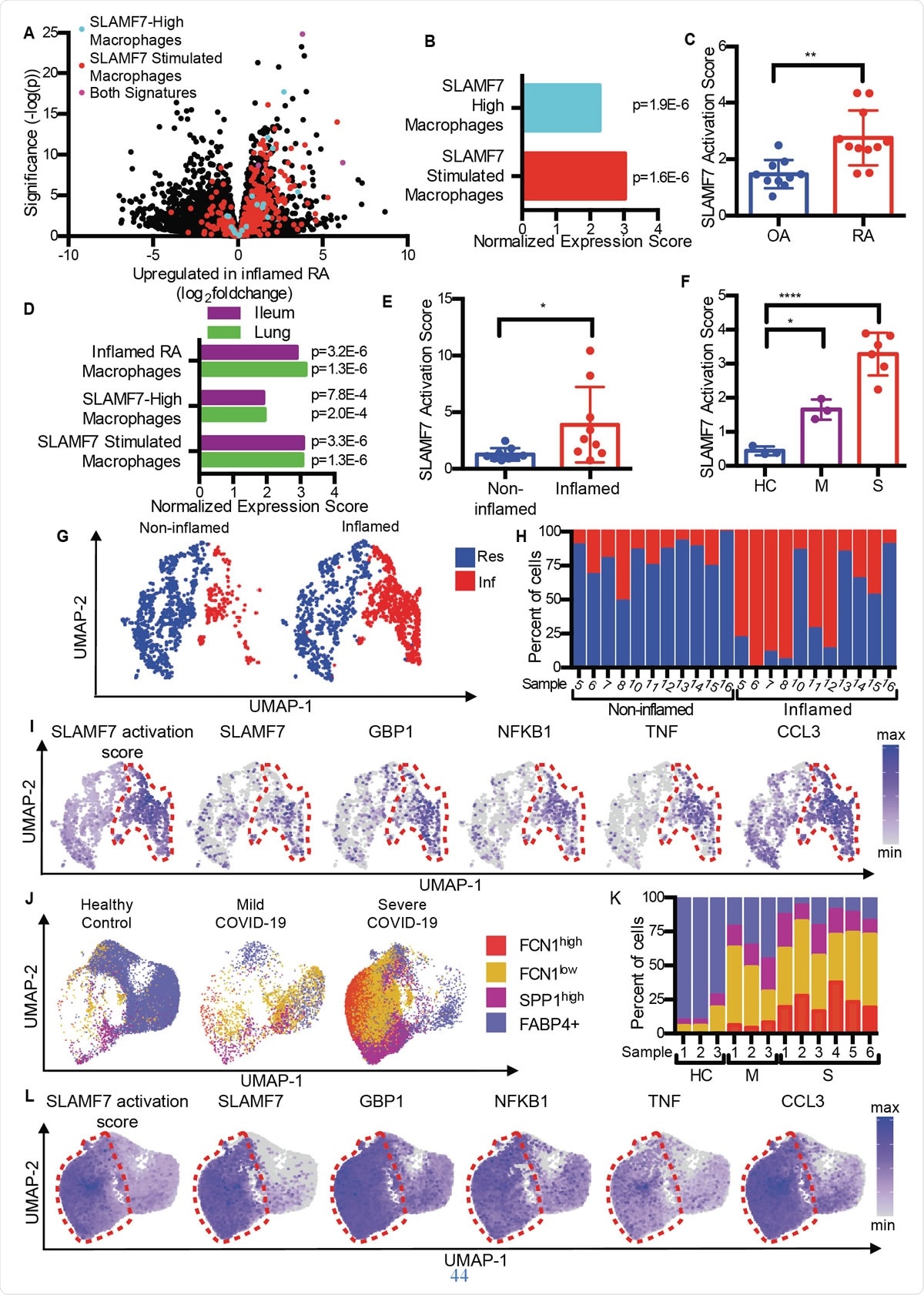 SLAMF7 superaktiverede makrofager driver betændelse ved autoimmun og infektionssygdom. A) Vulkanplot fra fig. 1A, der fremhæver gener fra "SLAMF7-High Macrophage Signature, "Macrophage SLAMF7 -stimuleringssignaturen, ”Og gener inkluderet i begge underskrifter. B) Gensets berigelsesanalyse, der sammenligner differentiel genekspression i RA versus OA med "SLAMF7-High Macrophage Signature" og "Macrophage SLAMF7 Stimulation Signature." C) SLAMF7-aktiveringsscore for bulk-RNA-seq-data om synoviale makrofager fra patienter med OA (n =10) eller RA (n =11). Data repræsenterer middelværdi ± SD. D) Gen-set berigelsesanalyse, der sammenligner genekspression fra makrofager fra betændte ilealvæv hos patienter med Crohns sygdom eller lunger hos patienter med COVID-19 med "Inflammet RA-makrofag-signatur", "SLAMF7-høj makrofag-signatur" og "Makrofag-SLAMF7-stimuleringssignatur." E) SLAMF7 -aktiveringsscore for makrofager fra ikke -betændt (n =9) og betændt ilealt væv (n =9). F) SLAMF7 -aktiveringsscore for bronchoalveolære skylningsmakrofager fra raske kontroller (n =3), eller personer med mild (n =3) eller alvorlig COVID-19 (n =6). Data i E-F repræsenterer middelværdi ± SD. G) UMAP -plot af makrofagklynger fra involverede og ikke -involverede ilealvæv. H) Procent af makrofager fra hver donor, der er tildelt hver klynge. I) UMAP -plots, der viser genekspression af ileal makrofagpopulationer. J) UMAP -plot af bronchoalveolære lavagemakrofagpopulationer. K) Procent af makrofager fra hver donor, der er tildelt hver population. L) UMAP -plots, der viser genekspression for bronchoalveolære lavagemakrofagpopulationer. Den parrede t-test blev brugt til tovejs statistiske sammenligninger, og envejs ANOVA med Dunnetts multiple sammenligningstest blev brugt til at sammenligne mild og alvorlig COVID-19 med sunde kontroller.*, p ≤ 0,05; **, p ≤ 0,01; ****, p <0,0001; Res, Resident makrofag klynge; Inf, Inflammatorisk makrofag klynge; HC, sund kontrol; M, mild COVID-19; S, alvorlig COVID-19.
SLAMF7 superaktiverede makrofager driver betændelse ved autoimmun og infektionssygdom. A) Vulkanplot fra fig. 1A, der fremhæver gener fra "SLAMF7-High Macrophage Signature, "Macrophage SLAMF7 -stimuleringssignaturen, ”Og gener inkluderet i begge underskrifter. B) Gensets berigelsesanalyse, der sammenligner differentiel genekspression i RA versus OA med "SLAMF7-High Macrophage Signature" og "Macrophage SLAMF7 Stimulation Signature." C) SLAMF7-aktiveringsscore for bulk-RNA-seq-data om synoviale makrofager fra patienter med OA (n =10) eller RA (n =11). Data repræsenterer middelværdi ± SD. D) Gen-set berigelsesanalyse, der sammenligner genekspression fra makrofager fra betændte ilealvæv hos patienter med Crohns sygdom eller lunger hos patienter med COVID-19 med "Inflammet RA-makrofag-signatur", "SLAMF7-høj makrofag-signatur" og "Makrofag-SLAMF7-stimuleringssignatur." E) SLAMF7 -aktiveringsscore for makrofager fra ikke -betændt (n =9) og betændt ilealt væv (n =9). F) SLAMF7 -aktiveringsscore for bronchoalveolære skylningsmakrofager fra raske kontroller (n =3), eller personer med mild (n =3) eller alvorlig COVID-19 (n =6). Data i E-F repræsenterer middelværdi ± SD. G) UMAP -plot af makrofagklynger fra involverede og ikke -involverede ilealvæv. H) Procent af makrofager fra hver donor, der er tildelt hver klynge. I) UMAP -plots, der viser genekspression af ileal makrofagpopulationer. J) UMAP -plot af bronchoalveolære lavagemakrofagpopulationer. K) Procent af makrofager fra hver donor, der er tildelt hver population. L) UMAP -plots, der viser genekspression for bronchoalveolære lavagemakrofagpopulationer. Den parrede t-test blev brugt til tovejs statistiske sammenligninger, og envejs ANOVA med Dunnetts multiple sammenligningstest blev brugt til at sammenligne mild og alvorlig COVID-19 med sunde kontroller.*, p ≤ 0,05; **, p ≤ 0,01; ****, p <0,0001; Res, Resident makrofag klynge; Inf, Inflammatorisk makrofag klynge; HC, sund kontrol; M, mild COVID-19; S, alvorlig COVID-19. Sammenligning af slidgigt (OA) med leddegigt, forskerne fandt ud af, at RA -væv indeholder makrofager med en betændelsessignatur, herunder opregulering af gener, der induceres af interferon samt gener, der koder for inflammatoriske kemikalier i kroppen. Genet med den højeste stigning i ekspression blandt disse var SLAMF7.
Dette blev fundet i lave niveauer i led -synovialvæv fra led betændt af OA, men på høje niveauer hos RA -patienter. Det var til stede i 55% af makrofagerne i sidstnævnte, men <6% af patienterne med OA. Det var til stede på to gange højere niveauer i synovialvæskemakrofager fra RA -gruppen sammenlignet med OA -gruppen, og på omkring en halv og en fjerdedel af makrofagerne i hver gruppe, henholdsvis. Imidlertid, dette var ikke tilfældet med en anden SLAM -receptor, peger på SLAMF7 som specifik for inflammatoriske makrofager i RA.
IFN-γ viste sig at være den primære inducer af denne receptor på makrofager, sammen med IFN-β, IL-1β og TNF-a ved lavere niveauer. Imidlertid, det pro-inflammatoriske cytokin IL-6 kunne ikke inducere SLAMF7-ekspression. Igen, de tidligere cytokiner reducerede niveauerne af en anden SLAM -receptor, CD84, til det halve.
Forskerne bekræftede også, at JAK-banen spillede en vigtig rolle i SLAMF7-medieret makrofagaktivering. JAK -hæmmeren ruxolitinib undertrykte det effektivt. Faktisk, dette lægemiddel bruges til behandling af myelofibrose, hvor, igen, aktiverede SLAMF7-udtrykkende makrofager findes. Det fordobler også CD84 -niveauer, hvilket kan betyde, at IFN-γ har modsatrettede og gensidige virkninger på disse to SLAM-receptorer.
I det næste trin, SLAMF7 -ekspression blev induceret ved høje niveauer på makrofager, af IFN-γ. Efterfølgende, aktiverende monoklonalt antistof eller rekombinant SLAMF7 -protein blev tilsat for at binde til receptorerne. Forskerne fandt ud af, at denne bindende begivenhed udløste dramatiske ændringer i genekspression.
Næsten 600 gener blev opreguleret - Macrophage SLAMF7 -stimuleringssignaturen - sammen med en stigning i flere inflammatoriske cytokiner og kemokiner, endda ud over stigningen forårsaget af IFN-γ alene. For eksempel, TNF-α og IL-6 niveauer stiger fra picomolære til nanomolære niveauer på dette tidspunkt. I øvrigt, selve udtrykket af SLAMF7 steg yderligere, foreslår en positiv feedback loop.
Binding af makrofager til SLAMF7 sætter også en myeloid inflammatorisk cyklus i gang, udover at primere inflammasomet til at reagere stærkt på mikrobielle TLR-bindende antigener, eller til cytokiner, med en massiv frigivelse af IL-1β. På den anden side, når en kombination af IFN-γ + LPS (et potent bakteriemolekyle) blev brugt til at aktivere makrofagerne, cytokinprofilen karakteristisk for SLAMF7 -binding blev ikke observeret. Imidlertid, der var en delvis lighed mellem cytokinrespons og genekspressionsprofil, der opstod, da IFN-γ første gang blev brugt, efterfulgt af LPS -eksponering.
Forskerne sagde, “ Dette SLAMF7-aktiveringsprogram hviler på og er et separat trin efter primær stimulering af makrofager med IFN-γ eller andre M1-differentierings- og aktiveringsfaktorer . ” Den karakteristiske tilstand for dette aktiveringsprogram-den superaktiverede makrofaginflammatoriske tilstand induceret af SLAMF7-engagement (SAM7)-er en indledende forstærkning af makrofagerne med IFN-γ, hvorved SLAMF7 dramatisk opreguleres. Bindende begivenheder ved denne receptor fuldender nu aktiveringen af de primede makrofager for at producere en hyperinflammatorisk tilstand af makrofagaktivering.
Denne vej ser ud til at blive opretholdt og yderligere forstærket af en autokrin feedback -loop, involverer TNF-α, som hurtigt induceres (inden for to timer) efter SLAMF7 -engagement og derefter fortsætter med at bygge op over tid. Bevis for dette omfatter halvering af TNF-α-ekspression med anti-TNF-antistof, eller ved at dæmpe TNF -receptorer med siRNA.
De fandt ud af, at den gennemsnitlige SLAMF7 -aktiveringsscore i RA var næsten det dobbelte af personer med OA, hvilket indikerer, at denne receptor er tæt involveret i betændelse hos dem med RA.
Tilsvarende overlappende makrofagaktiveringsgenprofiler blev genereret både ved inflammatorisk tarmsygdom (IBD) og i COVID-19, sammenlignet med RA. Faktisk, bronchoalveolære skyllevæskeceller og celler fra betændt tarmvæv i COVID-19 og IBD viste de samme makrofagaktiveringssignaturer. De bemærkede også en todelt SLAMF7 -aktiveringsscore i betændt tarm i forhold til normalt tarmvæv. Og ved alvorlig COVID-19, scoren var seks gange højere sammenlignet med mild COVID-19. Alt dette tyder på dominansen af SAM7 -programmet for makrofagaktivering under inflammatoriske tilstande, især da SLAMF7 -receptoren ikke findes på residente makrofager i normalt væv.
Undersøgelse af forskellige makrofagundergrupper, de fandt ud af, at inflammatoriske makrofager havde ekstremt høje aktiveringsresultater sammenlignet med residente makrofager. Igen, tre forskellige undergrupper af makrofager hos COVID-19-patienter blev påfaldende øget i forhold, med to af disse grupper, der viser ekspansion i alvorlig sygdom. Interessant nok, disse havde de højeste aktiveringsscorer, og makrofager fra alvorligt syge COVID-19-patienter havde ekstremt høje SLAMF7-ekspressionsniveauer, sammen med meget høje niveauer af mange andre inflammatoriske og interferon-inducerbare markører og receptorer.
Kort sagt, SAM7-tilstanden kan være en vigtig komponent i det hyperinflammatoriske respons, der ses ved COVID-19-lungebetændelse, såvel som i RA, og IBD. Imidlertid, den sekventielle måde, hvorpå en sådan aktivering opnås, tillader også anvendelse af flere forskellige terapeutiske modforanstaltninger. Disse omfatter JAK -hæmmere som ruxolitinib, TNF-α-hæmmere, eller SLAMF7 -blokade af Elotuzumab. Den sidste kategori er især nyttig, fordi den kan tillade, at SAM7 -programmet selektivt hæmmes, mens makrofager stadig kan udføre deres normale essentielle immunfunktioner.
bioRxiv udgiver foreløbige videnskabelige rapporter, der ikke er peer-reviewed og, derfor, ikke skal betragtes som afgørende, vejlede klinisk praksis/sundhedsrelateret adfærd, eller behandles som etablerede oplysninger.
 Nem hjemmelavet mørk chokoladeopskrift
At have en sund godbid er en seriøs sag. Jeg taler om noget, du kan nyde, som ikke vil sætte dig 3 dage (eller mere) tilbage på din helbredende rejse. Det kunne være forskellen mellem at holde sig p
Nem hjemmelavet mørk chokoladeopskrift
At have en sund godbid er en seriøs sag. Jeg taler om noget, du kan nyde, som ikke vil sætte dig 3 dage (eller mere) tilbage på din helbredende rejse. Det kunne være forskellen mellem at holde sig p
 Leverens anatomi og funktion
Leverdefinition og fakta Leveren er et stort, kødfuldt organ, der sidder på højre side af maven. Leveren har to store sektioner, kaldet højre og venstre lapper. Leveren er et essentielt organ, d
Leverens anatomi og funktion
Leverdefinition og fakta Leveren er et stort, kødfuldt organ, der sidder på højre side af maven. Leveren har to store sektioner, kaldet højre og venstre lapper. Leveren er et essentielt organ, d
 Bedste SIBO-diætplan:hvad du behøver at vide
Så du er blevet diagnosticeret med tyndtarmsbakteriel overvækst (SIBO) og har fået at vide, at du skal følge en SIBO-diætplan. Men hvilken diæt skal du vælge, og hvor længe skal du følge den? I dag ge
Bedste SIBO-diætplan:hvad du behøver at vide
Så du er blevet diagnosticeret med tyndtarmsbakteriel overvækst (SIBO) og har fået at vide, at du skal følge en SIBO-diætplan. Men hvilken diæt skal du vælge, og hvor længe skal du følge den? I dag ge