Afvigende opregulering af 14-3-3ơ udtryk fungerer som en ringere prognostisk biomarkør for mavekræft
Abstract
Baggrund
14-3 -3ơ er en intracellulær, phosphoserin bindende protein og foreslog at være involveret i tumorigenese. Men udtrykket dynamik 14-3-3ơ og dets klinisk-patologisk /prognostisk signifikans i humane tumorer er stadig kontroversiel.
Metoder Salg Fremgangsmåden immunhistokemi (IHC) og Western blot blev anvendt til at undersøge protein ekspression af 14 -3-3ơ i gastrisk cancer og parrede normale hosliggende gastriske mucosale væv. Modtag drift karakteristik (ROC) kurve analyse blev anvendt til at bestemme en cutoff score for 14-3-3ơ udtryk i et træningssæt (n = 66). For validering blev ROC-afledte cutoff score underkastet analyse af sammenslutningen af 14-3-3ơ udtryk med patientens resultat og kliniske karakteristika i en test sæt (n = 86) og overordnede patienter (n = 152).
resultater
udtrykket frekvens og ekspressionsniveauer af 14-3-3ơ var signifikant højere i gastrisk cancer end i normale gastriske mucosale væv. Korrelation analyse viste, at høj ekspression af 14-3-3ơ i gastrisk cancer var signifikant korreleret med klinisk udvikling og tumorinvasion. Desuden i sættet test og overordnede patienter viste Kaplan-Meier analyse, at forhøjet 14-3-3ơ udtryk forudsagt dårligere samlet overlevelse (OS) og progressionsfri overlevelse (PFS). Vigtigt er det, var høj 14-3-3ơ udtryk også forbundet med forkortet overlevelsestid i fase III og fase IV gastrisk kræftpatienter. Multivariat analyser viste, at 14-3-3ơ udtryk var en uafhængig prognostisk parameter i mavekræft.
Konklusioner
Disse resultater dokumenterer, at høj ekspression af 14-3-3ơ kan være vigtigt i tumor progression og servere som en uafhængig molekylær markør for dårlig prognose af gastrisk cancer. Således overekspression af 14-3-3ơ identificerer patienter med høj risiko og er et hidtil ukendt terapeutisk molekylært mål for denne tumor.
Baggrund
mavekræft er en af de mest almindelige årsager til kræft-relaterede dødsfald på verdensplan [1] især i østasiatiske lande som Kina, Japan [2]. I 2005 var der ca. 0,4 mio nye tilfælde og 0,3 millioner dødsfald fra mavekræft i Kina [3]. Trods de seneste fremskridt inden for kirurgiske teknikker og medicinsk behandling, den samlede 5-års overlevelsesraten for mavekræft i Kina er fortsat lav på omkring 40%. Mange undersøgelser har vist, at multiple genetiske ændringer, herunder tumorsuppressorgener, onkogener, celleadhæsionsmolekyler, celle-cyklus regulatorer og vækstfaktorer, er ansvarlige for udviklingen og progressionen af gastrisk cancer [4]. Undersøgelser har bragt i orden mange afvigende udtrykte gener i mavekræft herunder BMI1
[5], COX-2
[6], HER3
[7], RKIP
og STAT3
[8], SPARC
[9] og HER2
[10, 11], der gør vurdering af mavecancerpatienter risiko mere præcist. Men lovende molekyler, der har klinisk-patologisk /prognostisk betydning i mavekræft forblive væsentligt begrænset. Det er nødvendigt yderligere at forstå de molekylære mekanismer, der er involveret i gastrisk kræft og til at identificere mere værdifulde prognostiske markører, således at ikke blot forbedre dårligere prognose, men også give nye lovende terapi mål.
14-3-3 proteiner er en familie på omkring 30 kD dimerisk højt bevarede proteiner og allestedsnærværende udtrykkes i alle eukaryote organismer [12]. Der er syv nært beslægtede gener (β, γ, ε, η, ζ, O, T) i 14-3-3 familie proteiner. Disse gener danner ofte heterodimerer eller homodimerer og binder sig til over 100 forskellige protein-ligander [13, 14]. Således er 14-3-3-proteiner involveret i mange forskellige cellulære signalprocesser herunder celleproliferation, cellecykluskontrol, apoptose og malign transformation [14, 15]. Blandt de syv isotyper blev 14-3-3ơ oprindeligt karakteriseret som en menneskelig brystepiteliet markør 1 (HME1) og identificeret som en tumor undertrykke gen [12, 16]. Voksende beviser viste, at 14-3-3ơ var signifikant nedsat eller tabt på grund af tavshed af genet via hypermethylering i flere solide tumorer [17-22]. Tidligere rapporter fundet der faldt udtryk for 14-3-3ơ forudsagt en dårlig overlevelse i bryst- og nasopharyngeal cancer [23, 24]. Imidlertid selvmodsigende med tumor suppressor rolle 14-3-3σ, overekspression af 14-3-3ơ i bugspytkirtelkræft celle førte til medikamentresistens, cellemigration og invasion [25]. Desuden høj ekspression af 14-3-3σ var en uafhængig prognostisk faktor for dårlig overlevelse i bugspytkirtlen og kolorektal cancer [26, 27]. Således varierer den biologiske rolle 14-3-3ơ i tumorigenese og progression af forskellige typer af humane cancere afhængigt af specifik tumortype. Her valgte vi mavens kræft prøver med streng protokol til at opdage 14-3-3ơ udtryk dynamik og analysere deres klinisk-patologiske /prognostiske betydninger.
Metoder
Patienter
En alt 216 primære mavecancerpatienter fra arkiverne af Institut for Patologi i tredje og andet Tilknyttede Hospital i Sun Yat-Sen University (Guangzhou, Kina) blev oprindeligt rekrutteret i vores undersøgelse. Alle patienter gennemgik indledende kirurgisk resektion fra marts 2001 til januar 2006. Vi yderligere screenet patienter ved hjælp af en streng støttekriterier protokol som følger: mikroskopisk bekræftede adenokarcinom i maven; uden nogen metastatiske sygdomme; ingen tidligere kemoterapi eller stråleterapi historie; modtager forenet regime som førstevalg kemoterapi efter resektion af primære tumorer (vi forenet som FOLFOX regime: fluorouracil, leucovorin og oxaliplatin), og ingen strålebehandling administreres til nogen af patienterne; har over 5 års opfølgningsperiode. I sidste ende blev 52 patienter med tab af opfølgning og 12 patienter med mangel på kliniske karakteristika udelukket fra dette studie, hvilket fører til 152 gastrisk kræftpatienter undergiver yderligere kliniske og overlevelse analyse. I detaljer, den samlede kohorte bestod af 105 mænd og 47 kvinder med en median alder på 58,0 år (interval, 27-81 år). 103 patienter blev censused som døden i løbet af de 5 års follow-up tid, herunder 5 tilfælde døde af postoperative komplikationer og 98 sager døde af tumor progression. Af de samlede patienter blev 66 patienter randomiseret ved computer (SPSS 17,0 software) til træningssættet, og de resterende 86 patienter blev randomiseret til den indstillede test. Klinisk-patologiske variabler af de to kohorter, såsom alder, køn, kliniske stadium, tumorinvasion, node fase, og histologi differentiering, blev inkluderet i denne undersøgelse. Alle tumorer blev klassificeret og iscenesat i henhold til de reviderede retningslinjer der anbefales af Den Internationale Union mod Kræft. Vi opnåede tidligere patienters samtykke og godkendelse fra Institut Research etiske komité af Sun Yat-Sen University for brug af klinisk materiale, der er beskrevet i nærværende undersøgelse.
Tissue microarray konstruktion
vævet microarrays (TMAS) blev konstrueret som en fremgangsmåde beskrevet tidligere af Xie et al [28]. Kort fortalt blev paraffinindlejrede vævsblokke og de tilsvarende histologiske hematoxylin og eosin-farvede objektglas overlejret for TMA prøveudtagning. Interesseret kerne vævsbiopsier (0,6 mm i diameter) blev udstanset fra repræsentative tumor områder og fra tilstødende maveslimhinden væv fra blokke af enkelt donor væv ved hjælp af en trepan (tredobbelte cylindre fra karcinom væv og en cylinder fra normal tilstødende maveslimhinden væv). Vævscylinderne blev derefter overført til en modtager paraffin blok ved definerede positioner ved anvendelse af et væv-arraying instrument (Beecher Instruments, Silver Spring, MD, USA).
Immunohistokemisk analyse og evaluering
TMA'erne Objektglassene blev afparaffiniseret i xylen , rehydreret gennem gradueret alkohol, nedsænket i 3% hydrogenperoxid i 10 min for at blokere endogen peroxidaseaktivitet, og antigen hentes af tryk kogning i 3 min i Tris /EDTA (pH = 8,0). Derefter blev objektglassene inkuberet med det primære antistof ifølge 14-3-3σ (monoklonalt muse; 01:50; Santa Cruz, SC-100638) i 1 time ved stuetemperatur. Efter at være blevet inkuberet med det sekundære antistof i 30 minutter, blev prøverne farvet med DAB (3, 3-diaminobenzidin). Endelig blev snittene modfarvet med hematoxylin, dehydreret og monteret. En negativ kontrol blev opnået ved at erstatte det primære antistof med en normal murin IgG. Kendte Immunofarvning-positive colorectal carcinom objektglas blev anvendt som positive kontroller som tidligere rapporteret [27].
Den brune granuler i cytoplasmaet i 14-3-3σ blev betragtet som positiv farvning. Vi scorede farvningen intensitet som følger: 0, ingen farvning; 1+, mild farvning; 2+, moderat farvning; 3+, intens farvning. Arealet af farvning blev bedømt som følger: 0, ingen farvning af celler i eventuelle mikroskopiske felter; 1+, < 30% af væv farvet positive; 2+, mellem 30% og 60% farvet positive; 3+, > 60% farvet positive. 14-3-3σ ekspression blev vurderet ved kombineret vurdering af farvningsintensitet og udvidelse. Den mindste score, når summeres (intensitet + udvidelse) var 0, og den maksimale var 6. Kriterierne i denne undersøgelse er blevet bredt tidligere accepteret [24]. Angivelse af 14-3-3σ blev vurderet og scoret af to uafhængige patologer (Drs. F Tang og ZY Feng), der var blindet til de klinisk-patologiske data. Aftalen af disse to patologer på IHC score nåede til 84% (128 identiske scores i alt 152 sager), hvilket tyder på vores pointsystem var yderst solid og reproducerbar. Hvis resultaterne er rapporteret af de to patologer var konsekvent, blev den valgte værdi. de interobserver uenigheder (ca. 6% af de samlede sager) blev imidlertid revideret for anden gang, efterfulgt af en endelig dom, som begge patologer.
Western blot-analyse
mavekræft og parrede normale tilstødende maveslimhinden væv var jorden og lyseret med RIPA-buffer på is, før det underkastes Western blot-analyse. Proteinkoncentrationen blev påvist ved Bradford-metoden med BSA (Sigma-Aldrich) som standard. Ens mængder af celler og væv ekstrakt (40 ug) blev underkastet SDS-PAGE og overført til nitrocellulose-membran (Bio-Rad) til antistof-blotting. Membranen blev derefter blokeret og inkuberet med muse-anti-glyceraldehyd-3-phosphat-dehydrogenase (GAPDH) antistof (Abmart, # M20006) og muse-anti-14-3-3σ antistof (Santa Cruz, SC-100638).
Udvælgelse af cutoff score for 14-3-3σ "positive" udtryk
ROC kurve analyse blev udsat for udvælgelsen af 14-3-3σ cutoff score i træningssættet, som tidligere [29] beskrevet. Kort fortalt, idet sensitivitet og specificitet for udfaldet studeret på hver score blev plottet at generere en ROC-kurve. Den score lokaliseret tættest på det punkt ved maksimal følsomhed og specificitet, det punkt (0,0, 1,0) på kurven, blev valgt som cutoff score fører til det største antal tumorer som korrekt blev klassificeret som havende eller ikke havende resultatet. For at lette ROC kurve analyse blev overlevelse funktioner dikotomiseret:. Overlevelse (død VS. andre (censureret, levende eller død af andre årsager))
Opfølgning
Alle patienter havde opfølgende poster for over 5 år. Efter afslutning af terapien blev patienterne observeret efter 3 måneders intervaller i de første 3 år og med 6 måneders intervaller derefter. Samlet overlevelse blev defineret som tiden fra diagnose til dødsdagen eller når censused på den seneste dato, hvis patienterne stadig var i live. Progressionsfri overlevelse blev defineret som tiden fra diagnosen til datoen for lokale svigt /fjernmetastaser eller datoen for død eller når censused på den seneste dato.
Statistisk analyse Hus Til overlevelsesanalyse, optimal beskæringspunkts for 14- 3-3σ ekspression blev opnået ved ROC-analyse i træningssættet (n = 66). Til validering, blev forholdet mellem 14-3-3σ ekspression, som blev klassificeret af ROC-analyse-genereret cutoff point, og OS, PFS evalueret i afprøvningen sæt (n = 86) og samlede patienter (n = 152). Den chi-square test eller Fishers eksakte test blev anvendt til at vurdere forholdet mellem 14-3-3σ udtryk og klinisk-patologiske variabler. Den multivariate Cox proportionel risiko model blev anvendt til at estimere hazard ratio og 95% konfidensintervaller for patient resultat. Forholdet mellem 14-3-3σ udtryk og OS, blev PFS bestemt af Kaplan-Meier analyse. De log-rank test blev udført for at værdsætte forskellen i overlevelsessandsynligheder mellem patient delmængder. Alle p
værdier citerede var to-sidet og p
< 0,05 blev betragtet som statistisk signifikant. Statistisk analyse blev udført ved hjælp af SPSS v. 17,0 (SPSS, Inc, Chicago, IL).
Resultater
14-3-3σ udtryk i mavekræft og normale maveslimhinden væv
blev opdaget 14-3-3σ i cytoplasmaet og overudtrykt i gastrisk cancer (figur 1A og 1 A '), mens normale parrede gastriske mucosale væv viste næsten negativ ekspression (figur 1B og 1B). I overensstemmelse med dette resultat, Western blot-analyse afslørede en lignende konklusion i gastrisk cancer og normale tilgrænsende gastriske mucosale væv (figur 1C). Figur 1 14-3-3σ ekspression i humane primære gastrisk cancer og normale tilgrænsende gastrisk slimhindevæv. (A) 14-3-3σ blev påvist i cytoplasmaet og overudtrykt i gastrisk cancer væv (100 ×). (B) Tilstødende ikke neoplastiske gastrisk slimhindevæv viste næsten negativ ekspression af 14-3-3σ (100 ×). (A '), (B') demonstrerede højere forstørrelse (400 x) fra det område af boksen i (A) og (B) hhv. (C) Western blot-analyse af 14-3-3σ ekspression i repræsentative primær gastrisk cancer væv (T) og normal tilstødende slimhindevæv (N). Lige belastning af protein blev bestemt ved GAPDH.
For yderligere at vurdere overlevelse analyse og undgå problemerne med flere valg beskæringspunkts blev ROC kurve analyse anvendes til bestemmelse cutoff score for 14-3-3σ udtryk. Som vist i figur 2A og 2B, den 14-3-3σ cutoff score for OS og PFS i træningssættet var 3,25 (p
< 0,001) og 3,35 (p
= 0,003) henholdsvis. Vi valgte således en 14-3-3σ udtryk score på 3 (> 3 VS. ≤ 3) som den ensartede cutoff point for overlevelse analyse i sættet testning. Figur 2 Receiver opererer karakteristiske (ROC) kurver analyse af 14-3-3σ cutoff score i træningssættet. (A) 14-3-3σ cutoff point for samlet overlevelse i træningssættet. (B) 14-3-3σ cutoff point for progressionsfri overlevelse i træningssættet. Ved hver immunhistokemisk score, idet følsomheden og specificiteten for udfaldet undersøgt blev afbildet, hvorved der genereres et ROC-kurve. 14-3-3σ cutoff score for samlet overlevelse, progressionsfri overlevelse var 3,25 og 3,35 hhv.
14-3-3σ udtryk og kliniske funktioner
De kliniske funktioner i disse to grupper af patienter, herunder alder, køn , klinisk fase, tumor invasion, node fase, histologi differentiering, 14-3-3σ udtryk, blev opsummeret i tabel 1. ROC-afledte 14-3-3σ cutoff score på 3 i uddannelsen indstillet held adskilt test sat i høj ( 44/86, 51,2%) og lav (42/86, 48,8%) 14-3-3σ udtryk undergrupper. Høj udtryk for 14-3-3σ blev hovedsageligt findes i mere avancerede tumor stadier (77/107 i fase III + IV VS. 12/45 i p
fase I + II, = 0,004). Desuden korrelationsanalyse viste, at høj 14-3-3σ udtryk var korreleret med klinisk udvikling (p
< 0,001 for både sæt) og tumor invasion (p
< 0,001 for uddannelse sæt og p
= 0,005 til test sæt) i begge sæt. 14-3-3σ forbundet til patienternes alder i sættet test (p
= 0,01), men ikke i træningssættet. Vi kunne ikke påvise nogen sammenhæng mellem 14-3-3σ med andre patientkarakteristika, herunder køn, node scenen, og histologi differentiation.Table en sammenslutning af 14-3-3σ udtryk med patientens karakteristika i primær gastrisk kræft
Variabel
Alle sager
Training sæt (n = 66)
Test sæt (n = 86)
|
High
udtryk
Low
udtryk
p
en
High
udtryk
Low
udtryk
p
en
Alder (år)
≥ 58.00 b
83
25 (30,1%)
13 (15,7%)
0,627
29 (34,9%)
16 (19,3%)
0,010
< 58.00
69
20 (29,0%)
8 (11,6%)
15 (21,7%)
26 (37,7%)
Køn
Male
105
29(27.6%)
16(15.2%)
0.340
31(29.5%)
29(27.6%)
0.887
Female
47
16(34.0%)
5(10.6%)
13 (27,7%)
13 (27,7%)
Klinisk fase
I + II
45
6 (13,3%)
12 (26,7%)
0,000
6 (13,3%)
21 (46,7%)
0.000
III + IV
107
39 (36,4%)
9 (8,4%)
38 (35,5 %)
21 (19,6%)
Tumor invasion
T1+T2
23
0(0%)
7(30.4%)
0.000
3(13.0%)
13(56.5%)
0.005
T3+T4
129
45(34.9%)
14(10.9%)
41 (31,8%)
29 (22,5%)
Node fase
N0+N1
101
32(31.7%)
15(14.9%)
0.979
24(23.8%)
30(29.7%)
0.105
N2+N3
51
13(25.5%)
6(11.8%)
20 (39,2%)
12 (23,5%)
Histologi-differentiering
Well
51
15(29.4%)
11(21.6%)
0.123
11(21.6%)
14(27.5%)
0.395
Poorly
101
31(30.7%)
10(9.9%)
33 (32,7%)
28 (27,7%)
en x2 test
b median alder
14-3-3σ udtryk og overlevelse analyse: univariat overlevelsesanalyse
Som vist i figur 3A og 3C viste Kaplan-Meier analyse, forhøjet 14-3-3σ udtryk kraftigt forudsagde en ringere OS i sættet test (p
< 0,001) og overordnede patienter (p
< 0,001). Desuden 14-3-3σ ekspression var også en stærk prognostisk faktor for PFS i afprøvningen apparat (s
< 0,001, figur 3B) og samlede patienter (p
< 0,001, figur 3D). I betragtning af den dårlige resultat i sene mavekræft, blev yderligere analyse udført med hensyn til 14-3-3σ udtryk i delmængder af mavecancerpatienter med stadium III og IV. Resultaterne viste, at sammenlignet med 14-3-3σ lav ekspression, høj ekspression af 14-3-3σ viste en signifikant tendens mod værre OS og PFS i mavecancerpatienter af stadium III (p
= 0,001 for OS og p
= 0,017 for PFS, figur 4A og 4B) og trin IV (p
< 0,001 til OS og p
= 0,001 for PFS, 4C og 4D). Resultater i de samlede patienter svarede til dem fundet i test sæt (figur 4E-H). Figur 3 Kaplan-Meier overlevelsesanalyse af 14-3-3σ ekspression i sættet prøvning og overordnede patienter. (A) Højere 14-3-3σ udtryk var tæt korreleret med dårlig samlet overlevelse og (B) progressionsfri overlevelse i sættet test. (C) Patienter med højere 14-3-3σ udtryk erhvervede også en ringere samlet overlevelse og (D) progressionsfri overlevelse i overordnede patienter. I sættet test og overordnede patienter, den gennemsnitlige varighed af den samlede overlevelse for patienter med lav og høj ekspression af 14-3-3σ var 73,0 VS. 17,0 måneder (p
< 0,001) og 73,0 VS. 14.0 måneder (p
< 0,001). Henholdsvis
figur 4 Kaplan-Meier overlevelsesanalyse af 14-3-3σ udtryk i delmængder af mavecancerpatienter med stadium III og IV (log-rank test). (A) Sandsynlighed for samlet overlevelse og (B) progressionsfri overlevelse af patienter med stadium III mavekræft i afprøvningen sæt: lav udtryk, n = 17; høj ekspression, n = 26; (C) Sandsynlighed for samlet overlevelse og (D) progressionsfri overlevelse fase IV patienter med mavekræft i sættet test: lav udtryk, n = 5; høj ekspression, n = 11. (E) Sandsynlighed for samlet overlevelse og (F) progressionsfri overlevelse af patienter med stadium III mavekræft i de overordnede patienter: lavt udtryk, n = 22; høj ekspression, n = 55; (G) Sandsynlighed for samlet overlevelse og (H) progressionsfri overlevelse fase IV patienter med mavekræft i de overordnede patienter: lavt udtryk, n = 9; høj ekspression, n = 21.
Multivariate Cox regressionsanalyse
at undgå indflydelse forårsaget af univariat analyse, ekspressionen af 14-3-3σ samt andre parametre blev undersøgt i multivariat Cox-analyse (tabel 2 og tabel 3). I sættet test, blev 14-3-3σ faktisk vist sig at være en betydelig uafhængig prognostisk faktor for dårlig OS (hazard ratio, 4,527; 95% CI, 2,274-9,012; p
< 0,001; tabel 2) og PFS (hazard ratio, 3,582; 95% CI, 1,717-7,475; p
= 0,001; tabel 2). Lignende resultater blev også observeret i de overordnede patienter (hazard ratio 5,161; 95% CI, 2,990-8,909; p
< 0,001 til OS og hazard ratio, 4,416; 95% CI, 2,482-7,856; p
<0,001 til PFS, tabel 3). Af andre parametre, blev klinisk fase fundet at være en uafhængig prognostisk faktor for patientens overlevelse i sættet test, men ikke i de samlede patients.Table 2 Resultater af multivariat Cox proportional-farer analyse test sæt
Variabel
For døden
For progressionsfri overlevelse
|
Hazard Ratio
95%
konfidensinterval
p
Hazard Ratio
95%
konfidensinterval
p
Age < 58.00
år (vs. ≥ 58 år)
1,101
0,637 til 1,902
0,731
1,056
0,577-1,936
0,859
Køn Mand
(VS . Female)
0,772
0,408-1,461
0,427
1,049
0,525-2,094
0,892
Klinisk fase
IV + III (VS. II + I)
3,391
1,156-9,949
0,026
5,220
1,529 til 17,823
0,008
Tumor invasion
T 4 + T3 (VS. T 2 + T 1)
1,066
0,320-3,553
0,917
0.730
0,206-2,585
0,626
Nodal stadie N 3 + N 2 Hotel (VS. N 1 + N 0)
0,705
0,387-1,282
0,251
0,735
0,373-1,448
0,373
Differentiering
Low (VS. Høj)
0,862
0,437-1,701
0,668
0,936
0,442-1,982
0,863
14-3-3σ
Positiv (VS. negativ)
4,527
2,274-9,012
0.000
3,582
1,717 til 7,475
0.001
tabel 3 Resultater af multivariat Cox proportional-farer analyse overordnede patienter
Variabel
For døden
For progressionsfri overlevelse
|
Hazard Ratio
95%
konfidensinterval
p
Hazard Ratio
95%
konfidensinterval
p
Age < 58.00
år (vs. ≥ 58 år)
1,046
0,701 til 1,562
0,825
1,036
0654-1,642
0,880
Køn Mand
(VS . Female)
0,713
0,474 to1.073
0,105
0,733
0,409-1,278
0,165
Klinisk fase
IV + III (VS. II + I)
0,988
0,500 to1.952
0,972
1,355
0,558-3,121
0,476
Tumor invasion
T 4 + T3 (VS. T 2 + T 1 )
2,175
0,896-5,278
0,086
1,432
0,547-3,747
0,
|  Steve's SCD Diet Healing Journal:Uge 23 – SCD legal Summer Cocktails
Steve's SCD Diet Healing Journal:Uge 23 – SCD legal Summer Cocktails
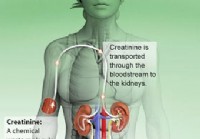 Kreatinin blodprøve (normale, lave, høje niveauer)
Kreatinin blodprøve (normale, lave, høje niveauer)
 Hvad er hyppig vandladning et tegn på?
Hvad er hyppig vandladning et tegn på?
 Sådan slipper du af med gas med det samme
Sådan slipper du af med gas med det samme
 Opdagelse af den hemmelige årsag til din sygdom...
Opdagelse af den hemmelige årsag til din sygdom...
 6 kasusstudier af tarminfektion:Hvorfor du bør få afføringstest udført ASAP
6 kasusstudier af tarminfektion:Hvorfor du bør få afføringstest udført ASAP
 Hvor længe kan du leve med trin 5 nyresygdom?
Selvom levetiden for fase 5 nyresygdom afhænger af visse faktorer, varierer den gennemsnitlige tid, en patient lever fra 5 til 10 år. Det er svært at sige, hvor længe du kan leve med fase 5 nyresygdo
Hvor længe kan du leve med trin 5 nyresygdom?
Selvom levetiden for fase 5 nyresygdom afhænger af visse faktorer, varierer den gennemsnitlige tid, en patient lever fra 5 til 10 år. Det er svært at sige, hvor længe du kan leve med fase 5 nyresygdo
 Rom-kriterierne for Irritable Bowel Syndrome (IBS)
Irritabel tyktarm (IBS) er stort set klassificeret som en udelukkelsestilstand. Med andre ord diagnosticeres IBS normalt, efter at alle andre årsager til symptomer, såsom infektion eller sygdom, er ud
Rom-kriterierne for Irritable Bowel Syndrome (IBS)
Irritabel tyktarm (IBS) er stort set klassificeret som en udelukkelsestilstand. Med andre ord diagnosticeres IBS normalt, efter at alle andre årsager til symptomer, såsom infektion eller sygdom, er ud
 Årsager til blødning fra esophageal-varicer
Esofagus-varicer er åreknuder i spiserøret. Disse årer, som alle åreknuder, kan briste og bløde meget let. Esophageal variceal blødning er en potentielt livstruende tilstand, som skal genkendes og beh
Årsager til blødning fra esophageal-varicer
Esofagus-varicer er åreknuder i spiserøret. Disse årer, som alle åreknuder, kan briste og bløde meget let. Esophageal variceal blødning er en potentielt livstruende tilstand, som skal genkendes og beh