Eine wirksame Arzneimittelentwicklung muss die Anzahl der in den Zyklus eintretenden Arzneimittelkandidaten rationalisieren, um die Kosten und die Zeit des Prozesses zu senken. Jüngste Studien empfehlen die Integration einer Vielzahl von Techniken zur Entwicklung von Pipelines für Forschung und Entwicklung (F&E) sowie die Verwendung genetischer Daten, um die wahrscheinlich erfolgreichsten neuen Medikamente zu identifizieren. Proteomik und Transkriptomik gehören zu den wertvollsten Gebieten in diesem Zusammenhang.
Derzeit, Es gibt über 150 klinische Studien, in denen Medikamente getestet werden, von denen angenommen wird, dass sie das Überleben von COVID-19-Patienten erhöhen und die Genesung verbessern. Dazu gehören Hydroxychloroquin, Chloroquin, und Baricitinib.
Ein anderer Weg, um Beweise für potenziell nützliche Medikamente gegen COVID-19 zu sammeln, besteht darin, die Wirtsproteine zu finden, die den Viruseintritt und die Infektion erleichtern. und durch Prüfung der Möglichkeit, frühere Wirkstoffziele im SARS-CoV wiederzuverwenden, um das aktuelle Virus zu bekämpfen, schweres akutes respiratorisches Syndrom Coronavirus 2 (SARS-CoV-2).
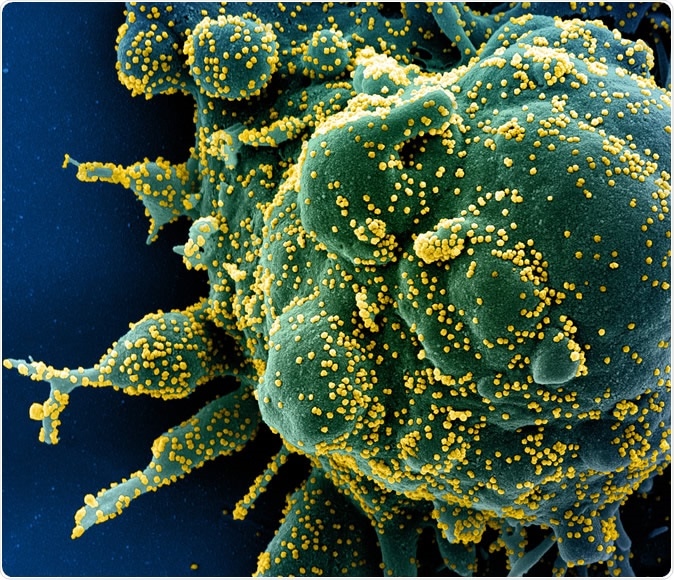 Neuartiges Coronavirus SARS-CoV-2 Farbige rasterelektronenmikroskopische Aufnahme einer apoptotischen Zelle (grün), die stark mit SARS-COV-2-Viruspartikeln (gelb) infiziert ist, aus einer Patientenprobe isoliert. Bild aufgenommen in der NIAID Integrated Research Facility (IRF) in Fort Detrick, Maryland. Bildnachweis:NIAID
Neuartiges Coronavirus SARS-CoV-2 Farbige rasterelektronenmikroskopische Aufnahme einer apoptotischen Zelle (grün), die stark mit SARS-COV-2-Viruspartikeln (gelb) infiziert ist, aus einer Patientenprobe isoliert. Bild aufgenommen in der NIAID Integrated Research Facility (IRF) in Fort Detrick, Maryland. Bildnachweis:NIAID Eine kürzlich durchgeführte Studie fand über 330 menschliche Wirtsproteine, die für die Infektion des Menschen mit dem Virus notwendig sind. Diese interagieren mit 26 viralen Proteinen. Dies könnte dazu beitragen, die Forschung und Entwicklung auf der ersten Route voranzutreiben.
Die zweite Methode wurde von einigen Studien verwendet, die 59 Mausgene hervorgebracht haben, die mit der früheren SARS-CoV-Infektion in Verbindung gebracht werden. Unter diesen, es gibt 44, die Äquivalente im menschlichen Genom haben. Durch die Blockierung von Virus-Human-Protein-Interaktionen, Es könnte möglich sein, virale Infektionsmechanismen effektiver mit einer geringeren Wahrscheinlichkeit einer Arzneimittelresistenz zu bekämpfen, im Vergleich zur direkten Bekämpfung des Virus.
Ein Hauptproblem bei diesem Ansatz ist die Gefahr, unbeabsichtigt andere Wirkungen hervorzurufen, die komplexe Krankheitszustände verschlimmern oder ihnen sogar zugute kommen könnten. Die aktuelle Studie zielt darauf ab, zu evaluieren, wie sich diese Wirkstoffziele auf die Funktion des menschlichen Körpers auswirken könnten. basierend auf dem Verständnis der zugrunde liegenden Genetik.
Die Forscher verwendeten das Protokoll zur Priorisierung von Medikamenten, die sie früher erfolgreich entwickelt haben, 353 Wirkstoffziele zu testen, die möglicherweise mit dem Virus interagieren. Sie wollten beobachten, wie diese Medikamente andere äußerlich erkennbare Auswirkungen der Infektion verursachen, und wie sie bei komplexen Krankheiten sowohl beabsichtigte als auch unbeabsichtigte Wirkungen erzielten.
Sie erstellten zunächst einen Krankheitsatlas, der die menschlichen Proteine und Gene darstellt, die am Viruseintritt beteiligt sind. Dies geschah über Mendelsche Randomisierungsstudien, Bereitstellung von über 372, 000 einzigartige Vorhersagen darüber, wie das Medikament eine Krankheit beeinflusst. Dies basierte sowohl auf Plasma-Proteomik als auch auf gewebespezifischer Transkriptomik.
Als Ergebnis, Sie konnten bewerten, wie diese 353 potenziellen Medikamente bei 49 Phänotypen einer Virusinfektion wirken könnten, wie sie über 500 komplexe Krankheiten beeinflussen könnten, und 72 Phänotypen der Krankheit ändern. Diese Ergebnisse wurden anhand von Daten aus Arzneimittelstudien, sowie das medikamentöse Genom, die Top-Medikamente mit der höchsten Möglichkeit für eine Wiederverwendung zu identifizieren, und die geringsten Nebenwirkungen.
Sie haben eine Open-Access-Online-Plattform geschaffen, die die Ergebnisse aller Tests enthält, um es jedem zu ermöglichen, die Ergebnisse für eines der Medikamente schnell zu überprüfen.
Der Atlas der Arzneimittel-Target-Krankheit-Wechselwirkungen bietet über 370, 000 Zielkrankheitsassoziationen in 11 Geweben, die für das COVID-19-Szenario relevant sind. Von ihnen, 833 hatten starke Beweise aus der MR-Bildgebung der 11 Gewebe. 726 davon zeigten auch eine robuste Kolokalisation, für eine Kolokalisationswahrscheinlichkeit von über 70 %. Dies waren die robustesten Ergebnisse der Studie.
Die Bedeutung des Nachweises solcher Assoziationen ist die Fähigkeit, Analysen durchzuführen, wie sich die Expression bestimmter Targets auf bestimmte Krankheiten auswirkt, je nach Gewebe. Zum Beispiel, die Auswirkungen der Wirkstoffziele auf Morbus Crohn, Hypertonie, atopische Störungen, und Diabetes festgestellt werden konnte. Irgendwo von 11-17 der Zielgene hatten Assoziationen mit diesen vier Krankheiten, basierend darauf, welches Gewebe untersucht wurde.
Zweitens, die Wirkstoff-Targets wurden auf Assoziation mit 49 viralen Infektionsphänotypen analysiert. Es gab zwei starke Assoziationen, nämlich, das NEU1-Gen bei chronischer Hepatitis und das DPY19L1-Gen bei viraler Enteritis. Es gab auch drei weniger starke, aber suggestive Assoziationen, wie das JAK2-Gen bei chronischer Hepatitis.
Drittens, die studie zeigte 45 potenzielle wege, auf denen die proteine Krankheitsmerkmale beeinflussen könnten, und 430 ähnliche assoziationen mit der mRNA-Expression. Unter diesen, es gab 95 Targets, die mit 105 Krankheiten oder Krankheitsausprägungen assoziiert waren. Das JAK2-Gen, zum Beispiel, ist mit neun Krankheitsphänotypen verbunden, von Atopie bis Fettleibigkeit, was auf potentiell pleiotrope Wirkungen für dieses Gen hindeutet.
Schließlich, Sie fanden 249 Assoziationen, bei denen das Wirkstoffziel einen Krankheitsphänotyp je nach analysiertem Gewebe unterschiedlich beeinflusste. Darunter waren 52 einzigartige Gene, die in 7 Geweben exprimiert wurden, um 47 einzigartige Krankheiten zu beeinflussen.
Es gab 29 stark assoziierte gewebeabhängige Wirkungen des Wirkstoff-Targets auf die Krankheit in mehr als einem einzelnen Gewebe. von denen nur zwei nicht die gleiche Wirkungsrichtung zeigten, wenn sie im Blut sowie in einer Reihe anderer Gewebe exprimiert wurden.
Zum Beispiel, das DHODH-Gen beeinflusst das Lipoprotein-Cholesterin niedriger Dichte (LDL). Ein Medikament, das gegen hohes LDL vermarktet wird, genannt Leflunomid, funktioniert, indem es dieses Gen hemmt. Leflunomid wird auch als COVID-19-Therapie erwogen.
Die Analyse zeigte, dass dieses Medikament nur in Bezug auf LDL ohne viele andere unterschiedliche Wirkungen exprimiert wird. über ein breites Gewebespektrum von der Lunge bis zum Dickdarm.
Die Forscher bewerteten die 726 von MR gefundenen Assoziationen zwischen Ziel und Krankheit, unter Verwendung von Daten aus klinischen Studien sowie der mutmaßlichen Beweise dafür, dass sie unterschiedliche phänotypische Wirkungen in einer Reihe von Geweben verursachten, um die betäubendsten Assoziationen zu finden. 499 davon waren einzigartige Kombinationen von Ziel und Krankheit, wobei die anderen in mehr als einem Gewebe beobachtet werden.
Sie richteten vier Wertungsklassen ein, wie der Omics-Score, das Probeergebnis, der Drogenfähigkeits-Score, und der Infektionsindex. Jede Punktzahl wurde von 1 bis 100 skaliert. Es gab hohe Punktzahlen für 2 der 499 Verbände in 3 von 4 Klassen, was sie zu den Zielen mit der höchsten Entwicklungspriorität machte. 77 schnitten in zwei Klassen hoch ab und 97 in einer. Die verbleibenden 323 wiesen allgemein niedrige Werte auf und gelten daher als Wirkstoffziele mit der niedrigsten Priorität.
Einige Ziele umfassen das ITGB5-Gen, auf das das Medikament Cilengitide abzielt, die für Glioblastome und ähnliche Tumoren gedacht war. Seine hohen Werte und das genetische Profil deuten darauf hin, dass es das Potenzial hat, den Bluthochdruck zu senken. Unter den Top 5, allen fehlten starke Assoziationen mit Erkrankungen wie Herzrhythmusstörungen, die ihre Verwendung bei COVID-19 beeinträchtigen könnten.
Auf der anderen Seite, das TLR9-Gen, auf die das Medikament Hydroxychloroquin abzielt, hat hohe Werte in zwei Kategorien, aber niedrige Werte für die anderen beiden. Es liegen noch keine klinischen Beweise für den antiviralen oder klinischen Nutzen einer Kombination dieses Arzneimittels mit Azithromycin vor. Außerdem, dieses Gen kann die Wahrscheinlichkeit eines embolischen Schlaganfalls erhöhen, Asthma, und bestimmte Immunzustände.
Die Studie konnte die Priorisierung von Arzneimittelzielen auf drei Arten fördern:Untersuchung der Sicherheitsprobleme, die sich aus der Umnutzung von Arzneimitteln für die COVID-19-Behandlung ergeben können; Identifizierung vielversprechender Wirkstoffziele; und Herausfinden, wie das Wirkstoffziel das menschliche Phänomen in verschiedenen Geweben beeinflusst.
Mit diesem Ansatz, ein potenzielles Medikament, Baricitinib, wird auf seine Wirksamkeit bei COVID-19 getestet. Es wird angenommen, dass es das JAK2-Protein hemmt, und reduzieren so systemische Entzündungen. Jedoch, die aktuelle Studie schlug vor, dass es auch chronische Hepatitis verursachen könnte. Eigentlich, die Literatur legt nahe, dass Hepatitis B nach Behandlung mit dem JAK-2-Hemmer Ruxolitinib reaktiviert wird.
Zu den drei Medikamenten mit hohem Potenzial aus dieser Studie gehören das Immunsuppressivum Leflunomid, bei rheumatoider Arthritis eingesetzt, unter anderen Bedingungen, und Cilengitide. Ersteres hat antivirale Aktivität gegen mehrere Viren, und die aktuelle Studie legt auch nahe, dass es lipidsenkende Eigenschaften hat, während letztere blutdrucksenkende Wirkung hat, möglicherweise.
Schließlich, einige dieser Targets werden in mehreren Geweben exprimiert, um den gleichen Phänotyp zu erzeugen, andere zeigen jedoch eine sich ändernde, gewebespezifische Expression.
Obwohl einige Einschränkungen bestehen, Die Studie bietet eine Pipeline für statistische genetische Studien und eine Open-Access-Plattform, um Wirkstoffziele gegen COVID-19 nach Priorität zu ordnen. Genomweite Assoziationsstudien (GWAS) könnten die Datenqualität weiter verbessern, Dies macht es noch nützlicher, vielversprechende Wirkstoffziele unter potenziell wiederverwendeten Wirkstoffen zu finden.
medRxiv veröffentlicht vorläufige wissenschaftliche Berichte ohne Peer-Review und deshalb, sollte nicht als schlüssig angesehen werden, die klinische Praxis/das gesundheitsbezogene Verhalten anleiten, oder als etablierte Information behandelt.
 Sind Antidepressiva bei Reizdarmsyndrom nützlich?
Sind Antidepressiva bei Reizdarmsyndrom nützlich?
 Rohschokoladen-Mandarinen-Tarte
Rohschokoladen-Mandarinen-Tarte
 Wissenschaftler entwickeln einen Ansatz zur Impfung gegen Darmentzündungen
Wissenschaftler entwickeln einen Ansatz zur Impfung gegen Darmentzündungen
 Symptome und Behandlung von Magengeschwüren bei Kindern
Symptome und Behandlung von Magengeschwüren bei Kindern
 Was Sie über pflanzliche stimulierende Abführmittel wissen müssen
Was Sie über pflanzliche stimulierende Abführmittel wissen müssen
 Röntgendiagnostik des scharfen Ileus - Diagnostik des akuten Abdomens
Röntgendiagnostik des scharfen Ileus - Diagnostik des akuten Abdomens
 Was Sie über Bentyl (Dicyclomine) wissen müssen
Bentyl (Dicyclomin) ist eine Art von Medikament, das als Anticholinergikum bekannt ist. Es ist auch ein krampflösendes Mittel, das Krämpfe in den Darm- und Blasenmuskeln verhindert, indem es diese Mus
Was Sie über Bentyl (Dicyclomine) wissen müssen
Bentyl (Dicyclomin) ist eine Art von Medikament, das als Anticholinergikum bekannt ist. Es ist auch ein krampflösendes Mittel, das Krämpfe in den Darm- und Blasenmuskeln verhindert, indem es diese Mus
 Erstmals Mikroplastik in menschlichen Abfällen nachgewiesen
Eine Analyse von menschlichen Stuhlproben von Teilnehmern aus acht Ländern ergab, dass jede einzelne getestete Probe Mikroplastik enthielt und bis zu neun verschiedene Kunststoffe vorhanden waren.
Erstmals Mikroplastik in menschlichen Abfällen nachgewiesen
Eine Analyse von menschlichen Stuhlproben von Teilnehmern aus acht Ländern ergab, dass jede einzelne getestete Probe Mikroplastik enthielt und bis zu neun verschiedene Kunststoffe vorhanden waren.
 Wie kann ich meinen aufgeblähten Bauch reduzieren?
Was ist Blähungen? Blähungen können dazu führen, dass sich Ihr Magen ausgestreckt oder zu voll anfühlt. Reduzieren Sie Ihren aufgeblähten Bauch, indem Sie Kamille, Anis, Kümmel, Koriander, Kurkuma
Wie kann ich meinen aufgeblähten Bauch reduzieren?
Was ist Blähungen? Blähungen können dazu führen, dass sich Ihr Magen ausgestreckt oder zu voll anfühlt. Reduzieren Sie Ihren aufgeblähten Bauch, indem Sie Kamille, Anis, Kümmel, Koriander, Kurkuma