Tehokkaan lääkekehityksen on virtaviivaistettava sykliin tulevien ehdokaslääkkeiden määrää, alentaa prosessin kustannuksia ja aikaa. Viimeaikaiset tutkimukset suosittelevat erilaisten tekniikoiden sisällyttämistä tutkimus- ja kehitystyökalujen kehittämiseen sekä geneettisten tietojen käyttämistä todennäköisimpien onnistuneiden uusien lääkkeiden tunnistamiseksi. Proteomiikka ja transkriptiikka ovat arvokkaimpia aloja tätä tarkoitusta varten.
Nykyisessä, yli 150 kliinisessä tutkimuksessa testataan lääkkeitä, joiden uskotaan mahdollisesti tehostavan eloonjäämistä ja parantavan COVID-19-potilaiden elpymistä. Näitä ovat hydroksiklorokiini, klorokiini, ja barisitinibi.
Toinen tapa kerätä todisteita mahdollisesti hyödyllisistä lääkkeistä COVID-19:tä vastaan on löytää isäntäproteiinit, jotka helpottavat viruksen pääsyä ja tartuntaa, ja tutkimalla mahdollisuutta asettaa aikaisemmat huumeiden kohteet uudelleen SARS-CoV:ssä nykyisen viruksen torjumiseksi, vakava akuutti hengitystieoireyhtymä koronavirus 2 (SARS-CoV-2).
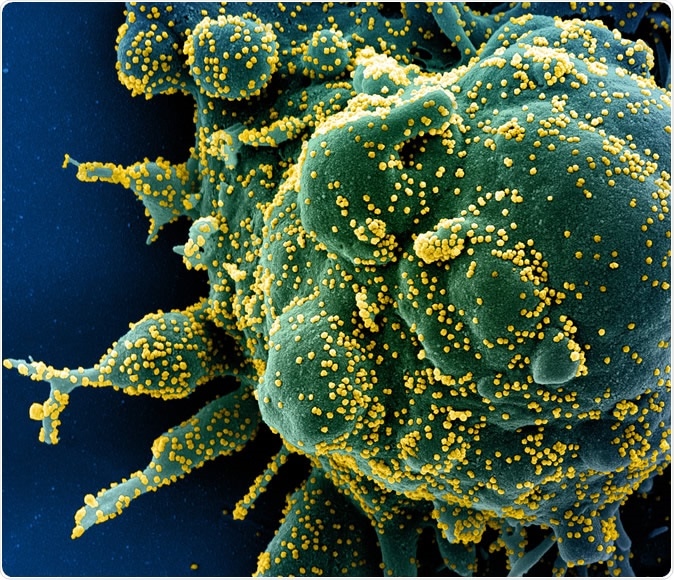 Uusi koronavirus SARS-CoV-2 Värjätty pyyhkäisyelektronimikroskooppi apoptoottisesta solusta (vihreä), joka on voimakkaasti saastunut SARS-COV-2-viruspartikkeleilla (keltainen), eristetty potilasnäytteestä. Kuva otettu Fort Detrickin NIAID:n integroidussa tutkimuslaitoksessa (IRF), Maryland. Luotto:NIAID
Uusi koronavirus SARS-CoV-2 Värjätty pyyhkäisyelektronimikroskooppi apoptoottisesta solusta (vihreä), joka on voimakkaasti saastunut SARS-COV-2-viruspartikkeleilla (keltainen), eristetty potilasnäytteestä. Kuva otettu Fort Detrickin NIAID:n integroidussa tutkimuslaitoksessa (IRF), Maryland. Luotto:NIAID Äskettäisessä tutkimuksessa löydettiin yli 330 ihmisen isäntäproteiinia, jotka ovat välttämättömiä viruksen tartuttamiseksi ihmisiin. Nämä ovat vuorovaikutuksessa 26 virusproteiinin kanssa. Tämä voisi edistää T &K -toimintaa ensimmäisellä reitillä.
Toista menetelmää on käytetty muutamissa tutkimuksissa, jotka ovat tuottaneet 59 hiiren geeniä, jotka liittyvät aikaisempaan SARS-CoV-infektioon. Näiden joukossa on 44, joilla on vastaavat ihmisen genomissa. Estämällä viruksen ja ihmisen proteiinien vuorovaikutuksia, voi olla mahdollista kohdistaa virusinfektiomekanismeja tehokkaammin ja pienempi mahdollisuus lääkeresistenssiin, verrattuna suoraan virukseen kohdistamiseen.
Tämän lähestymistavan ensisijainen ongelma on vaara, että tahattomasti syntyy muita vaikutuksia, jotka voivat pahentaa monimutkaisia sairaustilanteita tai jopa hyötyä niistä. Tämän tutkimuksen tarkoituksena on arvioida, miten nämä lääkekohteet voivat vaikuttaa ihmiskehon toimintaan, perustuu taustalla olevan genetiikan ymmärtämiseen.
Tutkijat käyttivät protokollaa lääkkeiden priorisointiin, joita he ovat menestyksekkäästi kehittäneet aiemmin, testata 353 lääkekohdetta, jotka mahdollisesti ovat vuorovaikutuksessa viruksen kanssa. He halusivat seurata, miten nämä lääkkeet aiheuttivat muita ulkoisesti havaittavia infektion vaikutuksia, sekä siitä, miten he saavuttivat toivotut ja tahattomat vaikutukset monimutkaisiin sairauksiin.
He rakensivat ensin sairauden atlasin, joka näytti ihmisen proteiineja ja geenejä, jotka osallistuvat viruksen tuloon. Tämä tapahtui Mendelin satunnaistamistutkimusten kautta, tarjoaa yli 372, 000 ainutlaatuista ennustetta siitä, miten lääke vaikuttaa sairauteen. Tämä perustui plasman proteomiikkaan sekä kudosspesifiseen transkriptiikkaan.
Tuloksena, he pystyivät arvioimaan, miten nämä 353 potentiaalista lääkettä voisivat toimia 49 virusinfektion fenotyypissä, miten ne voivat vaikuttaa yli 500 monimutkaiseen sairauteen, ja muuttaa 72 taudin fenotyyppiä. Nämä tulokset arvioitiin lääkekokeiden tietojen perusteella, samoin kuin huumeiden käyttökelpoinen genomi, tunnistamaan parhaat huumeet, joilla on suurin mahdollinen käyttötarkoitus, ja vähiten sivuvaikutuksia.
He ovat luoneet online-avoimen käyttöympäristön, joka sisältää kaikkien testien tulokset, jotta kuka tahansa voi tutkia nopeasti minkä tahansa lääkkeen tuloksia.
Lääkekohteiden ja sairauksien yhteisvaikutusten atlas tarjoaa yli 370, 000 kohdetautiyhdistystä 11 kudoksessa, jotka ovat merkityksellisiä COVID-19-skenaariossa. Niistä, 833:lla oli vankkaa näyttöä 11 kudoksen MR -kuvantamisesta. Näistä 726 osoitti myös vahvaa kolokalisoitumista, kolokalisoinnin todennäköisyys on yli 70%. Nämä olivat tutkimuksen vahvimmat havainnot.
Tällaisten yhdistysten havaitsemisen tärkeys on kyky suorittaa analyysejä siitä, miten tiettyjen kohteiden ilmentyminen vaikuttaa tiettyihin sairauksiin, kudoksesta riippuen. Esimerkiksi, lääkekohteiden vaikutukset Crohnin tautiin, verenpaine, atooppiset häiriöt, ja diabetes voidaan arvioida. Missä tahansa kohdegeeneistä 11-17 oli yhteyksiä näihin neljään sairauteen, minkä kudoksen perusteella tutkittiin.
Toiseksi, lääkekohteista analysoitiin yhteys 49 virusinfektion fenotyyppiin. Siellä oli kaksi vahvaa yhdistystä, nimittäin, NEU1 -geeni, jolla on krooninen hepatiitti, ja DPY19L1 -geeni, jolla on viruksen enteriitti. Siellä oli myös kolme vähemmän vahvaa mutta vihjailevaa yhdistystä, kuten JAK2 -geeni, jolla on krooninen hepatiitti.
Kolmanneksi tutkimus osoitti 45 mahdollista tapaa, joilla proteiinit voivat vaikuttaa sairauden piirteisiin, ja 430 samanlaista yhteyttä mRNA:n ilmentymiseen. Näiden joukossa oli 95 kohdetta, jotka liittyivät 105 sairauteen tai taudin ilmentymiseen. JAK2 -geeni, esimerkiksi, liittyy yhdeksään sairauden fenotyyppiin, vaihtelevat atopiasta lihavuuteen, joka ehdottaa mahdollisesti pleiotrooppisia toimia tälle geenille.
Lopuksi, he löysivät 249 yhdistystä, joissa lääkekohde vaikutti sairauden fenotyyppiin eri tavalla analysoidun kudoksen mukaan. Näiden joukossa oli 52 ainutlaatuista geeniä, jotka ilmenivät 7 kudoksessa vaikuttamaan 47 ainutlaatuiseen sairauteen.
Lääkekohteen kudoksesta riippuvaisia vaikutuksia tautiin oli 29 voimakkaasti sidoksissa useampaan kuin yhteen kudokseen, joista vain kaksi ei osoittanut samaa vaikutussuuntaa ilmaistuna veressä ja monissa muissa kudoksissa.
Esimerkiksi, DHODH-geeni vaikuttaa pienitiheyksiseen lipoproteiinikolesteroliin (LDL). Huume, jota markkinoidaan korkeaa LDL:ää vastaan, nimeltään Leflunomide, toimii estämällä tätä geeniä. Leflunomidia harkitaan myös COVID-19-hoitona.
Analyysi osoitti, että tämä lääke ilmentyy vain suhteessa LDL:ään ilman monia muita erilaisia toimia, laajalla kudoskirjoilla keuhkoista paksusuoleen.
Tutkijat pisteytivät 726 MR:n löytämää yhdistettä kohteen ja sairauden välillä, käyttäen kliinisten tutkimusten tietoja sekä oletettua näyttöä siitä, että ne aiheuttivat erilaisia fenotyyppisiä vaikutuksia eri kudoksissa, keksimään huumeidenkäyttävimmät yhdistykset. 499 heistä olivat ainutlaatuisia kohteen ja sairauden pareja, muiden havaittiin useammassa kuin yhdessä kudoksessa.
He perustivat neljä pisteytysluokkaa, kuten omics -pisteet, koepisteet, huumausainepistemäärä, ja infektiopisteet. Jokainen pisteet skaalautui yhdestä 100:een. Korkeat pisteet annettiin kahdelle 499 yhdistyksestä 3:sta 4 luokasta, mikä teki heistä tavoitteet, joilla on korkein kehitysprioriteetti. 77 sijoittui korkealle kahdessa luokassa ja 97 yhdessä. Lopuilla 323:lla oli yleisesti alhaiset pisteet, ja siksi niitä pidetään alhaisimpina huumeiden kohteina.
Jotkut kohteet sisältävät ITGB5 -geenin, jota kohdistaa lääke Cilengitide, joka oli tarkoitettu glioblastoomille ja vastaaville kasvaimille. Sen korkeat pisteet ja geneettinen profiili viittaavat siihen, että sillä on potentiaalia alentaa korkeaa verenpainetta. 5 parhaan joukossa, kaikilla ei ollut vahvaa yhteyttä sellaisiin tiloihin kuin sydämen rytmihäiriöt, jotka voivat vaikuttaa niiden käyttöön COVID-19-taudissa.
Toisaalta, TLR9 -geeni, joka on kohdistettu lääkkeeseen hydroksiklorokiini, on korkeat pisteet kahdessa luokassa, mutta alhaiset pisteet muissa kahdessa. Tämän lääkkeen ja atsitromysiinin yhdistelmän antiviraalista tai kliinistä hyötyä ei ole vielä kertynyt. Lisäksi, tämä geeni voi lisätä embolisen aivohalvauksen mahdollisuutta, astma, ja tietyt immuunijärjestelmät.
Tutkimus pystyi edistämään huumeiden kohteiden priorisointia kolmella tavalla:tarkasteltiin turvallisuusongelmia, joita saattaa aiheutua lääkkeiden uudelleenkäytöstä COVID-19-hoitoon; lupaavien lääkekohteiden tunnistaminen; ja sen selvittäminen, miten lääkekohde vaikuttaa ihmisen fenomiin eri kudoksissa.
Tätä lähestymistapaa käyttämällä mahdollinen lääke, Barisitinibi, sen tehokkuutta COVID-19-taudissa testataan. Sen uskotaan estävän JAK2 -proteiinia, ja siten vähentää systeemistä tulehdusta. Kuitenkin, nykyinen tutkimus ehdotti, että se voi myös aiheuttaa kroonista hepatiittia. Itse asiassa, kirjallisuus viittaa siihen, että hepatiitti B aktivoituu uudelleen JAK 2 -inhibiittorin ruxolitinibihoidon jälkeen.
Tämän tutkimuksen kolme suurta potentiaalista lääkettä sisältävät immunosuppressiivisen lääkkeen Leflunomidin, käytetään nivelreumassa, muiden ehtojen joukossa, ja Cilengitide. Edellisellä on antiviraalinen vaikutus useita viruksia vastaan, ja nykyinen tutkimus viittaa myös siihen, että sillä on lipidejä alentavia ominaisuuksia, kun taas jälkimmäisellä on verenpainetta alentava vaikutus, mahdollisesti.
Lopuksi, jotkut näistä kohteista ilmaistaan useissa kudoksissa saman fenotyypin tuottamiseksi, mutta toiset osoittavat muuttuvaa ekspressiota kudokselle.
Vaikka joitakin rajoituksia on olemassa, tutkimus tarjoaa putkilinjan tilastolliselle genetiikkatutkimukselle ja avoimen alustan, jolla voidaan järjestää lääkekohteet COVID-19-tautia vastaan tärkeysjärjestyksessä. Genomin laajuiset assosiaatiotutkimukset (GWAS) voivat parantaa edelleen tietojen laatua, mikä tekee siitä yhä hyödyllisemmän lupaavien lääkekohteiden löytämisessä mahdollisesti uudelleenkäytettyjen lääkkeiden joukosta.
medRxiv julkaisee alustavia tieteellisiä raportteja, joita ei ole vertaisarvioitu, ja siksi, ei pidä pitää ratkaisevana, ohjaa kliinistä käytäntöä/terveyteen liittyvää käyttäytymistä, tai käsitellään vakiintuneina tietoina.
 Orgasmi:alkuperäinen tulehduskipulääke
Orgasmi:alkuperäinen tulehduskipulääke
 Kuinka löytää oikeat ravitsemusohjeet terveen suoliston kannalta? Rekisteröityneet ravitsemusterapeutit kumoavat 5 yleistä suoliston terveyteen liittyvää myyttiä
Kuinka löytää oikeat ravitsemusohjeet terveen suoliston kannalta? Rekisteröityneet ravitsemusterapeutit kumoavat 5 yleistä suoliston terveyteen liittyvää myyttiä
 SCD Spagetti (unohda nuudelit, kastike on ohjelman tähti)
SCD Spagetti (unohda nuudelit, kastike on ohjelman tähti)
 Mitä ovat laktoosi-intoleranssin oireet?
Mitä ovat laktoosi-intoleranssin oireet?
 5 hylättyä kolonoskopian myyttiä:COVID-19-versio
5 hylättyä kolonoskopian myyttiä:COVID-19-versio
 Miten rei'itetty pohjukaissuolihaava korjataan?
Miten rei'itetty pohjukaissuolihaava korjataan?
 Mikrobit voivat ennustaa kuolemaan johtavia seurauksia hengitetyissä COVID-19-potilaissa
Läsnäolo Mycoplasma salivarium hengitettynä COVID-19-infektion sairastavien potilaiden alemmissa hengitysteissä liittyy lisääntynyt todennäköisyys kuolla. Tulos oli osa molekyylitutkimusta, jossa ta
Mikrobit voivat ennustaa kuolemaan johtavia seurauksia hengitetyissä COVID-19-potilaissa
Läsnäolo Mycoplasma salivarium hengitettynä COVID-19-infektion sairastavien potilaiden alemmissa hengitysteissä liittyy lisääntynyt todennäköisyys kuolla. Tulos oli osa molekyylitutkimusta, jossa ta
 Steve's SCD Diet Healing Journal:Viikko 24 – Lehtikaalisiru epäonnistuu!
SCD Lifestylen perustaja Steve Wright on vihdoin murtunut ja aloittanut polkunsa suoliston paranemiseen. Monien vuosien diagnosoimattoman ruoansulatussodan jälkeen hänen kehossaan nämä viikoittaiset v
Steve's SCD Diet Healing Journal:Viikko 24 – Lehtikaalisiru epäonnistuu!
SCD Lifestylen perustaja Steve Wright on vihdoin murtunut ja aloittanut polkunsa suoliston paranemiseen. Monien vuosien diagnosoimattoman ruoansulatussodan jälkeen hänen kehossaan nämä viikoittaiset v
 Haavainen paksusuolitulehdus
Haavainen paksusuolitulehdus on sairaus, joka vaikuttaa paksusuoleen ja peräsuoleen. Se aiheuttaa ärsytystä ja tulehdusta ja johtaa lopulta paksusuolen limakalvon haavaumiin. Haavainen paksusuolituleh
Haavainen paksusuolitulehdus
Haavainen paksusuolitulehdus on sairaus, joka vaikuttaa paksusuoleen ja peräsuoleen. Se aiheuttaa ärsytystä ja tulehdusta ja johtaa lopulta paksusuolen limakalvon haavaumiin. Haavainen paksusuolituleh