Su estudio titulado, “Las tiopurinas activan una respuesta de proteína desplegada antiviral que bloquea la acumulación de glicoproteína viral en el modelo de infección de cultivo celular, "Se publicó en línea como una preimpresión en el sitio bioRxiv * .
Los investigadores explicaron que los virus que están envueltos, como el coronavirus, tienen material genético que puede codificar proteínas de membrana que pueden sintetizarse y modificarse en el retículo endoplásmico (RE) antes de que puedan ser transportadas a las áreas de ensamblaje de las partes del virión.
Si la capacidad de plegamiento de la proteína ER se ve abrumada por demasiadas partículas de virión, hay una sobrecarga de proteínas desplegadas en el RE. Esto desencadena una respuesta de proteína desplegada (UPR). Esto activa el factor de transcripción-6 (ATF6), inositol que requiere la enzima 1 (IRE1) y la cinasa del retículo endoplásmico similar a PKR (PERK). Estos pueden sentir que la sala de emergencias está bajo estrés, y así hay una síntesis de factores de transcripción básicos de cremallera de leucina (bZIP).
A medida que se activa el EPU, aumenta la capacidad de plegamiento de proteínas del RE. Esto también desencadena la degradación asociada a ER (ERAD). Todas las proteínas que no se pliegan correctamente se extraen del RE y se degradan a través del proteasoma 26S.
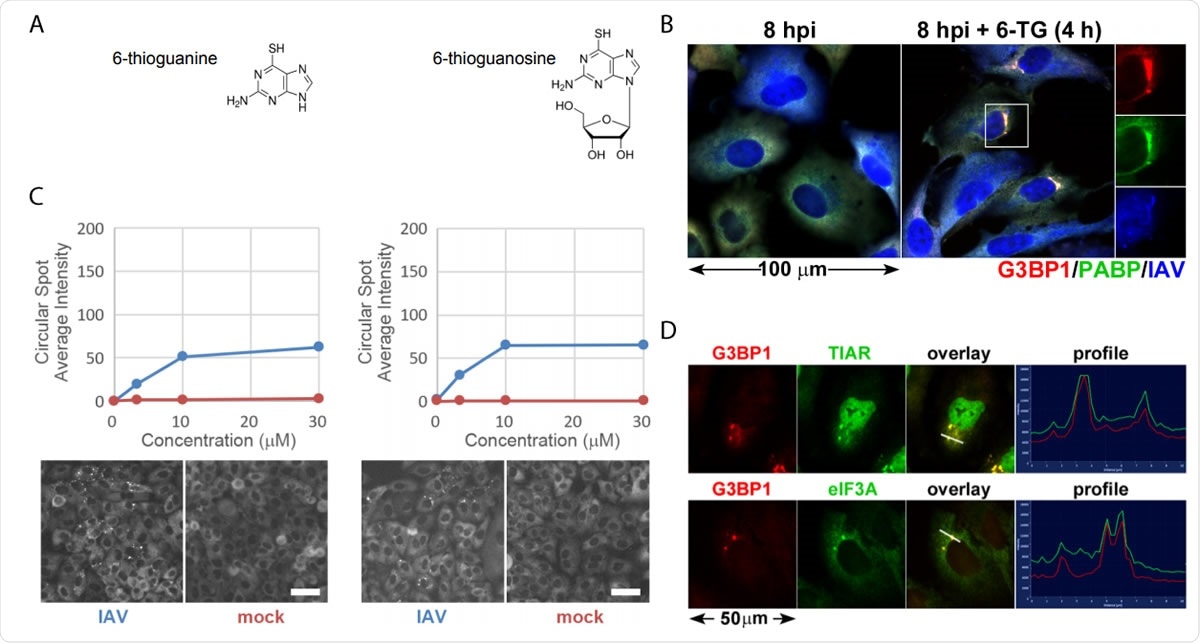 Los análogos de tiopurina 6-TG y 6-TGo inducen selectivamente gránulos de estrés en células infectadas con IAV. (A) Diagramas estructurales de pequeñas moléculas identificadas en la pantalla. (B) Cuantificación de la formación de focos de EGFP-G3BP en células infectadas con IAV-Udorn (azul) o simuladas (rojo) tratadas con dosis crecientes de 6-TG y 6-TGo (arriba) e imágenes de Cellomics representativas del canal EGFP de las células tratadas con 30 µM de 6-TG y 6-TGo (parte inferior). A las 4 hpi, las células fueron tratadas con 0, 1, Dosis de 10 y 30 uM de análogos de tiopurina 6-tioguanina (6- TG) o 6-tioguanosina (6-TGo). A las 8 hpi, las células se fijaron y se tiñeron con Hoeschst 33342. La captura de imágenes automatizada se realizó usando un lector Cellomics Arrayscan VTI HCS. Se capturaron 15 imágenes para cada pocillo y se calculó la intensidad media de EGFP-G3BP1 punteada. (C) Las células A549 se infectaron con IAV-CA / 07 a una MOI de 1. A las 4 hpi, las células se trataron con 6-TG o se trataron de forma simulada. A las 8 hpi, las células se fijaron e inmunotinieron con anticuerpos dirigidos a las proteínas marcadoras de gránulos de estrés G3BP1 (rojo), PABP (verde) y un anticuerpo policlonal IAV (azul) que detecta antígenos de NP, M1, y HA, seguido de tinción con anticuerpos secundarios conjugados con Alexa. (D) Las células A549 se infectaron con IAV-CA / 07 a una MOI de 1. A las 4 hpi, las células se trataron con 6-TG (10 µM). A las 8 hpi, las células se fijaron e inmunotinieron con anticuerpos dirigidos a las proteínas marcadoras de gránulos de estrés G3BP1 (rojo), TIAR (verde) y eIF3A (verde), seguido de tinción con anticuerpos secundarios conjugados con Alexa. Imágenes capturadas en un microscopio fluorescente Zeiss Axioimager Z2. Se muestran imágenes representativas. Las barras de escala representan 20 µm.
Los análogos de tiopurina 6-TG y 6-TGo inducen selectivamente gránulos de estrés en células infectadas con IAV. (A) Diagramas estructurales de pequeñas moléculas identificadas en la pantalla. (B) Cuantificación de la formación de focos de EGFP-G3BP en células infectadas con IAV-Udorn (azul) o simuladas (rojo) tratadas con dosis crecientes de 6-TG y 6-TGo (arriba) e imágenes de Cellomics representativas del canal EGFP de las células tratadas con 30 µM de 6-TG y 6-TGo (parte inferior). A las 4 hpi, las células fueron tratadas con 0, 1, Dosis de 10 y 30 uM de análogos de tiopurina 6-tioguanina (6- TG) o 6-tioguanosina (6-TGo). A las 8 hpi, las células se fijaron y se tiñeron con Hoeschst 33342. La captura de imágenes automatizada se realizó usando un lector Cellomics Arrayscan VTI HCS. Se capturaron 15 imágenes para cada pocillo y se calculó la intensidad media de EGFP-G3BP1 punteada. (C) Las células A549 se infectaron con IAV-CA / 07 a una MOI de 1. A las 4 hpi, las células se trataron con 6-TG o se trataron de forma simulada. A las 8 hpi, las células se fijaron e inmunotinieron con anticuerpos dirigidos a las proteínas marcadoras de gránulos de estrés G3BP1 (rojo), PABP (verde) y un anticuerpo policlonal IAV (azul) que detecta antígenos de NP, M1, y HA, seguido de tinción con anticuerpos secundarios conjugados con Alexa. (D) Las células A549 se infectaron con IAV-CA / 07 a una MOI de 1. A las 4 hpi, las células se trataron con 6-TG (10 µM). A las 8 hpi, las células se fijaron e inmunotinieron con anticuerpos dirigidos a las proteínas marcadoras de gránulos de estrés G3BP1 (rojo), TIAR (verde) y eIF3A (verde), seguido de tinción con anticuerpos secundarios conjugados con Alexa. Imágenes capturadas en un microscopio fluorescente Zeiss Axioimager Z2. Se muestran imágenes representativas. Las barras de escala representan 20 µm. Cuando la partícula de virus invade una célula, intenta replicarse rápido, y esto agobia a la sala de emergencias. El virus libera ráfagas de glicoproteínas que abruman al ER. El virus, sin embargo, es capaz de eludir el EPU y promueve una replicación eficiente.
El IAV puede codificar tres proteínas integrales de membrana:hemaglutinina (HA), neuraminidasa (NA), y proteína de matriz 2 (M2). Si bien la replicación de IAV provoca la activación selectiva de la UPR, Mecanismos específicos pueden activar la UPR pero luego evitarla para promover una replicación viral efectiva. El equipo explica que los efectos de las proteínas NA y M2 en la UPR no están claros, pero HA puede promover la EPU.
Varios coronavirus (CoV) pueden activar la UPR. Esto incluye el "virus de la bronquitis infecciosa (IBV), virus de la hepatitis del ratón (MHV), virus de la gastroenteritis transmisible (TGEV), coronavirus humano (HCoV) -OC43, y SARS-CoV-1 ”. Toda la secuencia genética, sin embargo, no reacciona de manera similar a la replicación de CoV.
El equipo identificó dos análogos de tiopurina aprobados por la FDA llamados “6-tioguanina (6-TG) y 6-tioguanosina (6-TGo)”. Se encontró que estos bloquean la replicación de IAV y HCoV-OC43 cuando su dosis se incrementó de manera gradual.
Pateamine A y Silvestrol se habían probado previamente. Estas dos tiopurinas, sin embargo, se descubrió que interrumpían el proceso de acumulación de glicoproteínas virales que podrían activar la UPR. En las células que habían sido tratadas con 6-TG, la síntesis de glicoproteínas virales podría restaurarse parcialmente mediante la inhibición química de la UPR.
Las proteínas CoV Spike (S) que se expresan en la superficie del virus mostraron activación UPR. La proteína S del nuevo coronavirus o SARS-CoV-2 S también provocó la activación de la UPR. 6-TG inhibió la acumulación de proteínas de fusión S0 de longitud completa o S2 escindidas con furina, notaron. No afectó al ectodominio S1. 6-TG podría inducir UPR que acelera el recambio mediado por ERAD de las glicoproteínas S0 y S2 ancladas a la membrana, el equipo encontró.
Los investigadores experimentaron y encontraron que un compuesto químicamente similar tiopurina 6-mercaptopurina (6-MP) tuvo poco efecto sobre la UPR y no afectó la replicación de IAV HCoV-OC43.
Reflexionando sobre el mecanismo de inducción de la UPR por los compuestos de tiopurina 6-TG y 6-TGo, El equipo escribió que es poco probable que estos efectos estén mediados por la incorporación de ADN o ARN de 6-TG debido a varias razones. La primera razón es que el estrés asociado con la replicación viral no induce específicamente la UPR. La segunda razón es que entre las proteínas virales, la acumulación de glicoproteínas y su procesamiento se interrumpió de forma selectiva. La tercera razón fue que los niveles de ARN mensajero de HA y NA en el IAV no se vieron afectados significativamente. 6 MP, por otra parte, se puede convertir en trifosfato de 6-tioguanosina pero no indujo UPR y no tuvo efectos sobre las glicoproteínas de IAV o la replicación de OC43.
El equipo escribió que sus datos revelan que "las moléculas inductoras de UPR podrían ser antivirales efectivos dirigidos al huésped contra virus que dependen de los procesos de ER para respaldar una replicación eficiente". Por tanto, la inducción de UPR por 6-TG y 6-TGo podría ser un método novedoso mediante el cual la propia célula huésped podría desencadenar un mecanismo antiviral. Este ha sido un mecanismo de acción único previamente no reconocido, escribió el equipo.
Escribieron en conclusión, "... estos datos indican que 6-TG y 6-TGo son antivirales eficaces dirigidos al huésped que desencadenan la UPR e interrumpen la acumulación de glicoproteínas virales".
medRxiv publica informes científicos preliminares que no son revisados por pares y, por lo tanto, no debe considerarse concluyente, orientar la práctica clínica / comportamiento relacionado con la salud, o tratada como información establecida.
 ¿Podrían los compuestos antivirales derivados de microalgas combatir el SARS-CoV-2 y otros virus?
¿Podrían los compuestos antivirales derivados de microalgas combatir el SARS-CoV-2 y otros virus?
 El síndrome del intestino permeable no solo es aterrador, sino extremadamente peligroso para la salud
El síndrome del intestino permeable no solo es aterrador, sino extremadamente peligroso para la salud
 4 errores comunes de betaína HCl
4 errores comunes de betaína HCl
 ¿Qué es una gastrectomía parcial?
¿Qué es una gastrectomía parcial?
 Trastornos digestivos:qué significa el tipo y el color de su caca
Trastornos digestivos:qué significa el tipo y el color de su caca
 Enfermedades digestivas:apendicitis
Enfermedades digestivas:apendicitis
 Abrazar la muerte:la mentalidad clave para construir un negocio de salud en línea exitoso
Me desperté y miré mi teléfono. Era el cumpleaños de Steve. ¿Qué le dices a tu mejor amigo en su cumpleaños? ¿Decirle lo importante que es para ti? ¿Enviarle algo divertido? ¿Simplemente decirle feli
Abrazar la muerte:la mentalidad clave para construir un negocio de salud en línea exitoso
Me desperté y miré mi teléfono. Era el cumpleaños de Steve. ¿Qué le dices a tu mejor amigo en su cumpleaños? ¿Decirle lo importante que es para ti? ¿Enviarle algo divertido? ¿Simplemente decirle feli
 La VERDAD sobre los alimentos sin gluten:¿Ayuda o daña la salud intestinal?
Cuando me diagnosticaron la enfermedad celíaca en 2007, no tenía ni idea de lo que era la comida sin gluten. Nunca había oído hablar de él antes y definitivamente no sabía dónde comprarlo. Pero en es
La VERDAD sobre los alimentos sin gluten:¿Ayuda o daña la salud intestinal?
Cuando me diagnosticaron la enfermedad celíaca en 2007, no tenía ni idea de lo que era la comida sin gluten. Nunca había oído hablar de él antes y definitivamente no sabía dónde comprarlo. Pero en es
 Estreñimiento
Una mujer sentada en el inodoro mientras sufre de estreñimiento. ¿Qué datos debo saber sobre el estreñimiento? ¿Cuál es la definición médica de estreñimiento? El estreñimiento se define médicamente c
Estreñimiento
Una mujer sentada en el inodoro mientras sufre de estreñimiento. ¿Qué datos debo saber sobre el estreñimiento? ¿Cuál es la definición médica de estreñimiento? El estreñimiento se define médicamente c