anticuerpo monoclonal conjugado BRCAA1 nanopartículas magnéticas fluorescentes para la formación de imágenes in vivo
magnetofluorescent selectiva de cáncer gástrico
Resumen Antecedentes
El cáncer gástrico es 2o cáncer más común en China, y sigue siendo la segunda causa más común de cáncer muerte -related en el mundo. ¿Cómo reconocer células de cáncer gástrico prematuro sigue siendo un gran desafío para diagnóstico y tratamiento de pacientes con cáncer gástrico precoz. Este estudio está dirigido a desarrollar un tipo de nanosondas multifuncionales en vivo
dirigido imágenes magnetofluorescent de cáncer gástrico.
Métodos
se preparó anticuerpo monoclonal BRCAA1, fue utilizado como primer anticuerpo para teñir 50 pares de especímenes de cáncer gástrico y control del cáncer tejidos mucosos gástrica normal, y conjugado con nanopartículas magnéticas fluorescentes con 50 nm de diámetro, las nanosondas magnéticas fluorescentes BRCAA1 conjugado resultantes se caracterizaron por microscopía electrónica de transmisión y espectrometría de fotoluminiscencia, nanosondas as-preparadas se incubaron con células de cáncer gástrico MGC803, y se inyectaron en ratones modelo cargado con cáncer gástrico de 5 mm de diámetro a través de vena de la cola y, a continuación se obtuvieron imágenes por imagen óptica de fluorescencia y resonancia magnética, se investigó su biodistribución. Los cortes de tejido fueron observadas por microscopía de fluorescencia, y los órganos importantes como el corazón, pulmón, riñón, cerebro e hígado fueron analizadas por hematoxilina y eosina método (HE).
: Resultados de la BRCAA1 anticuerpo monoclonal se preparó con éxito, BRCAA1 proteína exhibe un exceso de expresión en el 64% tejidos de cáncer gástrico, sin expresión en los tejidos de la mucosa gástrica de control normales, no existe diferencia estadística entre los dos grupos (P Hotel < 0,01). El BRCAA1 conjugado fluorescente magnética nanosondas exhiben muy baja toxicidad, baja intensidad magnética y baja intensidad de fluorescencia con un pico-azul-turno de FMNPs puros, podría ser endocitosis por las células de cáncer gástrico MGC803, podría apuntar vivo
tejidos de cáncer gástrico en cargadas por los ratones, y se podría utilizar para obtener imágenes de los tejidos de cáncer gástrico mediante formación de imágenes fluorescentes y las imágenes de resonancia magnética, y distribuido principalmente en los tejidos de cáncer gástrico locales dentro de 12 h después de la inyección. Tinción análisis mostró que no se observaron daños evidentes en los órganos importantes.
Conclusiones
Las nanopartículas de anticuerpos monoclonales conjugados con BRCAA1 de alto rendimiento fluorescentes magnéticas pueden dirigirse in vivo
células de cáncer gástrico, se puede utilizar para magnetofluorescent simultánea proyección de imagen, y puede tener un gran potencial en aplicaciones como de doble modelo de formación de imágenes y terapia térmica local del cáncer gástrico precoz en un futuro próximo.
Antecedentes
el cáncer gástrico fue una vez el segundo cáncer más común en la palabra [1]. Hasta la fecha, en los Estados Unidos, malignidad estómago es actualmente el cáncer más común 14a, y el cáncer más común día 2 en China [2, 3]. El cáncer gástrico sigue siendo la segunda causa más común de muerte por cáncer en el mundo, y sigue siendo difícil de curar porque la mayoría de los pacientes se presentan con enfermedad avanzada. Por lo tanto, la forma de reconocer, pista o matar las células de cáncer gástrico precoz es muy clave para el diagnóstico y tratamiento de pacientes con cáncer gástrico precoz.
Hasta la fecha, en busca de biomarcadores estrechamente asociados con el cáncer gástrico sigue siendo una tarea importante. Desde 1998, hemos estado siendo tratado de establecer un sistema gástrico precoz del cáncer de preaviso [4], y la esperanza de utilizar este sistema de pre-alerta para detectar células de cáncer gástrico precoz para reconocer los pacientes con cáncer gástrico precoz. Aunque se identificaron algunos genes expresados de manera diferente-asociados con el cáncer gástrico precoz [5, 6], no un gen puede ser confirmado a ser biomarcador específico de cáncer gástrico. Por lo tanto, con el fin de reconocer células de cáncer gástrico precoz, sólo hemos elegido biomarcadores potenciales asociados con el cáncer gástrico, y combinamos las nanopartículas y técnicas de imagen molecular, tratamos de encontrar
primeras células de cáncer gástrico in vivo de imágenes in vivo
dirigida tumor en . En nuestro trabajo anterior, hemos examinado y gen BRCAA1 clonado (cáncer de mama asociado al antígeno 1 de genes) de la línea celular de cáncer de mama MCF-7cells [AF208045, también llamado ARID4B (que contiene el dominio 4B proteína interactiva rica en AT)], e identificaron su antígeno péptido epítopo SSKKQKRSHK [7, 8]. También preparamos anticuerpo policlonal BRCAA1, y observamos que la proteína BRCAA1 expuso sobre-expresión en muestras clínicas casi el 65% de los tejidos de cáncer gástrico [9-11]. También observamos que el antígeno es expresado BRCAA1-over en líneas celulares de cáncer gástrico como MKN-1, MKN-74, SGC-7901, Kato-III y MGC803 células. Por lo tanto, predecimos que la proteína BRCAA1 puede ser una molécula de direccionamiento potencial de in vivo
células de cáncer gástrico.
En los últimos años, las tecnologías de formación de imágenes moleculares basados en nanosondas multi-funcionales han hecho grandes progresos. Por ejemplo, las nanopartículas, tales como puntos cuánticos, nanopartículas magnéticas y nanorods de oro, etc., han sido utilizados para formación de imágenes molecular [12-19]. Hasta el momento varias tecnologías de formación de imágenes de animales pequeños han sido desarrolladas, como la imagen óptica (OI) de la bioluminiscencia (BLI), fluorescencia (FLI) y de la microscopía intravital (IVM), micro-PET, MRI y CT [20-26]. Entre todas estas tecnologías, cómo mejorar su resolución espacial y sensibilidad profundidad del tejido es un gran desafío. Hasta ahora, en vivo
tejidos tumorales con más de 1 cm de diámetro pueden ser fácilmente identificados por CT, MRI, PET y imágenes de bioluminiscencia, los tumores con menos de o igual a 5 mm de diámetro es muy difícil de ser encontrado en pacientes clínicos. En nuestros informes anteriores, las nanopartículas magnéticas fotosensibilizador conjugado se utilizaron con éxito para
vivo simultánea magnetofluorescent de imágenes y la focalización en la terapia [27]. Sin embargo, la capacidad de orientación de nanosondas dependía de nanopartículas magnéticas altamente. También preparamos un CdTe cuántica nanosistema clúster dot ribonucleasa-A-conjugado multifuncional para obtener imágenes de cáncer sincrónico y la terapia [28], la capacidad de orientación de nanosondas como preparados depende de péptido RGD. Algunos estudios muestran que la proteína HER-2 exhibe la expresión anormal en 6-35% tejidos de cáncer gástrico [29, 30], y se ha utilizado como la diana terapéutica para los pacientes clínicos con cáncer gástrico [31], por lo tanto, HER-2 proteína posee un gran potencial en formación de imágenes y la terapia del cáncer gástrico. Sin embargo, hasta la fecha, ningún informe muestra que las imágenes y la terapia del cáncer gástrico
vivo en específico se basa en marcadores biológicos asociados con el cáncer gástrico.
En los últimos años, hemos preparado de forma controlable puntos cuánticos recubiertos con sílice y super-paramagnético compuestos de nanopartículas (FMNPs) con señales fluorescentes fuertes y excelentes propiedades magnéticas, y las han utilizado para bio-etiquetado, el seguimiento de las células madre, bio-separación, la orientación de imagen y la hipertermia de tumores [29-32], también se observó que a medida preparada nanopartículas poseen una buena biocompatibilidad y estabilidad [33-38].
En este trabajo, utilizamos plenamente las ventajas de FMNPs y antígeno BRCAA1, anticuerpo monoclonal preparado contra la proteína BRCAA1 y nanosondas magnéticas fluorescentes de anticuerpos conjugados con BRCAA1 preparado monoclonales (BRCAA1- FMNPs), empleada modelo de ratones desnudos cargado con cáncer gástrico de 5 mm de diámetro y sistema de imágenes IVIS y Resonancia magnética, investigó la viabilidad de nanosondas como preparados para no invasiva in vivo
objetivo de imagen dual modal del cáncer gástrico. Los resultados muestran que nanosondas tan preparadas se pueden utilizar para
in vivo de doble modelo de imágenes de cáncer gástrico, y pueden tener un gran potencial en aplicaciones como de doble modelo de formación de imágenes y terapia térmica local del cáncer gástrico precoz en un futuro próximo.
resultados y Discusión
Caracterización de anti-BRCAA1 monoclonal Antibody
Como se muestra en la Tabla 1, se obtuvieron con éxito dos positivos líneas celulares clon S-200-5 y S-335-5, sus títulos eran diferentes, finalmente seleccionamos el anticuerpo monoclonal anti-BRCAA1 de la línea celular S-200-5 como el primer anticuerpo para teñir tejidos de cáncer gástrico y los tejidos de control. Se encontró que la proteína BRCAA1 exhibió sobre-expresión en 64% tejidos de cáncer gástrico, ninguna expresión en el control normal de los tejidos de la mucosa gástrica, como se muestra en la Figura 1, no existe diferencia estadística entre dos grupos (P
< 0,01). Este resultado es casi idéntico al nuestro informe anterior [4, 9-11], lo que sugiere que el antígeno altamente BRCAA1 puede ser seleccionado como el objetivo potencial para el cáncer gástrico más, si tan preparados nanosondas pueden reconocer el 64% de los pacientes con cáncer gástrico precoz, será muy útil para el diagnóstico y la terapia de clínicos gástrico patients.Table cáncer 1 Los títulos de anticuerpos monoclonales BRCAA1 en fluido de ascitis inducida por células de hibridoma por ELISA Clon
título de anticuerpos *
Clon
BRCAA1 (C) -OVA **
BRCAA1 (C) BSA **
BSA ** **
OVA
S-200-5
1.024.000 1.024.000
Hotel < 1,000 Hotel < 1,000
S-335- 5
128.000 512.000
Hotel < 1,000 Hotel < 1,000
* el recíproco de la dilución de ascitis fluido, la primera dilución de líquido ascítico fue de 1: 1.000.
** los antígenos fueron revestidos en la placa de ELISA.
Figura 1 Expresión de la proteína BRCAA1 en tejidos de cáncer gástrico y de control normal de los tejidos de la mucosa gástrica. R: tejidos de cáncer gástrico, × 100; B: tejidos de control normales, × 50.
preparación y caracterización de BRCAA1- FMNPs nanosondas
Como se muestra en la Figura 2A, FMNPs preparadas se componen de CdTe y magnéticos nanopartículas de sílice-envuelto, su tamaño era 50 nm o más en diámetro. Como se muestra en la Figura 2D, después de FMNPs se conjugaron con el anticuerpo anti-BRCAA1, fotoluminiscencia nanosondas as-preparados '(PL) intensidad fue menor que la de FMNPs, exhibiendo la izquierda de desplazamiento de 40 nm, que era debido a la disminución de la tasa de polarización de las moléculas circundantes, y que resulta en la disminución del desplazamiento de Stokes, resultando finalmente en un desplazamiento al azul en los espectros de emisión. Del mismo modo, la intensidad magnética de nanosondas como preparados también fue menor que FMNPs. Figura 2 Caracterización de nanosondas anti-BRCAA1-FMNPs. A: foto HR-TEM de FMNPs; B: la propiedad magnética de anti-BRCAA1-FMNPs nanosondas; C: Zeta-potencial de FMNPs con el grupo amino, COOH, un grupo Si-O; D:. PL espectros de FMNPs conjugados con y sin anticuerpo BRCAA1
En el curso de la preparación BRCAA1-FMNPs nanosondas, encontramos que la funcionalización de la superficie de FMNPs era muy clave para conjugado de anticuerpo anti-BRCAA1 con FMNPs a través de enlace covalente. Como se muestra en la Figura 2C, los diferentes grupos funcionales de FMNPs tienen diferentes valores de potencial zeta. FMNPs tenía-O-grupo Si negativo, su valor potencial zeta fue -34,05 mV, los FMNPs con grupo amino tenían valor positivo potencial zeta de 24.80 mV, con FMNPs grupo carboxilo tenido valor potencial zeta negativo de -30,50 mV. Hemos observado que los grupos carboxilo en la superficie de FMNPs conjugados con anticuerpo anti-BRCAA1 más fácil que los grupos amino en la superficie de FMNPs. Como se muestra en la Tabla 2, la tasa promedio de acoplamiento anticuerpo anti-BRCAA1 con FMNPs-COOH era 80.28% .Tabla medición de la frecuencia 2 Acoplamiento de FMNPs-anticuerpo anti-BRCAA1
|
la concentración total del anticuerpo anti-BRCAA1 (ng /l)
la concentración de anticuerpo anti-BRCAA1 en la mezcla de reacción residual (ng /l)
tasa de acoplamiento (%)
1
1000.0
197.3
80.27
2
1000.0
191.2
80.88
3
1000.0
203.0
79.70
Como preparados para nanosondas in vitro
dirigidos células de cáncer gástrico
capacidad de las nanosondas como preparados in vitro
fueron observadas por microscopio de fluorescencia y calculados por el citómetro de flujo FACSCalibur orientación. Como se muestra en la Figura 3, FMNPs dispersados al azar en el interior del citoplasma, y anti-BRCAA1-FMNPs nanosondas existían alrededor del nucleolo. Ambos FMNPs y preparados BRCAA1-FMNPs nanosondas pueden entrar en el citoplasma de las células MGC803 después de 4 h de incubación con MGC803 células, como se muestra en la Figura 4A, FMNPs podrían etiquetar 25.23% MGC803 células, el 74.77% de las células permanecen no podían ser etiquetados. Como se muestra en la Figura 4B, 45,92% MGC803 células podría ser etiquetado por las nanosondas BRCAA1-FMNPs. Cuando FMNPs y anti-BRCAA1-FMNPs nanosondas se incubaron, respectivamente, con MGC803 células y células de fibroblastos humanos de 0,5 h, se observó una gran cantidad de anti-BRCAA1-FMNPs nanosondas entraron en MGC803 células, algunas nanosondas introducen en células de fibroblastos humanos, unos FMNPs podría MGC803 entrar en las células y las células de fibroblastos humanos, lo que sugeriría que el anti-BRCAA1-FMNPs nanosondas pueden dirigirse específicamente a las células MGC803. La imagen de resonancia magnética de MGC803 células y células de fibroblastos humanos se incubaron con anti-BRCAA1-FMNPs para 4 h se muestra en la Figura 5, MGC803 células exhibieron fuerte señal magnética que las células de fibroblastos humanos (HDF), que también mostraron que las nanosondas preparados pueden dirigirse MGC803 células específicamente. Figura 3 in vitro imágenes de fluorescencia de 803 MGC después tratado con FMNPs y nanopartículas FMNPs-BRCAA1 (aumento = x 200). El grupo superior de las imágenes ilustran FMNPs aleatoria distribuyen en el citoplasma, el grupo inferior de las imágenes exhibió FMNPs-BRCAA1 dispersa alrededor del nucléolo y había capacidad de la MGC803 bien dirigido.
Figura 4 citómetro de flujo FACSCalibur análisis de MGC803 marcado con FMNPs y FMNPs-BRCAA1. A: la MGC803 tratado con 50 mg /ml de FMNPs durante 24 h mostraron 25,23% de células se marcaron con FMNPs. B: la MGC803 tratado con 50 mg /ml de FMNPs-BRCAA1 durante 24 h ilustran hasta 45,92% de células se marcaron con FMNPs-BRCAA1
Figura 5 RM de MGC803 células y células HDF.. R: MGC803 células con anti-BRCAA1-FMNPs. B: células HDF con anti-BRCAA1-FMNPs. C:. MGC803 células con sólo FMNPs
nanosondas para imágenes fluorescentes in vivo de células de cáncer gástrico
Para evaluar las propiedades específicas de tumor de nanosondas anti-BRCAA1-FMNPs, modelos de ratones desnudos cargados de MGC-Como-preparó se prepararon y monitoreados bajo una forma no invasiva durante 12 h 803 células de cáncer gástrico mediante el uso de sistema de imagen de fluorescencia IVIS.
mediante la supervisión de la intensidad de fluorescencia en tiempo real en todo el cuerpo, el carácter de metas de tumor de la anti-BRCAA1- sonda FMNPs se determinó fácilmente en los ratones desnudos cargados con cáncer gástrico MGC803 células. Como se muestra en la Figura 6A, los enteros de animales producen señales fluorescentes dentro de 30 min de post-inyección de nanosondas, los tejidos tumorales subcutáneos podrían ser claramente delimitada a partir del tejido de fondo circundante entre 1 h y 12 h después de la inyección, con el máximo contraste se produce en 6 h después de la inyección. señal de fluorescencia fuerte fue aún ser detectada en el sitio del tumor a las 6 h después de la inyección, que indicaron que las nanosondas anti-BRCAA1-FMNPs se acumularon preferentemente en los tejidos tumorales. De hecho en base a los resultados de la Figura 6B, el mayor tumor a la proporción de fondo valor (TBR) altamente sugirió que como preparados nanosondas preferentemente acumula en los tejidos tumorales en comparación con tejidos normales de control. Esto se confirmó en imágenes de fluorescencia, lo que demuestra que la señal de fluorescencia de nanosondas como preparados en el sitio del tumor fue más fuerte entre todos los órganos ratones como se muestra en la Figura 6C. Además, después de 12 h después de la inyección de anti-BRCAA1-FMNPs nanosondas, la intensidad de fluorescencia en el tumor se observa todavía con claridad, mientras que la absorción de nanosondas preparados en los órganos normales no era evidente. Estos datos sugieren que la altamente nanosondas preparados pueden orientar altamente eficiente tejidos tumorales dentro de ratones desnudos cargados con cáncer gástrico. También se observó que aquellas nanosondas en todo el cuerpo del ratón desaparecieron casi por completo a las 12 h después de la inyección, también detectamos las nanosondas salieron fuera del sistema cholecyst (datos no mostrados), el pase cholecyst dependiente del tiempo de nanosondas altamente sugieren que a medida nanosondas -preparaciones no pueden permanecer en el interior de los ratones desnudos durante más tiempo, por lo tanto, como preparados nanosondas propio bien bio-seguridad. Figura 6 En vivo fluorescencia imágenes de acumulación de tumor y la distribución de tejido para nanopartículas FMNPs-BRCAA1 en MGC803 ratones portadores de tumor gástrico humano atímicos desnudos. A, En vivo
fluorescencia de imágenes de ratones desnudos atímicos. Se obtuvo MGC803 tumor gástrico humano después de la inyección de nanopartículas FMNPs-BRCAA1 en diferentes puntos de tiempo. La localización del tumor se especifica con una flecha. A-1: 0 h, A-2: 0,5 h, A-3: 1 h, A-4: 3 h, A-5: 6 h, A-6: 12 h. B, TBR [Tissue a fondo la relación (músculo)] valor. El valor TBR se determinó como sigue: TBR = (señal de la señal de fondo-Tumor) /(señal de fondo). imágenes C, ex vivo
de fluorescencia de órganos diseccionados y tumores de los ratones portadores de tumor gástrico humano MGC803 sacrificados a las 12 h después de la inyección de nanopartículas FMNPs-BRCAA1. Las imágenes de fluorescencia de los órganos diseccionados y tumor se obtuvieron utilizando una técnica de formación de imágenes de fluorescencia con un filtro de emisión de 630 nm. D, biodistribución de anti-BRCAA1 FMNPs en ratones después de la inyección intravenosa. Varios puntos de tiempo después de la inyección, las cantidades de hierro en muestras de tejido fueron evaluadas mediante espectrometría de masas ICP (n = 3).
Análisis patológico de tumor y los órganos importantes
In vitro
evaluación de los tejidos extirpados principales incluyendo el hígado, pulmón , bazo, riñón y corazón, así como el tumor, indican que el anti-BRCAA1-FMNPs sondas fueron principalmente up-tomado por los tejidos tumorales, que presentaban señales de fluorescencia fuertes, como se muestra en la Figura 7, mientras que otros tejidos incluyendo el hígado , pulmón, bazo y el corazón hasta tomó-anti-BRCAA1-FMNPs nanosondas muy inferior, lo que indica que a medida que furtherly preparado BRCAA1-FMNPs nanosondas pueden dirigirse a los tejidos de cáncer gástrico. También utilizamos tinción HE para comprobar todos los órganos, no se observaron daños evidentes en los órganos importantes [véase la disposición 1]. Figura 7 resultado del análisis de inmunofluorescencia. A, tejido tumoral. B, el hígado. (Aumento = × 200).
Nanosondas para MR Imaging de ratones desnudos cargados con cáncer gástrico As-preparó
In vivo
imágenes de RM se realizó en ratones desnudos cargado con cáncer gástrico subcutánea a 12 h después de la inyección . Imágenes representativas de mapas T2 se muestran en la Figura 8, después de la inyección de las nanosondas, se observó un cambio significativo en la intensidad de la señal en algunas regiones de los tumores, lo que indica que existía acumulación de las nanosondas en sitio del tumor como se muestra en la Figura 8B, como la flecha mostró. Como control, después de que el modelo de ratones con cáncer gástrico se inyectaron FMNPs durante 12 h, los ratones se realizaron las imágenes de RM, que no mostró señal intensa en la zona de tumor (Figura 8A). Figura 8 imagen de resonancia magnética de los ratones. A, FMNPs sin acoplamiento BRCAA1 B, FMNPs junto con BRCAA1
mecanismo potencial de la orientación de imagen
En los últimos años, las tecnologías de formación de imágenes moleculares se han utilizado para el tiempo real y de formación de imágenes no invasiva de tejidos tumorales vivo
en [39-43]. Por ejemplo, los puntos cuánticos, debido a sus propiedades fotoluminiscentes únicos, se han utilizado para bio-etiquetado y de imagen fluorescente [11-13, 33, 43], pero 'toxicidad puntos cuánticos limitado su aplicación en el cuerpo humano, hasta ahora algunos cuántica seguro se están desarrollando puntos. Las nanopartículas magnéticas también se han utilizado como reactivo de contraste para formación de imágenes MR [15, 33, 36]. Al mismo tiempo, la combinación de dos técnicas de imagen proporciona las ventajas de ambos que el uso de un método, que proporcionaría una información completa sobre la localización del tumor, el medio ambiente, y el estado.
En este estudio, hemos diseñado y preparado una sonda de imagen novedosa, que estaba compuesto por los puntos cuánticos de silicio-envuelta y nanopartículas magnéticas con el objetivo de mejorar su biocompatibilidad. Nuestros resultados muestran que los puntos cuánticos de silicio-envuelto preparados y nanopartículas magnéticas son muy estables, y el propio fuertes señales fluorescentes y la intensidad magnética. Uso de las fuertes señales fluorescentes de nanosondas como preparados, se obtuvieron con éxito las imágenes fluorescentes de in vivo
tejidos de cáncer gástrico en con 5 mm de diámetro en el modelo de ratones desnudos. El uso de las señales magnéticas fuertes de nanosondas como preparados, también obtuvimos con éxito las imágenes de RM in vivo de
tejidos de cáncer gástrico en con 5 mm de diámetro en el modelo de ratones desnudos. En comparación con los informes anteriores, el tamaño más grande de los tejidos tumorales (> 5 mm) podría ser fácilmente fotografiados mediante el uso de imágenes fluorescentes y las imágenes de resonancia magnética, como contraste, nuestros resultados mostraron que como preparados nanosondas puede detectar el tamaño más pequeño de los tejidos tumorales (menos 5 mm de diámetro), lo que mejoró notablemente la sensibilidad del método de detección. Nuestro resultado también es la primera vez que informe de imagen de doble focalización in vivo modal del
tejidos de cáncer gástrico en.
Cómo orientar vivo
tejidos de cáncer gástrico en es también un problema impugnable. Hasta la fecha, no se informó de biomarcadores específicos de cáncer gástrico. Aunque HER-2 de proteínas se confirmó que la expresión positiva en 6-35% de los tejidos de cáncer gástrico [28-31], proteína HER-2 también muestra la sobre-expresión en muchos tejidos tumorales, tales como cáncer de mama, cáncer de pulmón, cáncer de colon, etc, por lo tanto, HER-2 no debe ser biomarcador específico para el cáncer gástrico. Nuestros resultados mostraron que el antígeno BRCAA1 sólo está sobreexpresado en el 64% o menos de los tejidos de cáncer gástrico de los pacientes de cirugía clínicos, también confirmamos que el antígeno BRCAA1 se sobreexpresa en algunas líneas celulares de cáncer gástrico como MKN-1, MKN-74 , SGC-7901, Kato-III y MGC803 [6-9]. Utilizamos MGC803 células para preparar modelo de ratones desnudos cargado con cáncer gástrico, y con éxito observado que a medida preparadas nanosondas preferentemente acumula en los tejidos tumorales en comparación con tejidos normales de control, y que el aumento del tiempo de post-inyección. También observamos que inyectan nanosondas en todo el cuerpo exhibieron el aclaramiento dependiente del tiempo y las señales fluorescentes disminuyeron gradualmente a medida que el tiempo transcurrido debido al sistema de excreción hepática cholecyst y claridad de riñón de nanosondas como preparados. Varios informes mostraron que las nanopartículas de riñón sólo claras con 5 nm de diámetro, en nuestro estudio, se observó que a medida preparadas nanosondas con 50 nm de diámetro también podría ser aclarada dentro de 12 h. Este mecanismo concreto está en marcha.
Nanoprobe bioseguridad es también un problema importante [44], que decide la perspectiva aplicación de nanosondas tan preparadas. Nuestros resultados totalmente mostraron que nanosondas tan preparadas no dañar órganos importantes como el hígado, riñón, corazón, pulmón, etc., tampoco exhibir a largo plazo permanecer en órganos importantes, lo que sugeriría que nanosondas como preparados poseen una buena biocompatibilidad, y tienen un gran potencial en aplicaciones tales como imágenes modelo dual y la terapia selectiva de cáncer gástrico precoz.
Conclusión
Hemos preparado con éxito una novela anti-BRCAA1-FMNPs nanosondas, que pueden ser utilizados para la formación de imágenes in vivo
modal en dos tales como imágenes fluorescentes y la resonancia magnética, y poseer una capacidad de orientación específica, obviamente, hacia un cáncer de los tejidos gástricos con 5 mm de diámetro durante 0,5 h, y 12 h de post-inyección, y la propia buena biocompatibilidad. Este debería ser el primer informe. Las nanosondas multifuncionales como preparados también se pueden utilizar para la terapia de hipertermia de cáncer gástrico in vitro bajo
alterna irradiación campo magnético, y tener un gran potencial en aplicaciones tales como formación de imágenes simultánea y la orientación terapia de cáncer gástrico clínica en un futuro próximo.
Materiales y métodos
Preparación de anticuerpos monoclonales anti-BRCAA1
se llevaron a cabo experimentos con animales de acuerdo a las Directrices para Cuidado de Animales y el empleo Comisión, Universidad de Shanghai Jiao Tong. Los anticuerpos monoclonales se prepararon contra un BRCAA1 proteína de fusión purificada. Ratones Balb /c hembras, de 4-6 semanas de edad, fueron adquiridos de la Shanghai ALC Animales de Laboratorio Co. Ltd., Academia de Ciencias de China (Shanghai, China). Los ratones se inmunizaron mediante inyección intraperitoneal con 50 g de proteína BRCAA1 purificado que se emulsionó con un volumen igual de adyuvante completo de Freund. Otras tres inyecciones se administraron usando adyuvante incompleto cada dos semanas. Tres días después de la última inyección, se recogieron las células de bazo de los ratones y se fusionaron con la línea celular de mieloma de ratón Sp 2/0. Después de 10-14 días, los sobrenadantes de cultivo se rastrearon con un ensayo ELISA en el que la fase sólida se revistió con la proteína BRCAA1 recombinante (2 mg /ml) que se utiliza para la inmunización. En el proceso de selección, los anticuerpos monoclonales que se unen con la proteína BRCAA1 revestido fueron seleccionados. Al limitar el doble dilución, se subclonaron las colonias positivas. fluidos ascíticos fueron cosechadas de los ratones cebados con una inyección intraperitoneal de 0,5 ml de pristano y luego inyectados con 10 6 células de hibridoma. La clase y la subclase de cada mAb se determinó usando un kit de isotipificación de anticuerpo monoclonal de ratón (Hy Cult Biotecnología B.V., Países Bajos). Los mAbs se purificaron a partir de los fluidos ascéticos de ratón utilizando una proteína G-Sepharose 4FF (Pharmacia, Uppsala, Suecia) según las instrucciones del fabricante para eliminar los componentes que pudieran interferir con los experimentos de biopanning. Los títulos de anticuerpos se determinaron mediante métodos de ELISA [45]. Finalmente, uno de los anticuerpos monoclonales anti-BRCAA1 preparados se utilizó como primer anticuerpo para teñir 50 especímenes de cáncer gástrico y controlar los tejidos de la mucosa gástrica, que fueron recogidos a partir de Changzheng y Hospital No.1 personas en Shanghai e identificados mediante el examen patológico.
preparación y funcionalización de superficies de FMNPs
preparación de Fe 3O nanopartículas 4 se basa en la co-precipitación de soluciones de iones ferrosos y férricos (relación 1: 2 molar) [46-49]. nanocristales de CdTe se sintetizaron de la siguiente manera de acuerdo con nuestro informe anterior: CdCl 2 (5 mmol) se disolvió en 110 ml de agua, y se añadieron 12 mmol de TGA con agitación, seguido por ajuste del pH a 11 mediante la adición gota a gota de solución 1 M de NaOH. La solución mezclada se coloca en un matraz de tres bocas de desaireado por N 2 burbujeo durante 30 min. Bajo agitación, 2,5 mmol de solución NaHTe libre de oxígeno se inyectó en el matraz de tres bocas, que estaba recién preparado a partir de polvo de teluro y NaBH 4 (tasa molar de 1: 2) en agua a 0 ° C. La solución resultante fue aproximadamente 4 mg /ml, y el producto 3,5 nm de diámetro emite, con un máximo alrededor de 630 nm. nanopartículas magnéticas fluorescentes (FMNPs) se prepararon usando el enfoque microemulsión inversa. Antes de acoplar las FMNPs con el BRCAA1, que primero funcionalizado el grupo funcional de superficie FMNPs como el grupo carboxilo. 95 ml de etanol y 2 ml de 3-aminopropiltrietoxisilano (APS) se añadieron para formar una solución mixta y se dejó reaccionar a temperatura ambiente durante 24 h. Los FMNPs aminosilano modificado se separaron por imán permanente y se lavaron con agua desionizada tres veces. Entonces vuelve a dispersar el FMNPs-NH 2 en 100 ml de dimetilformamida (DMF), añadido anhídrido succínico excesiva para formar una solución mixta y reaccionar a temperatura ambiente durante 24 h. Los FMNPs modificado con carboxilo se separaron por imán permanente de nuevo y se lavaron con agua desionizada tres veces.
Preparación y caracterización de anticuerpos FMNPs conjugado BRCAA1
Utilizamos proceso de dos pasos para obtener estable conjugación anti-BRCAA1-FMNPs [ ,,,0],48, 49]. 1,5 mg solución FMNPs-COOH se dispersó en 2 ml de tampón pH 7 PBS, y se sonicó durante 10 min. Luego mezclamos 1 ml de EDC fresca 400 mM y 100 mM SNSS en tampón pH 6,0 MES y se gira a temperatura ambiente durante 15 minutos. Después de esto, la solución resultante se separó por el campo magnético y 1 mg /ml de anticuerpo monoclonal BRCAA1 se añadieron a la mezcla anterior, se agitó en un lugar oscuro durante 2 h. Para eliminar BRCAA1 libre, la mezcla de reacción residual se separó por el campo magnético y el sólido restante se lavó con 1 ml de tampón PBS tres veces. Por último, 1 ml 0,05%-20 Tween /PBS se añadió a la conjugación BRCAA1-FMNPs y la final bio-conjugación se almacenó a 4 ° C. Cuando se utilizó, esta conjugación BRCAA1-FMNPs debe diluirse con PBS /0,05% de Tween-20. A continuación, se utilizó el dispositivo de Nano gota de cuantificar la tasa de acoplamiento de anticuerpos BRCAA1 con FMNPs-COOH. Antes de la reacción de acoplamiento, se midió la concentración total de anticuerpo BRCAA1. Después de la reacción de acoplamiento, se midió la concentración de anticuerpo en BRCAA1 mezcla de reacción residual y se calculó la tasa de acoplamiento según la ecuación:
acoplamiento (%) = (1-Concentración de anticuerpo BRCAA1 en mezcla de reacción residual /concentración total de anticuerpo BRCAA1) × 100. Francia El nanosondas como preparados y FMNPs puras se caracterizaron por microscopía electrónica de transmisión y de fotoluminiscencia espectrometría (PL), y el potencial Zeta analizador.
nanosondas para la formación de imágenes in Vitro
focalización de células de cáncer gástrico
línea celular de cáncer gástrico se utilizaron MGC803 células con proteína BRCAA1 sobre-expresado como células diana, células de fibroblastos humanos sin proteína BRCAA1 expresado fue utilizado como control, se cultivaron y se recoge, y luego fueron tratados con 50 g /-FMNPs BRCAA1 nanosondas ml y se cultivaron humidificado en un 5% de CO 2 incubadora de aire equilibrado a 37 ° C durante 4 h, mientras que el MGC803 y células de fibroblastos humanos fueron tratados con FMNPs como el grupo de control. Después, las células se lavaron con PBS tres veces, y las células fijadas con solución de glutaraldehído al 2,5% durante 30 min. Para la contratinción nuclear, MGC803 se incubaron con mM Hoechst 33258 1 en PBS durante 5 min. Las células fueron observadas por microscopio de fluorescencia (Nikon TS100-F), y la imagen por instrumento de imagen GE 3.0T HDX MR equipado con software Paravision 3.0.
Que también se utiliza el citómetro de flujo para evaluar la capacidad celular de cáncer gástrico de BRCAA1- orientación FMNPs nanosondas.
Investigaciones sobre el Estómago
Investigaciones sobre el Estómago
| 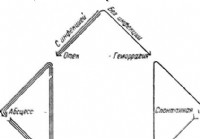 Clasificación de pancreatitis aguda - Diagnóstico de abdomen agudo
Clasificación de pancreatitis aguda - Diagnóstico de abdomen agudo
 tarta de chocolate crudo y mandarina
tarta de chocolate crudo y mandarina
 3 remedios caseros efectivos para la diarrea
3 remedios caseros efectivos para la diarrea
 ¿Cuál es la mejor manera de manejar el SII?
¿Cuál es la mejor manera de manejar el SII?
 Pruebas de microbioma:¿Qué es la disbiosis y cómo se comprueba?
Pruebas de microbioma:¿Qué es la disbiosis y cómo se comprueba?
 Mes de concientización sobre la gastroparesia
Mes de concientización sobre la gastroparesia
 Qué hacer cuando la vida te caga encima
Este fin de semana, comencé a releer Un hombre en busca de sentido. de Víctor Frankl. Lo he leído al menos dos veces al año, durante los últimos 3 años. Cuando empiezo a sentirme perdido, agotado o co
Qué hacer cuando la vida te caga encima
Este fin de semana, comencé a releer Un hombre en busca de sentido. de Víctor Frankl. Lo he leído al menos dos veces al año, durante los últimos 3 años. Cuando empiezo a sentirme perdido, agotado o co
 Cómo deshacerse de las náuseas y los vómitos
Náuseas y vómitos definición y hechos Las náuseas y los vómitos son síntomas de una enfermedad subyacente y no se deben a una enfermedad específica. Las náuseas y los vómitos son síntomas de una
Cómo deshacerse de las náuseas y los vómitos
Náuseas y vómitos definición y hechos Las náuseas y los vómitos son síntomas de una enfermedad subyacente y no se deben a una enfermedad específica. Las náuseas y los vómitos son síntomas de una
 Esta hormona podría mantenerlo enfermo
En esta publicación, profundizaremos en una de las hormonas más importantes de su cuerpo... y por qué generalmente se agota en personas con problemas de salud intestinal. El cortisol bajo es el patró
Esta hormona podría mantenerlo enfermo
En esta publicación, profundizaremos en una de las hormonas más importantes de su cuerpo... y por qué generalmente se agota en personas con problemas de salud intestinal. El cortisol bajo es el patró