Endoteelin lipaasiproteiinin on lupaava virtsan biomarkkeri diagnoosi mahasyövän
Abstract
tausta
Mahalaukun syöpä on yksi yleisimmistä pahanlaatuisia kasvaimia maailmassa. Löytäminen tehokas diagnostinen biomarkkereita virtsasta tai seerumista edustaisi ihanteellisin ratkaisu havaitsemaan mahasyövän aikana vuotuinen lääkärintarkastus. Tämän tutkimuksen tarkoituksena oli arvioida mahdollisten endoteelisolujen lipaasia (EL) virtsa- biomarkkeri diagnoosin mahasyövässä.
Menetelmät
ekspressiotasot EL mitattiin käyttäen Western-blottauksella ja immunohistokemiallisella värjäyksellä kokeita (kudos, seerumi, ja virtsa) näytteet mahasyöpäpotilaista versus
terveitä ihmisiä. Olemme myös tarkastaneet EL tasot virtsanäytteistä muiden syöpätyyppien (keuhko-, paksusuolen ja peräsuolen syöpien) ja hyvänlaatuisia vaurioita (gastriitti ja mahalaukun sileälihaskasvain) tarkistaa, jos EL oli erityinen syöpään.
Tulos
Havaitsimme erotetaan selkeästi toisistaan EL ilmennystasoissa virtsanäytteistä 90 mahasyöpäpotilaista ja 57 tervettä vapaaehtoista. Se oli noin 9,9-kertainen keskimääräinen lasku EL ilmentymisen tasot virtsanäytteistä mahasyövän verrattuna terveisiin kontrolleihin (P
< 0,0001), saavuttaa 0,967 AUC-arvo ROC (receiver operating ominaisuus) käyrä, joka osoittaa se on erittäin tarkka diagnostisena markkerina mahasyövän. Mielenkiintoista on, että ekspressiotasot EL kudoksessa ja seerumin näytteet eivät olleet läheskään yhtä erottelevia kuin virtsanäytteistä (P
= 0,90 ja P
= 0,79). Immunohistokemiallisissa kokeissa positiivinen ilmaus EL-proteiinin havaittiin 67% (8/12) mahalaukun viereisten noncancerous ja 58% (7/12) mahasyövän näytteitä. Ei ollut merkittävää tilastollista ilmentymisen tasoa tämän proteiinin välillä mahasyövän ja vastaavat noncancerous kudoksissa (P
= 0,67).
Päätelmät
virtsan EL kuin erittäin tarkka mahasyöpä biomarkkerit, joka on mahdollisesti sovellettavasta seulonta korkea herkkyys ja spesifisyys.
Virtual diat
virtuaalinen dia (t) tämän artikkelin löytyvät täältä: http: //www. diagnosticpathol logia. diagnomx. eu /vs /4527331618757552
avainsanat
endoteelisolujen lipaasi biomarkkerit Mahasyöpää Diagnoosi tausta
Mahalaukun syöpä on yksi yleisimmistä pahanlaatuisia kasvaimia maailmassa, joka edustaa kolmanneksi yleisin syy syöpään liittyvän kuoleman men ja viides johtava syy naisilla [1]. Noin kaksi kolmasosaa mahasyövän tapauksista esiintyy vähemmän kehittyneissä maissa, jotka ovat lähes kolme kertaa suurempi henkeä kohti kuin kehittyneissä maissa, kuten Euroopan maissa ja Pohjois-Amerikassa [2]. Mahalaukun syöpä on korkea kuolleisuus, koska sillä ei ole selvää kliinisiä oireita alkuvaiheessa. Tutkimukset osoittavat, että jos kasvain havaittiin ja resektoitiin varhaisessa vaiheessa, keskimäärin 5 vuoden pysyvyys on suhteellisen korkea [3, 4]. Siksi varhainen diagnosointi ja hoito ovat avainasemassa parantaa ennustetta mahasyövän potilaista.
Vaikka suuri määrä työtä on otettu teknologian kehitys helpottaa diagnoosin avulla gastroskopia ja immunohistokemiallinen analyysi, invasiivista luonnetta näiden menettelyjen avulla epäkäytännöllinen suuren mittakaavan seulontaan mahasyövän. Tehokas diagnostinen biomarkkereita virtsasta tai seerumista edustaisi ihanteellisin ratkaisu, joka mahdollistaa testauksen mahasyövän kautta veri- tai virtsakoe aikana vuosittain lääkärintarkastuksissa. Useat diagnostiset seerumin markkereita on ehdotettu mahasyövän, kuten MG7-Ag [5], karsinoembryonaalinen antigeeni (CEA), MUC1 ja MUC5AC [6]. State of the art on, että lähes kaikki niistä kärsivät melko alhainen herkkyyteen ja erityispiirteet syövän diagnosointiin, ja siksi ei ole käytetty laajalti kliinisesti [7]. Verrattuna kudosten ja seerumin, virtsan keräys on suhteellisesti helpompaa ja vähemmän invasiivisia. Se voi olla sopivampi suuren mittakaavan seulontaan syövän havaitsemiseen [8]. Käyttämällä vertailevia proteomic analyysejä, useita potentiaalisia virtsan biomarkkereiden on ehdotettu ja testattu muiden syöpien, kuten kystatiini B ja klusteriinille virtsarakon syövän [9, 10], hiilihappoanhydraasin IX ja katepsiini D munuaissyövän [11, 12], ja ADAM12 rintasyövän [13]. Mahasyövän, useat biomarkkerit on raportoitu, kuten pepsinogeeni I, prostaglandiini E2, ja liukoisen c-erbB-2 [14-16]. Varsinainen diagnostinen kyky mahasyövän on vielä arvioitava perusteellisesti, koska niitä ei ole laajalti käytetty kliinisissä diagnostiikkaan. Siksi on selvästi kiireesti tunnistamista ja tunnustamista uusien ja luotettavia diagnostisia markkereita seulontaan mahasyövän.
Olemme aiemmin toteuttaneet systeemibiologian tutkimuksen tunnistaa mahdolliset ehdokas biomarkkereita diagnosointiin mahalaukun syövän. Tässä tutkimuksessa olemme analysoineet geeni-ilmentymisen data 80 paria mahasyövän kudosten ja viereisen ei-syöpä kudoksia kerätään mahasyöpäpotilaista käyttäen microarray siruja, ja tunnistaa satoja eri tavoin ilmaistuna geenien syövän verrattuna
kontrollisilkkipaperia [17 ]. Sitten koulutettu tukivektoriluokitin (SVM), joka luokittelija ennustaa, mitkä näistä ilmentyvät eri geenit voivat olla niiden proteiinien erittyy virtsaan. Niistä ennustettu excretory proteiini, löysimme EL osoittaa korkea erotteleva tehon kannalta sen ilmaisun virtsanäytteistä mahasyövän potilaista verrattuna
terveitä ihmisiä [18].
Tässä laajentaa edellisessä tutkimuksessa, jonka tavoitteena on (a) edelleen vahvistavat, että EL on korkea erottelukyky tehon välillä virtsanäytteet mahasyövän potilaiden ja terveiden ihmisten laajemmalla joukko näytteitä, ja (b) osoittavat, että EL on erittäin spesifinen syöpään vertaamalla sen runsaus virtsanäytteistä mahasyövän muiden syöpä tyypit ja hyvänlaatuisia vaurioita. Tool menetelmät
näytteiden kerääminen
Kaikki näytteet kerättiin kolmen sairaalan Jilin University Norman Bethune Medical College, Changchun, Kiina ja Cancer sairaalan sidoksissa Xinjiangin Medical University, Urumqi, Kiina. Mahalaukun syöpä kudoksia ja vastaavat ei-syöpäkudokset kirurgisesti resektoitiin mahalaukun syöpäpotilailla. Seerumi ja aamulla random-saalis virtsanäytteet saatu syöpäpotilaiden ennen leikkausta. Nämä näyte kerättiin, aikana maaliskuusta 2011 alkaen syyskuuhun 2012. Kaikkiaan 90 mahasyövän tapaukset (67males ja 23 naarasta, ikäryhmä: 31-85 vuotta) ja 57 tervettä vapaaehtoista (30 urosta ja 27 naarasta; ikäryhmä : 29-76 vuotta) tutkittiin. Mahasyövän tapaukset diagnosoitu histologisten analyysien kuten suoliston ja hajanainen tyyppi mukaan Lauren luokituksen. Lisäksi, virtsanäytteet saatiin 9 keuhkosyöpäpotilaita, 10 paksusuolen syöpäpotilaiden, 10 peräsuolen syövän potilaille, 2 gastriitti potilasta, ja 2 mahalaukun leiomyooma potilailla, joita käytetään tarkistamaan, onko EL on erityinen syöpään. Seuraavia kriteereitä käytettiin näytekokoelma: (i) syöpäpotilailla saa olla alkanut mitään hoitoa niiden syövän; ja (ii) vapaaehtoisia terveen kontrolliryhmän ei pitäisi olla mitään vakavia systeemisiä sairauden aikaisemmin. Kirjallinen suostumus muodossa allekirjoittivat kukin osallistuja kun he olivat tietoa tutkimuksen tarkoituksesta, joka hyväksyttiin tutkimuksen eettiset komiteat Jilin University College of Medicine ja Xinjiangin Medical University, vastaavasti. Taulukossa 1 esitetään yhteenveto tietoa terveillä vapaaehtoisilla että mukana tässä study.Table 1 tiedot terveillä vapaaehtoisilla että mukana tässä tutkimuksessa
Ominaisuudet
Tissue
Serum
Virtsa
Mahasyöpää
12
12
90
keski-ikä (alue)
60 (42-76)
63 (84-39)
60 (31-85)
Sukupuoli
Mies
6
7
67
Female
6
5
23
kasvain sijainti
Cardia
3
2
39
Body
5
6
26
Antrum
3
4
16
Diffuse
1
0
9
Operation
Yhteensä gastrectomy
4
5
29
yhteensä gastrectomy
8
7
61
Lauren luokitus
Suoliston
5
4
39
Diffuusi
7
8
51
Histologia tyyppi
korkea tai kohtalainen
5
5
43
Huono tai erilaistumaton
7
7
47
Kasvain vaiheissa
Ι ja ΙΙ
2
4
31
ΙΙΙ ja ΙV
10
8
59
syvyys hyökkäyksen
T1 ja T2
5
9
30
T3 ja T4
7
3
60
solmun tila
N0
3
3
29
N1 ja N2
9
9
61
etäpesäke tila
M0
5
10
71
M1
7
2
19
Keuhkosyöpä -
-
9
keski-ikä (alue)
46 (42- 57)
Colon syöpä -
-
10
keski-ikä (alue) B-53 (46-65) B Peräsuolisyöpäpotilas
- -
9
keski-ikä (alue)
62 (47-78)
Healthy
12
12
57
keski-ikä (alue)
60 (42 -76)
54 (41-72)
47 (29-76) B gastriitti /Krooninen tulehdus -
-
2
keski-ikä (alue)
56 (43-69) B Gastritic sileälihaskasvain
2
keski-ikä (alue) B -
- 56 (51-62) B-Western blotting-analyysi
kudokset jauhetaan jauheeksi nestemäisessä typessä, ja sitten lyysattiin proteiinin uuttopuskuria [0,5 mol /l Tris-CI (pH 7,4), 150 mmol /L NaCl, 0,1 mmol /L etyleenidiamiinitetraetikkahappoa etikkahappo (EDTA) (pH 7,0) , 1 mmol /l fenyylimetyylisulfonyylifluoridia (PMSF), 2,5 mg /ml aprotiniinia, 1 mmol /l ditiotreitolia (DTT), 1% Triton X-100, 1% natriumdeoksikolaattia (SDS)]. Kaikki reagenssit hankittiin Beyotime (Beyotime, Shanghai, Kiina). Seerumin ja virtsan näytteitä säilytettiin läsnä ollessa proteaasi-inhibiittori (Roche, Basel, Sveitsi) steriileissä astioissa ja sentrifugoitiin (1000 x g 10 minuutin ajan 4 ° C: ssa) solukomponenttien poistamiseksi. Supernatantit kerättiin ja säilytettiin -80 ° C: ssa (pisin varastointi 6 kuukautta). 2 ml virtsanäytteet dialysoitiin tislattua vettä läpi suodattamalla kalvon (Dinguo, Peking, Kiina) 8 kDa cutoff 4 ° C: ssa ja sitten lyofilisoitiin -20 ° C: ssa. Kuiva-virtsanäytteet suspensoitiin uudelleen 10 mM fosfaattipuskuroidulla suolaliuoksella (PBS) (pH 7,5). Proteiini mitattiin käyttäen BCA Protein Assay Kit (Beyotime, Shanghai, Kiina). Virtsan kreatiniinipitoisuus olivat kvantisoidaan emäksinen pikraattiin menetelmällä (Jaffe: n reaktio), jossa kreatiniini rutiinitesti puoliksi autoanalysaattoria (Vital Micro 300, Alankomaat).
Western blot käytettiin mittaamaan ekspressiotasoja EL. 20 ug kokonais-proteiineja käytettiin kokeessa. Kaikki näytteet erotettiin käyttämällä 4-15% SDS-PAGE: lla (Bio-Rad Laboratories Inc., USA) ja siirrettiin PVDF-kalvolle (Bio-Rad Laboratories Inc., USA). Kaivoa inkuboitiin 5% maitoa blokkausliuosta 2 tuntia huoneen lämpötilassa. Kaivoa inkuboitiin polyklonaalisella vuohen anti-ihmisen EL primaarista vasta-ainetta (1: 400; Santa Cruz Biotechnologies, USA) huoneen lämpötilassa 1 tunnin ajan, joka pestiin kolme kertaa 5 minuutin ajan fosfaattipuskuroidussa suolaliuoksessa (PBS), ja sitten reagoimaan kanin anti-vuohi sekundaarista vasta-ainetta (1: 5000; Beyotime, Shanghai, Kiina). Kudosten, β-aktiini vasta-ainetta (1: 1000; Santa Cruz Biotekniikka, USA) recubated yhdenvertaista lastaus. Lopussa, kalvo peitti täysin yhtäläinen määrä tehostajana ja peroksidia ratkaisu ECL plus Kit (Beyotime, Shanghai, Kiina) 1 minuutti, ja sitten kaikki kalvot altistettiin elokuva. Tiheys bändi kvantifioitiin käyttäen Gel Image System (Tanon, Shanghai, Kiina). Kiinteä määrä on 1 ng puhdistettua EL standardia (R &D systems, Inc., USA) käytettiin positiivisena kontrollina kalibrointiin. Kanssa huomioon vaihtelut virtsan muodostuminen ja erittyminen, densitometrisesti EL virtsasta on ilmaistu suhteessa virtsan kreatiniinin pitoisuudet.
Immunohistokemia
mittaamiseksi ekspressiotasot EL syövän versus
vieressä noncancerous kontrollisilkkipaperia, molemmat kudosten kiinnitettiin 12-16 tuntia 4% paraformaldehydiä (pH 7,0), upotettiin parafiiniin ja leikattiin 4 um: n paksuisia leikkeitä. Plus Leikkeitä paistettiin 60 ° C: ssa 30 minuutin ajan. Parafiini poistettiin käyttäen ksyleeniin 30 minuuttia, ja Leikkeet rehydroitiin läpi sarjan alkoholia liuoksia ennen käsittelyä ja 1 mM: lla sitruunahappoa, pH 6,0, 100 ° C: ssa 5 minuuttia ja 1% H
2O 2: ssa 30 minuuttia. Sen jälkeen, kun on pesty tislatulla vedellä, leikkeitä inkuboitiin huoneen lämpötilassa 5% sian seerumia PBS: ssä 30 minuuttia ja EL-vasta-ainetta (1: 400; Santa Cruz Biotechnologies, USA) laimennettiin PBS: ssa yön yli 4 ° C: ssa, pestiin kolme kertaa 5 minuuttia PBS: ssä. Sitoutuneet vasta-aineet visualisoitiin värireagenssia Diaminobenzidine (Bios, Peking, Kiina). Leikkeet vastavärjättiin Mayerin hematoksyliinillä. Kaksi patologia ilman tietoa potilaiden kliininen tila arvioidaan kaikki värjätyt leikkeet itsenäisesti. Solut laskettiin suurennos on suuri kussakin tapauksessa (x 400), ja prosenttiosuus positiivisesti värjäämällä solut laskettiin. Solujen osuus, joilla EL ilmentyminen luokitella seuraavasti: 0 = alle 10%; 1 = 11% -50%; 2 = 51% -75%; 3 = yli 75%. Värjäytymisintensiteettiä oli luokiteltuna suhteellinen voimakkuus seuraavasti: 0 = negatiivinen; 1 = heikko; 2 = väli; 3 = voimakas värjäytyminen. Osuus ja intensiteetti tulokset olivat sitten kerrotaan olevan kokonaispistemäärä indeksi. Per tilastollinen analyysi, tulokset alle 2 pidettiin negatiivinen, ja tulokset on 2 tai suurempi pidettiin positiivisina.
Tilastollinen analyysi
chi-neliö testi ja Wilcoxonin allekirjoittivat rank testi käytettiin analysoimaan ekspressiotasoja EL parilliset syöpä ja noncancerous kudosnäytteistä. Analysoida ero EL ilmentymisen tasoja seerumissa ja virtsanäytteet välillä mahasyövän potilaiden ja terveiden kontrollien vastaavasti, Mann-Whitneyn testiä käytettiin. Chi-neliö testi käytettiin arvioimaan suhdetta virtsan EL ekspressiotasot ja kliinis muuttujia. Vaativille teho ilmentymisen tasojen EL virtsassa välillä näytettä syöpää ja kontrolliryhmän tutkittiin käyttäen receiver operating (ROC) käyrä ja alue ROC-käyrän alla (AUC). Kaikki testit olivat kaksisuuntaisia ja P
-arvo < 0,05 pidettiin tilastollisesti merkittävänä. Kaikki tilastolliset analyysit suoritettiin käyttämällä GraphPad Prism 5 tilastollisia ohjelmistoja.
Tulokset
EL ekspressiotasot virtsassa
Jotta semikvantitatiivinen analyysi virtsan proteiineja, käytimme suhteellinen EL ekspressiotasoja suhteessa kuin virtsan kreatiniini kussakin näytteessä normalisoimiseksi EL ilmaisun eri virtsanäytteitä. Havaitsimme erotetaan selkeästi toisistaan EL ilmennystasoissa virtsanäytteistä 90 mahasyöpäpotilaista (1,39 ± 0,68) ja 57 tervettä vapaaehtoista (0,14 ± 0,32). Havaitsimme noin 9,9-kertainen keskimääräinen lasku EL proteiinin tasot virtsanäytteistä mahasyövän potilaista verrattuna terveisiin kontrolleihin (P
< 0,0001). Tulokset voidaan nähdä kuviossa 1A ja kuviossa 2A. Olemme piirretty ROC käyrä luokitustarkkuudesta käyttäen EL ekspressiotasot kaikilla näillä virtsanäytteitä, antaa kokonaiskuvan vaativille teho proteiinin. Huomaa, että AUC tarjoaa laajalti hyväksytty indeksi laadun mittaamiseen taustalla luokittelijan kanssa AUC = 1,0 edustaa täydellinen luokitus ja AUC = 0,5 edustaa mitään erottelua. EL on saavuttanut AUC-arvo 0,967 95%: n luottamusväli (CI) ollessa [,942-+0,993], mikä osoittaa, että virtsan EL voivat toimia erittäin lupaava mahasyövän biomarkkeri diagnostisia tarkoitukseen (kuvio 2B). Kuvio 1 Edustava Western blot-analyysi EL-proteiinin runsautta. Positiivinen kontrolli kaistalla (+) sisälsi kaupallista EL standardi tuote, joka käytettiin normalisoimaan signaalin vasteen kaikissa geelit. (A), runsaus EL proteiinin virtsanäytteistä; (B), EL runsaus syöpää kudosnäytteitä ja vastaavia noncancerous näytteitä mahasyöpäpotilaista ilman hoitoa. Β-aktiini toimii sisäisenä latauskontrollina arvioimiseksi suhteellinen proteiini runsaus tasolla; (C), EL-proteiinia runsaasti seeruminäytteistä.
Kuvio 2 Virtsan EL proteiinia runsaus mahasyövän potilailla verrattuna terveisiin kontrolleihin. Kukin mittauspiste on yksi yksilö. (A), EL runsaasti näytteitä mahasyöpäpotilaista merkittävästi pienempi kuin näytteissä terveillä verrokeilla; (B), ROC käyrät Virtsan EL proteiinia. AUC-arvo oli 0,967.
Toteamme, että EL kaistan Western blot puuttui virtsanäytteistä 71 90 mahasyövän potilaiden ja kaikki 57 terveillä vapaaehtoisilla on EL bändi heidän virtsanäytteistä. Käyttämällä puuttuminen /läsnäolo EL kaistan cutoff kutsuessaan henkilöä, jolla mahasyöpä tai ei, nämä tiedot antavat aihetta kutsuvan herkkyys 79% [95% CI, ,690-,867] ja spesifisyys 100% [95% CI, +0,937-+1,000].
sitten tutki EL ekspressiotasot virtsanäytteistä mahalaukun syöpäpotilaiden ja sen suhde eri kliinis tekijöitä, nimittäin sukupuoleen, histologia erilaistuminen, kasvaimen vaiheesta, invaasio ja metastaasi tila. Ei merkittäviä tilastollisia yhteyksiä EL ekspressiotasot ja mitä tahansa näistä tekijöistä voidaan havaita. Korrelaatio virtsan EL ekspressiotasot ja kliinis tekijät on esitetty taulukossa 2.Table 2 korrelaatio virtsan EL ilmaisun ja kliinis-
kliinis (n)
EL poissa (%) B
EL läsnä (%)
P
n = 71
n = 19
Sukupuoli
Mies, (67) B-51 (72) B 16 (84) B 0,27
Nainen, (23) B-20 (28) B-3 (16) B Histologinen tyyppi
korkea tai kohtalainen, (43) B-31 (44) B 12 (63) B 0,13
Huono tai erilaistumaton, (47) B-40 (56) B 7 ( 37) B Lauren luokitus
Intestinal, (39) B-29 (41) B 10 (53) B 0,36
Diffuusi, (51) B-42 (59)
9 (47) B Kasvain vaiheissa
Ι ja ΙΙ, (31) B-22 (31) B-9 (47) B 0,18
ΙΙΙ ja ΙV, (59)
49 (69) B 10 (53) B syvyys hyökkäyksen
T1 ja T2, (30) B-21 (30) B-9 (47) B 0,14
T3 ja T4, (60) B-50 (70) B 10 (53) B-solmun tila
Absent, (29) B-23 (32) B-6 (32) B- 0,95
Present, (61) B-48 (68) B 13 (68) B etäpesäke tila
M0 (71) B 55 (77) B 16 (84)
0,52
M1 (19) B 16 (23) B-3 (16) B Olemme myös tarkistaa, jos EL on erityinen syöpään. Koska ensimmäinen yritys, olemme tutkineet EL ekspressiotasot virtsanäytteistä kolmen muun syöpätyyppeihin (keuhko-, paksusuolen ja peräsuolen syöpien) ja hyvänlaatuisia vaurioita (gastriitti ja mahalaukun sileälihaskasvain). Testi tehtiin virtsanäytteestä 9. keuhkosyöpää, 10 paksusuolensyöpä, 10 peräsuolen syöpä, 2 gastriitti, ja 2 mahalaukun sileälihaskasvain potilasta. Selvästi nähdään, että 9 ulos 9, 9 10, 10 10, 2 ulos 2 ja 2 pois 2 näytettä ovat EL bändi virtsanäytteistä keuhkosyöpien, paksusuolen syövät, peräsuolen syövän, gastriitti ja mahalaukun leiomyooma lla (kuvio 3). Vaikka tämä tulos ei takaa, että puute EL virtsassa on merkki ainoastaan mahalaukun syövän, se vahvasti siihen, että EL on hyvin spesifinen. Suuremmat testit tehdään meidän seurantatutkimuksessa, joka edellyttää huomattavasti enemmän potilaita muiden sairauksien mahdollisesti liittyvät mahasyövän, kuten haimasyöpä ja ruokatorven syöpä. Kuva 3 EL runsaus virtsanäytteistä muiden syöpätyyppeihin ja hyvänlaatuisia vaurioita. (A), yhdeksän keuhkosyöpä näytteitä; (B), Ten paksusuolensyöpä näytteitä; (C), Ten peräsuolen syövät näytteitä; (D), kaksi gastriitti ja kaksi gastritic sileälihaskasvain näytettä. (+) Positiivinen kontrolli kaistalla.
EL ekspressiotasot kudoksissa ja seerumit
Tutkimus osoittaa, että EL-proteiini puuttuu mahasyövässä virtsanäytteistä. Ottaen huomioon, että virtsa sisältää sekä proteiinia erittyy uroteeliin sekä proteiinien plasmasta tai solulyysin, olemme tutkineet myös EL ekspressiotasoja kudoksessa tai seerumista mahasyöpäpotilaista, jonka tarkoituksena on päätellä syitä tähän havaittujen poissaolon. Western blot suoritettiin mittaamiseksi EL ekspressiotasot syöpäkudoksessa näytteet ja vastaavat noncancerous näytteitä 12 käsittelemättömän mahasyöpäpotilaista (kuvio 1 B). Ei merkittävää eroa ekspressiotasot EL välillä havaittiin mahasyövän kudosnäytteitä ja vastaavat noncancerous näytteistä (Wilcoxonin allekirjoitettu rank testi, P
= 0,90).
Immunohistokemiallisella värjäyksellä kokeissa olemme huomanneet, että ruskea rakeet pääasiassa esiintyi sytoplasmassa (kuvio 4). Positiivinen ilmaus EL-proteiinin havaittiin 58% (7/12) mahasyövän ja 67% (8/12) mahalaukun vierekkäisten noncancerous näytteet (taulukko 3). Ei ollut eroa ekspressiotasot tämän proteiinin välillä mahasyövän ja vastaavat noncancerous kudokset (chi-neliö testi, P
= 0,67). Tutkimme myös mahdollisia suhdetta EL ekspressiotasot ja mahdollisesti merkitystä kliinispatologiset edellä mainittua tekijää. Ei suhdetta ei havaittu. Tulokset on esitetty taulukossa 4. Kuvio 4 immunohistokemiallinen analyysi EL kudoksissa mahasyövän ja vastaavat noncancerous näytteitä. Ruskea rakeet EL pääasiassa ilmestyi sytoplasmassa. Vieressä noncancerous kudokset on värjätty (A) (x 400). Syöpä kudokset on värjätty (B) (x 400).
Taulukko 3 EL ilmentymistä mahasyövän ja viereisen noncance Rousin näytteitä
n
ilmentyminen EL proteiinin
P
Negative
Positiivinen
Vieressä ohjaus
12
4 (33%) B-8 (67%)
0,67
mahasyöpää
12
5 (42%) B-7 (58%) B Taulukko 4 EL ilmaisun ja kliinis tekijöitä mahasyövässä kudoksissa
kliinis
n
EL
P
Negative
Positiivinen
Sukupuoli
Mies
6
2
4
0,56
Female
6
3
3
Ikä (vuosi) B ≤50
3
1
2
0,74
> 50
9
4
5
Lauren luokitus
Suoliston
5
3
2
0,28
Diffuusi
7
2
5
histologinen tyyppi
Highly eriytetyn
1
1
0
0,36
Kohtuullisen eriytetty
4
2
2
Huonosti eriytetty
7
2
5
Kasvain vaiheissa
I ja II
2
1
1
0,79
III ja IV
10
4
6
syvyys hyökkäyksen
T1 ja T2
5
2
3
0,92
T3 ja T4
7
3
4
Imusolmuke etäpesäke
Positive
3
1
2
0,74
Negatiivinen
9
4
5
sitten mitataan EL ekspressiotasot seerumeissa 12 mahasyövän potilaista ja
kuin 12 tervettä henkilöä (kuvio 1 C). Voidaan nähdä, että ei ole selvää eroa syövän näytteiden ja terveillä verrokeilla (Mann-Whitneyn testi, P
= 0,79). Toteamme, että EL ekspressiotasot on monenlaisia jakauma molemmissa näytesarjaa.
Keskustelu
Aiemmissa tutkimuksessa olemme kehittäneet uuden laskennallisen menetelmän ja soveltaa sitä ennustaa että EL saattaisi toimia erittäin lupaava diagnostiset merkkeihin virtsassa mahasyövän. Täällä olemme edelleen vahvistaneet tämän ennustuksen suurempiin vedostulostus, ja lisäksi olemme havainneet, että EL-proteiini on erittäin spesifinen syöpään.
EL on uusi jäsen triglyseridilipaasin geeniperheen, ja on korkea sekvenssihomologia kanssa lipoproteiinilipaasi (LPL) (45%), maksan lipaasi (HL) (41%) ja haiman lipaasi (PL) (21%) [19, 20]. EL on ensisijaisesti fosfolipaasi ja on joitakin triglyseridilipaasin aktiivisuutta, jolla on tärkeä rooli plasman korkean lipoproteiinien aineenvaihdunnan ja ateroskleroosin kehitykseen [21-25]. Useat tutkimukset ovat osoittaneet, että LPL on tärkeä rooli syövän synnyssä, mukaan lukien peräsuolen ja haiman syövät, keuhkosyöpä [26, 27]. Kuitenkin, EL ei ole raportoitu liittyvän syöpä paitsi kivesten sukusolujen kasvaimia, kun mekanismi on epäselvä [28].
Löytö, että ekspressiotasot EL on merkittävästi vähentynyt virtsan mahalaukun syövän potilaiden ja osoittamaan mitään eroa vastaava seeruminäytteet sekä kudosnäytteitä on hyvin kiehtova. Yksi mahdollinen syy voi johtua ominaisuuksien glomerulussuodatuksen järjestelmä. On tunnettua, että plasman proteiineihin suodatettiin vaikka glomerulusten perusteella niiden koot, maksut ja rakenteen muoto [29]. Pienet ja positiivisesti varautuneet molekyylit helpommin suodatetaan virtsaan kuin suuret ja negatiivisesti varautuneita proteiineja. Sekvenssi EL on useita positiivisesti varautuneita klustereita [30], joka voi olla syy, että se voidaan suodattaa pois terveiden ihmisten virtsasta. Kuitenkin mikroympäristön syöpäsolujen taipumus olla hapan [31], jotka saattavat muuttua positiivisesti varautuneet klustereita EL: ien ja negatiivisia, joten estää molekyylien suodatetaan virtsaan. Varmasti, tarkka syy on vielä ymmärrettävä, ja optio lisätutkimuksia.
Virtsa on ihanteellinen ei-invasiivisia lähde syövän havaitsemiseen. On kuitenkin syytä huomata, että virtsassa on suurta vaihtelua proteiinikonsentraatioiden koko päivän, joka voidaan vaikuttaa eri tekijät (ikä, ruokavalio, ja keräys aikaa). Tästä syystä se on keskeinen normalisoida proteiinin pitoisuus virtsassa mitattaessa ekspressiotasot proteiinia. Siksi käytimme suhteellinen EL ekspressiotasoja suhteessa kuin virtsan kreatiniinin kussakin näytteessä normalisoida EL ekspressiotasoja eri virtsanäytteitä. Tulokset Tämän tutkimuksen mukaan menetys virtsan EL ilmaisun voi antaa alustava mahasyövän aikana laajamittainen seulonta ja suoremmin tutkimuksia, kuten gastroskopia ja patologia testi biopsianäyte tarvitaan lopullista diagnoosia. Monet tutkimukset raportoivat, että diagnostiset biomarkkeri voi olla hyödyllinen prognostinen ja selviytymisen indikaattori mahasyövistä [32-34]. Se ei vain ennustaa ennuste tiedot syöpäpotilaiden, mutta myös antaa hoitoa strategian lääkäri. Niinpä selvitimme korrelaatio EL ekspressiotasot ja kliinis ominaisuudet mahasyövässä. Vaikka EL tekee lupaava diagnostinen markkeri mahasyövän, emme löytäneet vahvoja suhteita EL ekspressiotason ja kasvaimen ennustetekijöiden kliinis ominaisuuksia kuten kasvaintyyppi, invaasio ja TNM lavastus. Lisäksi koska lyhyellä aikavälillä tutkimuksen ja puute säännöllisen seurannan potilaita, emme voi arvioida eloonjäämismahdollisuus tässä tutkimuksessa. Rajallisten tietojen osoittivat, että EL ilmaisua ei voida käyttää hyödyllisenä prognoosi- ja selviytymisen indikaattorit mahasyövän. Seuraava tutkimus, pyrimme tutkimaan EL proteiinin ilmentymistä runsaasti potilaita eri kasvaimia ja sen seurannan tutkimuksiin, ja tutkia täsmälleen mekanismi EL rooli karsinogeneesi mahasyövän.
Päätelmä
johtopäätös, vaikka se ei liity kasvaimen vaiheesta tai luokka, virtsan EL voisi olla erittäin lupaava mahasyövän biomarkkereiden jotka voivat olla sovellettavissa suuren mittakaavan seulontoja korkea diagnostinen fidelity.
toteaa
Xueyan Dong, Guoqing Wang osaltaan yhtä tähän työhön.
lyhenteet
EL:
endoteelisolujen lipaasi
ROC:
Receiver operating ominaiskäyrä
AUC:
ala ROC-käyrän
julistukset
Kiitokset
Kiitämme Xiaoming Xu panoksestaan osasto patobiologian laboratorio, Norman Bethune Medical College Jilin University. Tätä työtä tukivat National Institutes of Health (1R01GM075331), "Arvoisat Scholar" avustusta Georgia Cancer Coalition, ja siemenet rahoitusta University of Georgia. Se oli myös tukee osittain National Basic Research Program of China (973 ohjelma, 2011CB512003), National Natural Science Foundation of China (81271897 ja 81071424), Specialized Research Fund tohtorikoulutuskeskukseen of Higher Education of China (20110061120093), Kiina Postdoctoral Science Foundation (20110491311 ja 2012T50304), Foundation of Jilin maakunnan Health Department (2011Z049) ja Bethune erityinen perusta Jilin University
kirjoittajien alkuperäinen toimitti asiakirjat kuville
Alla linkkejä kirjoittajien alkuperäiset toimitti asiakirjat kuville . Kaikki kirjoittajat luettu ja hyväksytty lopullinen käsikirjoitus.
 SCD Lifestyle 2.0 on täällä
SCD Lifestyle 2.0 on täällä
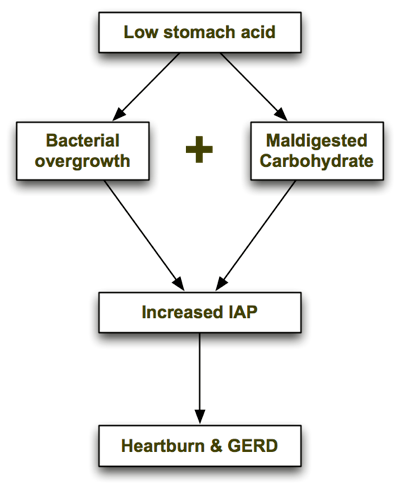 Erityinen hiilihydraattiruokavalio parantaa GERD:tä?
Erityinen hiilihydraattiruokavalio parantaa GERD:tä?
 12 yleistä ripulin syytä useimmat ihmiset eivät tiedä
12 yleistä ripulin syytä useimmat ihmiset eivät tiedä
 Mitä anastomoosien kolme tyyppiä ovat?
Mitä anastomoosien kolme tyyppiä ovat?
 6 parasta suolisto- ja terveyskirjaa, jotka sinun tulee lukea vuonna 2020
6 parasta suolisto- ja terveyskirjaa, jotka sinun tulee lukea vuonna 2020
 Kuinka kauan haavaisen paksusuolitulehduksen puhkeaminen kestää?
Kuinka kauan haavaisen paksusuolitulehduksen puhkeaminen kestää?
 Poluhiivan terveyshyödyt
Paniimoiva on oluenpanon aikana syntyvä hiivatyyppi. Sitä käytetään usein vaihtoehtoisessa lääketieteessä ruoansulatuksen edistämiseen. Sitä käytetään myös useiden terveyssairauksien, kuten vilustumis
Poluhiivan terveyshyödyt
Paniimoiva on oluenpanon aikana syntyvä hiivatyyppi. Sitä käytetään usein vaihtoehtoisessa lääketieteessä ruoansulatuksen edistämiseen. Sitä käytetään myös useiden terveyssairauksien, kuten vilustumis
 Ruoansulatuskanavan ongelmat ja verenvuodot
Ruoansulatuskanavan ongelmat ja verenvuototautikeskus Osallistu haimatulehdustestiin Paranna ruoansulatusta Ruoansulatushäiriö-diaesitys:Vältettävät ongelmaruoat Johdatus verenvuotoon suonikohjuihin
Ruoansulatuskanavan ongelmat ja verenvuodot
Ruoansulatuskanavan ongelmat ja verenvuototautikeskus Osallistu haimatulehdustestiin Paranna ruoansulatusta Ruoansulatushäiriö-diaesitys:Vältettävät ongelmaruoat Johdatus verenvuotoon suonikohjuihin
 Fenolit ja salisylaatit:mitä ne ovat ja miksi sillä on merkitystä
Fenolit eivät ole mitään muuta kuin luonnollisia kemikaaleja, jotka koostuvat bentseenirenkaasta, johon on kiinnittynyt yksi tai useampi hydroksyyliryhmä (OH) (tieteellinen puhe siitä, kuinka se koota
Fenolit ja salisylaatit:mitä ne ovat ja miksi sillä on merkitystä
Fenolit eivät ole mitään muuta kuin luonnollisia kemikaaleja, jotka koostuvat bentseenirenkaasta, johon on kiinnittynyt yksi tai useampi hydroksyyliryhmä (OH) (tieteellinen puhe siitä, kuinka se koota