XiangshaLiujunzi keittäminen lievittää oireita toiminnallisen dyspepsian säätelemällä brain-gut akseli ja tuotanto neuropeptidipitoisuudessa
tiivistelmä
tausta Kiina lääketieteen xiangshaliujunzi keittäminen (XSLJZD) on keskeinen rooli hoidossa toiminnallisen dyspepsian (FD), yhteinen kliininen ruoansulatuskanavan häiriö. Kuitenkin mekanismi tämä tauti on epäselvä. Brain-gut akseli säätelee ravinnon käyttäytymistä, ja tämä sääntelymekanismi välittää neuropeptidien. Brain-gut akselin vajaatoiminta ja neuropeptidi muuttaminen voi olla patologinen mekanismeja FD, ja aivojen-gut akseli sääntely voi vaikuttaa toiminnan lääkkeen. Tool Menetelmät
esitämme kokeessa vaikutus XSLJZD on FD arvioitiin muodossa ravinnonoton, sakkaroosi preferenssitestiarvioinnilla ja electromyogram. Muutokset neuropeptides [greliinin, kolekystokiniiniä (CCK) ja vasoaktiivinen intestinaalinen polypeptidi (VIP)] havaittiin kautta Immunohistokemian reaaliaikainen PCR ja ELISA.
Tulokset
XSLJZD kasvanut ravinnon ja prosenttiosuus sakkaroosia etusija (> 75%). Kuitenkin vaste mahalaukun säilöön vähentynyt. Lisäksi XSLJZD lisääntynyt greliini, CCK, VIP-proteiinien ja geenien vatsassa. XSLJZD myös lisääntynyt greliini, CCK ja VIP proteiineja seerumissa. Sitä vastoin, XSLJZD vähensi mRNA: n ilmentymisen näiden neuropeptidien hypotalamuksessa.
Päätelmät
XSLJZD lievittää oireita FD säätelemällä tuotanto greliinin, CCK ja VIP ja lisäämällä määriä näitä neuropeptidien liikkeessä. Tämä havainto voi auttaa selvittämisessä mekanismi FD ja voi tarjota lisää tietoa farmakokinetiikkaa XSLJZD.
Avainsanat
Xiangshaliujunzi keittäminen Toiminnallinen dyspepsia Brain-gut akseli Brain-gut peptidi Taustaa
Toiminnallinen dyspepsia (FD) on kliiniset ruoansulatuskanavan häiriö ominaista jatkuva tai toistuva kipu ja epämukavuus. Tämä vaiva on lähinnä kokemusta ylävatsan ilman näyttöä orgaanisen rakenteellisia poikkeavuuksia liittyvät näihin oireisiin. Kotitaloudessa tutkimuksessa noin 25% normaalista väestöstä Yhdysvalloissa kärsii FD [1]. Kiinassa selvä tilastot FD on puuttuu; kuitenkin useita teoksia osoittavat, että 8,66-11% potilaista valitsevat sairaalaan, koska vatsan täyteläisyyttä [2-4]. Useat pathophysiological mekanismeja on ehdotettu selittämään useita kliinisiä oireita, kuten yliherkkyys mahan laajeneminen, heikentynyt mukautuvaan mahaan ennen ateriaa, viivästynyt mahalaukun tyhjenemistä, muuttunut pohjukaissuolen herkkyys lipidejä tai happoa, epänormaali duodenojejunal liikkuvuutta ja keskushermoston (CNS) toimintahäiriö; kuitenkin, todisteet liittyvät oireet vaihtelevat potilaiden [5, 6]. Näin ollen tarkkaa mekanismia ei tunneta.
FD, esimerkiksi toiminnallisia maha-suolikanavan häiriöitä, on yhteinen patologinen tila vaikuttavat suolen, jota ohjataan hermoston [7]. Ruoansulatuskanavassa (GIT) ja hermostossa, myös keskushermoston ja enteerisen hermoston (ENS), ovat mukana kaksisuuntainen ulkoista viestintää parasympaattisen ja sympaattisen hermoston. Nämä hermot sisältävät efferent kuituja ja afferent aistien kuituja tarvitaan gut-aivojen signalointi. Tuojahermojen käsittävät monia anturit terminaaleissa suolistossa liittyvät viskeraalisen sa mekaanisten, kemo- ja noci-reseptorit; viritettynä, nämä anturit voivat laukaista erilaisia sisäelinten refleksejä, jotka säätelevät GIT toimintoja, kuten ruokahalu [8-10]. Häiriöt vaikuttavat sääntely kaksisuuntaista viestintää välillä aivot ja suolistossa (brain-gut akseli) ovat tärkeitä patogeneesin näitä sairauksia [11]. Neuropeptides ovat tärkeitä välittäjinä hermostoa ja välillä neuronien ja muiden solutyyppien. Neuropeptidit kuten greliini, kolekystokiniini (CCK) ja vasoaktiivinen intestinaalinen polypeptidi (VIP), ovat mahdollisesti sekaantuneet kaksisuuntainen gut-brain viestintä [12]. Greliini on 28 aminohapon peptidi, hormoni, [13], joka on valmistettu pääasiassa P /D1-solut mahalaukun oxyntic rauhanen; tämä hormoni esiintyy pääasiassa proksimaalisessa mahassa [14, 15]. Greliini on mukana monissa biologista aktiivisuutta, koska tämä hormoni soittaa autokriinisiä ja parakriinisiä rooleja sääntelyprosesseille, kuten ruokahalun säätelyyn, suolen liikkuvuuden, kasvuhormonin vapautumista, immuunimodulaatio [16, 17] ja aloittamisen ravinnon alle hermo valvonta [18]. CCK kuuluu gut-aivot perheen peptidihormoneille [19]. Tämä hormoni erittyy maha-järjestelmän ravinnon saannille vasteena; Lisäksi CCK vapautuu erikoistuneet neuronien myenteeri- plexus ja aivoissa [20]. Aiemmassa tutkimuksessa suonensisäinen injektio CCK tukahduttaa nälkää ja ruokinta ihmisillä [21-23]. CCK on mukana myös signaalitransduktion aivojen-gut akselin primäärisen tuovan hermon kautta kuidut Kiertäjähermo, ja samalla kuidut todennäköisesti käynnistää ilmentymisen reseptorit greliinin [24]. VIP, 28-aminohappo neuropeptidi, jaetaan keski- ja reuna-neuronien; tämä neuropeptidi on mukana monissa fysiologisissa suoliston toimintoja, kuten siittiöiden liikkuvuus sääntely, eritystoimintaa ja vasodilataatio, peristaltic refleksi esto pyöreässä sileän lihaksen kerros ja sulkijalihaksen rentoutumisen [25]. Hermosolujen VIP on myös välittäjänä hermoston vaste aspiriinin aiheuttama vatsa tulehduksellinen tila [26]. Nämä tutkimukset osoittivat, että häiriö aivojen-gut akseli voi olla patogeneesissä FD.
Xiangshaliujunzi keittäminen (XSLJZD), klassinen keittäminen käytetään aikana Qing-dynastian Kiinassa, on keskeinen rooli hoidossa FD; XSLJZD on tehokkaampi kuin prokineettistä lääkkeenä tämän taudin [27]. Kuitenkin mekanismi, jolla XSLJZD lievittää FD on edelleen tuntematon. Tutkimme mekanismi modifioidun XSLJZD siitä näkökulmasta aivojen-gut akselilla ja neuropeptidejä. Tämä sääntelymekanismina voi olla erityinen tila hoitoon FD. Tool Menetelmät
Eläimet
Sprague-Dawley-rottia käytettiin kaikissa kokeissa (SPF Laboratory Animal Technology Co, Ltd, Peking, Kiina) . Kokeet suoritettiin mukaisesti Opas hoito ja käyttö Laboratory Animals julkaissut National Institutes of Health (NIH Publications nro 85-23, tarkistettu 1996) ja jossa hyväksynnän Animal Care komitean Beijing Medical Centre. 10 päivän ikäiset rotanpoikasilla saivat 0,2 ml 0,1% jodiasetamidia (IA) 2% sakkaroosia letkulla suun kautta päivittäin 6 päivää. Kontrolliryhmä sai 0,2 ml 2% sakkaroosia [28]. 6 viikon ikäisiä IA-käsitellyillä rotilla jaettiin satunnaisesti neljään ryhmään: malli (n
= 12; sai saman tilavuuden vettä kuin ajoneuvo), XSLJZD-käsitellyssä ryhmässä (n
= 12; käsiteltiin XSLJZD), pieniannoksisen XSLJZD-hoidetussa ryhmässä (n
= 12; hoidettu puoli annosta XSLJZD) ja domperidonin käsitellyn ryhmän (n
= 12). 6 viikon ikäisiä sakkaroosi-käsiteltyjen rottien nimettiin kontrolliryhmässä (n
= 12). 6 viikon ikäisiä rotat saivat 5 ml /kg kunkin lääkkeen tai veden päivittäin suun kautta letkulla on 10 päivää.
Drugs
XSLJZD koostuu kahdeksasta eri Kiina kasviperäisten lääkkeiden (taulukko 1). Komponentit valmistettiin Pharmaceutical osasto Xiyuan Hospital, sidoksissa Kiinan Academy of TCM. Pure otteita komponenteista valmistettiin. Komponentit liuotettiin veteen. Puolet annoksesta (12,5 mg /kg) ja täyden annoksen (25 mg /kg) XSLJZD annettiin rotille alhaisen annoksen ja XSLJZD-hoidetuilla ryhmillä, vastaavasti. Domperidonia (3 mg /kg Xian Janssen Pharmaceutical Ltd.) annettiin rottien domperidoni-käsitellyssä ryhmässä. Täysi annos XSLJZD rotille oli muunnettu annos annetaan ihmisille. Samaan aikaan malli ja verrokkiryhmien saivat 5 ml /kg vettä päivässä suun kautta letkulla 10 days.Table 1 aineosat XSLJZD liuoksen
Tieteellinen nimi
Osa käyttää
osuus ainesosia (100%)
Astragalus mongholicus
viitteenä
12
Codonopsis pilosula
viitteenä
12
Rhizoma Atractylodis Macrocephalae
Rhizome
12
Poria Kookossaaret
Sclerotium
12
Fructus aurantii
Fruit
12
määritellään villosum
Fruit
6,4
Ligusticum Chuanxiong Hort.
Sclerotium
9.6
Rhizoma corydalis
Rhizoma
9,6
Medicated Leaven
Käymistuotteiden
12
Glycyrrhiza uralensis Fisch.
Root
2,4
Ruoalla mittaus
Ruokailu mitattiin ennen ja jälkeen lääkehoitoa. 18 tunnin paaston jälkeen rotat pidettiin yksittäin. Ruoka oli säädetty 7 tuntia, ja ruoan kulutus laskettiin.
Sakkaroosi preferenssitestiarvioinnilla (SPT) B SPT [29-31] tehtiin ennen ja jälkeen lääkkeet annettiin rotille. Ennen testiä suoritettiin, rottia hoidettiin sopeutua sakkaroosin liuokseen. Vuonna harjoituksen, rotat sijoitettiin yksittäin 48 tuntia häkissä, jossa on kaksi pulloa; yksi pullo sisälsi 1% sakkaroosia ratkaisu, kun taas toinen pullo sisälsi vesijohtovettä. Pullot sijoitettiin vasemmalle puolelle ja oikealle puolelle ruokinta osaston; kannat näiden pullojen vaihdettiin välein 12 h estää mahdollisten vaikutusten puolella etusija juomiskäyttäytymiseen. Harjoituksen jälkeen valmistui vain vesijohtovettä annettiin 6 tuntia. Ruokaa ja vettä sitten pidätetty rotista 18 tunnin ajan. Kokeessa istunnon rotille tarjotaan pääsy kaksi pulloa, joka sisälsi 1% sakkaroosia-liuoksella ja vedellä 1 tunti. Sakkaroosi etusija (SP) määrä määritettiin seuraavan yhtälön: SP = [sakkaroosin (g)] /[sakkaroosin (g) + veden saanti (g)]. Osuus rottien kunkin ryhmän kanssa SP-arvo > 75% laskettiin ja verrattiin kautta chi-neliö testi.
Mahapallosta venymisestä varten sähkömyografista (EMG) testaus [28]
jälkeen joutua yön yli paasto rotat nukutettiin intraperitoneaalisesti 1% pentobarbitaalinatriumilla (3 mg /kg) sen jälkeen, kun lääkkeet annettiin 10 päivää. Ilmapallot (2,5 cm pitkä) on valmistettu lateksista kondomit oli kiinnitetty pitkä katetri. Ylävatsan tehtiin viilto, ja ilmapallo sijoitettiin vatsan viillon läpi kärjessä silmänpohjan. Pylorus ei estetä, ja ei ole esteitä mahalaukun tyhjenemistä havaittiin. Polyeteeniä letku puhaltaa mahapallosta ilmalla oli exteriorised takaosassa kaulan. Sähkömyografista (EMG) Tutkimukset suoritettiin viikon kuluttua leikkauksesta. Ennen koetta, kaikki eläimet nukutettiin intraperitoneaalisesti 1% pentobarbitaalinatriumilla (3 mg /kg). Sitten pari ruostumattoman teräslangan implantoitiin acromiotrapezius (pintapuolisesti niska lihas) ja ulkoistetaan takana kaulan EMG tallennuksia.
Kokeessa rotat saivat sarjan 20 s mahapallosta venymisestä: 10, 20, 30, 40 ja 50 mmHg (mitattuna sphygmomanometer) välein 2 min välillä venymisestä. BL-420S biologinen ja toiminnallinen kokeellinen järjestelmää käytettiin tallentaa EMG jatkuvasti ja visualisoida tietoja. EMG korjattiin, ja AUC laskettiin 20 s pullistuma aikana. Lähtötilanteen aktiivisuutta, saadaan 20 s ennen turvotus, vähennettiin EMG aiheuttama turvotus. Tiedot on esitetty muutos perustason funktiona turvotus paineessa.
Immunohistokemia
jälkeen 10 päivää lääkehoidon, rotat nukutettiin 1% pentobarbitaalinatriumilla. Aivot ja vatsat poistettiin, kiinnitettiin 10% formaliinilla ja upotettiin parafiiniin. Kudokset sittemmin leikattiin 10 um: n leikkeiksi, asennettu Superfrost Plus dioja (1 jakso /dia) ja säilytettiin huoneenlämpötilassa. Ennen koetta suoritettiin, objektilasit deparaffinised käyttäen ksyleeniä, altistetaan mikroaaltouuni lämpöä välittämä antigeenin haku käyttämällä sitraattipuskuria, pH 6: ssa 45 minuuttia ja ne jäähdytettiin huoneen lämpötilaan. Näytteet upotettiin 3% H
2O 2 20 minuuttia inaktivoimaan endogeeninen peroksidaasi ja pestiin sen jälkeen PBS (kolmasti 2 min kukin). Leikkeitä inkuboitiin yön yli 4 ° C: ssa seuraavilla vasta-aineilla: polyklonaalinen kaniinin anti-greliini (1: 100, Abbiotec), kanin polyklonaalista anti-VIP (01:20, Abcam) ja polyklonaalista kanin anti-CCK-8 (1: 100, Abbiotec) puskurissa, joka sisälsi 0,01 M PBS: llä. Jonka 09:00 seuraavana päivänä, levyt pestiin PBS: llä (kolme kertaa 2 min kukin) ja inkuboitiin Polink-2 Plus® Polymer HRP Detection System (ZSGB-BIO, Beijing) mukaisesti valmistajan ohjeiden mukaisesti. Sen jälkeen leikkeitä pestiin kolme kertaa PBS: llä, visualisoitiin käyttämällä DAB 10 min ajan 37 ° C: ssa ja huuhdeltiin juoksevalla vedellä 2 min. Sen jälkeen kuivuminen, leikkeet asennetaan käyttäen neutraalia balsam. Osat visualisoitiin mikroskoopilla, ja kuvat hankittiin käyttämällä kameraa. Ainakin kolme osaa kohden rotta ja kolme rottaa ryhmää kohti analysoitiin. Mean integroitu optinen tiheys (MOD) laskettiin käyttäen Image-Pro Plus 6.0 analyysin ohjelmisto.
Reaaliaikainen PCR
10 päivän jälkeen huumehoidon rotat nukutettiin 10% kloraalihydraatti. Hypotalamuksen ja vatsat nämä rotat poistettiin. mRNA kvantifioitiin käyttämällä kvantitatiivista RT-PCR. Kokonais-RNA uutettiin rottien hypotalamuksen ja vatsan käyttämällä Promega SV kokonais-RNA: eristäminen (Promega, USA) valmistajan ohjeiden mukaisesti. Kokonais-RNA (2 ug) käänteiskopioitu käyttämällä PromegaGoScript (Promega, USA) valmistajan ohjeiden mukaisesti. Termosyklisointireaktio käytetyt olosuhteet on lueteltu seuraavasti: alustava aktivointi 95 ° C: ssa 30 s; 40 sykliä denaturointi 95 ° C: ssa 5 s, pariutuminen 60 ° C: ssa 30 s; ja sulaa käyrä määritys 65 ° C: sta 95 ° C: ssa 5 s. Alukkeet suunniteltiin käyttäen Primer-BLAST (NCBI, USA) mRNA: n sekvenssejä (GenBank) greliini- (NM_021669.2), VIP (NM_053991.1), CCK (NM_012829.2) ja glyseraldehydi-3-fosfaattidehydrogenaasin ( GAPDH; NM_017008.4, kontrollina). PCR-tuotteet ajettiin 0,8% agaroosigeelillä sen varmistamiseksi, että nämä tuotteet olivat odotettua kokoa. Tulokset normalisoitiin vastaan GAPDH ilme. Alukesekvenssejä luetellaan seuraavasti. Eteenpäin ja taaksepäin-alukkeita GAPDH-geenin olivat 5'-GGCACAGTCAAGGCTGAGAATG-3 'ja 5'-ATGGTGGTGAAGACGCCAGTA-3', vastaavasti. Eteenpäin ja reverse-alukkeita, että greliinin geenin olivat 5'-CCAAGGCCATGGTGTCTTCA-3 'ja 5'-CTGCAGTTTAGCTGGTGGCTTC-3', vastaavasti. Eteenpäin ja taaksepäin-alukkeita VIP-geenin olivat 5'-TCAGTTCCTGGCGATCCTGAC-3 'ja 5'-CTCCGCTAAGGCATTCTGCAA-3', vastaavasti. Eteenpäin ja reverse-alukkeita, että CCK-geenin olivat 5'-CCCGATACATCCAGCAGGTC-3 'ja 5'-AAATCCATCCAGCCCATGTAGTC-3', vastaavasti. 2 -ΔΔCt laskettiin, ja erot ryhmien analysoitiin käyttämällä ei-parametriset testit.
ELISA
Rotat nukutettiin 10% kloraalihydraatti 10 päivän kuluttua lääkehoidon. Verinäytteet kerättiin tyhjä steriileihin putkiin ja niiden annettiin hyytyä 2 tuntia huoneenlämpötilassa. Sen jälkeen nämä näytteet sentrifugoitiin 1000 rpm: llä 15 minuutin ajan. Seerumi poistettiin ja sitä säilytettiin -80 ° C: ssa. Greliini, VIP, ja CCK kvantitoitiin käyttämällä erityistä ELISA sarjat toimittamien CUSABIO (Wuhan, Kiina). Jokainen seerumi (100 ui) sekoitettiin näytteen laimentimen mukaisesti valmistajan ohjeiden mukaisesti. Absorbanssi määritettiin 450 nm: ssä.
Tietojen analysointi
Kaikki arvot, lukuun ottamatta saadaan sakkaroosia mieluummin testi, esitettiin keskiarvoina ± SE. Yksisuuntainen ANOVA tai ei-parametrinen testi suoritettiin vertailun vuoksi. Post hoc vertailut suoritettiin käyttäen Student-Newman-Keuls testin tai Mann-Whitney U
testi. Tilastollinen analyysi suoritettiin SPSS 17.0. P
< 0,05 pidettiin tilastollisesti merkittävänä.
Tulokset
XSLJZD lisäsi ravinnon rottien FD
jälkeen paasto yön yli, rotille FD kuluttaa pienemmän määrän ruokaa kuin kontrollirotilla aikana 7 h ajan (10,7 ± 0,6 vs. 8,7 ± 0,5; P
= 0,01; N
= 10 kussakin ryhmässä). XSLJZD saaneessa ryhmässä kulutetaan suuremman määrän ruokaa kuin mallissa ryhmä (10,7 ± 0,9 vs. 8,7 ± 0,5; P
= 0,04; N
= 10 kussakin ryhmässä). Samoin thedomperidone käsitellyn ryhmän kulutetaan suuremman määrän ruokaa kuin mallissa ryhmä (12,4 ± 0,7 vs. 8,7 ± 0,5; P
= 0,00). Mitään merkittävää eroa ei havaittu pieniannoksisilla XSLJZD hoidetussa ryhmässä ja malli ryhmään (8,4 ± 1,2 vs. 8,7 ± 0,5; P
> 0,1) (Fig. 1). Kuva. 1 Elintarvikkeiden saanti kunkin ryhmän. Ruoan nauttiminen oli alhaisempi mallissa ryhmässä verrattuna kontrolliryhmään. In XSLJZD-hoidetussa ryhmässä ja Domperidone hoidetussa ryhmässä, se oli suurempi verrattuna mallin ryhmässä. * P
< 0,05 verrattuna kontrolliryhmään; ** P
< 0,01 verrattuna kontrolliryhmään; △ P
< 0,05 verrattuna malliin ryhmä; △△ P
< 0,01 verrattuna malliin ryhmään. Tulokset esitettiin keskiarvona ± SE
XSLJZD prosenttiosuus kasvoi sakkaroosin kulutuksen (> 75%) rottien FD
sakkaroosi mieluummin testi, ei havaittu merkittävää eroa mitattuna sakkaroosin ja veden saanti keskuudessa ryhmät (P
> 0,05). Kuitenkin prosentuaalinen rottien SP-arvo on > 75% väheni merkittävästi rotilla FD (30%) kontrolliin verrattuna rottien (80%; P
= 0,001; n
= 10 kussakin ryhmässä ), kuten on osoitettu chi-neliö testi. Prosenttiosuus merkittävästi lisääntynyt XSLJZD-hoidetussa ryhmässä (75%) ja domperidonin-hoidetussa ryhmässä (75%) verrattuna rotat FD (30%; P
= 0,004; n
= 10 kussakin ryhmä). Alhaisen annoksen XSLJZD hoidetussa ryhmässä eivät osoittaneet merkittävää eroa mallista ryhmästä (Fig. 2). Kuva. 2 Prosenttiosuus rottien kunkin ryhmän kanssa sakkaroosia etusija (SP) arvo > 75%. Prosenttiosuus SP-arvo > 75% mallissa ryhmässä oli alhaisempi verrattuna kontrolliryhmään. In XSLJZD-hoidetussa ryhmässä ja Domperidone-hoidetussa ryhmässä osuus oli suurempi verrattuna mallin ryhmässä. ** P
< 0,01 verrattuna kontrolliryhmään ja △△ P
< 0,01 verrattuna mallin ryhmän Chi-square testi. Tulokset esitettiin prosentteina rottien kunkin ryhmän SP arvon > 75%
XSLJZD vähensi yliherkkyyttä mahalaukun pullistuminen rottien FD
jälkeen 10 päivän hoito, EMS testaus suoritettiin. Kontrolliin verrattuna rottien, rotat FD merkittävästi lisääntynyt EMG on pullistuma paineissa 20 mmHg (179,3% vs. 282,5%; P
= 0,000; n
= 3 kussakin ryhmässä), 30 mmHg (254,9% vs. 420,1%; P
= 0,000) ja 40 mmHg (315,4% vs. 412,3%; P
= 0,002). Ei kuitenkaan havaittu merkittävää eroa 50 mmHg. XSLJZD esti EMG-aktiviteetti rottien FD mahalaukun laajeneminen annoksesta riippuvalla tavalla. XSLJZD herättänyt merkittävää vaikutusta 20 (277,2% vs. 282,5%; P
= 0,016), 30 (398,3% vs. 420,1%; P
= 0,003) ja 40 mmHg (405,5% vs. 412,3%; P
= 0,015). Matala annos vaikutti merkittävästi EMG vasteita vain 30 (362,4% vs. 420,1%; P
= 0,034) ja 40 mmHg (353,3% vs. 412,3%; P
= 0,038) verrattuna rotat FD, kuten merkitty yksisuuntainen ANOVA. Lisäksi kontrolliryhmä ei merkittävästi poikkea Domperidonin-hoitoryhmässä (P
> 0,1) (Fig. 3). Kuva. 3 Elektromyografiset (EMG) vastaus mahalaukun pullistuminen rottien kunkin ryhmän. EMG vastaus mahan laajeneminen kunkin ryhmän venymiseen 10 mmHg 50 mmHg. In XSLJZD hoidetussa ryhmässä, EMG väheni merkittävästi verrattuna mallin ryhmä pullistuma 20 mmHg, 30 mmHg ja 40 mmHg. ** P
< 0,01 verrattuna kontrolliryhmään. Tulokset esitettiin keskiarvona ± SE. b edustaja EMG vaste 30 mmHg kunkin ryhmän
Expression suhteellisen neuropeptidien aivoissa ja mahalaukussa kunkin ryhmän
greliini-, CCK-8 ja VIP ilmaistiin rakeinen neuropeptidien sytoplasmassa hypotalamuksen (kuviot. 4, 5 ja 6) ja stratum basale mahan (kuviot. 7, 8 ja 9). Ilmaisut Näiden neuropeptides olivat alhaisemmat aivoissa ja mahassa rottien kanssa FD verrataan valvonta rotilla. Mahassa ja hypotalamus, greliini, CCK-8 ja VIP-rottien FD olivat alhaisemmat kuin ohjaus- rottien (P
< 0,05; N
= 3 kussakin ryhmässä). Matalan annoksen XSLJZD saaneista ryhmät eivät merkittävästi eroa mallista ryhmästä. Kuitenkin XSLJZD huomattavasti greliini, CCK-8 ja VIP-rottien FD (P
< 0,05; N
= 3). Greliini, CCK-8 ja VIP ja domperidoni-hoidetussa ryhmässä oli myös korkeampi kuin mallin ryhmän, lukuun ottamatta VIP on hypotalamuksen (P
< 0,05; N
= 3) (taulukko 2 ja kuvio . 10). Kuva. 4 Expression greliinin hypotalamuksen kunkin ryhmän. vertailuryhmällä. b Model ryhmä. c XSLJZD saaneessa ryhmässä. d Pieniannoksinen XSLJZD hoidetussa ryhmässä. e Domperidoni saaneessa ryhmässä. Greliini jaetaan sytoplasmassa hypotalamuksessa. (Kudosleikkeet nähtävissä 100 kertainen suurennus.) Positiivinen solujen greliini- olivat ruskeat ja pyöreä tai päärynän muotoinen. Vähemmän positiivisten solujen nähdään mallin ryhmässä
Fig. 5 Expression of CCK-8 hypotalamuksessa kunkin ryhmän. vertailuryhmällä. b Model ryhmä. c XSLJZD saaneessa ryhmässä. d Pieniannoksinen XSLJZD hoidetussa ryhmässä. e Domperidoni saaneessa ryhmässä. CCK-8 pääasiassa jakelee sytoplasmassa hypotalamuksessa. (Kudosleikkeet nähtävissä 100 kertainen suurennus.) Positiivinen solujen CCK-8 olivat ruskeat ja pyöreä tai soikea. Vähemmän positiivisia soluja voidaan nähdä mallin ryhmän ja alhaisen annoksen XSLJZD hoidetussa ryhmässä
Fig. 6 ilmentäminen VIP on hypotalamuksen kunkin ryhmän. vertailuryhmällä. b Model ryhmä. c XSLJZD saaneessa ryhmässä. d Pieniannoksinen XSLJZD hoidetussa ryhmässä. e Domperidoni saaneessa ryhmässä. Neuropepide VIP pääasiassa jakelee sytoplasmassa hypotalamuksessa. (Kudosleikkeet nähtävissä 100 kertainen suurennus.) Positiivinen soluja VIP olivat ruskeat ja pyöreä tai soikea. Vähemmän positiivisia soluja voidaan nähdä mallin ryhmän ja alhaisen annoksen XSLJZD-hoidetussa ryhmässä ja domperidonin-käsitellyssä ryhmässä
Fig. 7 Expression greliinin vatsassa kunkin ryhmän. vertailuryhmällä. b Model ryhmä. c XSLJZD saaneessa ryhmässä. d Pieniannoksinen XSLJZD hoidetussa ryhmässä. e Domperidoni saaneessa ryhmässä. Greliinin ilmaistuna rakeinen neuropetide sytoplasmassa stratum basale mahan (Kudosleikkeitä tarkasteltiin 20-kertaisella suurennuksella.) Brown solut olivat positiivisia greliini. Malli ryhmä ilmaisi alempi greliini- kuin kontrolliryhmä, XSLJZD huomattavasti greliini Rottien FD
Fig. 8 ilmentyminen CCK-8 vatsassa kunkin ryhmän. vertailuryhmällä. b Model ryhmä. c XSLJZD saaneessa ryhmässä. d Pieniannoksinen XSLJZD hoidetussa ryhmässä. e Domperidoni saaneessa ryhmässä. CCK-8 pääasiassa jakelee ositteessa basale mahan. (Kudosleikkeet nähtävissä 20-kertainen suurennus.) Positiivinen CCK-8 ilmaistuna ruskea rae, jaetaan solulimassa. Expression of CCK-8 oli alhaisempi mallissa ryhmässä ja pieniannoksisen XSLJZD hoidetussa ryhmässä, korkeampi kontrolliryhmässä, XSLJZD käsitellyn ryhmän ja domperidonin hoidetussa ryhmässä
Fig. 9 ilmentäminen VIP vatsassa kunkin ryhmän. vertailuryhmällä. b Model ryhmä. c XSLJZD saaneessa ryhmässä. d Pieniannoksinen XSLJZD hoidetussa ryhmässä. e Domperidoni saaneessa ryhmässä. VIP ilmaistiin rakeinen neuropetide sytoplasmassa stratum basale mahan (Kudosleikkeet nähtävissä 20-kertainen suurennus.) Brown solut olivat positiivisia VIP. Expression of VIP oli alhaisempi mallissa ryhmässä ja korkeampi kontrolliryhmässä, XSLJZD käsitellyn ryhmän ja domperidonin käsitellyssä ryhmässä
Taulukko 2 MOD-arvo suhteessa neuropeptidipitoisuudessa vatsassa ja hypotalamuksen kunkin ryhmän
Osa
Ryhmät
greliini-
CCK-8
VIP
Vatsa
Ohjaus
0,583 ± 0,008
0,714 ± 0,042
0,823 ± 0,025
Model
0,368 ± 0,010 **
0,467 ± 0,057 *
0,486 ± 0,025 **
XSLJZD
0,716 ± 0,050 * △△
0,706 ± 0,090 △
0,861 ± 0,107 △△
matala annos XSLJZD
0,356 ± 0,044 **
0,498 ± 0,039
0,652 ± 0,082
Domperidoni
0,543 ± 0,163 △△
0,863 ± 0,122 △△
0,711 ± 0,092 △
Hypothalamus
Ohjaus
0,497 ± 0,036
0,825 ± 0,081
0,561 ± 0,077
Model
0,268 ± 0,010 **
0,372 ± 0,006 **
0,365 ± 0,017 *
XSLJZD
0,417 ± 0,017 △△
0,995 ± 0,088 △△
0,594 ± 0,105 △
matala annos XSLJZD
0,372 ± 0,011 * △
0,540 ± 0,050 *
0,391 ± 0,012
Domperidoni
0,441 ± 0,059 △△
0,824 ± 0,163 △△
0,449 ± 0,046
* P
< 0,05 verrattuna kontrolliryhmään; ** P
< 0,01 verrattuna kontrolliryhmään; Δ P
< 0,05 verrattuna malliin ryhmä; ΔΔ P
< 0,01 verrattuna mallin ryhmän
Fig. 10 Mean integroitu optinen tiheys (MOD) arvo suhteessa neuropeptidien. MOD arvo neuropeptidipitoisuudessa vatsassa. b MOD arvo neuropeptidipitoisuudessa hypotalamuksessa. * P
< 0,05 verrattuna kontrolliryhmään; ** P
< 0,01 verrattuna kontrolliryhmään. △ P
< 0,05 verrattuna malliin ryhmä; △△ P
< 0,01 verrattuna malliin ryhmään. Tulokset esitettiin keskiarvona ± SE
XSLJZD kasvoi Neuropeptidien seerumissa rottien FD
greliini- väheni seerumissa rottien FD verrattuna kontrolliryhmän rottien (46,72 ± 4,92 vs. 189,9 ± 49,96; P
= 0,007; n
= 7 kussakin ryhmässä). Sen sijaan greliinin lisääntynyt XSLJZD hoidetussa ryhmässä verrattuna mallin ryhmän (186,4 ± 40,13 vastaan 46,72 ± 4,92; P
= 0,009; n
= 7 kussakin ryhmässä). Ei havaittu merkittävää eroa kesken kontrolliryhmään, matala-annoksista XSLJZD-hoidetussa ryhmässä ja domperidonin käsitellyn ryhmän osalta greliinin seerumissa. Samanlaisia greliini-, CCK väheni seerumissa rottien FD verrattuna kontrolliryhmän rottien (22,77 ± 3,59 vs. 77,19 ± 14,36; P
= 0,003; n
= 7 kussakin ryhmässä). CCK lisättiin XSLJZD annoksesta riippuvalla tavalla. Alhaisen annoksen XSLJZD saaneissa ryhmissä ei merkittävästi eroa rottien kanssa FD suhteen CCK seerumissa (P
> 0,10); kuitenkin XSLJZD-hoidetussa ryhmässä esiintyi merkittävä kasvu seerumin CCK verrattuna rottien FD (82,97 ± 13,47 vastaan 22,77 ± 3,59; P
= 0,001; n
= 7 kussakin ryhmässä). VIP vähennettiin seerumissa rottien kanssa FD (16,95 ± 5,15 vs. 75,61 ± 20,12; P
= 0,003; n
= 7 kussakin ryhmässä) verrattuna kontrolliryhmässä. VIP on XSLJZD hoidetussa ryhmässä lisääntyi merkitsevästi verrattuna mallin ryhmässä (62,71 ± 19,05 vastaan 16,95 ± 5,15; P
= 0,017; n
= 7 kussakin ryhmässä). Merkitsevää eroa VIP pieniannoksisen XSLJZD-käsiteltyjen ryhmien ja domperidonin hoidetuissa ryhmissä havaittiin. Kuitenkin kohtalainen annos XSLJZD voisi lisätä VIP seerumissa (Fig. 11). Kuva. 11 Expression suhteellisen neuropeptidipitoisuudessa seerumissa. ilmentäminen greliini- kunkin ryhmän. b ilmentäminen CCK kunkin ryhmän. c ilmentäminen VIP kunkin ryhmän. ** P
< 0,01 verrattuna kontrolliryhmään; ΔΔ P
< 0,01 verrattuna malliin ryhmään. Tulokset esitettiin keskiarvona ± SE
XSLJZD lisäsi geeni-ilmentymisen suhteellisen neuropeptidien mahassa
vatsaan, mRNA ilmaisuja greliini, CCK ja VIP-rottien FD oli pienempi verrattuna valvonnan rotat (P
< 0,05; N
= 6 kussakin ryhmässä). MRNA ilmauksia CCK ja VIP on XSLJZD-hoidetussa ryhmässä oli suurempi kuin mallin ryhmän. Ei ole merkittävää eroa greliinin ilmentyminen havaittiin mallissa ja lääkettä saaneissa ryhmissä. Kaikki kirjoittajat luettu ja hyväksytty lopullinen käsikirjoitus.
 Aika, jolloin erotin lääkärini (ja tärkeitä yksityisen konsultoinnin muutoksia)
Se oli 2007. Lääkärini katsoi ylös kaaviostani ja laski äänensä... Olen pahoillani, en tiedä mitä sanoa sinulle. Älä syö gluteenia. Et voi tehdä muuta, kun sinulla on tämä autoimmuunisairaus. Tulet o
Aika, jolloin erotin lääkärini (ja tärkeitä yksityisen konsultoinnin muutoksia)
Se oli 2007. Lääkärini katsoi ylös kaaviostani ja laski äänensä... Olen pahoillani, en tiedä mitä sanoa sinulle. Älä syö gluteenia. Et voi tehdä muuta, kun sinulla on tämä autoimmuunisairaus. Tulet o
 Persoonallista ravintoa on vielä tehtävä
Kun kohtaamme kysymyksen, mikä ruokavalio on paras henkilökohtaiselle terveydellemme, vastaus ei ole helppo. Yksilöllinen vaste ravitsemustoimenpiteisiin vaihtelee suuresti, ja suoliston mikrobiotolla
Persoonallista ravintoa on vielä tehtävä
Kun kohtaamme kysymyksen, mikä ruokavalio on paras henkilökohtaiselle terveydellemme, vastaus ei ole helppo. Yksilöllinen vaste ravitsemustoimenpiteisiin vaihtelee suuresti, ja suoliston mikrobiotolla
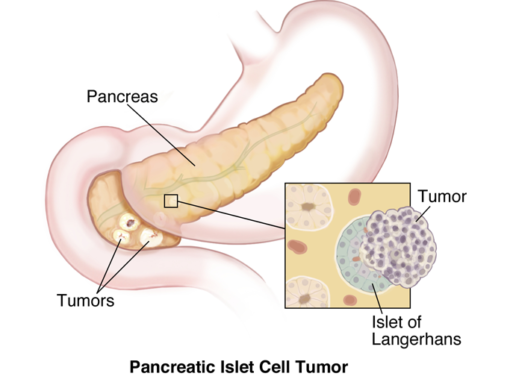 Haiman neuroendokriininen kasvain (PNET)
Haiman neuroendokriiniset kasvain (PNET) määritellään haiman saarekesolukasvaimiksi, jotka tuottavat saarekesolutyyppisiä hormoneja. PNET voi olla toimiva tai ei-toiminnallinen. Toiminnallinen: (tark
Haiman neuroendokriininen kasvain (PNET)
Haiman neuroendokriiniset kasvain (PNET) määritellään haiman saarekesolukasvaimiksi, jotka tuottavat saarekesolutyyppisiä hormoneja. PNET voi olla toimiva tai ei-toiminnallinen. Toiminnallinen: (tark