P27Kip1, säätelee glykogeenisyntaasikinaasi-3β, tulokset HMBA aiheuttama erilaistumista ihmisen mahasyövän cells
P27
Kip1, säätelee glykogeenisyntaasikinaasi-3β, tulokset HMBA aiheuttama erilaistumista ihmisen mahalaukun syövän solujen
Abstract
Taustaa
Mahalaukun syöpä on toiseksi yleisin syy maailmanlaajuiseen syöpään liittyvää kuolleisuutta. Vaikka erilaistamattomuuden ennustaa huonon ennusteen mahasyövän, molekyylitason mekanismi taustalla erilaistamattomuuden, joka voisi tarjota perustavanlaatuisia oivalluksia kasvainten kehittymiseen ja etenemiseen, on vielä selvittämättä. Lisäksi molekyylimekanismi taustalla vaikutukset heksametyleenibisasetamidi (HMBA), äskettäin löydetty eriyttäminen indusoija, edellyttää lisätutkimuksia ja ei ole raportoitu tutkimuksia, jotka koskevat vaikutusta HMBA mahalaukun syöpään. Tool Menetelmät
Perustuen tuloksiin FACS-analyysi, tasot osallistuvien proteiinien solusyklin tai apoptoosin määritettiin käyttämällä western blot jälkeen yhden hoitoja ja juokseva yhdistelmiä HMBA ja LiCI: n. GSK-3β ja protonipumpun tutkittiin western blottauksella jälkeen ylös säätelevä Akt ilmentyminen Ad-Akt infektio. Tutkia vaikutukset HMBA proteiinin lokalisaatio ja toiminta GSK-3β, CDK2 ja CDK4, kinaasimäärityksiä, immunosaostus ja Western blotting suoritettiin. Lisäksi, Northern blotting ja RNaasi-suojaus määritykset suoritettiin määrittämiseksi funktionaalisen pitoisuuden HMBA.
Tulokset
HMBA lisääntynyt p27Kip1 ilmaisun ja indusoi solusyklin pysähtymisen liittyy mahan epiteelisolujen erilaistumisen. Lisäksi hoidettaessa mahalaukun johdettuja soluja HMBA aiheuttama G0 /G1 pidätys ja säätely ylöspäin protonipumpun, merkkiaine mahasyövän erilaistumista. Lisäksi hoito HMBA lisäsi ilmaisun ja aktiivisuuden GSK-3β tumassa mutta ei sytosoliin. HMBA laski CDK2 toimintaa ja indusoi p27Kip1 ilmaisun, joka voitaisiin pelastaa GSK-3β. Lisäksi HMBA kasvoi p27Kip1 sitoutumista CDK2, ja tämä poistettiin GSK-3β eston.
Johtopäätökset
Tässä esitetyt tulokset viittaavat siihen, että GSK-3β toimintoja säätelemällä p27Kip1 kokoonpano CDK2, jolloin niillä on keskeinen rooli G0 /G1 pidätys liittyy HMBA aiheuttamaa mahan epiteelisolujen erilaistumisen.
avainsanat
HMBA mahasyövän GSK-3β tausta
mahalaukun syöpä on yksi yleisimmistä syövistä maailmassa ja kehittyy usein vastustuskykyä kemoterapiaa ja säteily hoitoja. Siksi yhdistelmähoitoa on ehdotettu puuttua sairauden paremmin ja vähentää todennäköisyyttä kehittää vastustuskyvyn [1]. Heksametyleenibisasetamidi (HMBA), hybridi polaarinen yhdiste (HPC) alunperin kehitetty erilaistumista aiheuttavaa ainetta kohtaan [2-6], aiheuttaa mahalaukun solujen uudelleen erilaistumista [7-9].
Mahalaukussa kantasoluja proliferatiivisen solun alue kannaksen alueella maharauhanen erottavat ja aiheuttaa erilaisia solutyyppejä [10, 11]. Kun ensimmäinen tuumorigeenisen tapahtuma, lisäksi syövän etenemiseen riippuu luonteesta alkutapahtuman ja kehitysvaiheen solun että jatkumiseksi ja muita mutaatioita, joita voi esiintyä. Jatkuva proliferaatio on tärkeä ominaisuus kantasolujen ja ruoansulatuskanavan kudoksissa mutaatiot todennäköisesti johtaa laajentamiseen muuttuneessa kantasoluja, lisää todennäköisyyttä lisä- mutaatioiden ja syövän etenemistä [12]. Siksi kohdistaminen mahasyöpä kantasoluihin on todennäköisesti tehokkain tapa kohdella mahasyövän. Noin 50% Länsi väestöstä kehittyy metaplasiasta keskeinen vaihe syövän kehitykseen [13], kiinnitetään huomiota polkuja, jotka ohjaavat lisääntymistä ja siten solujen erilaistumista. Näistä TGF-b, Myb, Wnt ja Hedgehog reitit ovat erityisen merkityksellisiä, näkyvästi solu-kohtalo erittely ja kuvio muodostumista alkionkehityksen aikana ja aikuisen kudosten uudistumista. Selvittäminen monimutkainen tuumorisuppressorin ja kiihdytin signalointireittejä, mikä vaikutus erilaistumisen modulaatio siirtymävaiheen /esisolujen, on keskeinen optimoimiseksi terapeuttisten hoitoon mahasyöpä.
Jotta epäkypsiä mahalaukun solujen erilaistumisen, ne vaativat pysyä G1 vaiheen solusyklin jonkin tietyn ajan kuluessa. Nisäkkäiden solusyklin säätelevät peräkkäisellä aktivaatio ja inaktivaatio erittäin konservoitunut perheen sykliiniriippuvaisten kinaasien (CDK); etenemisensä alussa tai puolivälissä G1 on riippuvainen CDK4 ja mahdollisesti CDK6, kun taas etenemisensä myöhään G1 ja S-vaiheessa vaatii aktivoinnin CDK2. Toiminta CDK voidaan estää sitoutumisen CDK estävän proteiinien kuten CIP /Kip perhe (p21 Waf1, p27 Kip1 ja p57 Kip2) ja INK4 perhe (p15Ink4b, p16Ink4a, p18Ink4c ja p19Ink4d ). P27 Kip1 säätelee transkription jälkeen proteolyyttisen hajoamisen. CDK2 sitoutuu p27 Kip1 ja fosforyloi sitä treoniini 187 [14], ja HMBA aiheuttama mahalaukun solujen erilaistumiseen liittyy ylössäätöä p27 Kip1 [15, 16] ja G0 /G1 pidätykseen. On kuitenkin olemassa muutamia yksityiskohtaisia tutkimuksia, jotka koskevat molekyylimekanismi HMBA ja ei ole ilmoitettu, joissa tutkitaan vaikutus HMBA mahalaukun syöpä.
Koska alavirran kohde fosfatidyyli-3-kinaasi /Akt (PI3-kinaasi /Akt ) reitissä GSK-3β säätelee solujen lisääntymistä ja erilaistumista [17-20]. Kertyvät todisteet osoittavat, että hypoaktiivisen GSK3p signalointia, joka toimii vuonna G1 saavat tietoa useista signalointi ja kehitykseen kulkuväylillä esiintyy yhdessä ihmisen erilaisiin syöpiin [21, 22]. GSK-3β on liitetty useita biologisissa prosesseissa, koska se fosforyloi laajaa substraattien mukaan lukien useita eriyttäminen tarkistuspisteitä, mukaan lukien c-Myc, etanat ja PI3K [23]. Aiemmin esto PI3-kinaasireitin on osoitettu lisäävän HMBA-välitteistä mahalaukun solujen erilaistumista [8]. Tässä tutkimuksessa rooli GSK-3β aikana mahalaukun solujen erilaistumista tutkittiin käyttäen ihmisen mahasyövän solulinjaa SGC7901, joka näyttää multipotentteina fenotyyppiä ja edustaa hyvin tunnettu malli mahalaukun erilaistumista. Tulokset viittaavat edesauttava rooli GSK-3β, että p27 Kip1 koulutusjakson aikana mahalaukun solujen erilaistumisen aiheuttamien HMBA. Tool Menetelmät
Soluviljely
mahasyöpä solulinja SGC7901 saatiin solusta pankin Kiinan tiedeakatemia ja viljeltiin kuten aiemmin on kuvattu [24]. SGC7901 solut infektoitiin adenoviruksella, joka koodaa aktivoidun muodon Akt (Ad-Akt) tai adenovi- ohjaus koodaavan vektorin β-galaktosidaasi (β-gal) on infektiokertoimella (MOI) 10 pfu /solu. Infektion jälkeen vektoreita yhden tunnin ajan, minkä jälkeen vaihto väliaineen ja inkuboitiin vielä 24 h, solut käsiteltiin läsnä ollessa tai poissa ollessa HMBA, ja proteiinia ja RNA uutettiin Länsi ja Northern-blottauksella, vastaavasti.
Materiaalit
HMBA, TSA, SB-415286 ja LiCI: ostettiin Sigma Chemical Company, USA. Adenovirusvektoreita, jotka koodaavat β-gal ja Myristoylated aktiivinen muoto Akt (Ad-Akt) ostettiin Cell BioLabs, USA. Vektori, joka koodaa katalyyttisesti aktiivisen mutantin GSK3p: n (HA-GSK-3βCA) hankittiin Addgene. Non-kohdistaminen ohjaus siRNA ja SMARTpool kohdistamiseen GSK-3β ostettiin Dharmacon, USA. Kaikki koettimet leimattiin biotiinilla Random Prime DNA Labeling Kit (Pierce).
Vasta-
Kanin anti-Akt, anti-fosfo-Akt (Ser473) ja antiphospho-GSK-3β (Ser9) ostettiin Cell Signaling , YHDYSVALLAT. Hiiren anti-GSK-3β, hiiren anti-p27 Kip1, hiiren anti-Top IIb ja hiiren anti-p21 Waf1 hankittiin BD Biosciences, USA. Hiiren anti-fosfo-GSK-3 (Tyr278 /Tyr216) saatiin Upstate, USA. Kanin anti-pilkotun PARP-vasta ostettiin Abcam, USA. Anti-protonipumpun ostettiin MBL International (USA). Polyklonaalinen anti-CDK2, anti-CDK4, anti-α-tubuliinin ja anti-kaspaasi-3 saatiin Santa Cruz Biotechnology (USA).
Sub-solun uuttamalla ja Western blotting
Nuclear ja solulimafraktioita uutettiin käyttäen NE-PER ydin- ja Sytoplasmiset Extraction reagenssit (Pierce, USA). Soluliman proteiinin (80 mg) tai tumaproteiini (20 mg) erotettiin 10% polyakryyliamidigeelillä ja siirrettiin PVDF-membraaneille kuten aikaisemmin on kuvattu [25]. Suodattimet inkuboitiin yhden tunnin ajan huoneen lämpötilassa blotting liuokseen. Membraaneja inkuboitiin yön yli 4 ° C: ssa primaaristen vasta-aineiden ja sen jälkeen imeyttämällä piparjuuriperoksidaasi-konjugoidun sekundaarisen vasta-aineen kanssa yhden tunnin ajan, ja visualisoitiin käyttämällä ECL-detektiojärjestelmässä.
Northern blotting ja RNaasi-suojaus määritykset (RPA)
Yhteensä RNA valmistettiin käyttämällä TRIzol-reagenssia (Invitrogen). Näytteet ajettiin 1,2% agaroosi /formaldehydi geelit ja siirrettiin tuettuja nitroselluloosalle. Kalvot hybridisoitiin biotiinileimattua mahalaukun protonipumpun cDNA-koetinta. Hybridisaation jälkeen GAPDH-koettimen, latauskontrollina, kalvot pestiin ja signaalit havaittiin käyttämällä ECL-detektiojärjestelmässä. RNaasisuojaus- kokeet suoritettiin käyttämällä RPA-III kit Ambion ja RiboQuant monikoetin RNaasi Protection Assay System käytettiin havaitsemaan useita spesifiset mRNA: t. 32P-leimattu antisense-RNA-koettimet valmistettiin käyttämällä ihmisen Apoptosis HCC-2 ja hCYC-1 Template sarjat ja hybridisaatiot suoritettiin valmistajan protokollan.
Solusyklianalyysiä
Mahasyöpää solut kerättiin käyttämällä trypsiiniä . Solut kerättiin, pestiin kahdesti jääkylmällä PBS: llä ja kiinnitettiin jääkylmällä 70% etanolilla. Sen jälkeen, kun pestiin kahdesti jääkylmällä PBS: llä, suspendoitiin uudelleen PBS: ään, joka sisälsi 100 U /ml RNaasi A: ta ja inkuboitiin 37 ° C: ssa 30 minuutin ajan, solut värjättiin PI (20 mg /ml) ja analysoitiin käyttäen FACScan (Becton Dickinson, San Jose, CA, USA), kuten aiemmin on kuvattu [25].
In vitro
kinaasimäärityk-
toiminta CDK2, CDK4: n ja GSK-3β mitattiin, kuten aiemmin on kuvattu [26, 27]. Lyhyesti, CDK2, CDK4 tai GSK-3β immunosaostettiin soluliman (100 mg proteiinia) tai ydinaseiden (25 mg proteiinia) otteita. Kinaasin aktiivisuus mitattiin inkuboimalla immunosaostettiin CDK2, CDK4: n tai GSK-3β 40 ml: ssa kinaasipuskuria 4 mg rekombinantti-Snail-proteiinin (mitata GSK-3β liittyvän kinaasiaktiivisuuden), 5 mg histoni H1 (mittaamiseksi CDK2 liittyvän kinaasin töissä) tai retinoblastoomaproteiinia (mittaamiseksi CDK4 liittyvän kinaasiaktiivisuuden) 30 ° C: ssa 30 minuutin ajan. Näytteet käsiteltiin kuten on kuvattu aiemmissa raporteissa [28].
Tulokset
GSK-3β vaimentaa HMBA aiheuttaman solusyklin pysähtymiseen ja SGC7901 solujen erilaistumista
SGC7901 soluja kertyneen G0 /G1 solusyklin Checkpoint ja eriytetty osaksi suoliston kaltainen fenotyyppi hoidon jälkeen HMBA [29]. GSK-3β edistää eston solusyklin etenemisen erottamaan soluihin [20, 30]. Näin ollen, onko GSK-3β on rooli HMBA aiheuttama SGC7901 solusyklin inhibitio tutkittiin. Kuten on osoitettu kuviossa 1a, hoito HMBA indusoi solujen kerääntyä G0 /G1 solusyklin tarkastuspiste. Käsittely litiumkloridin (LiCl), joka estää GSK-3β on Mg 2+ kilpailukykyisesti [31], kasvattanut solujen S-vaiheessa. Hoito yhdistelmällä LiCI ja HMBA päinvastaiseksi HMBA välittämä G1 solu pidätykseen. Samanlaisia tuloksia saatiin hoidon jälkeen SB-415286 estäjä GSK-3β [32] (Additional tiedosto 1). Nämä tulokset viittaavat siihen, että GSK-3β voisi olla rooli HMBA aiheuttama G1 pidätys. Sen ratkaisemiseksi, onko HMBA johti solukuoleman aikana 24 tunnin hoitojakson aikana, proteiini uutettiin arvioida, onko nostettiin PARP pilkkominen ja /tai aktiivinen kaspaasi-3. Kuten on osoitettu kuviossa 1 b, ei ollut kasvua PARP lohkominen ja aktiivinen kaspaasi-3, kunnes 48 h kuluttua HMBA hoidon. Tärkeä varhainen tapahtuma terminaalin solujen erilaistumista on niiden poistamista solusyklin [6]. Koska GSK-3β on dokumentoitu rooli solusyklin pysähtymiseen [33], oletettiin, että GSK-3β voisi estää erilaistumista. Näin ollen vaikutukset GSK-3β estäjien induktion HMBA-välitteisen mahalaukun protonipumpun ilmaisu, merkki mahalaukun erilaistumisen, tutkittiin. SGC7901 soluja esikäsiteltiin LiCl: (kuvio 1 c ja 1 d) tai SB-415286 (kuvio 1e ja 1f) eri pitoisuuksilla yhden tunnin ajan, ja käsiteltiin sitten HMBA 24 tuntia. LiCl: a inhiboi HMBA aiheuttamaa mahan protonipumpun ilmentymisen annoksesta riippuvalla tavalla. Yhdenmukaisesti näiden tulosten, SB-415286 esti mahalaukun protonipumpun proteiinin ja mRNA: n ilmentymisen, joka indusoitiin HMBA. Yhdessä nämä tulokset osoittavat, että GSK-3β tärkeä rooli HMBA välittämä mahalaukun solujen erilaistumista. Kuvio 1 inhibitio GSK-3β vaimentaa HMBA indusoiman solusyklin pysähtymiseen ja SGC7901 solujen erilaistumista. A, SGC7901 soluja esikäsiteltiin kanssa tai ilman 10 mM LiCl: a 30 min ja sen jälkeen yhdistelmänä hoidon kanssa, 10 mM HMBA 24 tuntia, minkä jälkeen kanssa määrän määrittämiseksi DNA-pitoisuus virtaussytometrialla. B, SGC7901 soluja käsiteltiin HMBA (10 mM) 24 tunnin ajan tai 48 tunnin ajan, ja ne valmistettiin Western blotting -analyysi. C &E, SGC7901 soluja esikäsitellään kanssa tai ilman 10 mM LiCl: a tai 10 μMSB-415286: ssa yksi tunti ja sen jälkeen seos käsittely 10 mMHMBA 24 tuntia. protonipumpun ilmentymistilanne määritettiin kautta western blotting-analyysi. D & F, kokonais-RNA uutettiin soluista ja Q-RT-PCR-analyysiä varten protonipumpun mRNA: n ilmentymisen suoritettiin. (Data edustavat keskiarvoa ± SD; * = p < 0,05 vs. kontrolli; * = p < 0,05 vs. HMBA yksin.).
Akt säätelee mahalaukun erilaistumisen aiheuttamien HMBA
GSK-3β inaktivoituu, kun se fosforyloituu alavirtaan Akt [34]. Siksi voidaan ennustaa, että aktivointi Akt by PI3-kinaasin olisi liittyy GSK-3β, ja sen jälkeen, inhibitio mahalaukun solujen erilaistumisen. Tämän hypoteesin testaamiseksi, SGC7901 solut infektoitiin Ad-Akt tai kontrollina vektorin. Infektio Ad-Akt lisääntyneen ilmentymisen fosforyloidun Akt, Akt ja fosforyloitu GSK-3β-proteiinin (kuvio 2a), mikä on yhdenmukaista aikaisempien tulosten kanssa, jotka osoittavat, että GSK-3β toimii substraattina Akt. Kuten on osoitettu kuviossa 2b, infektio SGC7901 solujen kanssa Ad-Akt adenovirusvektori yksinään ei ollut vaikutusta mahalaukun protonipumpun ja mRNA: n ilmentymisen. Kuitenkin infektio Ad-Akt vektori johti estoon mahalaukun protonipumpun mRNA ilmaisun aiheuttama HMBA verrattuna HMBA ja infektio ohjaus (β-gal) adenovirus, mikä viittaa siihen, että signalointi kautta PI3-kinaasi /AKT säätelee mahan solu erilaistuminen indusoitiin HMBA hoitoon. Kuvio 2 Akt säätelee mahalaukun erilaistumisen aiheuttamien HMBA. A, sytosolissa ja tumaproteiinit uutettiin käsiteltyjen solujen kuten ja eroteltiin SDS-PAGE: lla ja blotattiin anti-fosfo-Akt, -Akt, fosfo-GSK-3β, ja GSK-3β, käyttäen anti-α-tubuliinin ja Topo IIβ koska valvonta sytosolisten ja ydinvoiman jakeet vastaavasti. B, protonipumpun ilmentyminen mitattiin western blotting seurasi runsaus määrällisesti. (Data edustavat keskiarvoa ± SD; * = p < 0,05 vs. kontrolli; † = p < 0,05 vs. HMBA yksin.). C, Kokonais-RNA (40 ug) fraktioitiin, siirrettiin nitroselluloosamembraaneille ja tutkittiin leimatun protonipumpun cDNA; blotit stripattiin ja uudelleenseulottiin GAPDH.
Hoito HMBA lisäsi ilmaisun ja aktiivisuuden GSK-3β tumassa
Sen testaamiseksi, GSK-3β vaikutti HMBA hoito GSK-3β aktiivisuus määritettiin mittaamalla fosforylaatiota rekombinantti Snail, hyvin tunnettu substraatti GSK-3β [35, 36]. GSK-3β sijaitsee sytosolin ja ydinvoima osastoissa soluja, mutta pääasiassa solulimassa aikana G1 vaiheessa. Siksi ydin- ja sytoplasman proteiineja fraktioitiin kontrollista ja HMBA käsiteltyjä soluja ja tutkittiin GSK-3β aktiivisuutta. HMBA hoito johti lisääntymiseen toiminnan ydin- GSK-3β (kuva 3a), ja GSK-3β esto heikennettyjä HMBA välittämää G1 pidätetty, osoittaa rooli GSK-3β in HMBA aiheuttaman solusyklin pysähtymisen. Ser9 fosforylaatio GSK-3β vähentää GSK-3β aktiivisuutta, kun taas Tyr216 fosforylaatio lisääntyy GSK-3β toimintaa [37]. Analysoida mekanismeista lisääntynyt GSK-3β aktiivisuuden aiheuttama HMBA hoito, Ser9-fosforyloitu ja Tyr216-fosforyloitiin GSK-3β-proteiinin ilmentyminen määritettiin käyttäen western blotting. HMBA käsittely lisäsi ydin- ekspressiotasoja kaikista GSK-3β ja Tyr216-fosforyloitiin GSK-3β vaikuttamatta niiden ilmentymistä sytosoliin (kuvio 3b). Mielenkiintoista, HMBA hoito lisäsi Ser9 fosforyloimat- GSK-3β proteiinin ilmentymistä sekä sytosolin ja ydinvoima jakeet. Samanlaisia tuloksia saatiin hoidon jälkeen muiden HPCs, SAHA ja EMBA (Additional tiedosto 2). Lisäksi HPC lisääntynyt aktiivisuus GSK-3β tumassa osoituksena in vitro
kinaasimäärityk- (Additional tiedosto 3). Nämä tulokset viittaavat siihen, että HPC kasvattaa ydinvoiman GSK-3β aktiivisuutta riippumatta fosforylaation Ser9. Kuva 3 Käsittely HMBA lisäsi ilmaisun ja aktiivisuuden GSK-3β tumassa. A, SGC7901 soluja käsiteltiin (+) tai ilman (-) 10 mMHMBA 24 tuntia, ja kerättiin lopussa hoidon. Sytosoliin ja ydin- fraktiot valmistettiin ja GSK-3β aktiivisuus tutkittiin in vitro kinaasimääritykseen käyttäen Snail proteiinia substraattina. Fosforyloidun Snail-proteiini signaalit densitometrisesti määrä määritettiin ja ilmaistiin kertamuutosta suhteessa käsittelemättömän kontrolliryhmiin. B, SGC7901 soluja käsiteltiin 10 mM HMBA eri aikoja. Soluliman ja ydin- proteiinin fraktiot erotetaan ja western-blottaus suoritettiin käyttäen vasta-aineita GSK-3β, fosfo-GSK-3β (Ser9), fosfori-GSK-3α /β (Tyr278 /Tyr216), α-tubuliinin tai Topo IIβ.
inhibitio GSK-3β ohittaa HMBA aiheuttama CDK2 inhibition
Progression kautta G1 on riippuvainen CDK2 ja CDK4: n [38, 39]. Sen määrittämiseksi, onko GSK-3β sääntely HMBA-välitteisen G1 solusyklin pysähtymisen kautta tapahtuvaa CDK2 tai CDK4: n inhibitio, SGC7901 soluja esikäsiteltiin LiCl (kuvio 4a) tai SB-415286 (Kuvio 4b), ja sitten altistettiin yhdistelmä hoidon HMBA 24 tuntia ennen immunosaostusmäärityksissä tehtiin solulysaateista anti-CDK2 tai anti-CDK4-vasta-aineita, vastaavasti. Lisäksi, CDK2 tai CDK4-aktiivisuus määritettiin käyttämällä in vitro
kinaasimääritys. Käsittely HMBA yksinään esti CDK2 aktiivisuutta (ylhäällä, vasen paneeli), mutta kasvoi CDK4 aktiivisuutta (ylhäällä, oikea paneeli); GSK-3β käyttämällä LiCI: tai SB-415286 merkittävästi heikennetty HMBA CDK2: n aktiivisuuden (alhaalla). Hoito HMBA lisäsi ilmaisun ja aktiivisuuden GSK-3β tumassa. Yhdessä nämä tulokset viittaavat siihen, että GSK-3β edistää HMBA-välitteisen G1 solusyklin pysähtymisen estämällä CDK2. Kuvio 4 inhibitio GSK-3β ohittaa HMBA aiheuttama CDK2 inhibition. SGC7901 soluja esikäsiteltiin (+) tai ilman (-) 10 mM LiCl: a (A) tai 10 uM SB-415286 (B) 30 min, minkä jälkeen seos käsittely 10 mM HMBA 24 tuntia. Proteiini uutteet immunosaostettiin anti-CDK2 tai anti-CDK4-vasta-aineita. Tuloksena immuuni komplekseja analysoitiin CDK2 aktiivisuus käyttäen histoni H1 substraattina (ylempi paneeli) tai CDK4 toiminto, jossa käytetään Rb substraattina (alempi kuva). Fosforyloituu histoni H1 tai Rb-proteiinia signaalit kvantitoitiin densitometrisesti ja ilmaistiin kertamuutosta suhteessa käsittelemättömän kontrolliryhmiin.
GSK-3β säätelee ydinvoiman p27Kip1protein ilmaisu
Tutkia mekanismit HMBA välittämää G1 pidätyksen ja CDK2 esto edelleen, solusyklin-sääntelyyn mRNA ilmentyminen analysoitiin RPA määrityksiä. Hoito HMBA lisääntynyt P27 Kip1 mRNA: n ilmentymisen mutta laski p53, p57, P15 (kuva 5A oikealla), sykliini A ja sykliini D1 mRNA: n ilmentymisen (kuvio 5A vasemmalla). Kuitenkin hoito LiCl lisääntynyt p21 Waf1 mRNA: n ilmentymisen mutta ei vaikuta ekspressiotasot muita geenejä. Samanlaisia tuloksia saatiin, kun soluja käsiteltiin SB-415286 (Additional tiedosto 4). Nämä tulokset viittaavat siihen, että GSK-3β sääntely HMBA välittämän solukierron pysähtymisen ei liity transkription säätely solusyklin liittyviä geenejä. Kuva 5 mRNA geenien ilmentymisen suhteen solukierron. A, RNaasi-suojaus määritykset suoritettiin käyttäen RNA: ta SGC7901 soluja käsiteltiin joko 10 mM HMBA, 20 mM LiCl: a, tai niiden yhdistelmä HMBA ja LiCI: n 24 tuntia, hybridisoitu multi-koettimien solusyklin riippuvaisen kinaasin estäjät (A; HCC- 2) tai sykliinien (B, hCYC-1). B, SGC7901 soluja esikäsiteltiin (+) tai ilman (-) 10 mM LiCl: a (oikealla) tai 10 uM SB-415286 (vasen) ja 30 min, minkä jälkeen seos käsittely 10 mM HMBA 24 tuntia. Kokosoluproteiinikuviot uutteet erotettiin SDS-PAGE: lla, siirrettiin PVDF-kalvoille ja immunoblotattiin vasta p27Kip1, p21Waf1, CDK2, tai β-aktiini.
Analysoimiseksi mekanismeista GSK-3β-liittyvän solusyklin pysähtymisen lisäksi, ilmentymistä p21 Waf1 ja p27 Kip1 proteiinien SGC7901 käsitellyissä soluissa HMBA in läsnä ollessa tai ilman LiCI: n tai SB-415286 tutkittiin. Lisäksi LiCl (kuvio 5B oikealla) tai SB-415286 (kuvio 5B vasemmalla) heikennettyä induktion p27 Kip1, mutta ei p21 Waf1 proteiinin ilmentymisen, mikä viittaa siihen, että p27 Kip1 osallistuu solusyklin siirtymät säädellään GSK-3β. Kun p27 Kip1 kerääntyy tumaan se sitoutuu CDK2, estäen sen aktiivisuuden, ja lopulta aiheuttaa solusyklin pysähtymiseen. Lisäksi HMBA (10 mM) kasvoi p27 Kip1-proteiinin ilmentymistä sytosoliin ja ydin 0-24 tuntia käsittelyn jälkeen (kuva 6a). HMBA (0-5 mM) kasvoi p27 Kip1 ilmaisun jälkeen 24 h solulimafraktiot ja 48 tunnin jälkeen HMBA (5-10 mM) kasvoi p27 Kip1 ilmaisun ydin- jakeet (kuva 6b). Lisäksi LiCl (kuva 6c) tai SB-415286 (kuvio 6d) tukossa HMBA-lisääntynyt p27 Kip1 ydin- ilmaisu vaikuttamatta p27 Kip1 ilmaisun sytosoliin, mikä viittaa erityissääntelyä ydinvoiman p27 Kip1 ilmentyminen GSK-3β. Osoittaakseen rooli GSK-3β sääntelyssä ydinvoiman p27 Kip1 ilmaisun lisäksi, solut transfektoitiin siRNA suunnattu GSK-3β (kuva 6e). RNAi-välitteinen tukahduttaminen GSK-3β varmistettiin immunoblottauksella ja heikennettyjä ydin- p27 Kip1 induktion HMBA vaikuttamatta sytosolin p27 Kip1 induktio. Vahvista roolin GSK-3β sääntelyssä ydinvoiman p27 Kip1 ilme, SGC7901 solut transfektoitiin vektorilla, joka koodaa aktivoitua muotoa GSK-3β (GSK-3β-CA) tai tyhjän kontrollivektorin. Sytosoliin ja ydin- proteiinit uutettiin ja western-blottaus suoritettiin sen määrittämiseksi p27 Kip1 ilme. Transfektio SGC7901 solujen GSK-3βCA plasmidin lisännyt p27 Kip1 vuonna tumafraktios- (kuvio 6F) vaikuttamatta p27 Kip1 tasoa sytosoliin. Yli-ilmentyminen aktiivisen muodon GSK-3β vahvistettiin käyttäen western blotting ja in vitro
kinaasimäärityk- käyttäen Snail-proteiinin substraattina (kuvio 6G). Yhdessä nämä tulokset osoittavat, että GSK-3β osallistuu säätelyyn solusyklin läpi erityissääntelyä ydinvoiman p27 Kip1 proteiinin ilmentymisen. Kuva 6 Nuclear p27 Kip1 ilmaisun moduloidaan GSK-3β. A & B, SGC7901 soluja käsiteltiin HMBA (10 mM) yli ajan myötä (A) tai erilaisilla pitoisuuksilla 24 tunnin ajan. Soluliman ja ydin- proteiinin fraktiot erotetaan ja western blotting suoritettiin vasta p27Kip1, α-tubuliinin tai Topo IIβ. Leiri; D, SGC7901 soluja esikäsiteltiin (+) tai ilman (-) 20 mM LiCl: a (C) tai 10 uM SB-415286 (D) 30 min, minkä jälkeen seos käsittely 10 mM HMBA 24 tuntia. Sytosoliin ja ydin- proteiinit uutettiin analyysiä varten p27Kip1 proteiinin ilmentymisen. E, SGC7901 solut transfektoitiin siRNA suunnattu GSK-3β tai kontrolli-siRNA. Kaksikymmentäneljä tuntia transfektion jälkeen solut käsiteltiin HMBA vielä 24 tuntia. Sytosoliin ja ydin- proteiinit uutettiin analyysiä varten p27Kip1 proteiinin ilmentymisen. Knockdown GSK-3β ilmentyminen vahvistettiin Western blotting käyttäen anti-GSK-3β-aine. F, SGC7901 solut infektoitiin Ad-HA-GSK-3βS9A tai Ad-β-gal-MOI-arvolla 10 pfu /solu. 48 tunnin kuluttua inkubaation sytosoliin ja nukleaarinen proteiini uutettiin ja Western blotting suoritettiin käyttäen anti-p27Kip1, anti-HA, ja anti-GSK-3-vasta-aineita, vastaavasti käyttäen anti-α-tubuliinin tai Topo IIβ kuin lastaus ohjaus. GSK-3β toimintaa analysoitiin in vitro kinaasimääritykseen käyttäen Snail proteiinia substraattina (alapaneeli). p27Kip1 signaalit kvantitoitiin densitometrisesti ja ilmaistiin kertamuutosta nähden a-tubuliinia tai TopIIβ.
GSK-3β säätelee p27Kip1binding on CDK2
HMBA lisääntynyt p27 Kip1 proteiinin ilmentymisen, inhiboitu CDK2 aktiivisuus ja lisääntynyt CDK4 aktiivisuus (kuvio 4). Otteita ohjaus- tai HMBA käsiteltyjä soluja immunosaostettiin tutkia p27 Kip1 sitoutumalla CDK2 ja CDK4. Kuten on osoitettu kuviossa 7a, HMBA hoito lisäsi taso p27 Kip1 komplekseissa immunosaostettiin anti-CDK2 mutta ei komplekseja immunosaostettiin anti-CDK4. Re-luotaa suodattimet anti-CDK2 ja anti-CDK4 vasta vahvisti, että immuunisaostuksia ohjaus ja HMBA käsiteltyjä soluja sisälsi saman tason CDK2 ja CDK4. Näin ollen, HMBA näyttää aiheuttavan selektiivistä lisääntymistä p27 Kip1 sitoutumisen CDK2. Analysoida, GSK-3β vaikuttaa yhdistyksen p27 Kip1 kanssa CDK2, SGC7901 soluja esikäsiteltiin LiCl tai SB-415286 ja alistettiin yhdistelmä hoidon HMBA 24 h; Koko-solu-uutteet immunosaostettiin. Hoito GSK-3β estäjät, LiCl (kuva 7b) tai SB-415286 (kuva 7c) tukossa p27 Kip1 sitoutumisen CDK2. Nämä tulokset viittaavat siihen, että GSK-3β on välttämätöntä HMBA aiheuttama lisääntynyt p27 Kip1 sitoutumisen CDK2. Vahvista roolin GSK-3β säätelyyn p27 Kip1 yhdessä CDK2, SGC7901 solut transfektoitiin vektorilla, joka koodaa aktivoitua muotoa GSK-3β tai Ad-β-gal. Koko-solu-proteiini uutettiin ja immunosaostettiin. Kuten esitetty kuvassa 7d, transfektointi SGC7901 solujen GSK-3β-CA vektori johti tehostettuun p27 Kip1 komplekseissa immunosaostettiin anti-CDK2 verrattuna transfektion valvonnan plasmidin. Tämä viittaa siihen, että GSK-3β ei ole ainoastaan välttämätöntä HMBA välittämän p27 Kip1 sitoutumista CDK2, mutta myös riittävä lisäämään yhdistyksen p27 Kip1 kanssa CDK2 SGC7901 soluissa. Kuva 7 GSK-3β sääntely p27 Kip 1 yhdessä CDK2. A, SGC7901 soluja käsiteltiin (+) tai ilman (-) 10 mM HMBA 24 tuntia. Proteiini uutteet immunosaostettiin anti-CDK2 tai anti-CDK4-vasta-aineita. Kaniinin normaalilla lgG: tä käytettiin kontrollina. CDK2-tai CDK4 liittyvän p27Kip1 saadussa immuunikompleksien analysoitiin western-blottauksella käyttäen anti-p27Kip1 vasta-aineen anti-CDK2 tai -CDK4 vasta-loading valvontaa. B &C, SGC7901 soluja esikäsiteltiin (+) tai ilman (-) 10 mM LiCl: a (B) tai 10 uM SB-415286 (C) 30 min, minkä jälkeen seos käsittely 10 mM HMBA 24 tuntia. Proteiini uutteet immunosaostettiin anti-CDK2-vasta-ainetta. CDK2 liittyvä p27Kip1 saadussa immuunikompleksien analysoitiin samanlainen A. D, SGC7901 solut infektoitiin Ad-HA-GSK-3βCA tai vektorisäätö (Ad-β-gal) MOI-arvolla 10 pfu /solu. 48 tunnin kuluttua inkubaation kokosolu proteiini uutettiin ja immunosaostettiin anti-CDK2-aineella (ylempi paneeli). p27Kip1 analysoitiin western-blottauksella samanlainen A. yliekspressio HA-merkitty GSK-3CA vahvistettiin western-blottauksella käyttämällä anti-GSK-3β-vasta-ainetta (alempi paneeli). GSK-3β aktiivisuus tutkittiin in vitro
kinaasimääritykseen käyttäen Snail proteiinia substraattina (alapaneeli).
Keskustelu
PI3-kinaasi /Akt /GSK-3β signalointireitin on liitetty asetukseen solujen kasvun, apoptoosin ja erilaistumisen erityyppisten solujen [46]. Esillä olevassa tutkimuksessa, GSK-3β käyttäen täydentäviä lähestymistapoja (eli kemiallinen esto ja konstitutiivisesti aktiivinen Akt yli-ilmentyminen) heikennettyjä protonipumpun ilme, mitta mahan kaltaisia eriyttäminen, mahalaukun kasvainperäinen SGC7901 solulinjassa.
solujen lisääntyminen ja erilaistuminen ovat perinteisesti pidetään vastavuoroisia prosesseja, joissa solusyklin peruuttamisesta vaatimatta terminaalin eriyttäminen [40], ja P27 Kip1 tärkeä rooli [41, 42]. Geneettinen poistamista p27 muttei p21 on osoitettu vaikuttavan mahalaukun solujen erilaistumista, kun taas pakko p27 Kip1 ilmaisu johtaa erilaistumiseen, mikä viittaa siihen, että p27 Kip1 on tärkeämpää kuin p21 Waf1 säätelyssä mahalaukun solujen erilaistumista. Suostumuksella Näiden havaintojen GSK-3β heikennettyjä HMBA välittämä mahalaukun solujen erilaistumista ja GSK-3β estetty HMBA välittämää ydin- p27 Kip1 ilmaisu, kun taas yli-ilmentyminen aktiivinen muoto GSK-3β lisääntynyt ydinvoiman P27 Kip1 ilmaisua, mikä viittaa tärkeä rooli säätelyssä mahalaukun solujen erilaistumisen kautta sääntelyn ydin- p27 Kip1 ilme.
 7 kotihoitoa ummetukseen
7 kotihoitoa ummetukseen
 Luonnollinen rokote autoimmuunisairauksiin? (Hmm)
Luonnollinen rokote autoimmuunisairauksiin? (Hmm)
 IBS (ärtyvän suolen oireyhtymä) laukaisijat ja ehkäisy
IBS (ärtyvän suolen oireyhtymä) laukaisijat ja ehkäisy
 Vähä fermentoitujen hiilihydraattien ruokavalio parantaa IBD -potilaiden elämänlaatua
Vähä fermentoitujen hiilihydraattien ruokavalio parantaa IBD -potilaiden elämänlaatua
 Kuinka kauan peräpukaman putoaminen kestää?
Kuinka kauan peräpukaman putoaminen kestää?
 Kuinka loimme onnistuneen terveysneuvontakäytännön
Kuinka loimme onnistuneen terveysneuvontakäytännön
 Miltä Crohnin tautikohtaus tuntuu?
Mikä Crohnin tauti on? Crohnin taudin varhaiset merkit ovat matala-asteinen kuume, pitkittynyt ripuli, vatsakipu ja muut Crohnin tauti on tulehduksellinen suolistosairaus, johon liittyy maha-suo
Miltä Crohnin tautikohtaus tuntuu?
Mikä Crohnin tauti on? Crohnin taudin varhaiset merkit ovat matala-asteinen kuume, pitkittynyt ripuli, vatsakipu ja muut Crohnin tauti on tulehduksellinen suolistosairaus, johon liittyy maha-suo
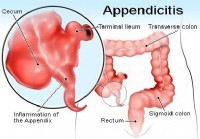 Onko se umpilisäke vai jotain muuta?
Lääketieteellinen kirjoittaja:Benjamin C. Wedro, MD, FAAEMLääketieteellinen toimittaja:Melissa Conrad Stöppler, MD Lääketieteessä on aina kysymättömiä kysymyksiä. Potilaat käyvät lääkärin vastaanotol
Onko se umpilisäke vai jotain muuta?
Lääketieteellinen kirjoittaja:Benjamin C. Wedro, MD, FAAEMLääketieteellinen toimittaja:Melissa Conrad Stöppler, MD Lääketieteessä on aina kysymättömiä kysymyksiä. Potilaat käyvät lääkärin vastaanotol
 Ripuli
Faktioita, jotka sinun pitäisi tietää ripulista Ruoka ripuliin – runsaasti kuitua sisältävät sitrushedelmät Rpuli on suolen liikkeiden lisääntymistä, ulosteiden löysyyttä tai molempia. Ripuli johtu
Ripuli
Faktioita, jotka sinun pitäisi tietää ripulista Ruoka ripuliin – runsaasti kuitua sisältävät sitrushedelmät Rpuli on suolen liikkeiden lisääntymistä, ulosteiden löysyyttä tai molempia. Ripuli johtu