Résumé
Différents types de méthylation des histones ont été associés à la progression du cancer. En fonction du site de méthylation des histones, ses effets sur la transcription sont différentes. DPY30 est un membre commun de complexes H3K4 méthyltransférase SET1 /histones MLL. Cependant, son expression et le rôle dans le cancer gastrique ont été mal caractérisés. Pour déterminer si DPY30 a des rôles physiopathologiques dans le cancer gastrique, son expression et les rôles ont été examinés. Immunohistochimie et PCR en temps réel a montré une régulation positive de l'expression de DPY30 dans certaines lignées cellulaires de cancer gastrique et les tissus des patients. Son effet de choc par l'ARNsi a diminué la prolifération, la migration et l'invasion des cellules cancéreuses gastriques, tandis que sa surexpression a montré les effets contraires. Ces résultats indiquent que DPY30 a un rôle critique dans la prolifération, la migration et l'invasion des cellules de cancer gastrique, et suggérer DPY30 pourrait être une cible thérapeutique dans le cancer gastrique
Citation:. Lee YJ, Han ME, Baek SJ, Kim SY, Oh SO (2015) Rôle des DPY30 dans la prolifération et la motilité des cellules de cancer gastrique. PLoS ONE 10 (7): e0131863. doi: 10.1371 /journal.pone.0131863
Editeur: Aamir Ahmad, École Wayne State University of Medicine, ETATS-UNIS
Reçu 3 Mars, 2015; Accepté 8 Juin 2015; Publié 6 Juillet, 2015
Droit d'auteur: © 2015 Lee et al. Ceci est un article en accès libre distribué sous les termes de la licence Creative Commons Attribution, qui permet une utilisation sans restriction, la distribution et la reproduction sur tout support, pourvu que l'auteur et la source originelle sont crédités
Disponibilité des données: Toutes les données pertinentes sont dans le papier
financement:. Ce travail a été soutenu par le Bio & Programme médical Technologie de développement (É2M3A9C6050213, OSO) et de la Fondation de base de recherche en sciences (É2R1A1A3010521, HME) de la National Research Foundation (NRF), financé par le gouvernement coréen (MEST), et par une subvention de la National R & D Programme pour lutte contre le cancer, Ministère de la Santé, des Affaires sociales et familiales, République de Corée (\0050, OSO). Les bailleurs de fonds ont joué aucun rôle dans la conception de l'étude, la collecte et l'analyse des données, la décision de publier, ou de la préparation du manuscrit
Intérêts concurrents:.. Les auteurs ont déclaré aucun conflit d'intérêts existent
Introduction
des modifications covalentes des queues histones, tels que, acétylation, phosphorylation, ubiquitination, et la méthylation, moduler la structure de la chromatine et de jouer un rôle essentiel dans la régulation de la progression du cycle cellulaire, la transcription des gènes, réparation de l'ADN, le développement embryonnaire, et la différenciation cellulaire [1, 2]. Tandis que l'augmentation acétylation des histones est généralement associée à l'activation de la transcription, la méthylation des histones est corrélée à l'activation de la transcription et de la répression. Par exemple, la méthylation de l'histone H3 à la lysine 9, 20 ou 27 résidus (H3K9, H3K20 ou H3K27) est impliqué dans le silençage génique transcriptionnelle, mais d'autre part, la méthylation à H3K4, H3K36 ou H3K79 est associée à la chromatine ouverte et la transcription des gènes actifs [3].
Chez les mammifères, les mono-, di- et tri-méthylation de H3K4 (H3K4me1, H3K4me2 et H3K4me3) sont effectuées par des complexes de la famille /MLL six SET1 distincte (SET1A, SET1B , MLL1, MLL2, MLL3 et MLL4) [4, 5]. Ces méthyltransférases H3K4 (H3K4MT) contiennent différentes sous-unités catalytiques, et les activités de tous les six complexes de la famille sont contrôlés par des composants de base sous-unités multiples communes, qui comprennent WDR5, RBBP5, ASH2L et DPY30, et sont aussi appelés WRADs. [6-9]. Une perte de toute sous-unité des résultats complexes WRAD à réduire la méthylation de H3K4. WDR5 et RBBP5 sont cruciales pour les trois types de méthylation de H3K4 (H3K4me1, H3K4me2 et H3K4me3), alors que ASH2L et DPY30 sont principalement nécessaires pour H3K4me3 [6, 8, 10, 11].
DPY30 est un membre de tous les SET1 /complexes MLL humains, et est nécessaire pour SET1 /activité méthyltransférase MLL complète [10, 12]. DPY30 a été impliquée dans le potentiel de différenciation des cellules souches embryonnaires (CSE) le long de la lignée neuronale [10] et est essentiel pour la bonne différenciation et la prolifération des cellules souches hématopoïétiques [12]. En outre, l'épuisement des DPY30 provoque des cellules à entrer dans un état de sénescence comme et upregulate p16 (CDKN2A) et p15 (CDKN2B), qui sont directement impliqués dans la sénescence [13].
Le cancer gastrique est l'un des principaux causes de décès liés au cancer dans le monde [14]. Bien que les progrès diagnostiques et thérapeutiques récentes offrent une excellente survie des patients atteints de cancer gastrique précoce, la maladie est généralement diagnostiquée à un stade tardif lorsque le pronostic est mauvais [15]. carcinogenèse gastrique entraîne l'accumulation progressive de diverses altérations génétiques et épigénétiques qui conduisent à gain de fonction par des oncogènes et la perte de fonction de gènes suppresseurs de tumeur. En outre, étant donné que la transcription du gène dépend fortement de la structure de la chromatine, altérée ou anormale méthylation des histones est généralement associée à la progression de la tumeur et le pronostic dans le cancer [16], et bien que l'état de méthylation des histones a été bien décrite dans de nombreux types de cancer, cet aspect reste incertaine dans le cancer gastrique [16, 17].
dans cette étude, afin de déterminer si DPY30 a des rôles physiopathologiques dans le cancer gastrique, son expression et les rôles ont été examinés.
Matériel et méthodes
culture cellulaire et transfection de siRNA
les lignées de cellules cancéreuses dérivées gastriques, SNU1, SNU16, SNU216, SNU620, SNU638 et NCI-N87 ont été achetés à la Corée Cell Line Bank (Séoul). La lignée cellulaire épithéliale gastrique, HFE145 ont été doué du professeur Hassan Ashktorab (Université Howard). Les lignées cellulaires de cancer gastrique ont été cultivées à 37 ° C dans un humidifiée à 5% de CO atmosphère d'air 2/95% dans RPMI 1640 supplémenté avec 25 mM d'HEPES, 10% de sérum bovin fœtal (FBS) (GE Healthcare Life Science, South Logan , UT, USA) et 100 pg /ml de pénicilline /streptomycine (Sigma-Aldrich, St Louis, MO, USA). DMEM (GE Healthcare Life Science) supplémenté avec 10% de SVF et 100 ug /ml de pénicilline /streptomycine a été utilisée pour la culture HFE145. Les cellules ont été transfectées avec des petits ARN interférents (siRNA) ou brouillés (SCR) siRNA en utilisant DhamaFECT réactif 1 ou 3 (Thermo Scientific, Lafayette, CO, USA) selon les instructions du fabricant. séquences de siRNA sont les suivantes: DPY30 siRNA duplex (ORF) (Bioneer, Daejeon, Corée), 5'-CAC UCU GAG UAC GGU CUC (dTdT) -3 ', 5'CUC UGA GUA CGG UCU CAC A (dTdT) -3 ', 5'CUC ACU UAU UCU AGG UAC U (dTdT) -3'; DPY30 siRNA duplex (3'-UTR) (Bioneer); 5'GCC GAC AAC AGA ACC UAU UUU UGG A (dTdT) -3 ', 5'GAG GCA GCU UUA AUU GCC août AUC A (dTdT) -3'; WDR5 siRNA duplex (Bioneer), 5'GUC CUU GUG AAG CUC GUC U (dTdT) -3 ', 5'GUC GUG AUC UCA ACA GCU U (dTdT) -3', 5'CAG AUU ACU ACC UUC UUG U (dTdT) -3 '; RBBP5 siRNA duplex (Bioneer), 5'GUG UGA AAA GGG CUC AGU A (dTdT) -3 ', 5'CAG AUU CUC AGG AUC UUG U (dTdT) -3', 5'GUG GUU GAG AUU AGU AGA U (dTdT) -3 '; ASH2L siRNA duplex (Bioneer), 5'GUA UGA ACG GGU UUU GUU A (dTdT) -3 ', 5'CUG AGA ACA CCU GAA AUC A (dTdT) -3', 5'GUC UAC CUU UCA UGA CCA A (dTdT) -3 '; brouillés (SCR) siRNA (Thermo Scientific), 5'GAU GCC CAA AAG AGC GAA A (dTdT) -3 '. DPY30 surexpression Le DPY30 ADNc a été cloné dans pLenti6.3 -V5 /DEST vecteur (vecteur de destination lentiviral) en utilisant le in vivo Pour les essais de sauvetage, nous avons modifié, suivi d'un protocole «interférences ARNi utilisant la collection Precision Lenti ORF ' (http://dharmacon.gelifesciences.com/uploadedFiles/Resources/precision-lentiorfs-rnai-rescue-appnote.pdf). En bref, les cellules ont été infectées avec des lentivirus recombinants (pLenti6.3-V5 /DEST ou des constructions DPY30-over). 24 heures après la transduction, le support contenant le virus ont été éliminés et remplacés par du milieu de culture complet. Le lendemain, la blasticidine a été ajouté à une concentration de 7,5 ug /ml. Les cellules ont été maintenues sous sélection pendant six jours, en remplacement de moyenne ou repiquage tous les 2-3 jours selon les besoins. Les populations de cellules sélectionnées de contrôle ou des cellules exprimant DPY30 ont été utilisés pour les expériences de transfection utilisant DPY30 siRNA ciblant le cadre de lecture ouvert (ORF) ou de la région 3 'non traduite (UTR). des échantillons de tissus ont été obtenus à partir de 23 patients coréens indépendants primaires gastriques de cancer qui ont subi une résection chirurgicale à Pusan national University Hospital et l'Hôpital Yangsan Pusan national University et a fourni un consentement éclairé écrit. L'étude a été approuvée par le Conseil de Pusan National University Hospital-Institutional Review (PNUH-IRB) et le Conseil de Pusan National University Hospital Yangsan-Institutional Review (PNUYH-IRB). L'ARN total à partir de tissus et de cellules ont été extraites en utilisant le réactif Trizol (Invitrogen) ou un kit RNeasy Mini (Qiagen, Valencia, CA, USA), selon les instructions du fabricant. En temps réel la réaction en chaîne par polymérase quantitative (-PCR en temps réel) a été utilisé pour vérifier les niveaux d'ARNm DPY30. ADNc ont été synthétisés avec MMLV transcriptase inverse (Promega, Madison, WI, USA), les amorces dNTP et oligo-dT. Les séquences d'amorces utilisées sont les suivantes: DPY30, 5'AAC GCA GGT TGC AGA AAA TCC T -3 'et 5'TCT GAT CCA GGT AGG CAC GAG -3'; WDR5, 5'TGT TAC TGG TGG GAA GTG GA -3 et 5'CTG TTG GGT GAC AAG CTG TT -3 '; RBBP5, 5'AGT GCA CAC ATC CAT CCA GT-3 'et 5'TCA CAG TCG CCT GAA AGA AC-3'; ASH2L, 5'TAC AAG AGC TGC ACG GTT TC-3 'et 5'CCA GCC CAT GTC ACT CAT AG -3'; GAPDH, 5'TGG GCC AGG AAA TCA CAT CC -3 'et 5'-CTC AGC GCC AGT GGA AAT GG -3'. PCR en temps réel a été réalisée en utilisant un système en temps réel LightCycler ™ 96 PCR (Roche, Nutley, NJ) et FastStart Essential ADN vert Master (Roche), selon les instructions du fabricant. GAPDH a été utilisé comme témoin interne. Une coloration immunohistochimique avec un anticorps polyclonal de lapin de DPY30 anti-humain (Sigma-Aldrich) a été effectuée sur une matrice de tissu de cancer gastrique (n = 59) ont acheté de SUPER BIO CHIPS (Séoul) ou sur des sections 4 um de spécimens enrobés de paraffine. En bref, après déparaffinage et réhydratation, les lames ont été traitées avec 0,3% de peroxyde d'hydrogène pendant 30 minutes pour inhiber l'activité de la peroxydase endogène, et bloquées avec 10% de sérum normal d'âne (PDN) et 1% de BSA dans 1 x tampon phosphate salin (PBS). Les lames ont été ensuite mises en incubation pendant une nuit à 4 ° C dans un tampon de blocage contenant un anticorps de lapin anti-humain DPY30 primaire (1:80, Sigma-Aldrich). L'anticorps secondaire (conjugué à la HRP), la liaison a été effectuée à une dilution de 1: 200 dans un tampon de blocage pendant 2 h à température ambiante. La détection a été réalisée avec HRP (Vector Laboratories) et de lames ont été contre-colorées en les traitant pendant 1 min avec un tampon de coloration hématoxyline (Sigma-Aldrich). Un jour après la transfection de cellules avec un ARNsi, le milieu a été remplacé par 1% de FBS et quatre jours plus tard, 10 pi de Ez-Cytox (ITSBIO, Séoul) a été ajouté et mis en incubation pendant 0,5 à 2 heures. Afin de vérifier l'effet de DPY30 surexpression sur la prolifération cellulaire, les cellules ont été ensemencées dans 10% de FBS, et après trois jours de culture, 10 pl de Ez-Cytox (ITSBIO) ont été ajoutés et incubés pendant 0,5 à 2 heures. viabilités cellulaires ont été déterminées en mesurant l'absorbance à 450 nm en utilisant victor3 plusieurs lecteurs (PerkinElmer, MA, USA). Boyden chambre dosage A modifié Boyden Transwell chambre (Neuro Probe, Gaithersburg, MD, USA) a été utilisé. Le fond de chambre a été rempli avec 50 ul de RPMI contenant 10% de FBS. Pour examiner les effets de DPY30 connus vers le bas, et SNU1 SNU16 (cellules non adhérentes) ont été transfectées avec l'ARNsi ciblant l'ORF. Un jour après la transfection, les cellules ont été lavées en suspension à une densité de 5 × 10 5 cellules /ml dans 50 ul de milieu RPMI additionné de 0,5% de FBS, et ensemencées dans la chambre supérieure. Pour supprimer les effets de la prolifération, on a ajouté la mitomycine C (0,01 pg /ml, Sigma-Aldrich). Les cellules ont été ensuite mises en incubation pendant 24 heures à 37 ° C avec 5% de CO2. Le nombre de cellules ayant migré a été évaluée par comptage des cellules dans des puits de fond. Pour examiner les effets de DPY30 surexpression, les cellules stables (cellules adhérentes; SNU216 et SNU638) ont été utilisés. Les cellules (simulées et DPY30-plus) ont été trypsinisées et ensemencées à une densité de 1 x 10 5 cellules /ml. Pour supprimer les effets de la prolifération, la mitomycine C a été ajouté. Les cellules ont été autorisés à migrer pendant quatre heures, les membranes ont été fixées et colorées en utilisant une solution Diff-quik (Sysmex, Kobe, Japon) et lavés avec de l'eau distillée. Les nombres de cellules dans 10 champs choisis au hasard ont été comptées à l'aide d'un microscope optique. Des expériences ont été réalisées en triple. Les capacités invasives des cellules cancéreuses ont été évaluées à l'aide de 8 um poreuses BioCoat Matrigel inserts de chambre (BD Bioscience, San Jose, CA, USA). Un jour après la transfection avec des SCR ou DPY30 ARNsi, les cellules ont été trypsinisées, et mis en suspension à une densité de 5 x 10 4 cellules /ml dans 500 pi de RPMI additionné de 0,5% de FBS et de la mitomycine C (0,01 pg /ml, Sigma ALDRICH). Les cellules ont ensuite été ajoutés à des inserts de chambre et placés dans des puits remplis avec 0,7 ml de milieu additionné de SBF à 10% en tant que facteur chimiotactique. Après incubation pendant 24 ou 48 heures, les cellules non envahissants au-dessus de la membrane ont été enlevées par grattage, et les cellules invasives sur la partie inférieure de la membrane sont fixées et colorées avec une solution Diff-Quik (Sysmex). Les nombres de cellules dans 10 champs choisis au hasard ont été comptées à l'aide d'un microscope optique. Des expériences ont été réalisées en triple et au moins 5 champs ont été comptés par expérience. Les résultats sont exprimés en tant que moyen ± écart-types (DS) de trois expériences indépendantes. Les significations des différences ont été déterminées à l'aide de l'étudiant t Expression de DPY30 dans les tissus de cancer gastrique Pour étudier l'expression de DPY30 dans le cancer gastrique humain, nous avons effectué immunohistochimie en utilisant une matrice de tissu de cancer gastrique ou d'archivage inclus dans la paraffine des coupes de tissus. Dans les tissus gastriques normaux, l'expression de DPY30 était difficile à détecter (figure 1A), mais dans les tissus cancéreux DPY30 protéine a été largement surexprimé (figure 1B-1D). Notamment, DPY30 a été surexprimé dans l'invasion des cellules de cancer gastrique (Fig 1B-1D). En outre, nous avons déterminé les taux d'ARNm de DPY30 dans une ligne normale immortalisée gastrique des cellules épithéliales (HFE145) et six lignes gastriques de cancer dérivés de cellules (SNU1, SNU16, SNU216, SNU620, SNU638 et NCI-N87) à l'aide de PCR en temps réel. Le niveau de DPY30 d'ARNm était considérablement plus élevé (fold change > 5) SNU1 et SNU16 que dans HFE145 cellules, alors que le niveau d'expression de DPY30 dans SNU216, SNU620 et SNU638 était similaire à ceux de HFE145 cellules et était plus faible (fold change > 10) dans NCI-N87 (Fig 1E). Nous avons également vérifié les niveaux d'ARNm de DPY30 dans les tissus du cancer de l'estomac. DPY30 a été fortement exprimé dans 15 cas (15/23, 65%) par comparaison avec les tissus normaux (figure 1f). Ces résultats indiquent que DPY30 est fortement exprimé dans certains cancers gastriques humaines. Afin de déterminer les rôles possibles de DPY30 dans les cellules de cancer gastrique, nous premier knocked-down DPY30 utilisant l'ORF-ciblage DPY30 siRNA et surveillé son efficacité knockdown par PCR en temps réel (figure 2A). L'ORF de ciblage DPY30 ARNsi (100 nM) a diminué le niveau de DPY30 d'ARNm dans HFE145, SNU1, SNU16, SNU216 et SNU638 cellules par comparaison avec l'ARNsi crypté (SCR) de 78%, 89%, 79%, 76%, et 88%, respectivement. Cinq jours après la transfection des cellules avec des SCR ou l'ARNsi ciblant l'ORF, nous avons effectué des dosages de prolifération. Knockdown de DPY30 a inhibé les proliférations de HFE145, SNU1 et SNU16 par rapport au SCR de 31%, 69% et 71% respectivement, tandis que l'effet de choc n'a pas affecté les proliférations de SNU216 et SNU638 (figure 2B), dans lequel le niveau d'expression DPY30 était faible (Fig 1E). Ensuite, nous avons produit des lignes DPY30 surexprimant cellulaires (DPY30-over) en utilisant HFE145, SNU216 et SNU638 cellules, puis comparé les niveaux d'ARNm dans les cellules DPY30 simulacres (contrôle) et les cellules DPY30-over. résultats de la PCR en temps réel ont montré que le niveau de DPY30 d'expression était de 4,2, 3,5 et 3,2 fois plus élevée dans DPY30 surexprimant HFE145, SNU216 et SNU638 cellules que les cellules simulées, respectivement (figure 2A). DPY30 surexpression amélioré les proliférations de HFE145, SNU216 et SNU638 cellules par rapport aux cellules simulacres de 1,9, 2,2 et 1,6 fois, respectivement (figure 2B). Pour confirmer la spécificité de DPY30 siRNA, nous avons effectué les expériences de sauvetage. Pour les expériences de sauvetage, nous avons utilisé un DPY30 siRNA ciblant 3'-UTR au lieu de ORF parce que le siRNA ORF-ciblage peut aussi dégrader la DPY30 exogène ORF ADN, nous avons introduit. Pour surexprimer DPY30, nous transduites SNU1 et SNU16 avec des particules virales, pLenti6.3-V5 /DEST (contrôle) ou des constructions DPY30-ORF-over. cellules SNU1 ou SNU16 DPY30 surexprimant ont montré une expression plus élevée de DPY30 2,1 ou 2,5 fois plus élevée que les cellules simulées, respectivement (figure 2C). Le siRNA ORF-ciblage a conduit à la régulation des niveaux d'expression de DPY30 par plus de 75% dans la maquette ainsi que les cellules DPY30-surexprimant. La 3'-UTR-ciblage siRNA régulé à la baisse l'expression de DPY30 par plus de 85% dans les cellules simulées, alors que, dans les cellules DPY30 surexprimant, il a diminué l'expression de DPY30 à un niveau similaire à celui des cellules SCR siRNA-transfectées ( La figure 2C). Ce résultat indique que l'ORF-DPY30 ADN exogène est résistant à l'extrémité 3 'UTR de cibles siRNA et est exprimé à un niveau similaire à celui de l'ARNm endogène DPY30. L'ORF de ciblage siRNA a inhibé la prolifération des cellules indépendamment de l'expression exogène DPY30 (figure 2D). La prolifération a été également inhibée par le siRNA 3'UTR-ciblage dans des cellules simulées, mais il a été partiellement inhibée dans les cellules DPY30-surexprimant. Dans les cellules surexprimant DPY30, l'ARNsi ciblant l'ORF a diminué la prolifération des SNU1 et SNU16 SCR par rapport à l'ARNsi de 74% et 66%, respectivement, mais l'ARNsi 3 'UTR de ciblage a diminué de 20% et 8%, respectivement . Ce résultat indique que DPY30 exogène sauve l'inhibition de la prolifération induite par le siRNA 3'-UTR-ciblage, et les phénotypes causés par DPY30 siRNA spécifiques ne sont pas des effets hors-cible. Parce que DPY30 est un composant de Wards , nous avons examiné les expressions et les rôles des autres composantes de Wards. PCR en temps réel a montré que les taux d'ARNm de WDR5 et RBBP5 dans SNU1, SNU16, et SNU216 SNU638 étaient semblables à ceux de HFE145. Cependant, le niveau de ASH2L d'ARNm étaient significativement plus élevés (fold change > 3) SNU1 et SNU16 que dans HFE145 cellules (figure 3A) comme DPY30 sur la figure 1E. Afin d'étudier si les composants WRAD sont associés à la prolifération de cellules de cancer gastrique, nous knockdowned chaque composant de WRAD utilisant leur siRNA spécifique et surveillé knockdown efficacité par PCR en temps réel (figure 3B). Chaque siRNA (100 nM) a diminué les taux d'ARNm dans les cellules SNU1 et SNU16 par rapport à SCR de 65% -75%. Knockdown de WDR5 et RBBP5 a inhibé la prolifération des cellules et SNU1 SNU16 par rapport au SCR de 30 à 48% (figure 3C). Cependant, ASH2L a inhibé la prolifération des SNU1 et SNU16, dans lequel le niveau d'expression de ASH2L était élevée, par comparaison avec SCR de 85% et 75%, respectivement. Nous avons ensuite examiné si DPY30 régule la migration des cellules de cancer gastrique. Knockdown de DPY30 a diminué les migrations de FBS induites par des cellules et SNU1 SNU16 contre SCR de 35% et 45%, respectivement (figure 4). En revanche, la surexpression augmente DPY30 migrations FBS induite par SNU216 et SNU638 cellules par rapport aux cellules simulées par 2,5 et 2,2 fois, respectivement (figure 4). Ces résultats nous ont amenés à examiner le rôle de DPY30 dans l'invasion des cellules cancéreuses gastriques. Dans un essai d'invasion de Matrigel, DPY30 ARNsi a inhibé l'invasion FBS induites par des cellules et SNU1 SNU16 SCR par rapport ARNsi de 65% et 84%, respectivement (figure 5A et 5C). En outre, DPY30 surexpression augmente les invasions FBS-induites de cellules SNU216 et SNU638 par rapport aux cellules simulacres de 3,2 et 2,9 fois, respectivement (figure 5B et 5C). Ces résultats montrent que DPY30 favorise la migration et l'invasion des cellules cancéreuses gastriques. Rôles de DPY30 dans la biologie du cancer ont été mal caractérisé, bien que son rôle dans la différenciation des CES et des cellules progénitrices hématopoïétiques avait été rapportée [10, 12]. Dans la présente étude, nous avons montré de nouveaux rôles de DPY30 dans le cancer gastrique. DPY30 est amplifié (données non montrées) et fortement exprimée (figure 1) dans certains tissus de cancer gastrique. De plus, son effet de choc ou surexpression réglementés la prolifération, la migration et l'invasion des cellules de cancer gastrique. Les modifications de l'expression, des translocations chromosomiques et des mutations somatiques des gènes codant pour les sous-unités de SET1 /complexes MLL ont été signalés dans de nombreux cancers. Ces résultats confirment le rôle crucial des membres de SET1 /complexes MLL dans la progression du cancer. Up-régulation de l'expression DPY30 n'a été observée que dans les cellules cancéreuses gastriques SNU1 et SNU16 entre six cellules de cancer gastrique que nous avons examinés. Toutefois, sa régulation positive a été observée dans plus de la moitié des tissus gastriques du cancer, nous avons examiné (figure 1). Il est difficile d'expliquer cet écart. Cependant, il est évident que le nombre des tissus du cancer de l'estomac, nous avons examiné ne suffit pas. Ainsi, une étude d'expression extensive utilisant beaucoup plus nombre de tissus est nécessaire pour évaluer la valeur clinique à l'avenir. Rôles de SET1 /MLL H3K4 complexe méthyltransférase dans la biologie du cancer est complexe. sous-unités réglementaires de SET1 /complexes MLL, y compris WRAD, contiennent les deux oncoprotéines puissants et suppresseurs de tumeurs. Par exemple, le gène codant pour la ménine NEM1, une sous-unité intégrale de MLL1 et MLL2 et est muté chez les patients atteints néoplasie endocrinienne multiple type 1 (NEM 1) [18, 19]. En outre, menin réglemente p18 (CDKN2C) et p27 (CDKN1B) en recrutant MLL1 complexe [20]. En revanche, WDR5, un composant du complexe WRAD, a été rapporté pour agir comme une oncoprotéine dans le cancer de la prostate, dans laquelle il est surexprimée et cruciale pour la prolifération induite par les androgenes des cellules tumorales [21]. ASH2L, ce qui est un autre composant du complexe WRAD et peut interagir avec l'oncoprotéine MYC [22], est crucial pour l'MYC /transformation Ha-ras-dépendante des fibroblastes d'embryon de rat. En outre, il est surexprimé dans de nombreux types de tumeurs et est essentielle pour la prolifération de cellules tumorales [23]. Dans la présente étude, nous avons montré des rôles de DPY30 comme une oncoprotéine dans le cancer de l'estomac. Quels sont les mécanismes moléculaires sous-jacents des rôles de DPY30 dans le cancer gastrique? Bien que nous ne révélons pas, plusieurs hypothèses peuvent être proposées sur la base des études précédentes. L'une des hypothèses possibles est que DPY30 surexpression conduit aux surexpressions d'oncogènes par une activité accrue H3K4MT. Épuisement des DPY30 ou ASH2L conduit à une diminution de H3K4me3, tandis que WDR5 et RBBP5 sont cruciales pour les trois types de H3K4 (H3K4me1, H3K4me2 et H3K4me3) [6, 8, 10, 11]. En outre, la surexpression de DPY30 seul peut augmenter l'activité H3K4MT [10]. Depuis H3K4me2 /3 est une marque active la transcription [3, 24], l'augmentation de H3K4MT peut directement upregulate de nombreux gènes, tels que, oncogènes, ou encore indirectement réguler à la baisse des suppresseurs de tumeurs. Un précédent rapport soutenant cette hypothèse est que ASH2L, une composante essentielle de SET1 /complexe MLL, a été montré à jouer comme une oncoprotéine [25, 26]. Un autre rapport précédent est que DPY30 active directement les expressions de protéines d'identité via H3K4 méthylation [13, 27]. protéines ID inhibé les activités de ETS1 et ETS2 qui peuvent induire une d'un gène suppresseur de tumeur p16. Dans la présente étude, nous avons montré que les composants de WRAD (WDR5, RBBP5 et ASH2L) peuvent inhiber la prolifération de cellules de cancer gastrique (figure 3), ce qui suggère que DPY30 acte par l'augmentation de l'activité H3K4MT. D'autres études sont nécessaires pour révéler les mécanismes sous-jacents les rôles des DPY30 dans les cellules de cancer gastrique.
système de clonage passerelle à base de recombinaison (Invitrogen, Carlsbad, CA, USA). Le vecteur donneur (pDONR221) hébergeant la séquence d'ADNc de DPY30 a été acheté de Ultimate ORF Clones (Invitrogen), et recombiné avec le contre-sélectionnable ccdB
gène pLenti6.3-V5 /DEST en utilisant un mélange clonase enzymatique LR (Invitrogen). Le vecteur pLenti6.3 vide /V5-DEST a été utilisé comme témoin maquette. lentivirus recombinants ont été produits dans des cellules 293FT, et utilisé pour infecter des cellules et SNU216 SNU638, selon les instructions du fabricant (système d'expression lentiviral ViraPower; Invitrogen). DPY30 surexprimant cellules stables ont été établies par sélection avec blasticidine (7,5 pg /ml) (Invitrogen).
PCR en temps réel
immunohistochimie
Essai de prolifération cellulaire
Matrigel test d'invasion
L'analyse statistique
-test pour les observations non appariées. Les valeurs P
de < 0,05 ont été considérées comme statistiquement significatives.
Résultats
Rôles de DPY30 dans la prolifération des cellules cancéreuses gastriques
Les rôles des DPY30 dans la migration et l'invasion des ulcères gastriques cellules cancéreuses
Discussion
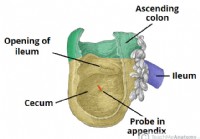 Le Cécum
Le Cécum
 Qu'est-ce que la rectopexie par résection ouverte et laparoscopique ?
Qu'est-ce que la rectopexie par résection ouverte et laparoscopique ?
 Une approche multi-omique pour le développement de médicaments contre le COVID-19
Une approche multi-omique pour le développement de médicaments contre le COVID-19
 Choux de Bruxelles rôtis à l'huile d'avocat avec orange et grenade
Choux de Bruxelles rôtis à l'huile d'avocat avec orange et grenade
 DeNovix annonce le gagnant du spectrophotomètre/fluoromètre Platinum DS11 FX+
DeNovix annonce le gagnant du spectrophotomètre/fluoromètre Platinum DS11 FX+
 Pleins feux sur les amis d'un régime spécifique de glucides :Sherry de SCDforLife
Pleins feux sur les amis d'un régime spécifique de glucides :Sherry de SCDforLife
 Hernie (hernie abdominale) 9 types, symptômes, causes et chirurgie
Quest-ce quune hernie abdominale ? Photo dune femme souffrant dune hernie douloureuse Une hernie abdominale survient lorsquun organe ou un autre morceau de tissu fait saillie à travers un affaibliss
Hernie (hernie abdominale) 9 types, symptômes, causes et chirurgie
Quest-ce quune hernie abdominale ? Photo dune femme souffrant dune hernie douloureuse Une hernie abdominale survient lorsquun organe ou un autre morceau de tissu fait saillie à travers un affaibliss
 Comment trouver les bons conseils nutritionnels pour un intestin en bonne santé ? Les diététistes démystifient 5 mythes courants sur la santé intestinale
Comme nous lavons expliqué dans ce blog, la meilleure façon de maintenir un intestin sain est de faire attention aux aliments que vous choisissez de manger. Cependant, tous les conseils nutritionnels
Comment trouver les bons conseils nutritionnels pour un intestin en bonne santé ? Les diététistes démystifient 5 mythes courants sur la santé intestinale
Comme nous lavons expliqué dans ce blog, la meilleure façon de maintenir un intestin sain est de faire attention aux aliments que vous choisissez de manger. Cependant, tous les conseils nutritionnels
 Pleins feux sur un régime alimentaire spécifique en glucides :Fernpixel
Nous accordons la priorité à la mise en avant des personnalités SCD sur Internet. Nous aimons entendre des histoires de réussite et voulons diffuser les connaissances de ceux qui sont assez courageux
Pleins feux sur un régime alimentaire spécifique en glucides :Fernpixel
Nous accordons la priorité à la mise en avant des personnalités SCD sur Internet. Nous aimons entendre des histoires de réussite et voulons diffuser les connaissances de ceux qui sont assez courageux