Résumé
mangiférine (MF), un xanthonoïde de Mangifera indica , a été prouvé avoir des effets gastro-antisécrétoires et antioxydantes contre différents modèles d'ulcère gastrique; cependant, son mécanisme moléculaire n'a pas encore été élucidé. Par conséquent, le but de cette étude était de tester l'effet modulateur sur plusieurs voies de signalisation en utilisant le modèle d'ischémie /reperfusion pour la première fois. Les animaux ont été traités avec MF oméprazole (OMP), et le véhicule. Les études mécanistiques ont montré que l'effet médié MF gastroprotection en partie par l'intermédiaire d'induire l'expression de Nrf2, HO-1 et PPAR-γ ainsi que la régulation négative de NF-kB. Étonnamment, l'effet de MF, en particulier la dose élevée, supérieure à celle médiée par OMP sauf pour Nrf2. Les résultats moléculaires ont été reflétées sur les biomarqueurs mesurés, où l'effet antioxydant de MF a été manifeste en augmentant la capacité antioxydante totale et le glutathion, outre la normalisation du niveau de malondialdéhyde. En outre, MF a diminué l'élévation E /R induite par l'oxyde nitrique, un effet qui était meilleure que celle des OMP. Dans le sérum, MF, proportionnelle à la dose, accru synthase endothéliale de l'oxyde nitrique, alors réduit l'isoforme inductible. En ce qui concerne l'effet anti-inflammatoire de MF, il a réduit le niveau d'IL-1β et sE-sélectine, des effets qui se sont reflétés au niveau des tissus de la myéloperoxydase, le marqueur d'infiltration neutrophile sérum. En outre, MF possédait un caractère anti-apoptotique en témoigne l'élévation de Bcl-2 et en réduisant celle de la caspase-3 dans un ordre de la dose. En conclusion, les mécanismes de gastroprotection intima de MF sont médiés, partiellement, par la modulation du stress oxydatif, l'inflammation et l'apoptose éventuellement par l'intermédiaire du Nrf2 /HO-1, PPAR-γ /NF-kB voies de signalisation.
Citation : Mahmoud-Awny M, AS Attia, Abd-Ellah MF, El-Abhar HS (2015) mangiférine Limite les Ulcère gastrique dans ischémie /reperfusion rats: Implication des PPAR-γ, NF-kB et Nrf2 /HO-1 voies de signalisation. PLoS ONE 10 (7): e0132497. doi: 10.1371 /journal.pone.0132497
Editeur: Ashraf B. Abdel-Naim, Faculté de Pharmacie, Université Ain Shams, EGYPTE
Reçu le 18 Mars 2015; Accepté 15 Juin 2015; Publié le 21 Juillet, 2015
Droit d'auteur: © 2015 Mahmoud-Awny et al. Ceci est un article en accès libre distribué sous les termes de la licence Creative Commons Attribution, qui permet une utilisation sans restriction, la distribution et la reproduction sur tout support, pourvu que l'auteur et la source originelle sont crédités
Disponibilité des données: Toutes les données pertinentes sont dans le papier
financement:.. les auteurs ont pas de soutien ou de financement pour signaler
intérêts concurrents:. les auteurs ont déclaré aucun conflit d'intérêts existent
introduction
au cours de l'ulcère gastrique prospérité maladie de upshots rassemblés à la détresse de l'équilibre entre la destruction et les événements de protection. Le stress oxydatif est un facteur clé qui engendre l'ulcère gastrique et entraîne la surproduction de radicaux libres (FRS) [1]. L'ischémie gastrique /reperfusion (I /R) imite archétype ulcère gastrique induite par le stress, auquel cas, les MRF élevées, l'oxyde nitrique (NO), leucocyte molécule d'adhésion "E-sélectine" [2], l'infiltration de neutrophiles [3], et déséquilibre redox [4] jouent un rôle important dans sa pathogénie. De même, le facteur nucléaire kappa B (NF-kB), un facteur de transcription redox-sensibles, a un rôle central dans la blessure I /R [5]. Elle régule l'expression de plusieurs gènes associés à une inflammation et une lésion des cellules, telles que l'interleukine (IL) -1β, -6, molécules d'adhésion cellulaire et de l'oxyde nitrique synthase inductible (iNOS). D'autre part, plusieurs facteurs modifiaient leur gastroprotection contre les dommages oxydatifs en atténuant la réponse inflammatoire, ceux-ci comprennent le récepteur activé par les proliférateurs des peroxysomes (PPAR) -γ [6, 7] et heamoxygenase-1 (HO-1) [8]. Ce dernier est l'isoforme inductible de HO qui répond à des contraintes, telles que le stress oxydatif et il reste largement considéré comme un mécanisme de protection contre les blessures des tissus oxydatifs [9].
L'un des régulateurs de transcription de HO-1 est le facteur nucléaire 2 facteur-E2 lié (Nrf2) [9], qui est localisée dans le cytoplasme dans des conditions normales et interagit avec Keap1 (le capteur riche en cystéine protéine moléculaire Kelch-like ECH associant protein 1) à se dégrader rapidement par la voie ubiquitine-protéasome [10, 11]. Au contraire, dans des conditions de stress oxydatif, Keap1 est oxydé et Nrf2 ubiquitination est abaissée [11], libérant ainsi, Nrf2 de Keap1. Nrf2 est ensuite transporté dans le noyau d'attacher à l'élément de réponse antioxydant du promoteur du gène cible [12, 13] provoquant la transactivation immédiate des gènes codants. Ces gènes comprennent de nombreux antioxydants enzymatiques et les gènes de détoxification tels que le glutathion (GSH) Peroxydase /réductase, HO-1 et GSH-S-transférase [14].
mangiférine (MF), un glucosylxanthone d'origine naturelle, possède un effet gastroprotective via Sur le plan moléculaire, le présent objectif était d'évaluer l'implication possible de Nrf2 /HO-1, PPARy et NF -κB voies de signalisation de l'effet gastroprotective de MF, en plus d'autres biomarqueurs de délimiter les mécanismes gastroprotective potentiels en utilisant l'hypoxie /modèle de réoxygénation. Matériaux et Animaux Homme PROCEDE des rats Wistar, pesant 180-220 g (Institut de recherche d'Ophtalmologie, Giza, Egypte) ont été maintenus sur un feu de 12h /cycles sombres, les conditions environnementales constantes et ont été maintenus sur un chow de bonne alimentation et de l'eau ad libitum mangiférine [MF] a été acheté auprès de Sigma-Aldrich Chemical Company (St Louis, MO, USA) et l'oméprazole [OMP] de Chemo SA (Lugano, Suisse). Tous les autres produits chimiques et réactifs utilisés étaient de qualité analytique. MF et OMP ont été dissous dans du sérum physiologique pour être injecté par voie intraperitoneale. Le modèle I /R a été réalisée selon la méthode précédemment décrit par Kotani et al. [17] avec quelques modifications. En bref, sous anesthésie au thiopental (50 mg /kg, i.p.), l'artère cœliaque chez le rat a été occluse pendant 30 min., Après quoi on a laissé la reperfusion pendant 72 heures par déclampage de l'artère. Les rats ont été répartis en 5 groupes (n = 7-9); les animaux du premier groupe ont reçu une solution saline et l'artère coeliaque a été manipulée sans serrage pour servir de groupe témoin opération fictive. Les rats dans les groupes suivants ont été soumis à I /R; le (second) groupe non traité, a reçu une solution saline et a été désigné comme témoin positif (I /R), tandis que les 3 autres groupes ont été traités, avec MF (10 mg /kg; MF 10, le troisième groupe), MF ( 20 mg /kg; MF 20, le quatrième groupe), et OMP (20 mg /kg; OMP 20, le cinquième groupe). Tous les traitements ont été effectués 30 min. avant l'opération et pendant 3 jours après la reperfusion. examens histopathologiques Estomac, à partir de trois animaux représentatifs dans chaque groupe, a été immédiatement immergé dans 10% de formaline-saline, inclus dans la paraffine, et 5 um ont été préparées, colorées à l'hématoxyline et l'éosine (H & E), et examinées au microscope mesures biochimiques A la fin du temps de reperfusion et sous anesthésie profonde de l'éther, le sang a été prélevé. la veine jugulaire pour préparer des sérums, puis les animaux ont été euthanasiés et l'estomac a été excisée, ouverte le long de la grande courbure, et on rince avec une solution saline glacée. L'étendue de la lésion de la muqueuse brut (indice Ulcère) a été évaluée et exprimée par la somme des longueurs de l'ulcère de l'estomac par mm [18]. En bref, une loupe éclairante (3x) a été utilisé pour mesurer la longueur des longues lésions (mm) de la partie glandulaire de l'estomac, tandis que les lésions petechea ont été comptées et chacune cinq lésions étaient représentés comme 1 mm de l'ulcère. Environ 50 mg de la muqueuse gastrique a été immergé pendant une nuit dans l'ARN solution plus tard, stocké à -80 ° C jusqu'à quantitative PCR en temps réel (qRT-PCR) quantification. La muqueuse restante a été abandonné au large et homogénéisé dans une solution saline glacée (MPW-120, Pologne) en utilisant la vitesse maximale pendant 1 min. L'homogénat a été centrifugé à 5000 tpm pendant 5 min à 4 ° C et les surnageants résultants ont été maintenus en aliquotes et conservé à -80 ° C jusqu'à ce que la détermination des paramètres gastriques. L'homogénat /niveaux des paramètres suivants de sérum ont été évalués en utilisant les kits ELISA correspondant comme indiqué entre parenthèses:.. IL-1β, sE-sélectine de (Abcam Inc., Cambridge, Royaume-Uni, Cat No. ab100768 et ab171334, respectivement), iNOS, eNOS (EIAab, Wuhan, Chine, Cat No. E0837r et E0868r, respectivement), B leucémie /lymphome-2 (Bcl-2;. USCN Life science Inc., Wuhan, Chine, Cat . No. E90778Bo) et de la caspase-3 (Cusabio Biotech Co., Wuhan, Chine, Cat. No. CSB-E08857r). Chaque biomarqueur a été traitée selon les procédures du fabricant fournies. Sérum capacité antioxydante totale (TAC) a été mesurée en utilisant la méthode de Benzie et Starin [19]. En bref, tripyridyltriazine ferrique (Fe 3 + -TPTZ) complexe a été réduit à la forme ferreuse par les antioxydants présents dans l'échantillon à un pH acide, pour donner une couleur bleue intense qui peut être contrôlé en mesurant la variation de l'absorbance à 593 nm. Le changement est directement lié à la puissance totale combinée ou la réduction des donneurs d'électrons anti-oxydants non enzymatiques présents dans le mélange réactionnel. Le niveau TAC a été exprimée en uM /L. L'activité de la MPO (U /g), un marqueur de neutrophile tissulaire infitration, a été évaluée en fonction de Bradley et al. [20]. La méthode est basée sur la mesure de l'oxydation de l'hydrogène peroxyde dépendant de l'o-dianisidine, catalysée par la MPO, ce qui se traduit par la formation d'un composé présentant une absorbance accrue à 460 nm. Comme un indice de substances à l'acide thiobarbiturique de lipoperoxydation réactifs (TBARS), représentée par MDA, a été utilisé pour déterminer les dommages oxydatifs, selon la méthode de Mihara et Uchiyama [21]. Le produit d'addition MDA-TBA développe une couleur rose, qui a été extrait par le n-butanol et mesurée à deux longueurs d'onde, à savoir muqueuse gastrique production de NO a été estimé indirectement que le nitrite /concentration en nitrates selon la méthode de Miranda et al. [23], où le trichlorure de vanadium a été utilisé pour réduire les nitrates en nitrites. Le colorant azoïque rose produit par la réaction du nitrite avec l'acide sulfanilique, suivie par le couplage subséquent avec le N- (1-naphtyl) -éthylènediamine a été mesurée par colorimétrie à 540 nm et de NOx a été exprimée en umol /g. l'ARN total a été extrait de la muqueuse gastrique en utilisant Simply kit P Extraction des ARN totaux (BioFlux, Hangzhou, Chine). La pureté de l'ARN obtenu a été vérifiée spectrophotométrique métriquement à 260/280 nm. Des quantités égales d'ARN (0,368 ug) ont été rétrotranscrit en premier brin d'ADN complémentaire (ADNc) à 37 ° C pendant 50 min. en utilisant 200 U /ul M-MuLV transcriptase inverse (SibEnzyme, Novosibirsk, Russie), 1 hexamère ul aléatoire (Qiagen, LRS Laboratories, Inc. Corée), et 0,1 M DTT dans un mélange de réaction de 50 ul. Pour évaluer l'expression de gènes cibles antioxydantes et associée à une inflammation, une RT-PCR a été réalisée en utilisant une PCR SYBR Green Master Mix (Qiagen) comme décrit par le fabricant. En bref, dans un volume réactionnel de 25 pi, 5 pi d'ADNc, on a ajouté 12,5 pi de mélange maître SYBR 2x vert et 2,5 ul (2,5 uM) de chaque amorce. Les séquences des amorces étaient les suivantes: PPAR-γ amorce sens 5'-GCGGAGATCTCCAGTGATATC-3 '; amorce anti-sens 5'-TCA GCGACTGGGACTTTTCT-3 '; NF-kB p65 amorce sens 5'-TGCAGAAAGAAGACATTGAGGTG-3 '; amorce anti-sens 5'- AGGCTAGGGTCAGCGTATGG-3 '; Nrf2 amorce sens 5'-ATGGCC ACACTTTTCTGGAC-3 '; amorce anti-sens 5'-AGATGTCAAGCGGGTCACTT-3 '; HO-1 amorce sens 5'- CGTGCAGAGAATTCTGAGTTC-3 '; amorce anti-sens 5'- AGACG CTTTACGTAGTGCTG-3 '; et la glycéraldéhyde-3 phosphate déshydrogénase (GAPDH) l'amorce sens 5'-GGGCAGCCCAGAACATCA-3 '; amorce antisens 5'-TGACCTTG CCCACAGCCT-3 '. Les réactions de PCR comprenaient 15 min à 95 ° C pendant l'activation de HotStarTaq DNA Polymerase, suivie de 45 cycles à 94 ° C pendant 15 s (dénaturation), 55 ° C pendant 30 s (recuit) et 72 ° C pendant 30 s (extension ). L'expression relative a été calculée à partir du 2 formule -ΔΔCT [24]. Les données ont été exprimées en moyenne ± S.E.M. de 7-9 animaux. Les comparaisons statistiques entre les moyennes ont été effectuées en utilisant une analyse de variance à un facteur (ANOVA), suivie par le test de Student-Newman-Keuls. La signification statistique de la différence a été considérée à P Résultats de MF et OMP sur I /indice d'ulcère induit par R- MF, fonction de la dose, interdit la lésion I /induite par R-gastrique, comme présenté par les valeurs de l'indice de l'ulcère (tableau 1) et l'effet de MF 20 est comparable à celui offert par OMP 20. effet de MF et OMP sur l'expression de l'ARNm des gènes antioxydants Comme illustré sur la figure 1A et 1B, réponse adaptative contre la blessure I /R a été mis en évidence dans la régulation positive de Nrf2 et HO-1 ARNm, ce qui explique la raison derrière le taux de GSH élevée dans non traité groupe I /R. Ces ARNm upregulations étaient encore plus vives dans les groupes traités, en montrant, par conséquent, la capacité antioxydante de MF. Comme présenté dans les tableaux 2 et 3 I /R insulte a provoqué un déséquilibre dans l'oxydation /état nitrosatif. Une hausse des taux de MDA (182%) et la production de NOx (187,6%), le parallèle avec 5,1 plis augmentation de iNOS, a été perçue dans le groupe non traité I /R. Au contraire, la blessure I /R réduit de moitié le bénéficiaire eNOS et a réduit le TAC (69,7%), par rapport à un groupe sham. Toutes ces modifications ont été rétablis par OMP, ainsi que MF, d'une manière dépendante de la dose. Dans presque tous les paramètres MF 20 a eu pour effet de premier plan. En ce qui concerne GSH, le modèle I /R, de manière inattendue, élevée par 32%, un effet qui a été encore renforcée par les différents régimes médicamenteux. Comme cela est représenté sur la figure 1C, les animaux avec I /R blessures ont révélé une diminution significative de l'expression gastrique du PPAR-γ anti-inflammatoire (25% du niveau fictif), avec une augmentation marquée en ce que le facteur pro-inflammatoire NF-kB (11,9 fois) (figure 1D). Fait intéressant, MF groupes traités ont été en mesure de contrer les effets de I /liés R-en fonction du niveau de dose testée. OMP, d'autre part, a montré un effet moindre que MF a fait le NF-kB, mais n'a pas modifié le PPAR-γ diminué. le tableau 4 présente le mal gastrique I /R-médiée, ce qui a aggravé les biomarqueurs inflammatoires. Il a stimulé les niveaux d'IL-1β, sE-sélectine, et l'activité MPO gastrique sériques de 5,2, 5,6, et 2,2 plis, respectivement, par rapport au simulacre opéré groupe témoin. Toutes ces modifications ont été interrompues de manière significative par le traitement avec MF d'une manière dépendante de la dose. Néanmoins, le MF 20 effets remplacé celle médiée par l'OMP standard de référence. Ces observations indiquent que MF peut moduler les cytokines inflammatoires et des neutrophiles recrutement pour atténuer I /lésion induite R. Comme présenté dans le tableau 4, le I /R insulte déclenché l'apoptose de la muqueuse gastrique comme en témoigne l'augmentation de 6.85 plis de la caspase-3. Dans le même contexte, I /R a diminué le niveau du marqueur anti-apoptotique Bcl-2 (59%). Cependant, l'administration de MF, d'une manière dépendante de la dose, a interrompu ces modifications de manière significative, les effets qui ont dépassé ceux médiés par OMP. L'amélioration de modifications histopathologiques gastriques effets des différents régimes de médicaments sur les biomarqueurs testés ont été confirmées par les résultats histologiques présentés dans la figure 2. La figure illustre les photomicrographies de la muqueuse de l'estomac, qui montrent [A] normale la muqueuse gastrique (mu), muqueux (sm) et musculeuse ( mL) l'architecture dans la section opération fictive rat. sections I /R [B] révèlent muées muqueuse (m), juxtraposed avec hémorragie sous-jacente (flèche noire), [C] sévère congestion vasculaire (V), foyer inflammatoire cellules infiltration (m), principalement en neutrophiles, et l'œdème (O) dans la sous-muqueuse. [D] MF 10 section divulgue seulement la congestion dans les vaisseaux sanguins sous-muqueux (V) avec légère infiltration de cellules inflammatoires (flèche jaune) et /ou oedème. D'autre part, [E] MF 20 coupe, similaire à un contrôle opérés de manière fictive, montre la structure histologique normale intacte, sauf pour une congestion vasculaire très doux (v) dans la sous-muqueuse; MF 20 effet remplacé celui de [F] OMP, où les vaisseaux sanguins congestionnés (V) et un œdème dans la couche sous-muqueuse sont encore détectés dans les sections OMP. Discussion Bien que des études antérieures ont documenté l'antioxydant [15] et anti-inflammatoires [25] capacités de MF, mais aucun n'a précisé les voies moléculaires potentiels impliqués dans les travaux de réparation des systèmes inflammatoires redox /perturbés. Ainsi, dans le présent travail, nous avons vérifié l'expression de la muqueuse gastrique Nrf2 /HO-1 pour comprendre si cette voie de signalisation est impliqué dans le mécanisme antioxydant MF. En outre, l'étude cible l'expression de NF-kB et PPAR-γ pour explorer aussi une partie de la machinerie moléculaire anti-inflammatoire possible MF. Nos études de transduction de signal ont révélé que I /R a considérablement régulée positivement l'ARNm Nrf2 et HO-1 pointant vers un éventuel effet d'adaptation de l'organisme contre l'insulte I /R endommager; ces résultats imitent celle de Pan et ses collègues [26] dans un modèle rétinien I /R. Amélioration de HO-1 expression de la protéine, régulée par Nrf2 [27], peut se produire en réponse à un stress oxydatif [28] et des maladies inflammatoires et est largement acceptée comme un mécanisme de protection contre les lésions tissulaires oxydatifs [9], les faits qui appuient nos constatations. MF, d'autre part, a confirmé son effet antioxydant, en élevant encore l'expression de Nrf2 et HO-1, des résultats qui ont été enregistrés précédemment dans un modèle hépatotoxique [29]. Au meilleur de notre connaissance, cette constatation est la première preuve directe pour un rôle gastroprotective de MF par la voie antioxydante Nrf2 /HO-1 dans le modèle I /induite par R-ulcéreux. Le caractère antioxydant du MF a été manifesté davantage ici par sa capacité à combattre l'élévation E /R induite par des peroxydes lipidiques [30] et la diminution du TAC [31]. Cependant, l'effet de I /R et MF sur GSH a montré la même tendance observée dans Nrf2 et HO-1 expression, où je /R causé, une augmentation subtile mais importante en GSH, un effet qui a été amplifié en outre par MF [32] . Cette action indique une réponse compensatoire possible contre I /R blessure et relie le GSH avec la voie de signalisation Nrf2 /HO-1 supporté jusqu'à présent par Das et al. [29]. La corrélation entre GSH et Nrf2 peut être liée à la diaphonie moléculaire entre la Nrf2 régulée positivement et γ-glutamyl ligase [10, 33], une enzyme qui catalyse l'étape de limitation de vitesse dans la synthèse GSH [34]. En outre, HO-1 rôle antioxydant provient de sa capacité à catalyser la dégradation de l'hème pro-oxydant dans le fer, la biliverdine, et monoxyde de carbone [35]; biliverdine est ensuite converti en bilirubine, qui agit comme un antioxydant contre la peroxydation lipidique [36]. En plus de réparer l'état redox perturbé, MF a étendu son effet d'entraîner le stress nitrosatif, aussi bien. MF oppose l'effet I /R sur les niveaux de eNOS /iNOS, où il rétablit l'activité de l'enzyme constitutive eNOS [37] et une diminution de l'isoforme inductible nocives [38]. Par conséquent, il est attendu que le niveau élevé de iNOS dans le groupe non traité est responsable du niveau de l'excédent de NOx, ce qui compromet l'intégrité de la muqueuse gastrique via Les événements délétères qui suivent l'I /R insulte comprennent la libération de médiateurs pro-inflammatoires ont augmenté et recrutement des leucocytes, en plus de perturber les oxydatives /machineries nitrosatif [42]. Dans l'étude actuelle, MF a validé son effet immuno-modulateur /anti-inflammatoire, qui a été documenté précédemment [25, 43], en inhibant l'IL-1β [43], E-sélectine [25] et l'infiltration de neutrophiles [44] dans d'autres différents modèles. Ces effets peuvent être liés en partie aux changements MF-modulatrices au niveau moléculaire. MF a induit l'expression du gène de PPAR-γ, ainsi que la régulation négative du parent inflammatoire facteur de transcription /médiateur de NF-kB, ce qui empêche, par conséquent, l'effet d'I /R. Des études antérieures ont rapporté que l'effet préjudiciable I /R est médiée partiellement via Auparavant Wu et al. [53] ont rapporté que PPAR-γ surexpression protège également le potentiel de membrane mitochondriale et empêche l'apoptose par régulation positive de l'expression des protéines de la famille Bcl-2 anti-apoptotiques. De même, le monoxyde de carbone, le sous-produit de l'activité HO-1, confère une activité anti-apoptotique par la régulation positive de la molécule anti-apoptotique Bcl-2, et la régulation négative du signal pro-apoptotique Bax [54]. Les données de l'étude ont démontré que I /lésions gastriques induites par R-est associé également à l'apoptose comme en témoigne la réduction marquée de Bcl-2 [55] et l'élévation de la caspase-3 [56], tandis que MF est revenue l'I /R l'apoptose induite par une élévation dépendante de Bcl-2 dose, et la réduction de la caspase-3. L'effet anti-apoptotique MF coïncide avec les résultats de Ghosh et al. [38] et peut être attribuée à la régulation positive MF à médiation par des niveaux d'ARNm de HO-1 PPAR-γ et /ou Tous ces résultats ont été reflétées en outre sur les changements histologiques. I /R insulte a provoqué l'excrétion de la couche protectrice de l'épithélium et a entraîné une hémorragie sous-jacente avec une congestion marquée des vaisseaux sanguins avec infiltration de cellules inflammatoires dans la lamina propria, un effet qui désigne la cessation du flux sanguin qui a été accompagnée d'oedème. La congestion des vaisseaux sanguins peut résulter de l'élévation du vasoconstricteur de l'endothéline-1 dans le tissu gastrique [57], l'augmentation de l'infiltration leucocytaire [58] et /ou une activité réduite de la eNOS comme indiqué dans la présente étude. Par conséquent, I /R était non seulement accompagné par la formation de radicaux libres, mais aussi avec une nette diminution dans les niveaux d'antioxydants endogènes et l'augmentation de l'infiltration de cellules inflammatoires, des modifications qui ont été entravés par MF, en particulier au niveau de dose élevé, où la normale histologique la structure a été observée. en ce qui concerne le médicament OMP de référence, qui exerce son effet gastroprotective par ses propriétés antioxydantes, anti-apoptotique [59], et anti-inflammatoire [60] actions, au-delà de la suppression de l'acide [61], nous avons délimité ici la les événements moléculaires qui contribuent à ces effets. Dans la présente étude, nous avons documenté que OMP effets antioxydants, comme en témoigne l'inhibition de la peroxydation lipidique et en augmentant les biomarqueurs de la défense, sont médiées via Bien que l'effet de OMP sur l'expression Nrf2 a dépassé celle de MF 20, mais le contraire est évident sur HO-1 et GSH, un écart qui peut être liés à leurs effets sur le NF-kB. Ce dernier a été prouvé pour agir comme un régulateur négatif de la voie Nrf2 en entrant en compétition avec lui pour la liaison au co-activateur de la transcription CREB binding protein (CBP) et aussi pour favoriser la liaison du co-répresseur de l'histone déacétylase 3 (HDAC3) à l'élément de réponse antioxydant (ARE) [62]; ces effets peuvent retarder la transcription médiée par Nrf2 de ses cibles en aval. En outre, la propriété anti-apoptotique de OMP invoqué non seulement sur sa capacité à augmenter le niveau de la protéine anti-apoptotique, Bcl-2 ou de diminuer le niveau de le marqueur apoptotique, caspase-3, tel que détecté dans la présente étude, mais aussi sur la réduction des dommages oxydatifs à l'ADN [59]. Enfin, on peut conclure que l'effet gastroprotective de MF, surtout à la dose de 20 mg /kg, peut être attribuée à l'activation de la voie Nrf2 /HO-1 anti-oxydant, la voie anti-inflammatoire PPAR-γ
ses activités de antisécrétoires et antioxydantes, tel que vérifié dans différents modèles animaux d'ulcération gastrique [15], mais pas le modèle I /R, qui est le but des travaux en cours. MF a été rapporté à médier son activité anti-oxydante, à différents niveaux de la séquence d'oxydation. Il génère des radicaux phénoxy MF et se lie aux ions métalliques (Fe 2 + /3 +) sous la forme d'un complexe MF-fer stable qui ne permet pas la génération d'hydroxyle (OH) des radicaux et /ou oxo-ferryl groupes et scavenges lipide peroxydé /les radicaux alcoxy, par conséquent, le maintien de l'équilibre à l'oxydation antioxydant cellulaire [16]. Malgré les réactions cellulaires détaillées décrites, cependant, les voies de signalisation moléculaires n'a pas été abordé auparavant.
. Avant d'expérimenter (24 heures) tous les animaux ont été maintenus individuellement dans de larges cages à fond de filet et à jeun. Les animaux ont été traités conformément aux lignes directrices approuvées par le soin et l'utilisation Comité des Faculté de pharmacie, Université du Caire, Le Caire, Egypte animale (Numéro de permis: PT 575). Tous les processus chirurgicales ont été réalisées sous anesthésie thiopental, et tous les efforts ont été faits pour minimiser la souffrance.
Médicaments
L'induction de l'ischémie de la muqueuse gastrique /reperfusion (I /R) et des traitements
sections
Estimation des paramètres d'homogénat /sérum en utilisant un ELISA technique
Estimation de l'activité gastrique /contenu de myéloperoxydase (MPO), malondialdéhyde (MDA), le glutathion réduit (GSH) et de l'oxyde nitrique total (NOx).
., 520 et 535 nm. Le procédé décrit par Ahmed et al. [22] a été adoptée pour évaluer les groupes sulfhydryle non protéiques (principalement GSH) par réaction avec le réactif de Ellman, après précipitation de la protéine SH-groupes. La réaction avec le réactif de Ellman formé une couleur jaune stable de l'acide 5 mercapto-2-nitrobenzoïque, qui a été mesurée par colorimétrie à 412 nm (mg /g)
.
quantitative en temps réel (RT) -PCR
L'analyse statistique
< 0,05.
Effet de
Effet de MF et OMP sur les paramètres redox
Effet de MF et OMP sur l'expression de l'ARNm de PPAR-γ et NF -κB gènes
Effet de MF et OMP sur les cytokines et les neutrophiles inflammatoires gastriques infiltration
Effet de MF et OMP sur les biomarqueurs apoptotiques
Effet de MF et OMP sur
son interaction avec l'anion superoxyde et la formation de peroxynitrite [39]. Ce dernier est un puissant radical libre qui perturbe les macromolécules cellulaires par peroxydation lipidique, l'altération mitochondriale directe, l'inhibition de la membrane Na + /K + - ATPase et la modification des protéines par oxydation [40]. Au contraire, la production MF-médiée de NOx peut être entraîné à partir des eNOS restaurés, et non iNOS, en soutenant, par conséquent, les antioxydants /libres propriétés antiradicalaires de MF [16]. Le NO de protection désaltère les radicaux libres avec la préservation conséquente de GSH dans la muqueuse gastrique; GSH agit à la fois en tant que piégeur nucléophile de superoxydes et comme un cofacteur dans la réduction GSH peroxydase médiée par des peroxydes d'hydrogène [41].
supprimer la PPAR-γ ARNm [7, 45], ce qui est un facteur de transcription qui agit comme un régulateur pléiotrope influent anti-inflammation, antioxydant, et les processus de nettoyage phagocytaires médiée. Outre son effet génomique directe, PPARy a été trouvé pour interagir négativement avec d'autres facteurs de transcription comme NF-kB, qui sous-tend de nombreux aspects de l'effet anti-inflammatoire /immunomodulateur de PPARy [25, 46], les faits que le ton avec nos conclusions. En outre, l'expression accrue de PPARy a été signalé à inhiber la production de NOx /iNOS [47], l'offre, ainsi, une explication pour l'inhibition MF-médiée par iNOS. PPARy empêche également les macrophages axée sur des cytokines et des molécules d'adhésion leucocytaire, comme on le voit ici, partiellement
par la suppression de l'expression du gène de NF-kB [25, 48]. En outre, MF a été signalé pour réduire l'adhérence des PMN à l'endothélium et gardée contre leur infiltration dans le tissu gastrique [49], parallèlement à la modulation de PPAR-γ et de l'expression du NF-kB. Ces résultats appuient la nôtre sur E-sélectine, iNOS et MPO, comme mentionné précédemment. En outre, le MF-induite HO-1 surexpression peut rationaliser le caractère anti-inflammatoire de MF, via
son monoxyde de carbone sous-produit, ce qui confère une propriété anti-inflammatoire [50]. À cette fin, les résultats expérimentaux de notre étude identifient un autre mécanismes gastroprotective aux niveaux moléculaires et cellulaires par lesquels MF protégée muqueuse gastrique contre I blessures /induite par R. Ces résultats corroborent les conclusions d'études antérieures dans un modèle expérimental de colite [51, 52], et épingler l'action anti-inflammatoire de la MF.
la voie de signalisation Nrf2 /HO-1. OMP a également inhibé la cytokine pro-inflammatoire IL-1β, ainsi que l'adhésion des neutrophiles et à l'infiltration comme représenté en réduisant le niveau sE-sélectine et de l'activité MPO, respectivement. Bien que les OMP downregulated l'expression du NF-kB, mais il ne pouvait pas lutter contre l'effet d'E /R PPAR-γ, ce qui suggère que l'effet anti-inflammatoire immuno-modulatrices /OMP découle de la suppression de l'expression du gène NF-kB, et éventuellement d'autres mécanismes, mais pas celle de PPAR-γ
.
via la régulation négative de NF-kB, et l'augmentation de la protéine anti-apoptotique Bcl 2 et la diminution de la caspase-3. Tous ces mécanismes enfin maintenir l'intégrité de la barrière muqueuse gastrique normale.
 Les microbiomes intestinaux et oraux prédisent la gravité du COVID-19
Les microbiomes intestinaux et oraux prédisent la gravité du COVID-19
 Champignons portobello farcis au poulet SCD
Champignons portobello farcis au poulet SCD
 Le Pepto-Bismol ou le Kaopectate peuvent-ils noircir vos selles ?
Le Pepto-Bismol ou le Kaopectate peuvent-ils noircir vos selles ?
 Une nouvelle étude pourrait aider à prévenir les infections mortelles chez les bébés
Une nouvelle étude pourrait aider à prévenir les infections mortelles chez les bébés
 Génétique :avez-vous une condamnation à mort prédéterminée ?
Génétique :avez-vous une condamnation à mort prédéterminée ?
 30 minutes de yoga pour la digestion
30 minutes de yoga pour la digestion
 Conseils pour adopter une approche saine pour le Nouvel An
Résumé :Améliorez votre santé digestive en cette nouvelle année en établissant des habitudes saines, comme arrêter de fumer, faire de lexercice régulièrement et manger plus de fibres. Une tradition
Conseils pour adopter une approche saine pour le Nouvel An
Résumé :Améliorez votre santé digestive en cette nouvelle année en établissant des habitudes saines, comme arrêter de fumer, faire de lexercice régulièrement et manger plus de fibres. Une tradition
 Dégradation du foie et de l'alcool
Le foie est votre plus grand organe interne, pesant environ 1,5 kg chez ladulte. Votre foie se trouve juste sous vos côtes dans la partie supérieure droite de votre abdomen. Il exécute plus de 500 fon
Dégradation du foie et de l'alcool
Le foie est votre plus grand organe interne, pesant environ 1,5 kg chez ladulte. Votre foie se trouve juste sous vos côtes dans la partie supérieure droite de votre abdomen. Il exécute plus de 500 fon
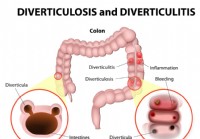 3 problèmes digestifs signalés par des douleurs abdominales
Veuillez tenir compte de la douleur de ces maladies Certains problèmes digestifs sont facilement résolus, sans avoir besoin de soins professionnels. Dautres conditions sont plus complexes, nécessitan
3 problèmes digestifs signalés par des douleurs abdominales
Veuillez tenir compte de la douleur de ces maladies Certains problèmes digestifs sont facilement résolus, sans avoir besoin de soins professionnels. Dautres conditions sont plus complexes, nécessitan