Sfondo
L'infezione da Helicobacter pylori Metodologia /Principali risultati Utilizzando un modello murino di infezione e biopsie gastriche di 29 individui, abbiamo analizzato il reclutamento dei macrofagi e polarizzazione durante H. pylori Conclusioni /Significato Questi risultati indicano che la vaccinazione dei topi contro H. pylori Visto:. Quiding-Järbrink M, S Raghavan, Sundquist M (2010) avanzato M1 macrofagi polarizzazione umana Helicobacter pylori Editor: Niyaz Ahmed, Università di Hyderabad, India Ricevuto: 26 agosto 2010; Accettato: 7 ottobre 2010; Pubblicato: 23 Novembre 2010 Copyright: © 2010 Quiding-Järbrink et al. Questo è un articolo ad accesso libero distribuito sotto i termini della Creative Commons Attribution License, che permette l'uso senza restrizioni, la distribuzione e la riproduzione con qualsiasi mezzo, a condizione che l'autore originale e la fonte sono accreditati Finanziamento:. Questo studio è stato sostenuto dal centro di eccellenza MIVAC, finanziato dalla Fondazione svedese per la ricerca strategica, la Adlerbert Research Foundation, Wilhelm & fondazione di Martina Lundgren, Inga-Britt & fondazione di Arne Lundberg, e l'Ospedale Universitario Sahlgrenska. I finanziatori avevano alcun ruolo nel disegno dello studio, la raccolta e l'analisi dei dati, la decisione di pubblicare, o preparazione del manoscritto Competere interessi:.. Gli autori hanno dichiarato che non esistono interessi in competizione Introduzione Helicobacter pylori Una risposta pro-infiammatoria forte è associata ad un aumento dei livelli di reattive dell'ossigeno e dell'azoto specie nella mucosa gastrica [3], che possono promuovere lo sviluppo del cancro [4]. Ad esempio, i topi infettati con H. pylori macrofagi M1 di solito prendono parte alla risposta immunitaria iniziale per l'invasione dei microrganismi e promuovere T helper (Th) 1 immunità, mentre i macrofagi M2 sono indotti durante la fase di risoluzione dell'infiammazione e sono coinvolti in macerie scavenging, rimodellamento dei tessuti, e la promozione di Th2 immunità [8], [9]. Polarizzazione dei macrofagi è diretto dal microambiente. macrofagi M1 sono indotte da interferone-gamma e microbici prodotti come lipopolisaccaride [9]. D'altra parte, i macrofagi M2 sono indotte da Th2- o citochine anti-infiammatorie e fattori di crescita, tra IL-4, IL-10 e TGF-β [8], [9]. Durante H. pylori Aumento della frequenza di macrofagi, eosinofili e neutrofili nella mucosa gastrica dopo H. pylori Il reclutamento di cellule innate al sito di infezione è un prerequisito per il controllo infettive. Non solo è possibile innata cellule, come i macrofagi e neutrofili, partecipare uccisione batterica; producono anche mediatori infiammatori, che ha fissato le basi per la risposta immunitaria conseguente. Per studiare l'accumulo di cellule innate nella mucosa gastrica durante H. pylori Gli eosinofili sono stati definiti come CD11b + Fig. 1C Siglec-F + cellule (, [17]). Queste cellule espresso livelli intermedi di F4 /80 e aveva un profilo di dispersione lato alto quando analizzata mediante citometria di flusso (Fig. 1E). Violetto cresolo colorazione dei ordinato CD11b + Siglec-F + cellule confermato eosinofili morfologia (Fig. 1C). La frequenza di eosinofili nella mucosa gastrica è stato raddoppiato dopo otto settimane e ha ulteriormente aumentato dopo 26 settimane di infezione (Fig. 1F). I neutrofili sono stati definiti come CD11b + Gr1 + cellule (Fig . 1D). Dal momento che l'anticorpo Gr1 riconosce sia l'epitopo Ly6C e Ly6G abbiamo confermato che tutti CD11b + Gr1 + cellule esprimono il marcatore neutrofili specifica Ly6G (Fig. 1D ed E). La frequenza di neutrofili aumentato di 10 volte otto settimane dopo l'infezione ed è stata ulteriormente aumentata dopo 26 settimane (Fig. 1F). Così, durante H. pylori Caratterizzazione gastrica DC Per caratterizzare DC gastrici, abbiamo identificato per la prima di una popolazione di CD11c + MHC-II + cellule (Fig. 2A). Quando queste cellule sono state ulteriormente analizzate per l'espressione di F4 /80 e la catena αE integrina CD103, la metà del CD11c + MHC-II + cellule sono stati identificati come F4 /80 + macrofagi (Fig. 2A ). Tuttavia, tra il CD11c + MHC-II + cellule che mancavano espressione di F4 /80, due popolazioni di cellule dendritiche putativi con l'espressione differenziale delle CD103 potrebbero essere distinti (Fig. 2A). A causa delle numerose richieste fluorocromi abbiamo scelto di caratterizzare solo il gastrico CD103 + Al fine di indagare i possibili effetti di H. pylori M1 polarizzazione dei macrofagi gastrici durante H. pylori Dal momento che i nostri risultati suggeriscono che i macrofagi gastrica potrebbero non essere pienamente attivate durante H. pylori per identificare la fonte di iNOS e CXCL11 nella mucosa gastrica, i macrofagi (CD11b + Gr1 -Siglec-F -MHC-II +), eosinofili (CD11b + Gr1 -Siglec-F + MHC-II -) e le restanti celle dopo Soppressione macrofagi ed eosinofili (CD11b - e CD11b + Gr1 +) sono stati ordinati dal pool cellule della lamina propria gastrici dei topi infettati con H. pylori network per 26 settimane (Fig. 4b). L'espressione di mRNA di iNOS e CXCL11 in popolazioni di cellule ordinati da topi infetti così come in cellule totali gastrico della lamina propria da topi sia ingenuo e infetto è stato quindi determinato mediante real-time PCR. Un numero sufficiente di macrofagi ordinati non poteva essere ottenuto da topi naive per l'analisi attendibile di espressione dell'mRNA. macrofagi gastrico hanno espresso il massimo livello di iNOS e CXCL11 rispetto alle altre popolazioni di cellule selezionate in cellule totali gastrici della lamina propria prima di ordinamento (Fig. 4C). Presi insieme, questi risultati mostrano che i macrofagi gastrici sono polarizzati a M1 durante la H. pylori La vaccinazione contro la H. pylori vaccinazione protettiva contro il H. pylori Inoltre, abbiamo analizzato la frequenza dei macrofagi nella mucosa gastrica dei topi immunizzati e verificate da citometria a flusso. Rispetto al infetti soli topi, topi immunizzati hanno avuto un significativo aumento della frequenza di macrofagi gastrici tre settimane dopo la sfida (Fig. 5C). Tuttavia, nonostante che i macrofagi sono stati reclutati per la mucosa gastrica dei topi immunizzati e sfidato, i macrofagi non hanno upregulate l'espressione di CD86 o MHC-II rispetto a infettato solo topi (Fig. 5D). Questi risultati mostrano che dopo la vaccinazione di successo con H. pylori Aumento dei macrofagi M1 polarizzazione umana gastrite atrofica Abbiamo poi studiato il ruolo di H. pylori Per verificare se la aumentata espressione di mRNA di marcatori M1 e M2 si traduce anche in un aumento dei livelli di proteine, proteine totali sono stati estratti da biopsie antrali e la concentrazione di iNOS e CCL18 è stato determinato mediante ELISA. biopsie gastriche da individui con gastrite atrofica era disponibile solo per l'estrazione di proteine da un volontario, che viene differenziale indicato nella figura 6B. La metà del H. pylori Nel loro insieme, questi risultati indicano la presenza di entrambi i macrofagi M1 e M2 nella mucosa gastrica di H. pylori In questo studio abbiamo investigato la polarizzazione di gastrica macrofagi durante H cronica. pylori A differenza di umana H . pylori osservato un reclutamento sequenziale di cellule innate alla mucosa gastrica dei topi SS1-infettati, con i macrofagi accumulare piuttosto tardi nel corso di infezione (26 settimane). Al contrario, le frequenze dei neutrofili gastrici ed eosinofili nella mucosa gastrica aumentati otto settimane dopo l'infezione e rimasta elevata a 26 settimane. L'accumulo di macrofagi verificato molto più veloce in topi vaccinati, nel qual caso la frequenza dei macrofagi gastrica è stata aumentata già tre settimane dopo il challenge. In precedenza, i neutrofili hanno dimostrato di essere reclutati per la mucosa gastrica dei topi SS1-infettati in due fasi, una fase precoce picco 1-2 giorni dopo l'infezione e una fase tardiva con inizio alle 2-3 settimane dopo l'infezione [24]. Un modello di reclutamento, simile a quella dei neutrofili, è stato anche descritto per macrofagi gastriche [24]. Tuttavia, i macrofagi sono stati definiti come CD11b + Gr1 - le cellule [24], una popolazione di cellule che nelle nostre mani è costituito principalmente da eosinofili (vedi Fig 1 e 2.). Asim et al. macrofagi definiti come CD11b + F4 /80 + cellule, e osservato un picco all'inizio del numero di macrofagi nella mucosa gastrica 1-2 giorni dopo l'infezione con H. pylori Siamo stati in grado di identificare due popolazioni di cellule dendritiche nella mucosa gastrica dei topi. Entrambi i sottoinsiemi esprimono alti livelli di CD11c e MHC-II, mancavano espressione del marcatore macrofagi F4 /80, ma differivano per quanto riguarda l'espressione del CD103. La frequenza di gastrico CD103 + DC non è cambiata dopo quattro, otto o 26 settimane di H. pylori Nonostante che i macrofagi M1 tipicamente upregulate MHC-II e molecole co-stimolatorie, non abbiamo potuto rilevare un aumento dell'espressione di MHC -II o CD86 sui macrofagi gastriche o CD103 + DC da entrambi i topi non immunizzati o immunizzati dopo l'infezione. Al contrario, in vitro incubazione di H. pylori Durante le risposte infiammatorie acute, i macrofagi sono in genere polarizzati per M1 ed esercitare potenti effetti anti-microbici. Ad esempio, l'infezione con Salmonella typhimurium Listeria monocytogenes fare macrofagi contribuiscono ad ospitare la difesa contro H. pylori In conclusione, questo studio dimostra che la vaccinazione dei topi contro H. pylori Materiali e Metodi Etica dichiarazione Lo studio è stato approvato dal comitato etico degli animali governo (Göteborgs djurförsöksetiska nämnd, 328/2008 e 254 /2009). L'etica umana comitato regionale di Västra Götaland in Svezia (706/03 e 85/06) ha approvato lo studio, e il consenso informato scritto è stato ottenuto da tutti i partecipanti. Questa è l'unica autorità che dà il permesso etica per la ricerca sugli esseri umani in Svezia, e non è direttamente associato ad ospedali o università. femminile C57BL /6 topi sono stati acquistati da Charles River Laboratories (Sulzfeld, Germania), o, nel caso degli esperimenti di vaccinazione da Taconic (Ejby, Danimarca). I topi sono stati infettati in età di 8-12 settimane. H. pylori I topi sono stati dati quattro 10 dosi microlitri di 500 mg H. pylori La valutazione della colonizzazione batterica Per la valutazione quantitativa della colonizzazione batterica in esperimenti di immunizzazione, la metà dello stomaco è stato delicatamente lavato con PBS e omogeneizzato utilizzando un omogeneizzatore Ultra Turrax ( IKA Technology Laboratory, Staufen, Germania). diluizioni seriali del omogenato sono stati piastrati su piastre di agar Skirrow. Quando le cellule lamina propria gastrica sono stati isolati da tutta stomaco non è stato possibile eseguire una stima quantitativa della carica batterica gastrica. In questo caso, lo stomaco, che è stato tagliato lungo la grande curvatura e lavato in PBS, è stato gentilmente striato su piastre di agar Skirrow. La presenza di H. pylori L'isolamento di cellule lamina propria gastrico Lo stomaco ghiandolare è stato tagliato in pezzi di 5 mm e incubato per un totale di tre volte con H.
innesca un'infiammazione gastrica cronica che può progredire a atrofia e adenocarcinoma gastrico. Polarizzazione dei macrofagi è una caratteristica sia cancro e infezioni, e può promuovere la progressione della malattia o la risoluzione. Tuttavia, il ruolo dei macrofagi e loro polarizzazione durante H. pylori
infezione non è stato ben definito.
infezione mediante citometria di flusso e la PCR in tempo reale. Abbiamo trovato un reclutamento sequenziale di neutrofili, eosinofili e macrofagi per la mucosa gastrica dei topi infettati. Analisi dell'espressione genica dei tessuti dello stomaco e macrofagi ordinati rivelato che i macrofagi gastrici sono stati polarizzati per M1 dopo H. pylori
infezione, e questo processo è stato notevolmente accelerato dalla prima vaccinazione. Umana H. pylori
infezione è stata caratterizzata da un misto M1 /M2 polarizzazione dei macrofagi. Tuttavia, in H. pylori
gastrite atrofica -associated, l'espressione di ossido nitrico sintasi inducibile è stata notevolmente aumentata rispetto a gastrite complicata, indicativo di una maggiore M1 macrofagi polarizzazione in questa lesione pre-maligne.
amplifica M1 polarizzazione dei macrofagi gastrici, e che una simile maggiore M1 polarizzazione è presente in umano H. pylori
indotta gastrite atrofica
-Associated gastrite atrofica e in I topi vaccinati. PLoS ONE 5 (11): e15018. doi: 10.1371 /journal.pone.0015018
colonizzano l'epitelio dello stomaco di oltre la metà della popolazione del mondo [1]. L'infezione è spesso vita lunga ed attiva una infiammazione cronica della mucosa gastrica, che in circa il 1-2% degli individui infettati casualmente sviluppa in adenocarcinoma gastrico [1]. Sviluppo del cancro gastrico, in particolare il tipo intestinale, è un processo in più fasi che progredisce decenni attraverso lesioni precancerose nella mucosa gastrica, come gastrite atrofica, metaplasia intestinale e displasia [2]. Il risultato dell'infezione dipende dalla virulenza del infettare H. pylori
ceppo, fattori ambientali come il fumo e la dieta, e ospitare i fattori genetici che influenzano il tipo e l'intensità della risposta infiammatoria [1].
per sei mesi hanno un aumento della frequenza di mutazioni gastrici rispetto ai topi non infetti [5]. Inoltre, i topi che sono carenti per l'enzima ossido nitrico sintasi inducibile (iNOS) hanno una ridotta incidenza di cancro gastrico dopo H. pylori
infezione e cancerogena sfida rispetto ai topi normali [6]. Mentre iNOS contribuisce allo sviluppo del cancro gastrico, un elevato livello di CCL18 chemochine nei tumori gastrici è associato ad una sopravvivenza prolungata di pazienti affetti da cancro gastrico [7]. È interessante notare che, iNOS è prodotto da classicamente attivati macrofagi M1 /considerando che la produzione CCL18 è un marchio di garanzia per alternativamente attivati macrofagi /m2 [8]. Presi insieme, questi risultati suggeriscono che la polarizzazione dei macrofagi può avere un ruolo importante nello sviluppo di H. pylori
-associated cancro gastrico.
infezione, i macrofagi sono assunti per la mucosa gastrica, dove contribuiscono alla produzione di citochine pro-infiammatorie e chemochine [10], [11], [12], [13], [14], [15] . Inoltre, un recente studio ha dimostrato che la deplezione liposomi mediata dei macrofagi ridotto patologia gastrica in H. pylori
topi -infected [16]. Nonostante ciò, la funzione dei macrofagi in vivo durante H. pylori
infezione rimane relativamente poco definito. La funzione dei macrofagi è intimamente accoppiato al loro stato di polarizzazione, che sembra avere un ruolo nello sviluppo del cancro gastrico [6], [7]. Pertanto, abbiamo esaminato macrofagi polarizzazione nella mucosa gastrica di H. pylori
topi -infected e gli esseri umani. Abbiamo dimostrato che la vaccinazione dei topi contro H. pylori
velocità ed amplifica M1 polarizzazione dei macrofagi gastrici. Inoltre, la gastrite atrofica lesioni pre-cancerose è caratterizzato da un macrofago maggiore M1 polarizzazione negli esseri umani.
Risultati
infezione
infezione, abbiamo infettato C57BL 6 topi /con il mouse-adattato H. pylori
Sydney ceppo 1 (SS1), e dopo quattro, otto e 26 settimane abbiamo analizzato l'infiltrato infiammatorio gastrico di topi individuale multicolore citometria a flusso. Il numero totale di cellule lamina propria isolati dallo stomaco non cambia durante le prime quattro settimane di infezione, ma a otto settimane dopo l'infezione è stato raddoppiato il numero totale di cellule isolate, ed a 26 settimane di infezione si è verificato un aumento di otto volte del numero totale di cellule isolate rispetto ai topi non infetti (Fig. 1A). Tra le cellule che vengono selezionate per lo stomaco erano macrofagi, eosinofili e neutrofili. macrofagi gastrico sono stati identificati come cellule che esprimono CD11b e complesso maggiore di istocompatibilità di classe II (MHC-II), ma manca l'espressione di Gr1 (marker neutrofili), CD103 (espressi da un sottogruppo di cellule dendritiche (DC)) e immunoglobuline acido sialico-binding come lectina (Siglec-F, marcatore eosinofili) (Fig. 1B). Queste cellule esprimono il marcatore macrofagi F4 /80 (Fig. 1E), e sulla base della morfologia cellulare sono stati confermati come macrofagi (Fig. 1B). La frequenza dei macrofagi nella mucosa gastrica rimasto invariato dopo quattro e otto settimane di H. pylori
infezione (Fig. 1F). Tuttavia, dopo 26 settimane la frequenza dei macrofagi gastrico è stato un aumento rispetto ai topi non infetti (Fig. 1F).
infezione c'è un accumulo sequenziale di neutrofili ed eosinofili, seguiti dai macrofagi nella lamina propria gastrica.
DC ulteriormente, dal momento che queste cellule sono stati implicati come importante cellule presentanti l'antigene nei tessuti della mucosa [18]. Gastrico CD103 + DC sono stati facilmente identificati mediante colorazione per CD11c e CD103 (Fig. 2B). Il gastrica CD103 + DC esprimono alti livelli di MHC-II, e consisteva in un CD11b basso e un CD11b alta sottoinsieme (Fig. 2C). In confronto, il gastrico CD103 - DC erano tutti CD11b alto (Fig 2D.). Inoltre, il CD103 + DC mancava espressione di CD8α e F4 /80 (Fig. 2C). Tuttavia, la frequenza di CD103 + DC non è cambiata in modo significativo nella mucosa gastrica dopo l'infezione (Fig. 2E).
macrofagi gastrica e CD103 + DC non riescono a upregulate molecole costimolatorie dopo H. pylori
infezione
infezione l'espressione di molecole co-stimolatorie e MHC-II da parte dei macrofagi gastrici e CD103 + DC, l'espressione di questi marcatori è stata analizzata mediante citometria a flusso, dopo quattro, otto e 26 settimane di infezione. Allo stato stazionario, macrofagi e CD103 + DC nella lamina propria gastrica espresso simili livelli della molecola CD86 costimolazione così come MHC-II (Fig. 3A). Sorprendentemente, l'espressione di CD86 e MHC-II da entrambi i macrofagi gastriche o CD103 + DC non è stato aumentato dopo l'infezione con H. pylori
rispetto a topi naive pari età analizzati in parallelo (Fig. 3B). Così, macrofagi e CD103 + DC nella lamina propria gastrica non riescono a upregulate CD86 e MHC-II dopo H. pylori
infezione, nonostante la risposta infiammatoria in corso.
infezione
infezione, abbiamo caratterizzato queste cellule ulteriormente indagando la loro polarizzazione M1 /M2. Per determinare la polarizzazione dei macrofagi durante H. pylori
infezione, abbiamo usato real-time PCR per misurare l'espressione di geni associati con M1 o M2 polarizzazione dei macrofagi nel tessuto gastrico [8], [9]. Abbiamo anche misurato l'espressione di IL-10, che può essere prodotta dai macrofagi regolamentazione [9]. Nessuno dei marcatori analizzati erano espressi in modo differenziale quattro settimane dopo la H. pylori
infezione rispetto ai topi naive (Fig. 4A). A otto settimane dopo l'infezione l'espressione della M1 marcatori iNOS e CXCL11 era significativamente aumentata, e questi marcatori sono stati ulteriormente upregulated a 26 settimane di infezione (Fig. 4a). Inoltre, l'espressione di IL-10 è stato upregulated in otto e 26 settimane di infezione rispetto a topi naive (Fig. 4A). Al contrario, i marcatori M2 trovano nella zona infiammatoria 1 (FIZZ1) e arginase-1 non erano differenzialmente espressi nello stomaco a quattro, otto o 26 settimane di infezione rispetto ai topi naive (Fig. 4A).
infezione.
amplifica macrofagi M1 polarizzazione
è generalmente associata con il rapido sviluppo di una risposta Th1 gastrica [19]. Dal momento che la citochina Th1 interferone-γ induce macrofagi M1 polarizzazione [9], abbiamo esaminato se la vaccinazione potrebbe influenzare la polarizzazione dei macrofagi durante H. pylori
infezione. A tal fine, i topi sono stati immunizzati per via sublinguale con H. pylori
lisato e tossina del colera adiuvante, e successivamente ha sfidato con H. pylori
SS1. Questo regime di immunizzazione ha comportato una significativa riduzione della carica batterica nello stomaco quattro settimane dopo il challenge (Fig. 5A). Allo stesso tempo, l'espressione di marcatori M1 e M2 nello stomaco è stato analizzato mediante PCR in tempo reale. Nei topi immunizzati, solo l'espressione di CXCL11 era significativamente upregulated quattro settimane dopo l'infezione rispetto ai topi naive (Fig. 5B). Al contrario, i topi immunizzati hanno mostrato una grande upregulation sia della M1 marcatori iNOS e CXCL11 mentre l'espressione della M2 marcatori FIZZ1 e arginase-1 non è stata modificata, quattro settimane dopo il challenge (Fig. 5B). L'aumentata espressione di iNOS e CXCL11 in immunizzati topi /contestata non era dovuto solo l'immunizzazione, poiché immunizzati ma i topi non-sfidati non ha modificato l'espressione di uno qualsiasi dei marcatori M1 o M2 analizzati rispetto ai topi completamente non trattati (dati non mostrati ).
lisato e tossina del colera, i macrofagi si accumulano nella mucosa gastrica e stanno rapidamente polarizzata a M1 dopo l'infezione.
infezione e gastrite atrofica per la polarizzazione dei macrofagi nella mucosa gastrica umana. A tal fine, l'espressione di marcatori umani M1 (iNOS, CXCL11) e M2 (CCL17, CCL18, CD206) è stata misurata nelle biopsie da dell'antro mediante real-time PCR. H. pylori
individui -infected con gastrite complicata mostrato una espressione significativamente elevati di mRNA sia per M1 (iNOS, 8 volte, CXCL11, 20 volte) e marcatori M2 (CCL17, 30 volte; CCL18, 70 volte, CD206 , 2 volte) rispetto ai volontari non infetti (Fig. 6a). Tuttavia, gli individui con gastrite atrofica (4/6 avevano metaplasia intestinale oltre ad atrofia) esprimono livelli ancora più elevati di iNOS mRNA rispetto a quelli con gastrite complicata (20 volte), mentre CXCL11 e marcatori di M2 polarizzazione sono stati espressi in modo simile (fig. 6A). In effetti, l'espressione di iNOS era 180 volte maggiore nei soggetti con gastrite atrofica rispetto ai controlli non infetti (Fig. 6A), indicando una maggiore polarizzazione dei macrofagi M1 gastrico nei pazienti con gastrite atrofica.
individui -infected avevano livelli rilevabili di proteina iNOS nella antro mentre la concentrazione di iNOS è stato al di sotto del limite di rilevabilità in tutti gli individui non infetti (Fig. 6b). L'espressione di iNOS mRNA e proteina iNOS era significativamente correlata (R 2 = 0.88, P
< 0.01) indica che l'analisi mRNA riflette l'espressione della proteina, anche quando i livelli di proteine sono bassi. La concentrazione del marcatore CCL18 M2 è aumentata nel tessuto gastrico da H. pylori
individui -infected rispetto ai controlli non infetti (Fig. 6b). Inoltre, la concentrazione di proteine CCL18 è risultata significativamente correlata con l'espressione di CCL18 mRNA (R 2 = 0,754, P
< 0,01).
individui -infected. Inoltre, gastrite atrofica è associato con una forte amplificazione espressione iNOS nella mucosa gastrica, indicando una maggiore M1 polarizzazione dei macrofagi.
Discussione
infezione. Abbiamo dimostrato che H. pylori
individui -infected esprimono mRNA nella mucosa gastrica indicativo di un misto M1 /M2 polarizzazione dei macrofagi, e questo è stata ulteriormente confermata a livello proteico. Tuttavia, in H. pylori
indotta gastrite atrofica c'è stato un marcato aumento nell'espressione di iNOS rispetto al gastrite semplice. gastrite atrofica conferisce un aumento del rischio di sviluppare il cancro gastrico rispetto al semplice H. pylori
gastrite -associated [20]. L'aumentata espressione di iNOS in gastrite atrofica può contribuire allo sviluppo del cancro gastrico mediante la produzione di specie reattive, che possono promuovere la carcinogenesi per induzione di danno al DNA, interruzione di riparazione del DNA, modificazioni post-traslazionale di proteine, e mutazioni di p53 [4]. Infatti, i topi iNOS con deficit hanno una ridotta incidenza di adenocarcinoma gastrico dopo H. pylori
infezione e sfida con un cancerogeno chimico rispetto ai topi normali [6]. Inoltre, polimorfismi nella regione promotore di iNOS, che portano ad una maggiore attività trascrizionale, correlano con una più alta incidenza di tipo intestinale del cancro gastrico in donne giapponesi [21].
infezione, SS1-infettati C57BL /6 topi ha mostrato un profilo di espressione genica nella mucosa gastrica indicativo di macrofagi M1 polarizzazione. analisi di espressione genica dei macrofagi ordinati isolati dalla mucosa gastrica dei topi infettati ha confermato che l'espressione della M1 marcatori iNOS e CXCL11 è arricchita nella popolazione macrofagi ordinato. Inoltre, la polarizzazione M1 dei macrofagi gastrici stato sostanzialmente accelerato dalla prima vaccinazione. Già quattro settimane dopo la sfida, i topi immunizzati upregulated l'espressione di iNOS e CXCL11 ad un livello simile a quello visto dopo 26 settimane di infezione da soli topi. Gli studi di topi iNOS-deficienti hanno mostrato che iNOS promuove lo sviluppo di atrofia e cancro nella mucosa gastrica durante Helicobacter
infezione [6], [22]. Inoltre, la clearance di H. pylori
dopo la vaccinazione si verifica indipendentemente iNOS [23]. Così, iNOS sembra contribuire ad ospitare patologia piuttosto che protezione durante l'infezione con H. pylori
. Pertanto, se la produzione maggiore di iNOS nella mucosa gastrica viene mantenuta dopo la vaccinazione, può essere un effetto collaterale indesiderato che può aumentare la gravità della H. pylori
infiammazione indotta e malignità, a meno che non si ottiene l'immunità sterile. Tuttavia, il contributo relativo di iNOS per ospitare patologia contro la protezione durante le diverse fasi di H. pylori
garantisce infezione ulteriori indagini.
[15]. Inoltre, il numero dei macrofagi è stata nuovamente aumentata a 60 e 120 giorni dopo l'infezione rispetto ai topi naive [15]. Estendiamo questi risultati dimostrando che l'assunzione di queste popolazioni di cellule innate viene mantenuto fino a 26 settimane dopo l'infezione. Inoltre, descriviamo l'accumulo di eosinofili nella mucosa gastrica, una popolazione di cellule che superano di gran lunga i macrofagi gastriche e neutrofili (Fig. 1). Infatti, il ruolo di eosinofili in H. pylori
gastrite indotta dovrebbe essere studiata ulteriormente. Eosinofili e macrofagi quota espressione di diversi marcatori, tra cui CD11b e F4 /80 (Fig. 1, [25]). Pertanto, più marcatori devono essere analizzati contemporaneamente al fine di distinguere queste popolazioni di cellule innate.
infezione. In contrasto con il nostro studio, un recente studio di Kao et al. non poteva rilevare CD103 + DC nella mucosa gastrica dei topi infetti [26]. Piuttosto, il CD103 + DC è emerso 24 ore dopo il H. pylori
infezione. Dal momento che i tempi di analisi differiscono tra questo studio e nostri esperimenti, è difficile confrontare direttamente i risultati.
con monociti umani [27], DC derivate da monociti umani [28], [29], [30], [31], osso murino DC derivate dal midollo [32], [33], o umano gastrici primaria DC [34], induce sovraregolazione delle molecole co-stimolatorie e MHC-II. Pertanto la mancata upregulate MHC-II e CD86 sui macrofagi gastrici e CD103 + DC in H cronica. pylori
infezione può essere causata dall'ambiente infiammatorio e non dai batteri per sé. Infatti, l'interazione tra PVS e H. pylori
in vitro non necessariamente riflettere ciò accade in vivo, in cui il microambiente locale nel sito di acquisizione e presentazione dell'antigene dell'antigene nonché il sottoinsieme DC coinvolti nella presentazione dell'antigene di H. pylori
, influenzerà la risposta. Ad esempio, le cellule T regolatorie, che sono prevalenti nel H. pylori
mucosa gastrica -infected [35], [36], può impedire l'up-regolazione delle molecole co-stimolatorie e MHC-II sulla DC [37]. Inoltre, IL-10 può impedire l'up-regolazione delle molecole co-stimolatorie e MHC-II sui macrofagi e DC [38].
induce M1 polarizzazione dei macrofagi, che è richiesto per il controllo delle infezioni [39]
o. Risoluzione di infiammazione è caratterizzata da uno spostamento di polarizzazione macrofagi M2, che promuove la guarigione dei tessuti. pazienti affetti da tubercolosi mostrano un aumento della produzione di citochine Th2 Con il progredire dell'infezione [40], [41], che può indurre M2 polarizzazione dei macrofagi. Nei topi, M1 polarizzazione dei macrofagi costituisce la risposta presto per Mycobacterium tuberculosis
, mentre macrofagi alveolari sono polarizzati a M2 durante l'infezione fase avanzata [42]. Tuttavia, il cambiamento di polarizzazione dei macrofagi indotta da infezioni croniche, spesso si traduce in una ridotta capacità dei macrofagi per uccidere i batteri invasori [39], [43]. D'altra parte, l'infiammazione cronica con persistente M1 macrofagi polarizzazione è associata ad un aumentato rischio di sviluppo del cancro [4].
? A differenza di neutrofili, macrofagi non sono spesso visti nel lume gastrico dopo la traslocazione attraverso l'epitelio [44]. Dal momento che H. pylori
preferenzialmente risiede nello strato di muco gastrico o sono attaccati alle cellule epiteliali gastriche, macrofagi non possono entrare in contatto diretto con i batteri interi. In effetti, l'esaurimento dei macrofagi di liposomi droga-caricato avuto alcun effetto sulla H. pylori
colonizzazione [16], suggerendo che i macrofagi possono non contribuire direttamente ad ospitare la difesa contro H. pylori
. Al contrario, i macrofagi possono promuovere la patologia gastrica. Ad esempio, l'esaurimento liposomi mediata dei macrofagi migliorato la gastrite indotta da H. pylori
infezione [16]. Inoltre, la cancellazione selettiva di β I-kB-chinasi nelle cellule mieloidi, che impedisce l'attivazione di NF-kB in queste cellule, inibisce lo sviluppo di atrofia gastrica dopo H. felis
infezione [45]. Così, i macrofagi non sembrano contribuire a Helicobacter
spazio, ma possono piuttosto promuovere la patologia gastrica
.
amplifica M1 polarizzazione dei macrofagi gastrici. Un fenomeno simile è visto in gastrite atrofica umana dove il misto M1 /M2 polarizzazione presente nella gastrite complicata è sostituita da una polarizzazione M1-dominato. Ciò può indurre un tumore-promuovere l'infiammazione, e spostando la polarizzazione dei macrofagi da M1 a M2 potrebbe quindi rappresentare un bersaglio terapeutico in H cronica. pylori
infezione.
Mouse
I batteri e l'infezione di topi
SS1 è stato coltivato su Columbia ISO piastre di agar per 2 giorni a 37 ° C, dopo di che sono stati trasferiti in brodo Brucella integrato con siero 5% fetale bovino (FCS) e gli antibiotici (vancomicina, 10 mg /ml; polimixina B , 20 U /ml; Trimethoprim, 5 mg /ml) e incubate agitando per una notte a 37 ° C in condizioni microaerofili. Prima infezione, la motilità dei batteri è stata confermata mediante microscopia. La concentrazione di batteri è stata stimata spettrofotometricamente. I topi ha ricevuto 3 × 10 8 unità formanti colonia di SS1 intragastricamente.
immunizzazione sublinguale
lisato (preparato dal ceppo Hel305 come precedentemente descritto [46]), combinata con 10 mcg tossina del colera (Lista Biological Laboratories Inc., Madison, NJ) per via sublinguale a intervalli di 1 settimana [47], [48]. Due settimane dopo l'ultima vaccinazione, i topi sono stati sfidati intragastricamente con 3 × 10 8 formanti colonie unità di H. pylori
SS1.
colonie è stata confermata da un test dell'ureasi. In questo modo abbiamo potuto confermare H. pylori
colonizzazione e usano ancora l'intero stomaco per l'isolamento delle cellule.
 Risoluzione dei problemi:la differenza tra ammalarsi e guarire
Risoluzione dei problemi:la differenza tra ammalarsi e guarire
 Cambiamento del microbioma respiratorio superiore nei bambini correlato alla suscettibilità alla SARS-CoV-2
Cambiamento del microbioma respiratorio superiore nei bambini correlato alla suscettibilità alla SARS-CoV-2
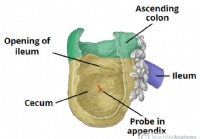 L'appendice
L'appendice
 Una nuova strategia può rafforzare la comunicazione intestino-cervello
Una nuova strategia può rafforzare la comunicazione intestino-cervello
 Quanto tempo ci vuole per riprendersi da una procedura di gastrodigiunostomia?
Quanto tempo ci vuole per riprendersi da una procedura di gastrodigiunostomia?
 Rimedi per la sindrome dell'intestino irritabile (IBS)
Rimedi per la sindrome dell'intestino irritabile (IBS)
 Caso di studio:Montse sta guarendo il suo intestino che perde
Passare da una dieta allaltra nella speranza di trovare quella magica è probabilmente qualcosa che ognuno di noi ha sperimentato prima o poi. La verità è che non esiste una dieta magica là fuori, per
Caso di studio:Montse sta guarendo il suo intestino che perde
Passare da una dieta allaltra nella speranza di trovare quella magica è probabilmente qualcosa che ognuno di noi ha sperimentato prima o poi. La verità è che non esiste una dieta magica là fuori, per
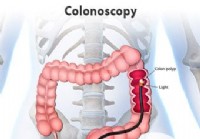 Procedura e preparazione della colonscopia
Illustrazione del colonscopio nel colon durante una procedura di colonscopia. Cosè una colonscopia? La colonscopia è una procedura che consente a un esaminatore (di solito un gastroenterologo) di val
Procedura e preparazione della colonscopia
Illustrazione del colonscopio nel colon durante una procedura di colonscopia. Cosè una colonscopia? La colonscopia è una procedura che consente a un esaminatore (di solito un gastroenterologo) di val
 La griglia mongola di BD è adatta alle diete specifiche per carboidrati!
Volevo solo pubblicare un post veloce su unesperienza culinaria di grande successo che ho avuto. Negli ultimi mesi ho provato a mangiare fuori nei ristoranti. Sfortunatamente, è successo solo 5 volte
La griglia mongola di BD è adatta alle diete specifiche per carboidrati!
Volevo solo pubblicare un post veloce su unesperienza culinaria di grande successo che ho avuto. Negli ultimi mesi ho provato a mangiare fuori nei ristoranti. Sfortunatamente, è successo solo 5 volte