Il randomizzato, Lo studio globale di Fase 2 ALTA è stato progettato per studiare l'efficacia e la sicurezza di ALUNBRIG in pazienti con NSCLC ALK+ localmente avanzato o metastatico che erano progrediti con crizotinib. I pazienti sono stati randomizzati a ricevere uno dei due regimi di ALUNBRIG:90 mg di ALUNBRIG una volta al giorno (n=112) o 180 mg una volta al giorno con un anticipo di sette giorni a 90 mg una volta al giorno (n=110).
"ALK+ NSCLC è una malattia grave e pericolosa per la vita che colpisce circa 40 persone, 000 persone in tutto il mondo ogni anno, e molti pazienti progrediranno o smetteranno di rispondere al trattamento di prima linea, " ha detto Stefania Vallone, Presidente, Cancro ai polmoni Europa. "Per le persone europee con ALK+ NSCLC, rimane una significativa esigenza insoddisfatta di nuove ed efficaci opzioni di trattamento".
"Mentre gli inibitori di ALK hanno dimostrato un'enorme crescita in questo spazio di trattamento negli ultimi dieci anni, avere un'opzione terapeutica mirata aggiuntiva disponibile per il trattamento di ALK+ NSCLC è stato atteso con impazienza, " disse Enriqueta Felip, M.D., dottorato di ricerca, Responsabile dell'Unità di Oncologia Toracica, Dipartimento di Oncologia dell'Ospedale Universitario Vall d'Hebron di Barcellona. "Con una sopravvivenza mediana libera da progressione di 16,7 mesi e una sopravvivenza globale di 34,1 mesi, ALUNBRIG ha mostrato risultati impressionanti, rappresentando nuovi progressi per il trattamento di ALK+ NSCLC in questo contesto."
"Lo studio ALTA ha stabilito ALUNBRIG come una potenziale opzione di trattamento di seconda linea per ALK+ NSCLC, dimostrando una significativa efficacia con un profilo di sicurezza gestibile, " disse Jesús Gómez-Navarro, M.D., Vicepresidente, Responsabile Ricerca e Sviluppo Clinico Oncologico, Takeda. "Con 16,7 mesi di sopravvivenza mediana libera da progressione, il più lungo di qualsiasi inibitore di ALK da riportare in questo contesto, ALUNBRIG offre un grande potenziale per i pazienti che hanno progredito con crizotinib. L'opinione positiva di oggi ci avvicina all'obiettivo finale di far progredire il paradigma di trattamento per il numero considerevole di pazienti con NSCLC ALK+ trattati con crizotinib che vivono in Europa. Attendiamo con impazienza la revisione da parte della Commissione europea del parere positivo del CHMP e l'introduzione di ALUNBRIG a pazienti e operatori sanitari nell'Unione europea, se approvato".
Come parte di questa presentazione, il CHMP ha anche riesaminato i dati della prima analisi ad interim dello studio di fase 3 ALTA-1L, che ha raggiunto il suo endpoint primario, come prova a sostegno. Nell'ALTA-1L, il trattamento con ALUNBRIG ha determinato un miglioramento statisticamente e clinicamente significativo della PFS rispetto a crizotinib, come valutato da un comitato di revisione indipendente in cieco. Il profilo di sicurezza associato ad ALUNBRIG era generalmente coerente con gli studi precedenti e l'etichettatura approvata da Stati Uniti e Canada.
Il parere positivo del CHMP per ALUNBRIG sarà ora riesaminato dalla Commissione europea, che ha l'autorità per approvare i medicinali per l'uso nei 28 stati membri dell'Unione Europea, così come la Norvegia, Liechtenstein e Islanda.
 Prenditi cura della salute dell'intestino durante la stagione del rientro a scuola
Prenditi cura della salute dell'intestino durante la stagione del rientro a scuola
 ricetta facile della cotoletta di vitello
ricetta facile della cotoletta di vitello
 Esiste una connessione tra IBS e infertilità?
Esiste una connessione tra IBS e infertilità?
 L'angioplastica può essere rischiosa per chi ha una cattiva circolazione delle gambe
L'angioplastica può essere rischiosa per chi ha una cattiva circolazione delle gambe
 Qual è la differenza tra fluoroscopia e radiografia?
Qual è la differenza tra fluoroscopia e radiografia?
 La diverticolite è contagiosa?
La diverticolite è contagiosa?
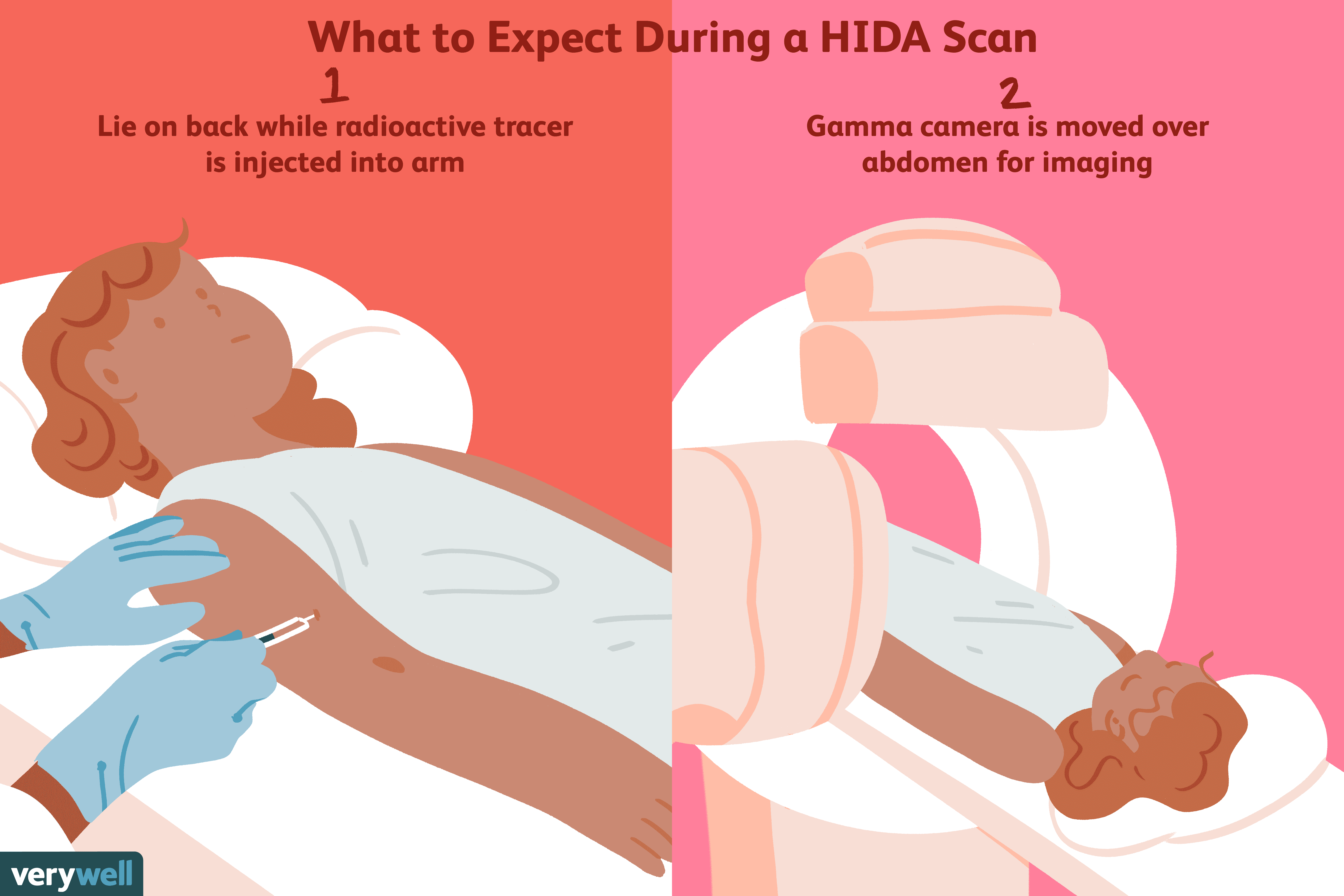 Che cos'è una scansione dell'acido epatobiliare imminodiacetico (HIDA)?
Una scansione dellacido iminodiacetico epatobiliare (HIDA), che a volte è anche chiamata colescintigrafia o scintigrafia epatobiliare, è un tipo di test di imaging nucleare che viene eseguito per visu
Che cos'è una scansione dell'acido epatobiliare imminodiacetico (HIDA)?
Una scansione dellacido iminodiacetico epatobiliare (HIDA), che a volte è anche chiamata colescintigrafia o scintigrafia epatobiliare, è un tipo di test di imaging nucleare che viene eseguito per visu
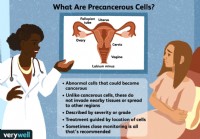 Cosa significa se hai cellule precancerose
Il termine cellule precancerose può sembrare spaventoso. La prima cosa da chiarire è che non tutte le cellule precancerose si trasformano in cancro. In effetti, la maggior parte non lo fa. Ma queste s
Cosa significa se hai cellule precancerose
Il termine cellule precancerose può sembrare spaventoso. La prima cosa da chiarire è che non tutte le cellule precancerose si trasformano in cancro. In effetti, la maggior parte non lo fa. Ma queste s
 Come viene eseguita una biopsia epatica transgiugulare?
Che cosè una procedura di biopsia epatica transgiugulare? In una biopsia epatica transgiugulare, il medico inserisce un catetere attraverso la vena giugulare nel collo e lo infila fino a il fegato
Come viene eseguita una biopsia epatica transgiugulare?
Che cosè una procedura di biopsia epatica transgiugulare? In una biopsia epatica transgiugulare, il medico inserisce un catetere attraverso la vena giugulare nel collo e lo infila fino a il fegato