sincrono ben differenziato tumore neuroendocrino e tumore gastrointestinale stromale dello stomaco: un caso
Abstract
sfondo
tumori neuroendocrini ben differenziati (carcinoidi) , derivanti da cellule del sistema neuroendocrino diffuso, rappresentano i tumori endocrini gastrici più comunemente incontrate. tumori stromali gastrointestinali (GIST), derivanti da cellule di Cajal interstiziali ubicati nella parete del tratto gastrointestinale e hanno un immunoreattività caratteristico per CD117 (c-kit proteine), rappresentano la maggioranza delle neoplasie mesenchimali gastrointestinali. verificarsi simultaneo di un GIST con un tumore neuroendocrino ben differenziato nello stomaco è molto raro.
Metodi
Clinica storia, endoscopia e istopatologici risultati sono stati utilizzati per le nostre considerazioni diagnostiche
. Risultati
Segnaliamo la coesistenza di un GIST ad alto rischio con un tumore neuroendocrino ben differenziato di comportamento clinico benigno, entrambi situati nello stomaco, in un uomo di 62 anni, precedentemente operati per un gastrica ben differenziato tumore neuroendocrino con un comportamento maligno incerto.
Conclusioni
Anche singolo ben differenziato, sporadica, reti di piccole dimensioni possono coesistere con GIST. Un approccio terapeutico iniziale appropriata combinata con un follow-up scrupolosa sembra giocare un ruolo significativo in termini di prevenzione di una malattia metastatica.
Parole
stomaco tumore neuroendocrino GIST Sfondo
tumori neuroendocrini dell'apparato gastrointestinale (NET) si pensa di derivare da cellule del sistema neuroendocrino diffuso del tratto [1] gastrointestinale (GI). Nello stomaco, la maggior parte dei tumori endocrini si trovano nel corpus o fondo, costituendo un gruppo di enterocromaffini-come cellule non funzionante, (ECL), oltre NETs differenziati (carcinoidi). NET gastrico sono divisi in quattro tipologie: a) di tipo I, associata con autoimmune cronica gastrite atrofica (A-CAG), b) di tipo II, legati alla endocrina multipla di tipo neoplasia 1 (MEN-1) o alla sindrome di Zollinger-Ellison ( ZES) ec) di tipo III, sporadica, estranei a ipergastrinemia o a-CAG, d) tipo IV, che rappresenta un gruppo eterogeneo di tumori che mostrano evidenza di differenziazione multidirezionale, come una combinazione di adenocarcinoma e NET [2-4].
i tumori stromali gastrointestinali (GIST) sono neoplasie mesenchimali derivanti dalle cellule interstiziali di Cajal localizzati all'interno della parete del tratto gastrointestinale [5, 6]. GIST mostrano una predilezione per lo stomaco, dove costituiscono la maggior parte dei tumori mesenchimali [7, 8]. Immunopositività per CD117 (c-kit proteine) è una caratteristica distintiva immunoistochimica di questi tumori [8, 9], per il quale la dimensione del tumore e l'attività mitotica sono i parametri più significativi per quanto riguarda la previsione del comportamento clinico [10, 11].
GIST sono stati segnalati per coesistere con una varietà di tumori, la percentuale di tali casi vanno dal 4,5% al 33% [12, 13]; in tali casi, lo stomaco è la posizione più frequente di GIST [12]. Il tumore coesistenti più comune è adenocarcinoma del tratto gastrointestinale [12, 13]; altri tipi includono linfomi, leucemie, carcinomi della mammella, della prostata, del pancreas o polmoni o adenoma adrenocorticale [12-16]. Allo stesso modo, studi precedenti hanno dimostrato un'associazione tra NET gastrointestinali e tumori epiteliali sincroni o metacroni che rappresentano circa il 10% al 46% dei casi [17, 18].
Per di più, la coesistenza di GIST con tumori endocrini del tratto gastrointestinale, come ad NET come ileale ben differenziato [19] o NET ben differenziato del pancreas [14] è stata inoltre riportata. Tuttavia, il verificarsi simultaneo di gastrico NET ben differenziati e GIST gastrico sembra essere rara, una manciata di casi che hanno finora segnalato, alla nostra migliore conoscenza [7, 9, 12, 20].
In questo contesto, abbiamo presentare la presente caso di insorgenza sincrona di un GIST e NET ben differenziato, entrambi situati nello stomaco di un paziente di sesso maschile. La nostra relazione sembra essere distintivo, in quanto comprende aspetti clinici e istopatologici unici. Presentazione
Caso
A 58 anni, di sesso maschile è stato ricoverato per dolori muscolari cronici. Durante il ricovero, un episodio di melena si è verificato, a seguito della quale è stato sottoposto sia colonscopia e gastroscopia; quest'ultimo descritto un circa 1,2 cm di larghezza lesione grande curvatura dello stomaco [Figura 1]. Un gastrectomia subtotale prossimale (con successiva ricostruzione del tratto GI), compresa la lesione, è stata quindi eseguita. A 6.5 × 4.2 × 1 cm campione chirurgico contenenti leggermente sporgenti, 1,2 cm ampio mucosa ad una distanza di 0,8 cm dal margine chirurgico più vicino è stata ricevuta; la mucosa rimanente era insignificante. Istologia ha mostrato la lesione di essere completamente asportato, NET ben differenziato con le cellule tumorali relativamente uniformi, immunopositive per cromogranina-A, synaptophysin e CD56; no mitosi rilevabili sono stati visti. Il tumore infiltrato sia muscolare mucose e la parte contigua della sottomucosa. Indice di proliferazione mediante un Ki67 /MIB-1 immunostain era inferiore al 2%. Non emboli vascolari sono stati visti. Il tumore è stato quindi classificato come gastrica NET ben differenziato con il comportamento maligno incerta [2, 21-23]. Adiacente mucosa gastrica mostrato lieve gastrite cronica, diffusa metaplasia intestinale incompleta dell'epitelio, nonché endocrine iperplasia delle cellule di tipi micronodulari semplice, lineare o. Una vasta post-operatorio work-up ha mostrato né segni di estensione del tumore, né prove di siero di autoimmunità; il paziente è stato quindi posto su un regolare follow-up. Un anno dopo, è stato sottoposto un'altra gastroscopia con biopsia che mostra gastrite cronica attiva con focolai di diffusa, sia metaplasia intestinale completa e incompleta dell'epitelio gastrico. Helicobacter pylori microrganismi non sono stati rilevati da una macchia Giemsa. Figura 1 Gastroscopia; un approssimativamente 1,2 cm grossa lesione nella grande curvatura dello stomaco. Si noti il buon contorno della lesione leggermente sporgente così come la sua emorragia, anche con dolci manipolazioni endoscopici.
Tuttavia, quattro anni post-op, CT ha mostrato un ben delineato, 3,5 cm di larghezza, lesione intramurale nella giunzione esofago-gastrica. livelli di gastrina nel siero erano entro i limiti normali. Il paziente ha subito l'asportazione della parte restante dello stomaco; Questo corrisponde ad una gastrectomia subtotale (con successiva ricostruzione del tratto GI) campione con un 35 cm di lunghezza maggiore e un 14,5 cm di lunghezza minore curvatura rispettivamente, insieme con un lungo 1,9 cm polsino duodenale. Una stenosi è stata osservata nei angularis incisura; inoltre, un, multilobulare, 3,5 cm grande tumore sporgente era situato vicino alla giunzione gastroesofagea, sulla parete anteriore dello stomaco, presentando, su sezioni, un colore biancastro con focolai brunastro e una consistenza fibrosa. La mucosa gastrica rimanente era insignificante.
Istologia ha mostrato il tumore consistere di interlacciamento fasci di cellule fusiformi [Figura 2]. Un totale di 15 mitosi per 50 campi ad alta potenza (con un obiettivo × 40) sono stati valutati nella maggior parte delle aree neoplastiche cellulari. Il tumore conteneva aree di infiltrazione emorragica o la degenerazione cistica ed era soprattutto spingere i confini. cellule neoplastiche furono intensamente decorate con anticorpi contro CD117 /c-kit [figura 2], CD34 e vimentina, erano focally immunoreattive per α-SMA e proteina S-100, ma non macchia per citocheratina 18. indice di proliferazione mediante una Ki67 /MIB-1 immunostain è stato di circa il 10%, con la colorazione predominante nelle aree tumorali periferiche. Di conseguenza, è stato istituito una diagnosi di GIST rischio moderato (sulla base di criteri stabiliti dall'Istituto Forze Armate di Patologia) [11] o GIST ad alto rischio (in base al National Institute of Health GIST Laboratorio-2001) [10]. Figura 2 GIST dello stomaco. Fig.2a (ematossilina-eosina /X10): modello di crescita neoplastica caratterizzata da interlacciamento fasci di cellule fusiformi con attività mitotica focale. Fig.2b (anti-CD117 /X20): Diffuse immunoreattività delle cellule neoplastiche
Inoltre, nella zona stenotica del angularis incisura (vedi sopra), totalmente asportato, 0,4 cm di larghezza, NET ben differenziato del comportamento clinico benigno. è stato identificato: si trovava nella mucosa e sottomucosa e consisteva in una popolazione cellulare monomorfa, con attività mitotica poco appariscente, formando adenoidi o aggregati solidi [Figura 3]. Una macchia blu Alcian emerso alcun mucina. Le cellule tumorali erano immunoreattive per cromogranina-A [Figura 3] e synaptophysin, ma non per CD56 e la serotonina. La proliferazione (Ki-67 /MIB-1) indice era pari a circa il 2%. Non emboli vascolari sono stati visti. La mucosa gastrica adiacente mostrato gastrite atrofica insieme vasta metaplasia intestinale completa [figura 3]. Giemsa non sono emersi da Helicobacter pylori. Così, sulla base dei più recenti dati che suggeriscono un ruolo della terapia con imatinib adiuvante in termini di miglioramento della sopravvivenza libera da recidiva dopo la resezione del GIST localizzato primaria, il paziente è stato posto sulla imatinib [24]; egli è vivo e ben un anno dopo la seconda operazione. Figura 3 Il secondo tumore neuroendocrino ben differenziato dello stomaco. Fig.3a (ematossilina-eosina /X10): Neoplasia localizzato nella mucosa e sottomucosa e consisteva di cellule monomorfa, con attività mitotica insignificante, formando adenoidi o aggregati solidi. Nota ghiandole gastriche adiacenti con aree di metaplasia intestinale. 3b (anti-cromogranina /X20):. Diffuse, intenso, immunoexpression dalle cellule tumorali
Conclusioni
delle relazioni precedenti per quanto riguarda il verificarsi simultaneo di GIST e NET ben differenziati nello stomaco abbiamo realizzato per recuperare solo i dati per tre casi. In particolare, un caso riguardava un vecchio maschio 69 anni con una storia familiare di cancro negativo che ha subito la rimozione di una massa polipoide sessili nel corpus dello stomaco. L'esame istologico del campione resecati dimostrato una sottomucosa GIST borderline, mentre nel sovrastante mucosa una rete ben differenziato (carcinoide), invadendo la lamina propria e inizialmente infiltrazione sottomucosa, è stato riconosciuto. Né H. pylori microrganismi né focolai di metaplasia intestinale sono stati identificati nella mucosa circostanti. Il paziente è morto di cause non correlate (attacco cardiaco) dodici mesi dopo l'intervento chirurgico, mentre i risultati di imaging sono stati tutti negativi relativi depositi metastatici delle lesioni di cui sopra [20].
Il secondo caso riguardava una donna di 65 anni, con GIST a basso rischio sulla parete anteriore della tomaia concomitante corpus gastrica con un tipo III NET ben differenziato localizzato sulla parete posteriore del corpus gastrica superiore; nessuna recidiva di tumore sia avvenuto 28 mesi dopo l'asportazione [9]. Nel terzo caso una femmina di 65 anni, che in precedenza aveva subito una gastrectomia subtotale per un GIST (categoria di rischio non menzionato), presentato con ipergastrinemia siero e lesioni polipoidi del moncone gastrico, un anno post-operatorio. Istologia mostrava tipo polipoide I gastrico bene NET differenziati, mentre l'esame istopatologico di campione escissione del restante dello stomaco documentato la coesistenza di un (categoria di rischio non menzionato) GIST [7]. Agaimy et al., Anche, sulla base di propri archivi e sui dati raccolti dalla letteratura, ha riferito di quattro gastrici NET ben differenziati in concomitanza con GIST [12]. Per quanto riguarda
meccanismi patogenetici implicati nel duplice sviluppo di GIST e NET ben differenziati nello stomaco, i dati sono ancora insufficienti. Anche se un ruolo di infezione da H. pylori non si può escludere, è allo stato attuale non è chiaro, forse a causa del piccolo numero di casi finora riportato. Così, Lin et al. non concludere alcun rapporto causale definito tra i GIST, ben NET differenziato e l'infezione da H. pylori [9], un punto valido anche nel nostro caso, in cui è stato mostrato alcun H. pylori. L'ipotesi che si basa su dati sperimentali nei ratti e sostiene la nozione che un singolo agente cancerogeno eventualmente interagisce con due tessuti adiacenti, inducendo lo sviluppo di tumori di diversi istotipi nello stesso organo, rimane essere motivata in tessuti umani [25-27 ]. Inoltre, non possiamo del tutto escludere la possibilità che i fattori genetici riguardanti specifiche mutazioni del gene potrebbe essere responsabile dello sviluppo sincrono di due tumori gastrici. D'altra parte, un aumento coincidenza di due neoplasie primarie nello stesso organo (stomaco) potrebbe essere anche una possibile considerazione. Ulteriori studi sono certamente necessari al fine di chiarire questo fenomeno.
Gastrico ben differenziati NET rappresentano il 8,7-41% di tutti gastrointestinali NET ben differenziati [2]. Le loro caratteristiche cliniche includono dolore addominale, vomito, anemia, sanguinamento massivo gastrica o, raramente, sindrome carcinoide [2, 27]. . Il nostro paziente ha avuto un episodio di melena che precede la diagnosi del suo primo NET ben differenziato, mentre il secondo è stato inciso diagnosticato
Nella nostra relazione, entrambi NET ben differenziati erano lesioni singole; nonostante il fatto che il primo tumore nata nel contesto di iperplasia delle cellule endocrine, l'assenza di indici autoimmunità siero osta sua classificazione come tipo I gastrico NET ben differenziati; entrambi i tumori, quindi, corrispondono al tipo III secondo la classificazione WHO [2-4]
Secondo la classificazione WHO, comportamento benigno di NET ben differenziati è associato con i seguenti criteri:. tumorale citologicamente blando confinato mucose e /o sottomucosa, non angioinvasive, meno di 1 cm di grandezza, non funzionante; queste caratteristiche si trovano principalmente nei tumori che sorgono nel contesto di A-CAG o MEN-1 /ZES. Al contrario, il comportamento maligno incerto NET ben differenziati è associato ad una non funzionante, tumore citologicamente insipido, di misura 1 a 2 cm di diametro, confinati alla mucosa e /o sottomucosa. Angioinvasione può essere presente in queste lesioni [2, 21-23]. Questa categoria comprende alcune delle reti gastrici di tipo II. Pertanto, nel nostro caso, il primo tumore neuroendocrino è stato diagnosticato un comportamento maligno incerto a causa della sua dimensione e il suo essere single.
Interventi chirurgici limitati (tra cui manipolazioni endoscopiche) rimangono il trattamento cardine per tipo I gastrica NET ben differenziati [28] . gastrectomia parziale combinato con un trattamento appropriato per ipergastrinemia concomitante è necessaria per il tipo II neoplasie [29]. Infine, una gastrectomia totale è consigliato per il tipo III NET ben differenziati, anche quando sono istologicamente ben differenziati, in particolare nei tumori di dimensioni superiori a 1 cm [2, 29], un trattamento inizialmente non eseguiti nel nostro caso, a causa del rifiuto del paziente.
GIST, pensato per derivare da cellule Cajal interstiziali della parete gastrointestinale [5, 6], dimostrano una chiara predilezione di genere; individui affetti sono soprattutto gli adulti tra il decennio 6 ° e l'8 [8]. GIST gastrici possono essere incidentalmente rilevati durante l'endoscopia, uno studio di imaging o in un campione chirurgico, dato che stanno crescendo lentamente tumori localizzati all'interno di strati più profondi della parete gastrointestinale. Anche se il nostro paziente era asintomatico, GIST di solito si manifestano con sintomi aspecifici, come nausea, vomito, dolore addominale o, il più delle volte, con sanguinamento, a causa di protrusione del tumore e l'allungamento della mucosa sovrastante; metastasi possono talvolta costituire il sintomo iniziale [8, 9].
terapia ottimale comprende l'asportazione chirurgica e il trattamento con imatinib. Quest'ultimo è adatto per i tumori non operabili, i casi in cui l'escissione totale si rivela impossibile o per ricorrenze [9, 30].
Per quanto riguarda la previsione di comportamento clinico, la proposta iniziale formulata dal National Institute of Health (NIH) Laboratorio GIST in 2001 ha definito il rischio di comportamento aggressivo in base alle dimensioni del tumore (dimensione singolo più grande) e conta mitotica (numero di figure mitotiche per 50 HPF) [10], la classificazione dei GIST in molto basso, basso, intermedio e alto categorie di rischio. Più di recente, l'Istituto delle Forze Armate di Patologia (AFIP) ha suggerito una nuova stratificazione del rischio dei GIST primario, introducendo il sito coinvolto accanto ai due criteri menzionati in precedenza, vale a dire l'indice e la dimensione [11] mitotico; in tal modo, i GIST gastrici sono stratificati come avendo nessuno, molto basso, basso, moderato o alto rischio di progressione della malattia. Indipendentemente dal sistema utilizzato, va tenuto presente che grandi tumori (soprattutto quelli più grandi di 10 cm), anche quando non avere attività mitotica rilevabile, possono mostrare recidive tardive e persino depositi metastatici. Secondo le linee guida dell'OMS, DNA-aneuploidia e alta attività proliferativa, valutati da marcatori di proliferazione, possono riflettere più alto potenziale maligno [8]. Nel nostro caso, il GIST è stato classificato come di rischio moderato in base ai criteri AFIP, mentre corrisponde alla categoria ad alto rischio in base ai criteri NIH.
In conclusione, abbiamo presentato un raro caso di un concomitante NET ben differenziati con un GIST nello stomaco. Gastroenterologi e patologi, in particolare, devono essere consapevoli di questo raro fenomeno dato che anche solo ben differenziato, sporadica (estranei a ipergastrinemia o A-CAG), reti di piccole dimensioni possono coesistere con GIST, come è stato dimostrato nel nostro caso. Un follow-up meticolosa (insieme ad un approccio terapeutico iniziale ben pianificata) deve essere eseguita per tutti i pazienti affetti da neoplasie predetti modo le conseguenze devastanti di una malattia metastatica da evitare.
Dichiarazioni
Ringraziamenti sezione
consenso informato scritto è stato ottenuto dal paziente ai fini della pubblicazione.
autori fascicoli presentati originali per
di seguito sono riportati i link ai degli autori fascicoli presentati originali per immagini. 'file originale per la figura 1 12876_2010_559_MOESM2_ESM.jpeg Autori 12876_2010_559_MOESM1_ESM.tiff autori file originale per la figura 2 12876_2010_559_MOESM3_ESM.jpeg Autori file originale per la figura 3 12876_2010_559_MOESM4_ESM.jpeg Autori file originale per la figura 4 interessi in competizione
Gli autori dichiarano di avere interessi in gioco.
 Trattare con una diagnosi IBS?
Trattare con una diagnosi IBS?
 Partecipa a The Healthy Gut
Partecipa a The Healthy Gut
 Mese di sensibilizzazione sulla gastroparesi
Mese di sensibilizzazione sulla gastroparesi
 "Modulando la tua dieta, puoi anche modulare i tuoi microbi":un'intervista con Clara Belzer
"Modulando la tua dieta, puoi anche modulare i tuoi microbi":un'intervista con Clara Belzer
 L'analisi del sangue per il DNA microbico potrebbe mettere in guardia dal cancro
L'analisi del sangue per il DNA microbico potrebbe mettere in guardia dal cancro
 Paleo Pumpkin Pancakes for Fall Family Fun (SCD friendly)
Paleo Pumpkin Pancakes for Fall Family Fun (SCD friendly)
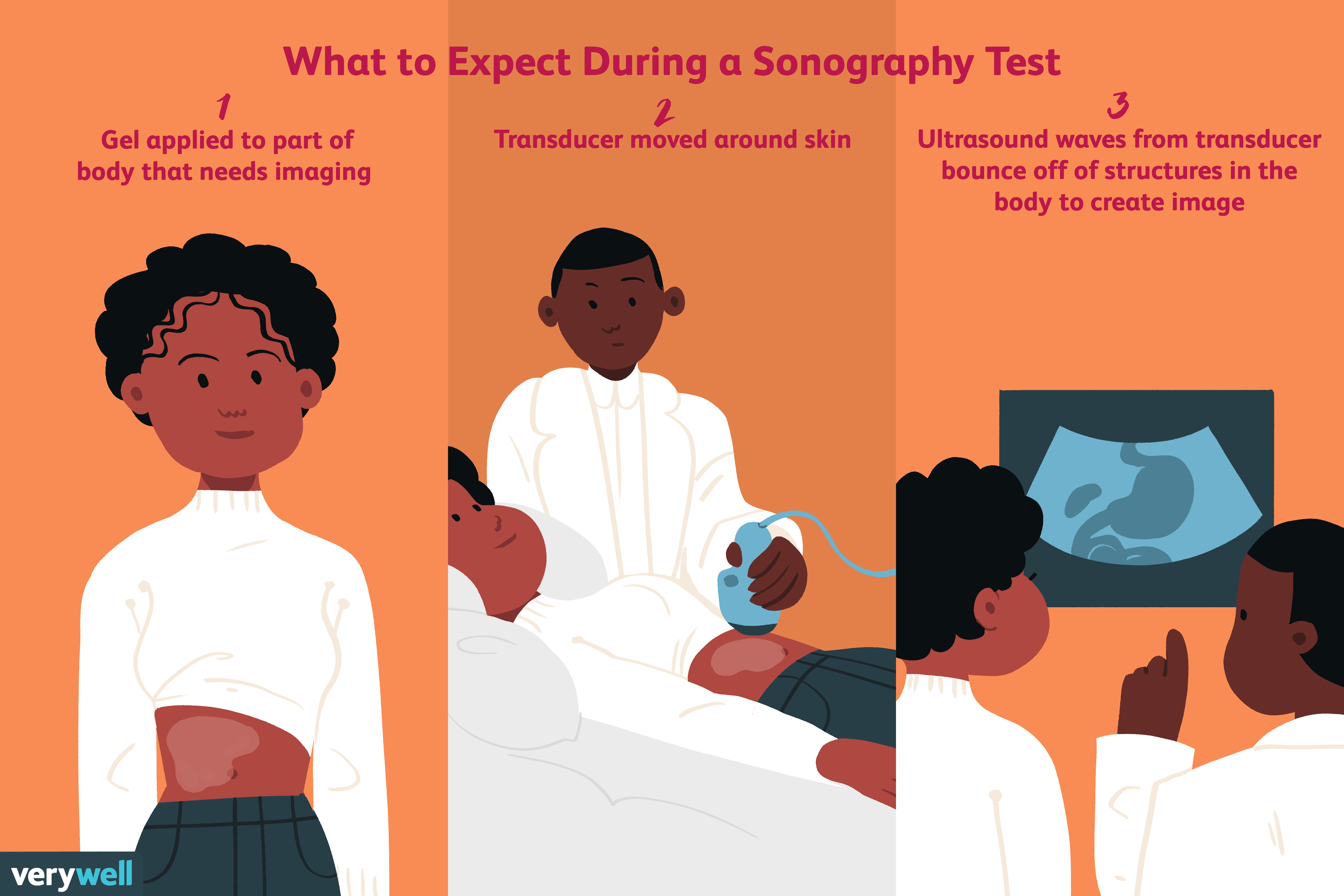 Che cos'è l'ecografia?
Lecografia è un test medico diagnostico che utilizza onde sonore ad alta frequenza, chiamate anche onde ultrasoniche, per rimbalzare sulle strutture del corpo e creare unimmagine. Opportunamente, il t
Che cos'è l'ecografia?
Lecografia è un test medico diagnostico che utilizza onde sonore ad alta frequenza, chiamate anche onde ultrasoniche, per rimbalzare sulle strutture del corpo e creare unimmagine. Opportunamente, il t
 Una nuova ricerca identifica un legame tra il microbioma intestinale e gli ictus
Un recente studio condotto presso la Cleveland Clinic dimostra limpatto delle diete ad alto contenuto di colina, che si trova spesso in quantità elevate nelle carni rosse e nei tuorli duovo, e trimeti
Una nuova ricerca identifica un legame tra il microbioma intestinale e gli ictus
Un recente studio condotto presso la Cleveland Clinic dimostra limpatto delle diete ad alto contenuto di colina, che si trova spesso in quantità elevate nelle carni rosse e nei tuorli duovo, e trimeti
 Ricette del 4 luglio
Se stai pianificando un pasto per festeggiare questo lungo weekend speciale, non cercare oltre, abbiamo alcune super ricette per il Canada Day e il 4 luglio per aiutarti a creare un barbecue SIBO frie
Ricette del 4 luglio
Se stai pianificando un pasto per festeggiare questo lungo weekend speciale, non cercare oltre, abbiamo alcune super ricette per il Canada Day e il 4 luglio per aiutarti a creare un barbecue SIBO frie