Diagnostisk testing er fortsatt et avgjørende verktøy i kampen mot COVID-19-pandemien. Standardtester for påvisning av SARS-CoV-2 innebærer å forsterke viralt RNA til påvisbare nivåer ved bruk av en teknikk som kalles kvantitativ revers transkripsjon PCR (RT-qPCR). Men først, RNA må ekstraheres fra prøven. Produsenter av RNA-ekstraksjonssett har hatt problemer med å følge med etterspørselen under COVID-19-pandemien, hindrer testkapasitet over hele verden. Med nye virusvarianter som dukker opp, behovet for bedre, raskere tester er større enn noensinne.
Et team ledet av Robert B. Hufnagel, M.D., Ph.D., sjef for NEI Medical Genetics and Ophthalmic Genomic Unit, og Bin Guan, Ph.D., stipendiat ved Ophthalmic Genomics Laboratory ved NEI, brukte et chelateringsmiddel laget av laboratorieforsyningsfirmaet Bio-Rad kalt Chelex 100 harpiks for å bevare SARS-CoV-2 RNA i prøver for påvisning av RT-qPCR.
"Vi brukte nasofaryngeal- og spyttprøver med forskjellige virionkonsentrasjoner for å evaluere om de kunne brukes til direkte RNA -deteksjon, "sa Guan, hovedforfatter av en rapport om teknikken, som publiserte denne uken i iScience. "Svaret var ja, med markert høy følsomhet. Også, dette preparatet inaktiverte viruset, gjør det tryggere for laboratoriepersonell å håndtere positive prøver. "
Hufnagels team fant sin oppdagelse ved å teste en rekke kjemikalier ved bruk av syntetiske og menneskelige prøver for å identifisere de som kan bevare RNA i prøver med minimal nedbrytning, samtidig som de tillater direkte påvisning av viruset ved RT-qPCR.
For å validere testen, NIDCRs Blake M. Warner, D.D.S., Ph.D., M.P.H., og teamet hans samlet pasientprøver (på Research Protocol NIH IRB 20-D-0094) og lagret dem i enten virale transportmedier, eller den nyutviklede chelateringsharpiksbufferen ved NIH Symptomatic Testing Facility.
Prøvene i virale transportmedier ble testet av COVID-19-testteamet ved NIHs Clinical Center, ledet av Karen M. Frank, M.D., Ph.D., ved bruk av konvensjonell RNA-ekstraksjon og RT-qPCR-testing. Prøvene i chelateringsharpiksbufferen ble oppvarmet og viralt RNA var, deretter, testet med RT-qPCR. Det nye preparatet økte RNA -utbyttet betydelig for testing, sammenlignet med standardmetoden.
Vi tror denne nye metoden har klare fordeler med å øke følsomheten, kostnads- og tidsbesparelser for testing. Metoden stabiliserer RNA ved romtemperatur for lettere transport, Oppbevaring, og håndtering i kliniske omgivelser. "
Robert B. Hufnagel, M.D., Ph.D., Sjef for NEI Medical Genetics and Ophthalmic Genomic Unit
NEI har beskyttet intellektuell eiendom rundt denne teknologien og søker partnere for samutvikling/lisensiering. Ta kontakt med [email protected] for mer informasjon ..
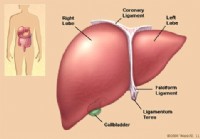 Medikamentindusert leversykdom
Hva er legemiddelindusert leversykdom? Bilde av lever Medikamentinduserte leversykdommer er sykdommer i leveren som er forårsaket av legeforeskrevne medisiner, reseptfrie medisiner, vitaminer, horm
Medikamentindusert leversykdom
Hva er legemiddelindusert leversykdom? Bilde av lever Medikamentinduserte leversykdommer er sykdommer i leveren som er forårsaket av legeforeskrevne medisiner, reseptfrie medisiner, vitaminer, horm
 5-Min Paleo Fish Fry
Jeg har to barn ... så la oss være ekte. Mange netter er de sexy middagstallerkene vi ofte ser på blogger en fantasi. (Gå inn i 5-minutters Paleo fiskeyngel.) Det er ikke glamorøst, men det får jobbe
5-Min Paleo Fish Fry
Jeg har to barn ... så la oss være ekte. Mange netter er de sexy middagstallerkene vi ofte ser på blogger en fantasi. (Gå inn i 5-minutters Paleo fiskeyngel.) Det er ikke glamorøst, men det får jobbe
 Hva er den beste måten å håndtere IBS på?
Denne uken (4. desember) på #AskADietitian snakker jeg om de BESTE måtene å håndtere IBS på – og hvorfor vi i Ignite gjør ting annerledes. Nei, det er ikke bare medisiner. Nei, sjokkerende nok er det
Hva er den beste måten å håndtere IBS på?
Denne uken (4. desember) på #AskADietitian snakker jeg om de BESTE måtene å håndtere IBS på – og hvorfor vi i Ignite gjør ting annerledes. Nei, det er ikke bare medisiner. Nei, sjokkerende nok er det